2. 中国水产科学研究院淡水渔业研究中心, 农业部淡水渔业和种质资源利用重点实验室, 无锡 214081
2. Key Laboratory of Freshwater Fisheries and Germplasm Resources Utilization, Ministry of Agriculture, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, China
随着水产养殖业和水产饲料行业的不断发展,对蛋白质源的需求也逐渐升高。由于鱼粉价格昂贵,且近年来产量有所下降,寻找新型的饲料蛋白质源成为当今饲料行业亟需解决的难题[1-2]。植物蛋白质源以其丰富的资源和低廉的价格成为了饲料行业中的主要蛋白质源[3-4],但抗营养因子含量高、适口性差、氨基酸不平衡等限制了其在水产动物饲料中的应用[5]。研究证实,豆粕、菜籽粕和棉籽粕等植物蛋白质中的抗营养因子会降低鱼体的免疫力,引起肠道组织病变,阻碍营养物质吸收,最终造成鱼体生长性能下降[6-7]。而有报道表明,由多种植物蛋白质组成的植物蛋白质复合物,在一定程度上可以改善单一的植物性蛋白质源替代鱼粉存在的不足[8]。近年来研究发现,植物蛋白质经过微生物发酵处理,不仅可以有效去除其含有的抗营养因子,还能分解蛋白质产生多种小肽,同时富含多种维生素和未知生长因子,有利于动物对营养物质的消化吸收,促进动物生长[9-12]。在畜禽动物上的研究表明,发酵豆粕可以显著提高仔猪的消化能力和抗病力,促进仔猪生长[13-14];促进黄羽肉鸡的生长,保证肠道发育,提升免疫力[15-16]。在水生动物上,现有的报道多集中于发酵豆粕替代鱼粉的研究上[4, 17-18],也有关于发酵豆粕替代豆粕的研究[19],而关于发酵豆粕替代复合植物蛋白质源的研究尚未见到报道。因此,本试验以团头鲂(Megalobrama amblycephala)为研究对象,在饲料鱼粉含量不变的基础上(鱼粉含量为6%),研究发酵豆粕替代复合植物蛋白质源(豆粕:棉籽粕:菜籽粕=2 : 1 : 2)对团头鲂幼鱼生长性能及肠道健康的影响,对发酵豆粕在团头鲂幼鱼配合饲料中的应用进行评估,为实际生产提供理论基础。
1 材料与方法 1.1 试验材料发酵豆粕由广东希普生物科技股份有限公司提供,豆粕发酵时所用菌株为地衣芽孢杆菌(菌株编号:GIM1.11)和枯草芽孢杆菌(菌株编号:GIM1.372)。发酵豆粕为淡黄色粉末,具有发酵物特有的气味,色泽一致,无霉变、结块、异臭等现象,其水分含量为8.02%,粗蛋白质含量为50.03%,其中小肽占粗蛋白质含量的18.78%,并且寡糖中的棉子糖含量仅为1.42%,水苏糖含量为4%。豆粕、棉籽粕和菜籽粕均由无锡通威股份有限公司提供。发酵豆粕、豆粕、棉籽粕和菜籽粕的氨基酸组成见表 1。
|
|
表 1 发酵豆粕、豆粕、棉籽粕和菜籽粕的氨基酸组成(干物质基础) Table 1 Amino acid composition of fermented soybean meal, soybean meal, cottonseed meal and canola meal (DM basis) |
试验选择体质健壮、大小均匀、初始体重为6 g左右的团头鲂幼鱼375尾,随机分成5组,每组3个重复,每个重复25尾。根据团头鲂的营养需求[20],设计5组等氮(32%粗蛋白质水平)等脂(10%粗脂肪水平)的试验饲料,试验饲料组成及营养水平见表 2。其中,对照组(D0组)以鱼粉、豆粕、棉籽粕和菜籽粕为主要蛋白质源,试验组分别用发酵豆粕替代饲料中25%(D25组)、50%(D50组)、75%(D75组)和100%(D100组)的复合植物蛋白质源(豆粕:棉籽粕:菜籽粕=2 : 1 : 2)。各组以豆油和大豆磷脂为脂肪源,同时参考团头鲂幼鱼的氨基酸需要量,在试验饲料中添加适量包膜赖氨酸和蛋氨酸。所有原料经粉碎和过60目筛后,按配比进行称重,然后按逐级扩大的方法混合均匀,同时加水和豆油使其充分混合,最后用SLP-45型制粒机(中国水产科学研究院渔业机械仪器研究所)制成1.5 mm颗粒状饲料,放至阴凉处自然风干。风干后,用12号自封袋封存,-20 ℃冰箱保存备用。
|
|
表 2 试验饲料组成及营养水平(干物质基础) Table 2 Composition and nutrient levels of experimental diets (DM basis) |
试验团头鲂鱼种由中国水产科学研究院淡水渔业研究中心南泉试验基地提供。试验鱼用含32%粗蛋白质和7%粗脂肪的商业料(无锡通威股份有限公司)驯化2周后,挑选体质健壮、大小均匀、初始体重为6 g左右的团头鲂鱼种375尾,随机分成5组,每组3个重复,每个重复25尾,放入15个圆形蓄养桶(规格为直径820 mm、高700 mm)中,采用循环流水控温系统进行养殖。每天08:00、12:00、16:00进行人工喂养,并根据具体摄食情况进行调整,以达到饱食水平为准。饲养期间水温保持27~30 ℃,pH 7.0~8.0,溶氧浓度>5 mg/L,氨态氮浓度<0.2 mg/L,亚硝酸盐氮浓度<0.05 mg/L。试验期80 d。
1.4 样品采集饲养试验结束,禁食24 h,然后统计每桶存活的试验鱼尾数和总重,并从中随机捞取4尾,经浓度为100 mg/L的MS-222麻醉后,用一次性注射器(经肝素钠润洗)从尾静脉处采血,获得的血液置于4 ℃条件下,4 000 r/min离心10 min,移取上清液至2 mL离心管,-20 ℃保存,用于血清生化指标的测定。随后将鱼放至冰盘,立即解剖取出内脏团,分离出前肠和中肠,并剪取适量长度的中肠肠段放入Bouin’s液中,常温固定,用于肠道组织结构观察,将剩余的前肠和中肠分别放入2 mL离心管,-20 ℃保存。其中,前肠用于消化酶活性的测定,而中肠则用于抗氧化酶活性的测定。
1.5 分析测定方法血清总蛋白(TP)、葡萄糖(GLU)、总胆固醇(TC)、甘油三酯(TG)含量及碱性磷酸酶(ALP)、谷丙转氨酶(ALT)、谷草转氨酶(AST)活性用迈瑞BS-400全自动生化分析仪测定,检测相关的试剂盒均购自深圳迈瑞生物医疗电子股份有限公司。
肠道样品测定前先经4 ℃冰箱解冻并用滤纸吸干表面水分,然后剪取肠道组织约0.1 g加入生理盐水0.9 mL,制成10%的组织匀浆液,随后在4 ℃条件下4 000 r/min离心20 min,取上清液用于测定。蛋白质含量采用考马斯亮蓝法进行测定,蛋白酶(PTS)活性采用福林-酚试剂法测定,丙二醛(MDA)含量及脂肪酶(LPS)、淀粉酶(AMS)、铜锌超氧化物歧化酶(CuZn-SOD)、锰超氧化物歧化酶(Mn-SOD)、谷胱甘肽过氧化物(GSH-Px)和过氧化氢酶(CAT)活性均采用试剂盒测定,检测相关的试剂盒均购自南京建成生物工程研究所,具体的测定方法按照试剂盒的说明进行操作。
中肠经Bouin’s液中固定后,按照常规的切片程序依次进行脱水、透明、浸蜡、包埋、切片,然后进行伊红-苏木精(HE)染色,最后进行观察,并选取具有代表性的视野拍照,用以结果分析。用Tsview 7.0软件图像分析系统测量中肠绒毛高度和肌层厚度。
1.6 指标计算成活率(survival rate,SR)、增重率(weight gain rate,WGR)、特定生长率(specific growth rate,SGR)、蛋白质效率(protein efficiency ratio,PER)、饵料系数(feed conversion ratio,FCR)、摄食率(feed intake,FI)、肥满度(condition factor,CF)、肝体比(hepatosomatic index,HSI)、脏体比(viscerosomatic index,VSI)分别按下式计算:

|
试验数据用SPSS 24.0软件中的单因素方差分析(one-way ANOVA)和Duncan氏多重比较法检验各组间的差异,P<0.05表示差异显著,结果均以平均值±标准误(mean±SE)表示。
2 结果 2.1 发酵豆粕对团头鲂幼鱼生长性能及形体指标的影响由表 3可知,与对照组相比,D50组终末体重、WGR和SGR显著升高(P<0.05),D50和D75组PER也显著升高(P<0.05),而D50和D75组FCR显著降低(P<0.05)。各组之间SR和FI均没有显著差异(P>0.05)。
|
|
表 3 发酵豆粕对团头鲂幼鱼生长性能的影响 Table 3 Effects of fermented soybean meal on growth performance of juvenile blunt snout bream (n=3) |
由表 4可知,各组之间的CF、HSI和VSI均没有显著差异(P>0.05)。
|
|
表 4 发酵豆粕对团头鲂幼鱼形体指标的影响 Table 4 Effects of fermented soybean meal on morphology indices of juvenile blunt snout bream (n=12) |
由表 5可知,D50组血清TC含量最低,且显著低于对照组(P<0.05);而对照组血清ALT活性最高,且显著高于其他各组(P<0.05)。各组之间血清TP、GLU、TG含量及ALP、AST活性均没有显著差异(P>0.05)。
|
|
表 5 发酵豆粕对团头鲂幼鱼血清生化指标的影响 Table 5 Effects of fermented soybean meal on serum biochemical indices of juvenile blunt snout bream (n=12) |
由表 6可知,D25组肠道LPS活性显著高于D100组(P<0.05)。各组之间肠道PTS和MAS活性没有显著差异(P>0.05)。
|
|
表 6 发酵豆粕对团头鲂幼鱼肠道消化酶活性的影响 Table 6 Effects of fermented soybean meal on intestinal digestive enzyme activities of juvenile blunt snout bream (n=12) |
由表 7可知,与对照组相比,D50组肠道CuZn-SOD活性显著升高(P<0.05),D75组肠道Mn-SOD活性显著升高(P<0.05),D25、D50和D75组肠道GSH-Px活性显著升高(P<0.05),D75和D100组肠道CAT活性也显著升高(P<0.05)。各组之间肠道MDA含量没有显著差异(P>0.05)。
|
|
表 7 发酵豆粕对团头鲂幼鱼肠道抗氧化指标影响 Table 7 Effects of fermented soybean meal on intestinal antioxidant indices of juvenile blunt snout bream (n=12) |
由图 1可知,随着饲料中发酵豆粕含量的升高,中肠绒毛高度先升高后下降,并在D75组达到最大值且显著高于对照组(P<0.05)。由图 2可知,各组之间中肠肌层厚度没有显著差异(P>0.05)。
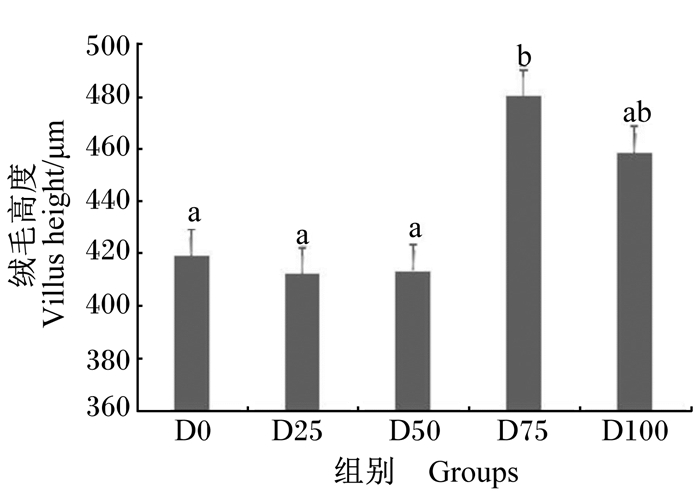
|
数据柱标相同小写字母或无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下图同。 Value columns with the same small or no letter superscripts mean no significant difference (P > 0.05), while with different small letters mean significant difference (P < 0.05). The same as below. 图 1 发酵豆粕对团头鲂幼鱼中肠绒毛高度的影响 Fig. 1 Effects of fermented soybean meal on midgut villus height of juvenile blunt snout bream |
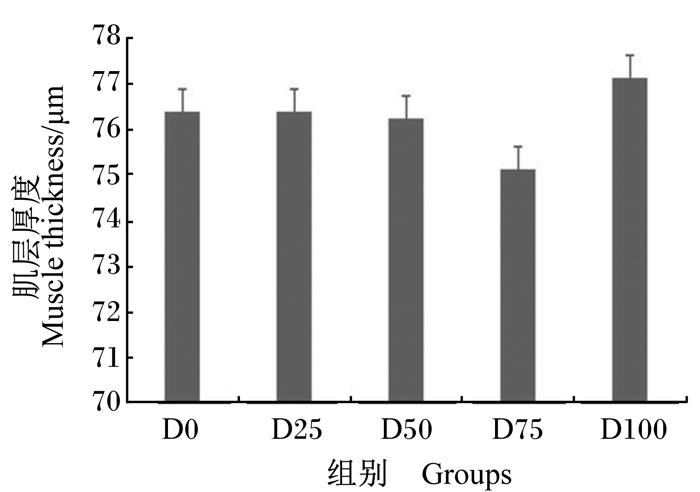
|
图 2 发酵豆粕对团头鲂幼鱼中肠肌层厚度的影响 Fig. 2 Effects of fermented soybean meal on midgut muscle thickness of juvenile blunt snout bream |
由图 3可知,对照组的病理症状最为明显,主要表现为黏膜上皮细胞脱落明显,绒毛空泡化严重,部分上皮细胞纹状缘发生融合。随着饲料中发酵豆粕含量的增加,试验组肠道组织结构有所改善,但仍出现了轻微的病理现象,D25和D100组出现少量黏膜上皮细胞脱落,D50组出现绒毛上皮纹状缘融合现象。相比之下,D75组的肠道组织结构相对完整,绒毛上皮细胞排列比较整齐。
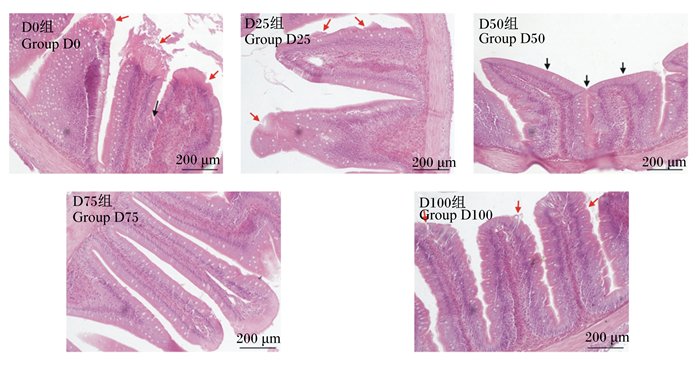
|
红色箭头表示黏膜上皮细胞部分脱落,黑色箭头表示纹状缘融合。 The red arrows indicate partial sloughing of mucosal epithelium tip, and the black arrows indicate a fusion of striated border. 图 3 发酵豆粕对团头鲂幼鱼肠道结构的影响 Fig. 3 Effects of fermented soybean meal on intestine structure of juvenile blunt snout bream (200×) |
本试验结果表明,发酵豆粕替代50%的复合植物蛋白质源能显著提高团头鲂幼鱼的WGR、SGR和PER,降低FCR。这说明发酵豆粕替代适量的植物蛋白质可以提高团头鲂幼鱼的饲料利用率和PER,从而促进生长。李云兰等[19]研究发现,发酵豆粕替代50%的豆粕可以显著提高鲤鱼(Cyprinus carpio)的PER。罗智等[21]研究表明,等氮替代饲料中22.1%的鱼粉,发酵豆粕组石斑鱼(Epinephelussp)的WGR、SGR和PER显著高于豆粕组。冷向军等[22]研究也表明,在同等替代10%的鱼粉蛋白质水平下,发酵豆粕组南美白对虾(Litopenaeus vannamei)的WGR显著高于豆粕组。究其原因,可能是因为豆粕经过微生物发酵处理后,其抗营养因子含量降低,小肽类物质和游离氨基酸含量增多,更有利于鱼类肠道的消化吸收,从而提高了饲料利用率,促进鱼类生长[20-21]。CF、HSI和VSI也是反映鱼类生长发育和健康状况的重要指标[23]。而本试验结果表明,各组之间CF、HSI和VSI没有显著差异,团头鲂形体特征正常。这说明发酵豆粕替代植物蛋白质不会影响团头鲂幼鱼的形体发育。值得注意的是,当发酵豆粕完全替代饲料中的复合植物蛋白质源时,团头鲂的生长性能略微下降,但较其他各组均无显著差异。这说明饲料中添加过量的发酵豆粕可能会对动物的生长产生负面影响,其可能与发酵豆粕的营养特性有关。发酵豆粕是豆粕经微生物发酵处理后的产物,其微生物含量远高于一般的植物蛋白质。从免疫学讲,微生物及其产物于动物而言都属于抗原,当它们进入动物体内后必将刺激机体产生抗体,而抗体的合成需要消耗能量和蛋白质,从而使得该阶段的饲料利用率降低[24-25]。这提示我们在饲料中添加发酵豆粕时,要注意其和其他蛋白质源之间的营养差异,适当地调整饲料中发酵豆粕的添加比例。
3.2 发酵豆粕对团头鲂幼鱼血清生化指标的影响鱼体的新陈代谢、生理状况以及健康等与血清TP、GLU和TG等指标密切相关,通过血清生化指标的检测可以评估机体的生长及健康状况[26]。ALP是与生物体内蛋白质、脂质和糖类等物质转化相关的重要代谢调控酶,也是与鱼类免疫相关的指标之一[27]。本试验结果表明,各组之间血清TP、GLU、TG含量和ALP活性均无显著差异,表明饲料中添加发酵豆粕对鱼体内主要营养物质的代谢转化功能没有影响。血清TC主要来自肝脏,是鱼体内脂类转运的主要形式之一,其含量的变化可以反映机体脂类吸收变化的状况,也是反映肝脏脂肪代谢状况的重要指标[28]。本试验结果表明,随着饲料中发酵豆粕含量的升高,血清TC含量先降后升,其中发酵豆粕在50%替代水平下血清TC含量较对照组显著下降,表明饲料中添加适量的发酵豆粕可以提高机体对脂类的吸收利用。研究表明,大豆蛋白质中的类雌激素异黄酮具有降胆固醇效应[29],而微生物发酵可以提高豆粕中的类雌激素异黄酮含量[30]。ALT和AST是体内营养物质代谢及转化过程中重要的转氨酶,通常情况下,血清ALT和AST活性较低,而肝脏受损时可能会导致血清ALT和AST活性升高[31]。本试验结果表明,与对照组相比,其他试验组血清ALT活性均显著下降,AST活性也有所下降但差异不显著,表明饲料中添加适量的发酵豆粕在一定程度上可以防止肝脏受损,保障机体健康。
3.3 发酵豆粕对团头鲂幼鱼肠道消化酶活性的影响鱼类对营养物质的消化分解作用主要依赖于机体消化系统分泌的消化酶,包括PTS、LPS和AMS等[32]。研究表明,豆粕等植物蛋白质中的胰蛋白酶抑制剂等抗营养因子会对鱼类肠道消化酶产生抑制作用[33-34],而经过微生物发酵处理后,其胰蛋白酶抑制因子、植酸等抗营养因子可被有效降解[35-36]。在牙鲆(Paralichthys olivaceus)上的研究发现,饲料中发酵和不发酵豆粕蛋白质替代不同水平的鱼粉蛋白质对肠道AMS活性没有显著影响,而在同等替代45%的鱼粉蛋白质水平下,根霉发酵豆粕组肠道胰蛋白酶活性显著高于不发酵豆粕组[37]。本试验结果表明,发酵豆粕替代不同水平的复合植物蛋白质源,对肠道PTS和AMS活性没有显著影响,而在25%~75%的替代水平下,肠道LPS活性有不同程度地提高,其中25%替代水平组的LPS活性达到最高且显著高于100%替代水平组,说明饲料中添加适量的发酵豆粕可以提高团头鲂幼鱼的消化能力。我们推测,一方面可能是因为相比于对照组,添加了发酵豆粕的替代组胰蛋白酶抑制因子、植酸等抗营养因子含量更低;另一方面,豆粕经微生物发酵后可能产生了益生菌、大豆肽等活性因子,适量的添加会能够促进动物肠道消化酶的合成和分泌,亦可提高肠道消化酶的活性[38]。
3.4 发酵豆粕对团头鲂幼鱼肠道抗氧化指标的影响MDA与鱼体组织和细胞氧化损伤紧密相关,是判断鱼体是否产生抗氧化应激的重要指标[39]。本试验结果表明,各试验组间肠道MDA含量没有显著差异,表明发酵豆粕替代植物蛋白质不会引起团头鲂肠道产生抗氧化应激。SOD、CAT和GSH-Px等是机体抗氧化系统中重要的抗氧化酶,它们能清除机体内细胞的正常代谢或受外源因素的诱导而产生的活性氧簇,降低机体的氧化应激[40]。本试验结果表明,饲料中添加适量的发酵豆粕可以显著提高团头鲂幼鱼肠道CuZn-SOD、Mn-SOD、GSH-Px和CAT活性。这可能与发酵豆粕含有的大豆抗氧化肽、大豆异黄酮甙元等生物活性分子有关[41-42],它们本身具有很强的氧化活性,对于抑制、延缓脂质氧化,保护机体组织器官免受自由基的侵害有特定作用[43-44];同时,大豆抗氧化肽还可诱导机体器官或细胞抗氧化蛋白质的表达,增强抗氧化酶活性,从而提高机体的抗氧化能力[45]。由此可见,饲料中添加适量的发酵豆粕能够提高团头鲂肠道抗氧化酶活性,增强机体的抗应激能力,减少鱼类疾病的发生。
3.5 发酵豆粕对团头鲂幼鱼肠道组织结构的影响肠道是鱼类进行营养物质消化吸收的主要器官,保证肠道功能的正常运行对机体的健康非常重要[46]。肠道绒毛的主要作用是扩大吸收面积,因此肠道绒毛高度可以作为判断机体吸收能力的重要依据[47]。肠道肌层厚度与营养物质的吸收速率有关,肌层厚度降低在一定程度上可以提高营养物质的跨膜转运效率[11, 48]。本试验通过显微观察发现,未添加发酵豆粕的对照组,团头鲂幼鱼肠道组织结构受损严重,肠绒毛发育不正常,而发酵豆粕替代适量的植物蛋白质源可以有效改善肠道组织结构,并促进肠绒毛的生长发育。D75组肠道绒毛高度出现最高值且显著高于对照组,且肠道肌层厚度相对较低,但各组间肌层厚度无显著差异。李云兰等[19]研究发现,发酵豆粕替代100%豆粕可以促进鲤鱼肠绒毛的生长发育,维持肠道功能正常。在大黄鱼(Larimichthys Crocea)[49]和眼斑拟石首鱼(Sciaenops ocellatus)[50]上的研究表明,饲料中添加适量发酵豆粕可以降低鱼类肠道的过敏反应,减轻肠道损伤,并维持肠道结构的完整。一方面,可能是因为豆粕经过发酵处理,抗营养因子含量减少,降低了肠道的氧化应激,保障了肠上皮细胞的正常增殖,这也与我们的抗氧化数据相吻合;另一方面,豆粕经过微生物的酵解作用会产生大量的小肽分子和其他活性因子,可能会对肠道的生长发育起到一定的促进作用[51]。
4 结论综上所述,本试验条件下,饲料中发酵豆粕替代50%~75%的复合植物蛋白质源,可以有效提高团头鲂幼鱼的生长性能,增强肠道消化和抗氧化能力,并改善肠道组织结构,保障肠道的健康发育。
| [1] |
陈丽纯. 全球鱼粉市场回顾与供求现状分析[J]. 中国水产, 2018(6): 74-78. |
| [2] |
DOSSOU S, KOSHIO S, ISHIKAWA M, et al. Effect of partial replacement of fish meal by fermented rapeseed meal on growth, immune response and oxidative condition of red sea bream juvenile, Pagrus major[J]. Aquaculture, 2018, 490: 228-235. DOI:10.1016/j.aquaculture.2018.02.010 |
| [3] |
杨小佳, 王金水, 管军军, 等. 豆粕的营养价值及影响因素[J]. 粮食与饲料工业, 2013(3): 44-46. |
| [4] |
TIBALDI E, HAKIM Y, UNI Z, et al. Effects of the partial substitution of dietary fish meal by differently processed soybean meals on growth performance, nutrient digestibility and activity of intestinal brush border enzymes in the European sea bass (Dicentrarchus labrax)[J]. Aquaculture, 2006, 261(1): 182-193. |
| [5] |
REFSTIE S, STOREBAKKEN T, ROEM A J. Feed consumption and conversion in Atlantic salmon (Salmo salar) fed diets with fish meal, extracted soybean meal or soybean meal with reduced content of oligosaccharides, trypsin inhibitors, lectins and soya antigens[J]. Aquaculture, 1998, 162(3/4): 301-312. |
| [6] |
宋霖, 蔡春芳, 叶元土, 等. 四种植物蛋白对黄颡鱼肠道形态结构的影响[J]. 淡水渔业, 2012, 42(6): 54-60. DOI:10.3969/j.issn.1000-6907.2012.06.010 |
| [7] |
BURRELLS C, WILLIAMS P D, SOUTHGATE P J, et al. Immunological, physiological and pathological responses of rainbow trout (Oncorhynchus mykiss) to increasing dietary concentrations of soybean proteins[J]. Veterinary Immunology and Immunopathology, 1999, 72(3/4): 277-288. |
| [8] |
杨奇慧, 谭北平, 周小秋, 等. 植物蛋白质复合物替代凡纳滨对虾饲料中鱼粉的研究[J]. 动物营养学报, 2014, 26(6): 1486-1495. DOI:10.3969/j.issn.1006-267x.2014.06.008 |
| [9] |
吴慧.乳酸菌固态发酵植物饼粕饲料的研究[D].硕士学位论文.泰安: 山东农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10434-1016114840.htm
|
| [10] |
刘稳结.混菌发酵生产鱼粉替代物的研究[D].硕士学位论文.大连: 大连工业大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10152-1014165569.htm
|
| [11] |
张秀敏.棉粕的发酵工艺及其在鲫鱼饲料中的应用研究[D].硕士学位论文.南京: 南京农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10307-1016043250.htm
|
| [12] |
肖萌.益生菌混合发酵菜籽粕及其营养特性的研究[D].硕士学位论文.长沙: 湖南农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10537-1015604314.htm
|
| [13] |
刘海燕, 秦贵信, 于维, 等. 发酵豆粕对仔猪生长性能、血液生化和抗氧化指标的影响[J]. 中国饲料, 2010(17): 19-21. DOI:10.3969/j.issn.1004-3314.2010.17.007 |
| [14] |
章世元, 全丽萍, 徐健超, 等. 发酵豆粕对断奶仔猪生长性能、养分消化率和胃肠道发育的影响[J]. 中国饲料, 2008(16): 8-11. DOI:10.3969/j.issn.1004-3314.2008.16.004 |
| [15] |
许丽惠, 祁瑞雪, 王长康, 等. 发酵豆粕对黄羽肉鸡生长性能、血清生化指标、肠道黏膜免疫功能及微生物菌群的影响[J]. 动物营养学报, 2013, 25(4): 840-848. DOI:10.3969/j.issn.1006-267x.2013.04.023 |
| [16] |
杜继忠. 发酵豆粕替代豆粕对快大黄羽肉鸡的应用效果[J]. 养禽与禽病防治, 2009(8): 14-15. |
| [17] |
林佳洁.发酵豆粕替代鱼粉对黄金鲫生长、免疫及肠道组织的影响[D].硕士学位论文.长春: 吉林农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10193-1016732974.htm
|
| [18] |
李惠, 黄峰, 胡兵, 等. 发酵豆粕替代鱼粉对斑点叉尾鮰生长和饲料表观消化率的影响[J]. 淡水渔业, 2007, 37(5): 41-44. DOI:10.3969/j.issn.1000-6907.2007.05.010 |
| [19] |
李云兰, 高启平, 帅柯, 等. 发酵豆粕替代豆粕对鲤鱼生长性能和肠道组织结构的影响[J]. 动物营养学报, 2015, 27(2): 469-475. DOI:10.3969/j.issn.1006-267x.2015.02.017 |
| [20] |
任鸣春, 周群兰, 缪凌鸿, 等. 团头鲂营养需求与健康研究进展[J]. 水产学报, 2015, 39(5): 761-768. |
| [21] |
罗智, 刘永坚, 麦康森, 等. 石斑鱼配合饲料中发酵豆粕和豆粕部分替代白鱼粉的研究[J]. 水产学报, 2004, 28(2): 175-181. |
| [22] |
冷向军, 王文龙, 周洪琪, 等. 不同大豆产品替代鱼粉饲养南美白对虾的试验[J]. 淡水渔业, 2006, 36(3): 47-49. DOI:10.3969/j.issn.1000-6907.2006.03.011 |
| [23] |
陈涛, 王爱民, 胡毅, 等. 饲料蛋白水平对梭鱼形体指标及血液生化指标的影响[J]. 江苏农业科学, 2018, 46(12): 125-129. |
| [24] |
江永才. 我国发酵饲料的生产现状及未来展望[J]. 饲料广角, 2005(7): 13-15. DOI:10.3969/j.issn.1002-8358.2005.07.005 |
| [25] |
宋文新, 邵庆均. 发酵豆粕在水产动物饲料中的应用[J]. 粮食与饲料工业, 2009(11): 28-30. DOI:10.3969/j.issn.1003-6202.2009.11.011 |
| [26] |
周玉, 郭文场, 杨振国, 等. 鱼类血液学指标研究的进展[J]. 上海水产大学学报, 2001, 10(2): 163-165. |
| [27] |
BERNSTINE E G, HOOPER M L, GRANDCHAMP S, et al. Alkaline phosphatase activity in mouse teratoma[J]. Proceedings of the National Academy of Sciences of the United States of America, 1973, 70(12): 3899-3903. DOI:10.1073/pnas.70.12.3899 |
| [28] |
傅伟龙, 江青艳, 高萍. 动物生理学[M]. 北京: 中国农业科技出版社, 2001.
|
| [29] |
LUI M C Y, AGUIAR C L, ALENCAR S M, et al. Isoflavones in soy protein isolate and soy protein concentrate[J]. Food Science and Technology, 2003, 23: 206-212. |
| [30] |
杨守凤, 徐建雄. 基于复合益生菌和枯草芽孢杆菌发酵转化大豆异黄酮的比较研究[J]. 饲料研究, 2014(3): 1-4, 24. |
| [31] |
杨景丰, 华雪铭, 郭子好, 等. 发酵豆粕替代鱼粉和豆粕对罗氏沼虾生长、血清生化及免疫基因表达的影响[J]. 水生生物学报, 2018, 42(4): 719-727. |
| [32] |
徐革锋, 陈侠君, 杜佳, 等. 鱼类消化系统的结构、功能及消化酶的分布与特性[J]. 水产学杂志, 2009, 22(4): 49-55. DOI:10.3969/j.issn.1005-3832.2009.04.013 |
| [33] |
ESCAFFRE A M, INFANTE J L Z, CAHU C L, et al. Nutritional value of soy protein concentrate for larvae of common carp (Cyprinus carpio) based on growth performance and digestive enzyme activities[J]. Aquaculture, 1997, 153(1/2): 63-80. |
| [34] |
RICHTER N, SIDDHURAJU P, BECKER K. Evaluation of nutritional quality of moringa (Moringa oleifera Lam.) leaves as an alternative protein source for Nile tilapia (Oreochromis niloticus L.)[J]. Aquaculture, 2003, 317(1/2/3/4): 599-611. |
| [35] |
HIRABAYASHI M, MATSUI T, YANO H, et al. Fermentation of soybean meal with Aspergillus usamii reduces phosphorus excretion in chicks[J]. Poultry Science, 1998, 77(4): 552-556. DOI:10.1093/ps/77.4.552 |
| [36] |
FENG J, LIU X, XU Z R, et al. Effects of Aspergillus oryzae 3.042 fermented soybean meal on growth performance and plasma biochemical parameters in broilers[J]. Animal Feed Science and Technology, 2007, 134(3/4): 235-242. |
| [37] |
陈京华.微生物发酵、外源酶制剂和促摄食物质对牙鲆(Paralichthys olivaceus)利用豆粕蛋白的影响[D].博士学位论文.青岛: 中国海洋大学, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10423-2006181475.htm
|
| [38] |
TOVAR-RAMÍREZ D, INFANTE J Z, CAHU C, et al. Influence of dietary live yeast on European sea bass (Dicentrarchus labrax) larval development[J]. Aquaculture, 2004, 234(1/2/3/4): 415-427. |
| [39] |
BAI S C, LEE K J. Different levels of dietary DL-α-tocopheryl acetate affect the vitamin E status of juvenile Korean rockfish, Sebastes schlegeli[J]. Aquaculture, 1998, 161(1/2/3/4): 405-414. |
| [40] |
陈光海, 刘晓平. Keap1-Nrf2信号通路与细胞氧化应激反应相关性研究进展[J]. 医学理论与实践, 2016, 29(15): 2012-2015. |
| [41] |
徐聪聪.固态发酵豆粕制备大豆抗氧化活性肽的研究[D].硕士学位论文.广州: 暨南大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10559-1013027413.htm
|
| [42] |
NAIM M, GESTETNER B, ZILKAH S, et al. Soybean isoflavones, characterization, determination, and antifungal activity[J]. Agriculture Food Chemistry, 1974, 22(5): 806-810. DOI:10.1021/jf60195a031 |
| [43] |
闫祥华, 顾景范, 孙存普, 等. 大豆异黄酮抗脂质过氧化作用及其机制初探[J]. 解放军预防医学杂志, 2000, 18(1): 14-17. DOI:10.3969/j.issn.1001-5248.2000.01.004 |
| [44] |
王银萍, 吴家祥, 张凤兰, 等. 大豆皂甙和人参茎叶皂甙对糖尿病大鼠血SOD和LPO的影响[J]. 白求恩医科大学学报, 1993, 19(2): 122-123. |
| [45] |
LEE J S. Effects of soy protein and genistein on blood glucose, antioxidant enzyme activities, and lipid profile in streptozotocin-induced diabetic rats[J]. Life Sciences, 2006, 79(16): 1578-1584. DOI:10.1016/j.lfs.2006.06.030 |
| [46] |
周小秋.营养物质与鱼肠道健康的关系[C]//中国畜牧兽医学会动物营养学分会第十一次全国动物营养学术研讨会论文集.长沙: 中国畜牧兽医学会, 2012: 246-260. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-SEKM201210002027.htm
|
| [47] |
吴桐强, 钟蕾, 刘庄鹏, 等. 谷氨酰胺二肽对草鱼幼鱼生长、血清生化、免疫指标及肠道组织结构的影响[J]. 动物营养学报, 2019, 31(8): 3682-3689. |
| [48] |
彭翔, 宋文新, 周凡, 等. 发酵豆粕替代鱼粉对黑鲷胃肠道和血清指标的影响[J]. 江苏农业学报, 2012, 28(5): 1096-1103. |
| [49] |
何娇娇, 王萍, 冯建, 等. 发酵豆粕对大黄鱼生长、肠道结构及肠道微生物菌群的研究[J]. 水生生物学报, 2018, 42(5): 919-928. |
| [50] |
ZHOU Q C, BUENTELLO J A, GATLIN Ⅲ D M. Effects of dietary prebiotics on growth performance, immune response and intestinal morphology of red drum (Sciaenops ocellatus)[J]. Aquaculture, 2010, 309(1/2/3/4): 253-257. |
| [51] |
EZQUERRA J M, GARCÍA-CARREÑO F L, CARRILLO O. In vitro digestibility of dietary protein sources for white shrimp (Penaeus vannamei)[J]. Aquaculture, 1998, 163(1/2): 123-136. |




