2. 苏州市阳澄湖国家现代农业示范区发展有限公司, 苏州 215123
2. Suzhou Yangchenghu National Modern Agricultural Industrial Park Co., Ltd., Suzhou 215123, China
甲壳动物的体色取决于类胡萝卜素含量[1]。然而由于缺乏相关酶系,甲壳动物不能从头合成类胡萝卜素,但它们可以将食物中的类胡萝卜素直接沉积或转化为自身所需的类胡萝卜素[2]。虾青素是甲壳动物体表色素中最主要的类胡萝卜素,它与蛋白质结合形成蓝色的虾青素蛋白质,使许多甲壳动物呈现出深青蓝体色。在高温条件下蛋白质变性,螯合物中虾青素解离显出本身的红色[3]。体色是甲壳动物商品质量的重要指标。
在人工养殖条件下,配合饲料中有效色源少且成分不稳定,导致了甲壳动物体色远不及纯天然的野生品种[4]。通过在配合饲料中添加特定的有效色源可以在一定程度上弥补上述不足[5]。然而,虾青素价格高昂,添加虾青素的成本占饲料配料成本的10%~20%[6],提高虾青素在动物体内沉积率成为降低成本的潜在途径。
虾青素作为一种脂溶性色素,其消化、吸收和转运需要有脂类存在。磷脂分子具有极性和非极性双亲性质,是一种良好的表面活性剂;磷脂本身容易被乳化,还具有乳化脂肪的作用[7]。研究表明,添加磷脂能够提高虾青素在肠道中的吸收率,有助于虾青素在体内沉积[8]。
虾青素结构中含有长的不饱和共轭系统,外层是不稳定的电子轨道,能够高效地清除细胞中的自由基[9]。游离虾青素清除自由基的能力是维生素E的500倍,当虾青素在体内清除活性氧自由基后会被还原为相应的酮等还原产物。因此,诱导氧化应激的因子可能会降低虾青素的沉积。而磷脂能提高抗氧化酶活性,从而降低活性氧自由基的产生[10]。因此,两者在抗氧化过程中可能具有协同效应,这可能是磷脂有利于虾青素沉积的又一潜在途径。
日本沼虾(Macrobrachium nipponense),又名河虾、青虾,隶属长臂虾科,沼虾属,是我国水产养殖中的一个重要品种,仅2016年的产量就达27.26万t[11]。日本沼虾甲壳颜色也是评价其商品质量的重要依据。因此,本研究以日本沼虾为对象,旨在探讨磷脂对虾青素沉积的影响及两者在氧化应激时的互作关系,为饲料虾青素的有效利用提供理论支持,也为揭示日本沼虾的抗氧化调节机制提供参考。
1 材料与方法 1.1 试验饲料以鱼粉、棉籽粕、豆粕、菜籽粕和花生粕为主要蛋白质源,以鱼油、豆油和磷脂为主要脂肪源,磷脂水平分别设为0、20和40 g/kg,虾青素水平分别设为0和4 g/kg,根据饲料中磷脂和虾青素的添加水平设计6个组:不添加磷脂和虾青素的对照组(CON组),分别添加20和40 g/kg磷脂组(PL1和PL2组),仅添加4 g/kg虾青素组(AX组),分别添加20 g/kg磷脂+4 g/kg虾青素和40 g/kg磷脂+4 g/kg虾青素组(AXPL1和AXPL2组)。试验饲料组成及营养水平见表 1。将各种固态原料混合后粉碎过80目筛,维生素和矿物质等微量原料采用逐级扩大法混合,再加入鱼油、豆油和磷脂以及水混合均匀,然后用双螺杆挤条机(LY双螺杆挤条机,常州市佳发制粒干燥设备有限公司)压制成粒径为1.0 mm的饲料,常温风干,密封后于-20 ℃保存备用。
|
|
表 1 试验饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) |
试验在苏州市阳澄湖国家现代农业示范区发展有限公司研究生工作站进行。日本沼虾购买于本地虾苗繁育场。在室内水泥池中驯养15 d,期间投喂对照组饲料。分组前禁食24 h,将2 160尾平均体重为(1.00±0.00) g的日本沼虾随机分为6组,每组3个重复,每个重复120尾。日本沼虾随机分配在18个体积为400 L的圆形塑料缸内饲养(盛水量300 L),每缸放养120尾,每种饲料投喂3缸虾。缸内放置有盆栽伊乐藻和聚氯乙烯(PVC)平网片作为日本沼虾附着物。每天07:30和18:30各饱食投喂1次。养殖期间及时捞出死虾、称重记录。养殖用水为经沉淀至少48 h的阳澄湖水。试验期间水温16~20 ℃,水体pH为7.40~8.20,氨浓度低于0.05 mg/L,连续增氧保持溶氧浓度在6.40~7.30 mg/L。每3天吸污1次并换水1/3。
4周后禁食24 h,称量每缸虾的总重并计数,每缸中随机取20尾试验虾直接制备分析样品,另随机取20尾虾进行氨胁迫试验:用氯化铵将水体氨浓度调制为(32.25±0.42) mg/L(纳氏比色法测定[12]),注入300 L的水族箱中,将虾移入,胁迫24 h后采样分析。
1.3 样品制备与分析方法 1.3.1 样品制备将虾置于冰盘上解剖,取肝胰腺组织,用4 ℃预冷的去离子水冲净,放入4%甲醛溶液固定,4 ℃冰箱保存,用于组织形态学观察。其余的肝组织用4 ℃预冷的去离子水冲净,放入EP管,用锡箔纸包裹于液氮速冻,置于-80 ℃冰箱中保存。
1.3.2 饲料营养水平测定水分含量测定采用低温冷冻干燥法(LJB18型冷冻干燥机,北京四环科学仪器厂有限公司),粗蛋白质含量测定采用凯氏定氮法(GB 5009.5—2010),粗脂肪含量测定采样索氏抽提法(GB/T 14772—2008)。
1.3.3 肝胰腺虾青素提取与测定虾青素的提取和测定方法参考Wang等[13]方法,称取0.20 g组织样品于研钵中研磨,用30 mL丙酮无损转入50 mL离心管离心,重复提取3次,合并上清液于分液漏斗。向分液漏斗加入按一定比例配制的正己烷、氯化钠(NaCl)和双蒸水混合液,充分混匀,静置,再于50 mL容量瓶定容。制备好的样品中虾青素含量采用高效液相色谱法测定。色谱柱为SUPELCOSILTM LC-18-DB HPLC Column: 250 mm×4.6 mm,流动相为甲醇:乙腈=9 : 1,流速1 mL/min,检测波长475 nm,柱温为室温,进样体积20 μL。虾青素标准曲线为y=76 369x+162.29 (R2=0.99)。
1.3.4 肝胰腺总抗氧化能力(T-AOC)和总超氧化物歧化酶(T-SOD)活性测定称取0.10 g左右肝胰腺组织,加入9倍体积0.86%预冷生理盐水,用高速匀浆机(S10高速匀浆机,上海沪析实业有限公司)制成匀浆液,2 500 r/min离心10 min,用试剂盒(南京建成生物工程研究所)测上清液中T-AOC和T-SOD活性。U/mg prot是指每毫克蛋白质中所含酶活性单位数。
1.3.5 肝胰腺超氧化物歧化酶(SOD)mRNA表达测定取-80 ℃保存的肝胰腺组织样品于液氮中研磨,参照Trizol使用说明书进行总RNA提取。用DNase Ⅰ对RNA进行消化处理,所得RNA经紫外分光光度计检测浓度,1%琼脂糖凝胶电泳检测后,按照PrimeScriptTM RT 1st strand cDNA Synthesis Kit试剂盒说明书合成cDNA的第1链,-20 ℃保存备用。参考原居林[14]克隆目的基因SOD,设计特异引物(表 2)。以无菌水作为阴性对照,以β-肌动蛋白(β-actin)为参比基因。20 μL反应体系为:稀释的cDNA样本2 μL、灭菌蒸馏水6 μL,SYBR Premix Ex Taq 10 μL,8 μmol/L的上、下游引物各1 μL。分析仪器为Line Gene 9600荧光定量PCR仪。反应程序为:95 ℃预变性20 s;95 ℃ 15 s,60 ℃ 2 s,共40个循环;熔解段95 ℃ 15 s、60 ℃ 60 s、95 ℃ 15 s。每次反应都通过从95 ℃降至60 ℃(4 ℃/s)绘出熔解曲线。试验结果用2-ΔΔCt方法[15]分析。
|
|
表 2 实时荧光定量PCR引物序列 Table 2 Primer sequences for real-time quantitative PCR |
取甲醛固定24 h后的肝胰腺组织样品,按常规组织切片制作程序进行脱水、透明、浸蜡、包埋、切片,切片厚度5 μm,苏木精-伊红(HE)染色。用显微成像系统(AXoskop显微镜,Carl Zeiss,德国;彩色摄像机,JVCKY-F30,日本)观察并拍摄。
1.4 数据分析数据采用SPSS 22.0软件进行统计分析,组间差异采用单因子方差分析(one-way ANOVA)和三因子方差分析(three-way ANOVA,3个因子分别为磷脂、虾青素及氨胁迫),差异显著时再进行Duncan氏法多重比较。试验所得数据以平均值±标准差(n=3)来表示。各组氨胁迫前与氨胁迫后的差异采用独立样本t检验。P<0.05为差异显著。
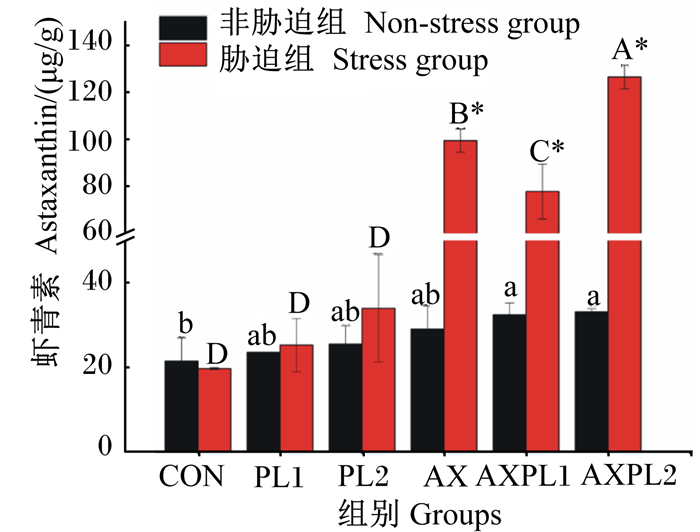
2 结果 2.1 肝胰腺中虾青素含量由图 1可见,氨胁迫前(非胁迫组),与CON组相比,PL1、PL2和AX组的肝胰腺中虾青素含量有所增加,但差异不显著(P>0.05);AXPL1和AXPL2组的肝胰腺中虾青素含量显著增加(P<0.05)。氨胁迫后(胁迫组),AX、AXPL1和AXPL2组的肝胰腺中虾青素含量大幅度升高,均显著高于CON组(P<0.05),且AXPL2组显著高于AX组(P<0.05)。同时,氨胁迫后的AX、AXPL1和AXPL2组的肝胰腺中虾青素含量显著高于氨胁迫前(P<0.05)。由表 3可见,三因子方差分析结果显示,磷脂、虾青素及氨胁迫均使肝胰腺中虾青素含量显著升高(P<0.05),且三因子中两两交互作用及三者交互作用显著(P<0.05)。
|
非胁迫组中,数据柱标不同小写字母表示差异显著(P<0.05)。胁迫组中,数据柱标不同大写字母表示差异显著(P<0.05)。*表示氨胁迫前与氨胁迫后差异显著(P<0.05)。下图同。 Among non-stress groups, value columns with different small letters mean significant difference (P < 0.05). Among stress groups, value columns with different capital letters mean significant difference (P < 0.05). * means significant difference between before and after ammonia stress(P < 0.05). The same as below. 图 1 不同饲料对日本沼虾肝胰腺中虾青素含量的影响 Fig. 1 Effects of different diets on hepatopancreas astaxanthin content of Macrobrachium nipponense |
|
|
表 3 三因子方差分析结果 Table 3 Results of three-way ANOVA |
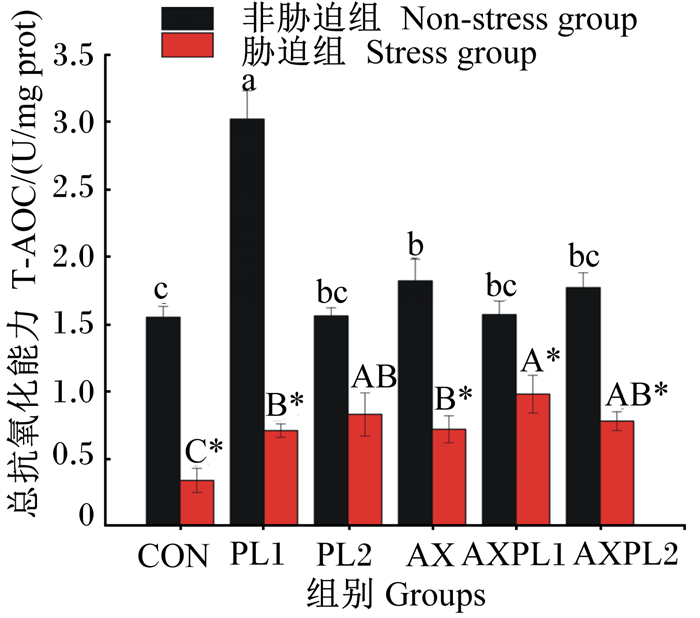
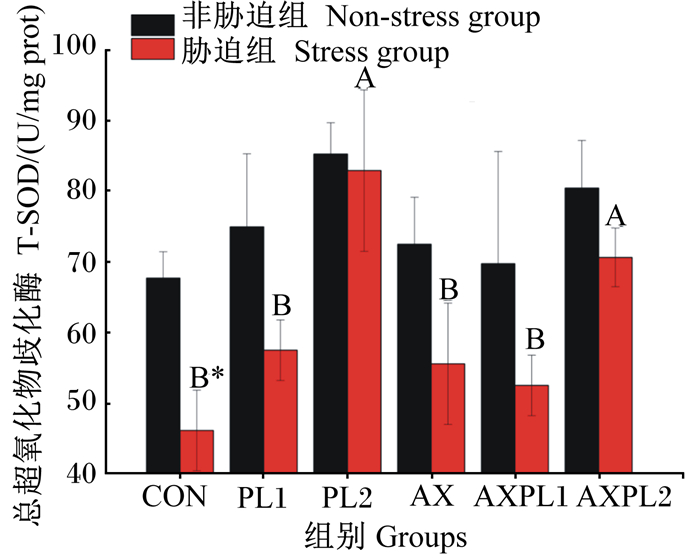
由图 2和图 3可见,氨胁迫前,与CON组相比,各试验组肝胰腺T-AOC均提高,其中PL1和AX组显著高于CON组(P<0.05);与CON组相比,各试验组肝胰腺T-SOD活性均提高,但无显著差异(P>0.05)。氨胁迫后,与CON组相比,各试验组肝胰腺T-AOC均显著提高(P<0.05),PL2和AXPL2组肝胰腺T-SOD活性显著提高(P<0.05)。同时,氨胁迫后各组肝胰腺T-AOC和T-SOD活性均下降,氨胁迫后的各组(除PL2组)的肝胰腺T-AOC显著低于氨胁迫前(P<0.05),氨胁迫后的CON组肝胰腺T-SOD活性显著低于氨胁迫前(P<0.05)。由表 3可见,三因子方差分析结果显示,磷脂使肝胰腺T-AOC和T-SOD活性显著升高(P<0.05),虾青素使肝胰腺T-AOC和T-SOD活性降低(P>0.05),氨胁迫使肝胰腺T-AOC和T-SOD活性显著下降(P<0.05)。三因子中肝胰腺T-AOC的两两交互作用及三者交互作用显著(P<0.05)。
|
图 2 不同饲料对日本沼虾肝胰腺T-AOC影响 Fig. 2 Effects of different diets on hepatopancreas T-AOC of Macrobrachium nipponense |
|
图 3 不同饲料对日本沼虾肝胰腺T-SOD活性影响 Fig. 3 Effects of different diets on hepatopancreas T-SOD activity of Macrobrachium nipponense |
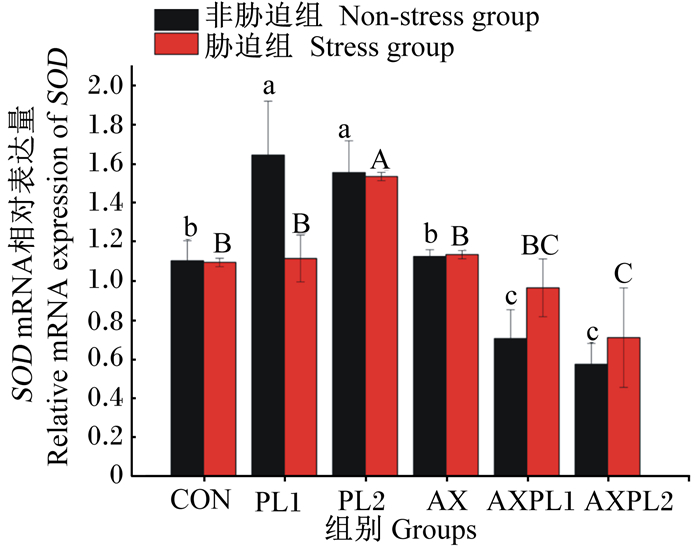
由图 4可见,氨胁迫前,与CON组相比,PL1和PL2组的肝胰腺SOD mRNA表达显著上调(P<0.05),AX组的肝胰腺SOD mRNA表达无显著变化(P>0.05);AXPL1和AXPL2组的肝胰腺SOD mRNA表达显著下调(P<0.05),且显著低于PL1、PL2、AX组(P<0.05)。氨胁迫后,与CON组相比,PL2组的肝胰腺SOD mRNA表达显著上调(P<0.05),PL1、AX和AXPL1组的肝胰腺SOD mRNA表达无显著变化(P>0.05),AXPL2组的肝胰腺SOD mRNA表达显著下调(P<0.05)。同时,与氨胁迫前相比,氨胁迫后的CON、PL1和PL2组的肝胰腺SOD mRNA表达下调(P>0.05),而AX、AXPL1和AXPL2组的肝胰腺SOD mRNA表达上调(P>0.05)。由表 3可见,三因子方差分析结果显示,磷脂及氨胁迫对肝胰腺SOD mRNA表达的影响不显著(P>0.05),虾青素使肝胰腺SOD mRNA表达显著下调(P<0.05)。虾青素与氨胁迫、虾青素与氨胁迫交互作用以及三者交互作用显著(P<0.05)。
|
图 4 不同饲料对日本沼虾肝胰腺SOD mRNA表达的影响 Fig. 4 Effects of different diets on expression of SOD mRNA in hepatopancreas of Macrobrachium nipponense |
摄食不同饲料的日本沼虾胁迫前肝胰腺组织切片照片见图 5。与CON组相比,PL1、PL2、AX、AXPL1和AXPL2组的肝胰腺B细胞数量均相对增多。

|
CNO:对照组 CON group;PL1:PL1组 PL1 group;PL2:PL2组 PL2 group;AX:AX组 AX group;AXPL1:AXPL1组 AXPL1 group;AXPL2:AXPL2组 AXPL2 group。B:B细胞 B cell。 图 5 摄食不同饲料的日本沼虾肝胰腺组织切片 Fig. 5 Tissue section of hepatopancreas of Macrobrachium nipponense feeding different diets (400×) |
肝胰腺中虾青素含量受饲料的影响较大[16]。单独添加虾青素能增加肝胰腺中虾青素含量,当有磷脂存在时,更加促进肝胰腺中虾青素积累。虾青素为非水溶性物质,因此肠道对其吸收较慢,有效利用率低[17]。磷脂具有双亲性,其极性头与虾青素分子中的羟基具有较高的亲和力[18],能够与虾青素形成混合胶束,乳化虾青素[19],从而有助于虾青素增溶,提高肠道吸收能力,进而提高虾青素在肝胰腺中含量。本研究结果提示,在饲料中添加虾青素时,应同时添加足量的磷脂,从而提高虾青素的利用率。
水产动物在正常生长代谢过程中会产生一定量的自由基,胁迫状态下产生的自由基更多[20]。自由基在体内积累会损伤DNA,导致细胞凋亡,进而降低水产动物生长性能、抗病力及存活率[21]。机体存在清除自由基的防御系统,包括酶促(SOD等)和非酶促(虾青素等)抗氧化系统。已有研究发现磷脂能激活抗氧化酶系转录和翻译,影响SOD基因的表达水平和抗氧化酶活力,而虾青素具有直接的抗氧化功能[22],能够高效地清除细胞中的自由基[9],因而降低对酶促抗氧化的依赖,降低肝胰腺SOD活性[23],下调肝胰腺SOD mRNA表达[24]。本试验中,磷脂显著提高了T-SOD活性和T-AOC,虾青素则显著下调了肝胰腺SOD mRNA表达,并使肝胰腺T-SOD活性和T-AOC有所下降,与上述报道一致。
轻度胁迫条件下,水产动物通过提高T-SOD活性和T-AOC清除过量产生的自由基[25]。但在强胁迫条件下,抗氧化酶活性下降[26]。本研究中,氨胁迫后CON组的日本沼虾肝胰腺T-SOD活性和T-AOC都显著低于氨胁迫前,提示本试验中氨浓度对日本沼虾胁迫较强,超过了其正常的生理调节范围,损伤了抗氧化系统[27]。单独或同时添加磷脂与虾青素均使胁迫后日本沼虾肝胰腺T-AOC显著升高(除PL2组),肝胰腺T-SOD活性也有所升高,表明添加磷脂或虾青素都有助于提高肝胰腺清除自由基的能力,有助于降低氧化应激损伤。
值得注意的是,本研究中发现,氨胁迫后的AX、AXPL1和AXPL2组的肝胰腺中虾青素含量显著高于氨胁迫前。这可能意味着胁迫状态下以虾青素为代表的非酶促抗氧化体系在日本沼虾氧化应激中扮演了重要角色,甚至可能是其抗氧化的首选途径[28]。氨胁迫后以AXPL2组肝胰腺中虾青素含量升幅最大,且显著高于AX组,提示较高的磷脂水平可能有利于日本沼虾对内源虾青素的调用。饲料中未添加虾青素的CON、PL1、PL2组则可能由于体内虾青素积累量少,没有足够的虾青素可调用,因此,胁迫后未见肝胰腺中虾青素含量显著升高。
赵卫红等[29]指出,B细胞是肝胰腺细胞中具有营养吸收功能的细胞。氧化损伤和中毒均可导致肝胰腺中B细胞数量减少[30]。实验室条件下光照、换水管理等胁迫因子较多,正常饲养时日本沼虾事实上也处于一定的环境胁迫之中。与CON组相比,单独和同时添加磷脂和虾青素时日本沼虾肝胰腺B细胞数量均相对增多,推测与磷脂和虾青素对肝胰腺氧化损伤的保护作用有关。
4 结论综上所述,饲料中添加磷脂有利于日本沼虾沉积外源虾青素和调用内源虾青素,体内沉积的虾青素能降低日本沼虾肝胰腺T-AOC和T-SOD活性,对肝胰腺形态具有保护作用。
| [1] |
齐霁, 陈立侨, 孙盛明, 等. 不同磷脂水平下中华绒螯蟹幼蟹的胆碱需要量[J]. 中国水产科学, 2013, 20(2): 372-379. |
| [2] |
DALL W. Carotenoids versus retinoids (vitamin A) as essential growth factors in penaeid prawns (Penaeus semisulcatus)[J]. Marine Biology, 1995, 124(2): 209-213. DOI:10.1007/BF00347124 |
| [3] |
HUSSEIN G, GOTO H, ODA S, et al. Antihypertensive potential and mechanism of action of astaxanthin:Ⅲ.Antioxidant and histopathological effects in spontaneously hypertensive rats[J]. Biological and Pharmaceutical Bulletin, 2006, 29(4): 684-688. DOI:10.1248/bpb.29.684 |
| [4] |
HIGUERA-CIAPARA I, FÉLIX-VALENZUELA L, GOYCOOLEA F M. Astaxanthin:a review of its chemistry and applications[J]. Critical Reviews in Food Science and Nutrition, 2006, 46(2): 185-196. DOI:10.1080/10408690590957188 |
| [5] |
YAMADA S, TANAKA Y, SAMESHIMA M, et al. Pigmentation of prawn (Penaeus japonicus) with carotenoids:Ⅰ.Effect of dietary astaxanthin, β-carotene and canthaxanthin on pigmentation[J]. Aquaculture, 1990, 87(3/4): 323-330. |
| [6] |
BAKER R T M, PFEIFFER A M, SCHÖNER F J, et al. Pigmenting efficacy of astaxanthin and canthaxanthin in fresh-water reared Atlantic salmon, Salmo salar[J]. Animal Feed Science and Technology, 2002, 99(1/2/3/4): 97-106. |
| [7] |
胡玲, 曾秋凤, 丁雪梅, 等. 饲粮添加大豆卵磷脂乳化剂对肉鸡生长性能、养分利用率和血清生化指标的影响[J]. 动物营养学报, 2012, 24(10): 1928-1938. DOI:10.3969/j.issn.1006-267x.2012.10.012 |
| [8] |
CAI X H, GRANT D J W, WIEDMANN T S. Analysis of the solubilization of steroids by bile salt micelles[J]. Journal of Pharmaceutical Sciences, 1997, 86(3): 372-377. DOI:10.1021/js9602148 |
| [9] |
CACECI T, NECK K F, LEWIS D D H, et al. Ultrastructure of the hepatopancreas of the Pacific white shrimp, Penaeus vannamei (Crustacea:Decapoda)[J]. Journal of the Marine Biological Association of the United Kingdom, 1988, 68(2): 323-337. DOI:10.1017/S002531540005222X |
| [10] |
FENG L, CHEN Y P, JIANG W D, et al. Modulation of immune response, physical barrier and related signaling factors in the gills of juvenile grass carp (Ctenopharyngodon idella) fed supplemented diet with phospholipids[J]. Fish & Shellfish Immunology, 2016, 48: 79-93. |
| [11] |
王志, 崔广同, 蔡春芳, 等. 磷脂影响日本沼虾对饲料中脂肪的需要量[J]. 动物营养学报, 2018, 30(6): 222-231. |
| [12] |
邹李昶, 任夙艺, 王志铮, 等. 氨氮急性胁迫对日本沼虾(Macrobrachium nipponensis)死亡率、耗氧率及窒息点的影响[J]. 海洋与湖沼, 2015, 46(1): 206-211. |
| [13] |
WANG Z, CAI C F, CAO X M, et al. Supplementation of dietary astaxanthin alleviated oxidative damage induced by chronic high pH stress, and enhanced carapace astaxanthin concentration of Chinese mitten crab Eriocheir sinensis[J]. Aquaculture, 2018, 483: 230-237. DOI:10.1016/j.aquaculture.2017.10.006 |
| [14] |
原居林.克氏原螯虾和日本沼虾体内微囊藻毒素累积净化规律研究[D].博士学位论文.咸阳: 西北农林科技大学2016. http://cdmd.cnki.com.cn/Article/CDMD-10712-1017008231.htm
|
| [15] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [16] |
麻楠, 龙晓文, 赵磊, 等. 饲料中添加合成虾青素对中华绒螯蟹成体雌蟹性腺发育、色泽和抗氧化能力的影响[J]. 水生生物学报, 2017, 41(4): 755-765. |
| [17] |
STOREBAKKEN T, NO H K. Pigmentation of rainbow trout[J]. Aquaculture, 1992, 100(1/2/3): 209-229. |
| [18] |
BRITTON G. Structure and properties of carotenoids in relation to function[J]. FASEB Journal, 1995, 9(15): 1551-1558. DOI:10.1096/fasebj.9.15.8529834 |
| [19] |
OLSEN R E, KIESSLING A, MILLEY J E, et al. Effect of lipid source and bile salts in diet of Atlantic salmon, Salmo salar L., on astaxanthin blood levels[J]. Aquaculture, 2005, 250(3/4): 804-812. |
| [20] |
HOLDOM M D, LECHENNE B, HAY R J, et al. Production and characterization of recombinant Aspergillus fumigatus Cu, Zn superoxide dismutase and its recognition by immune human sera[J]. Journal of Clinical Microbiology, 2000, 38(2): 558-562. |
| [21] |
WANG W N, ZHOU J, WANG P, et al. Oxidative stress, DNA damage and antioxidant enzyme gene expression in the Pacific white shrimp, Litopenaeus vannamei when exposed to acute pH stress[J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2009, 150(4): 428-435. |
| [22] |
裴素蕊, 管越强, 马云婷. 饲料中添加虾青素对凡纳滨对虾生长、存活和抗氧化能力的影响[J]. 水产科学, 2009, 28(3): 126-129. DOI:10.3969/j.issn.1003-1111.2009.03.003 |
| [23] |
WANG W N, WANG A L, ZHANG Y J. Effect of dietary higher level of selenium and nitrite concentration on the cellular defense response of Penaeus vannamei[J]. Aquaculture, 2006, 256(1/2/3/4): 558-563. |
| [24] |
XIE S W, FANG W P, WEI D, et al. Dietary supplementation of Haematococcus pluvialis improved the immune capacity and low salinity tolerance ability of post-larval white shrimp, Litopenaeus vannamei[J]. Fish & Shellfish Immunology, 2018, 80: 452-457. |
| [25] |
DUAN Y F, ZHANG Y, DONG H B, et al. Effect of desiccation on oxidative stress and antioxidant response of the black tiger shrimp Penaeus monodon[J]. Fish & Shellfish Immunology, 2016, 58: 10-17. |
| [26] |
GUNAWICKRAMA S H N P, AARSAETHER N, ORBEA A, et al. PCB77 (3, 3', 4, 4'-tetrachlorobiphenyl) co-exposure prolongs CYP1A induction, and sustains oxidative stress in B(a)P-exposed turbot, Scophthalmus maximus, in a long-term study[J]. Aquatic Toxicology, 2008, 89(2): 65-74. |
| [27] |
洪美玲, 陈立侨, 顾顺樟, 等. 氨氮胁迫对中华绒螯蟹免疫指标及肝胰腺组织结构的影响[J]. 中国水产科学, 2007, 14(3): 412-418. DOI:10.3321/j.issn:1005-8737.2007.03.010 |
| [28] |
ZHANG J, LIU Y J, TIAN L X, et al. Effects of dietary astaxanthin on growth, antioxidant capacity and gene expression in Pacific white shrimp Litopenaeus vannamei[J]. Aquaculture Nutrition, 2013, 19(6): 917-927. DOI:10.1111/anu.12037 |
| [29] |
赵卫红, 王资生, 张余霞, 等. 雌二醇对日本沼虾肝胰腺的脂肪酸含量及组织结构的影响[J]. 海洋渔业, 2014, 36(6): 542. DOI:10.3969/j.issn.1004-2490.2014.06.010 |
| [30] |
PINHO G L L, DA ROSA C M, YUNES J S, et al. Toxic effects of microcystins in the hepatopancreas of the estuarine crab Chasmagnathus granulatus (Decapoda, Grapsidae)[J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2003, 135(4): 459-468. |




