马匹在运动过程中,肌肉细胞收缩导致能量消耗以及体内代谢产物积累,是引起疲劳和影响运动成绩的重要因素。L-精氨酸(L-arginine, L-Arg)广泛参与机体代谢,它及其代谢产物在心血管、神经、免疫和内分泌系统中具有多种功能,可以调控蛋白质合成、促进蛋白质沉积[1-3],还能促进骨骼肌对脂肪酸和葡萄糖的氧化,增加骨骼肌糖原含量[4],降低血液中乳酸、氨含量[5-6],提高肌细胞能量利用效率,减少代谢废物的堆积,对机体运动代谢有重要意义。N-氨基甲酰谷氨酸(N-carbamylglutamate,NCG)是L-精氨酸前体的结构类似物,常用作增加精氨酸内源性合成的饲料添加剂[7]。目前,L-精氨酸作为运动营养补充剂在运动员中的应用已有研究,摔跤运动员运动前摄入L-精氨酸对递增运动的运动能力和代谢有积极影响[8]。健康男性补充L-精氨酸可降低中等强度运动的氧气(O2)消耗,延长剧烈运动时的耗竭时间[9]。但是在运动马中,L-精氨酸、N-氨基甲酰谷氨酸对血液中代谢物含量影响的研究鲜有报道。代谢组学可在不设定将要检测的具体指标时对代谢物“全景式”扫描,再对检测的显著代谢标志物和差异代谢物进行分析[10],可对机体的整体状态进行评价[11]。因此,本试验选用伊犁马速度赛用马为试验对象,应用非靶向代谢组学检测分析技术,探究L-精氨酸、N-氨基甲酰谷氨酸对伊犁马3 600 m速度赛赛前赛后血浆代谢物的影响,为L-精氨酸、N-氨基甲酰谷氨酸在调控速度赛用马运动代谢中的应用提供参考。
1 材料与方法 1.1 试验设计及饲粮组成挑选15匹年龄为2岁、体重[(388.88±23.24) kg]相近并经过严格训练的速度赛用伊犁马,测定3 600 m速度赛成绩后分为3组,分别为对照组、L-精氨酸组、N-氨甲酰谷氨酸组,每组5匹(3♂+2♀)。每日进行等强度训练,进行为期4周的补喂试验,试验第28天进行3 600 m速度赛。
试验马匹每天饲喂等量试验饲粮,每日饲粮由8 kg青干草和4 kg精料补充料组成。试验用精料补充料参照Xiao等[12]和Liu等[13]的研究按等能等氮设计配制。对照组精料补充料中添加30.75 g/kg L-丙氨酸[相当于补喂123 g/(匹·d)L-丙氨酸];L-精氨酸组参照Kelley等[9]研究结果,精料补充料中添加15.00 g/kg L-精氨酸[相当于补喂60 g/(匹·d)L-精氨酸];N-氨甲酰谷氨酸在运动马中的研究报道少见,因此N-氨甲酰谷氨酸组参考大鼠[13]、猪[14]研究中N-氨甲酰谷氨酸的添加比例,精料补充料中添加3.00 g/kg N-氨甲酰谷氨酸、27.9 g/kg L-丙氨酸[相当于补喂12 g/(匹·d)N-氨甲酰谷氨酸、112 g/(匹·d)L-丙氨酸]。试验饲粮组成及营养水平见表 1。
|
|
表 1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
试验马匹单厩饲养管理,自由饮水。试验饲粮由青干草和精料补充料组成。精料补充料每天每匹马4 kg,青干草每天每匹马8 kg,均分成3次补喂,分别在07:00、15:00和22:00。先粗后精,先采食青干草1 kg,再补给精料补充料,待精料补充料采食完毕后,继续添喂青干草。每天按时打扫马厩,清除粪便和垫料,更换垫草。
1.3 训练方案及场地试验马匹每天进行1次速度训练,马匹训练时间安排在11:30—13:30或者16:00—18:00。首先进行热身训练(骑师骑乘试验马先在草道上慢步2圈),随即进入沙道,进行5圈快步训练,然后7圈慢步训练,最后6圈跑步训练。训练场地为新疆昭苏种马场马匹训练赛道,赛道由椭圆形沙道和草道组成。内部沙道由细沙构成,深度40 cm,底部为土基,道宽21 m,周长为800 m;外部草道由天然牧草形成,宽20 m,周长为1 000 m。
1.4 血浆采集及预处理 1.4.1 血浆采集在正试期第28天进行的3 600 m速度赛,分别在赛前2 h、赛后即刻(即马匹完成赛程时立即采集血液)、赛后2 h使用肝素钠抗凝管采集血液,以3 500 r/min离心10 min,收集血浆,分装,液氮冻存。
1.4.2 样本预处理 1.4.2.1 试验样本预处理取待检测血浆样本100 μL置于EP管中,加入400 μL 80%的甲醇水溶液(4倍体积甲醇),涡旋振荡,置-20 ℃静置60 min,14 000×g、4 ℃离心20 min,取一定量的上清置于1.5 mL离心管中,真空冷冻干燥,残留物用100 μL的复溶剂进行溶解,涡旋振荡,14 000×g、4 ℃离心15 min,正离子模式取8 μL、负离子模式取12 μL上清液进样,进行液相色谱-质谱(LC-MS)分析。
1.4.2.2 质控(QC)样本预处理从每个已处理好的样本中取等量上清液混匀作为QC样本,blank样本为试验样本的空白基质,预处理过程与试验样本相同。
1.5 指标测定 1.5.1 色谱分析样品采用Vanquish UHPLC超高效液相色谱系统进行分离。柱温:40 ℃;流速:0.3 mL/min。正模式流动相组成:流动相A,0.1%甲酸、95%乙腈、10 mmol/L醋酸铵;流动相B,0.1%甲酸、50%乙腈、10 mmol/L醋酸铵。负模式流动相组成:流动相A,95%乙腈、10 mmol/L醋酸铵,pH 9.0;流动相B,50%乙腈、10 mmol/L醋酸铵,pH 9.0。色谱梯度洗脱程序见表 2。
|
|
表 2 色谱梯度洗脱程序 Table 2 Chromatographic gradient elution procedure |
样品经Vanquish UHPLC超高效液相色谱系统分离后用QE HF-X质谱仪进行质谱分析。扫描范围选择质荷比(m/z)100~1 500;电喷雾电离源(ESI源)的设置如下:电喷雾电压(spray voltage)3.2 kV;鞘气流速(sheath gas flow rate)35 arb;辅助气流速(aux gas flow rate)10 arb;加热毛细管温度(capillary temperature)320 ℃。极性(polarity):正极(positive),负极(negative);串联质谱(MS/MS)二级扫描为数据依赖扫描(data-dependent scans)。
1.6 数据处理将下机数据文件导入Compound Discoverer软件中,进行保留时间、质荷比等参数的简单筛选,然后对不同样品根据保留时间偏差0.2 min和质量偏差0.005‰进行峰对齐,使鉴定更准确,随后根据设置的质量偏差0.005‰、信号强度偏差30%、信噪比3、最小信号强度100 000、加和离子等信息进行峰提取,同时对峰面积进行定量,再整合目标离子,进行分子式的预测并与mzCloud数据库进行比对,用blank样本去除背景离子,用QC样本对定量结果进行归一化,最后得到数据的鉴定和定量结果。然后对数据进行质控,保证数据结果的准确度、可靠性,对代谢物进行主成分分析(PCA)、偏最小二乘法分析(PLS-DA)。PLS-DA模型以变量投影重要度(VIP)>1.0、差异倍数(FC)>1.2或FC < 0.833为差异显著水平。
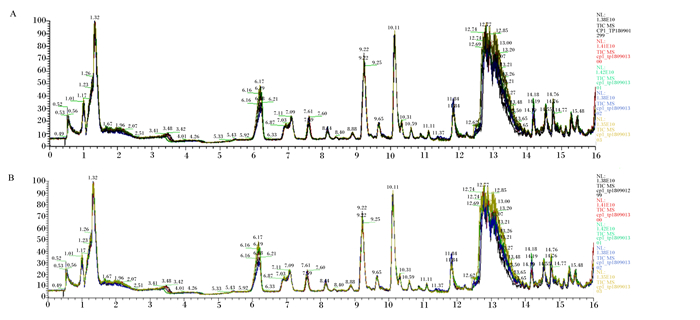
2 结果与分析 2.1 代谢物总离子色谱图伊犁马血浆中代谢物总离子色谱图见图 1。采用非靶向分析方法,以伊犁马血浆为研究对象,获得正、负离子检测模式下的原始数据。经数据格式转换、峰识别、峰滤过与峰对齐,最终获得包括质荷比、保留时间及其峰面积的2个二维数据阵。使用Compound Discoverer软件根据离子流图提取化合物信息,在mzCloud数据库中进行化合物对比鉴定及确证,对化合物精确定性和相对定量。
|
横坐标为保留时间,纵坐标为离子强度,反映了血浆样本中各组分随保留时间的变化规律。A为正离子模式,B为负离子模式。 The abscissa is the retention time, and the ordinate is the ionic strength, which reflects the change of the retention time of each component in the plasma sample. A is positive ion mode and B is negative ion mode. 图 1 伊犁马血浆中代谢物总离子色谱图 Fig. 1 Total ion chromatography of plasma metabolites of Yili horses |
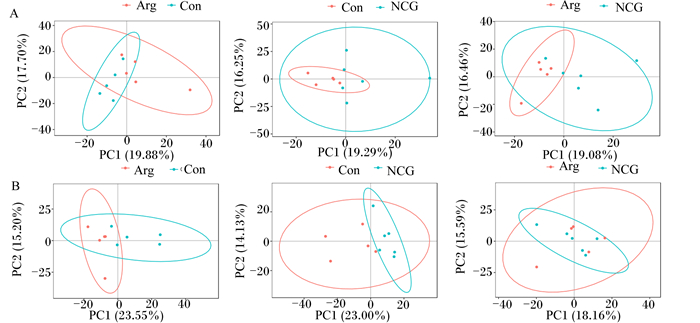
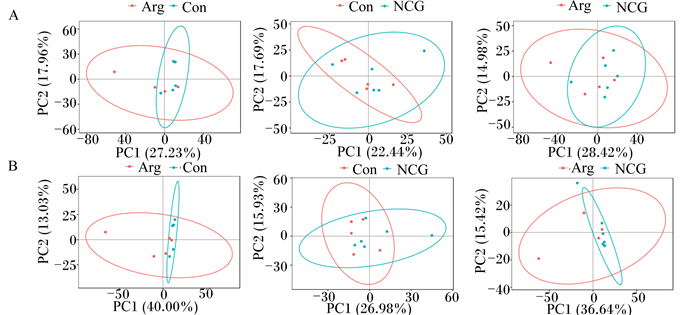
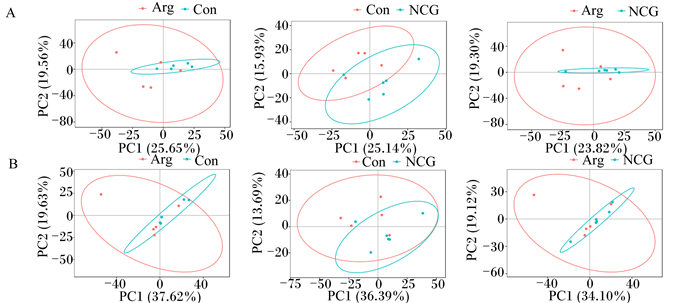
对不同组样本数据进行无事监督的PCA,得分图见图 2、图 3、图 4。由图可知,各组样本均处于椭圆置信区间内,并且5个质控样本能够较好地聚类在一起,说明代谢物检测系统的稳定性较好,代谢物检测数据可靠。虽然不同组样本间有交叉现象,但是不同组之间仍有明显分开区域,可通过深入分析进一步研究不同组血浆代谢物的差异。
|
图中横坐标PC1和纵坐标PC2分别表示排名第1和第2的主成分的得分,散点颜色表示样本的分组,置信椭圆为95%。A为正离子模式,B为负离子模式。Con:对照组;Arg:L-精氨酸组;NGG:N-氨甲酰谷氨酸组。图 3、图 4同。 The transverse PC1 and the vertical PC2 indicate the scores of the first and second principal components, respectively. The scatter color indicates the group of the sample, and the confidence ellipse is 95%. A is the positive ion mode and B is the negative ion mode. Con: control group; Arg: L-Arg group; NGG: NCG group. The same as Fig. 3 and Fig. 4. 图 2 不同组伊犁马3 600 m速度赛赛前2 h血浆代谢物PCA得分图 Fig. 2 PCA score plot of plasma metabolites at 2 h before 3 600 m speed race of Yili horses in different groups |
|
图 3 不同组伊犁马3 600 m速度赛赛后即刻血浆代谢物PCA得分图 Fig. 3 PCA score plot of plasma metabolites at immediately after 3 600 m speed race of Yili horses in different groups |
|
图 4 不同组伊犁马3 600 m速度赛赛后2 h血浆代谢物PCA得分图 Fig. 4 PCA score plot of plasma metabolites at 2 h after 3 600 m speed race of Yili horse in different groups |
运用偏最小二乘回归建立代谢物表达量与样本类别之间的关系模型,来实现对样本类别的预测。建立各组的PLS-DA模型,经七次循环交互验证(7-fold cross-validation)得到的模型评价参数(R2、Q2)见表 3,R2和Q2越接近1表明模型越稳定可靠。表 3中结果显示本试验采用正离子和负离子模式数据建立的PLS-DA模型其模型解释能力较强,预测能力较差,但排序检验R2>Q2,说明该模型的解释能力大于该模型的预测能力,未“过拟合”,说明模型能较好的描述样本,较可靠。
|
|
表 3 PLS-DA模型及排序检验的评价参数 Table 3 Evaluation parameters of PLS-DA model and sort check |
采用PLS-DA模型第一主成分的VIP值,并结合t检验的P值来寻找差异性表达代谢物,设置阈值为VIP>1.0、FC>1.2或FC < 0.833且P < 0.05。
2.3.1 补喂L-精氨酸或N-氨甲酰谷氨酸对伊犁马3 600 m速度赛赛前2 h血浆中代谢物的影响补喂L-精氨酸或N-氨甲酰谷氨酸对伊犁马3 600 m速度赛赛前2 h血浆中代谢物的影响见表 4。与对照组相比,L-精氨酸组血浆精氨酸、乙酰谷氨酸、谷氨酰脯氨酸、亮氨酸、色氨酸、5-羟色氨酸、柠檬酸含量显著升高(P < 0.05),血浆L-丙氨酸、L-γ-谷氨酰丙氨酸、乙酰精氨酸、谷氨酰胺含量显著降低(P < 0.05);N-氨甲酰谷氨酸组血浆精氨酸、乙酰谷氨酸、乙酰亮氨酸、亮氨酸、色氨酸、5-羟色氨酸、胆红素含量显著升高(P < 0.05),血浆L-丙氨酸、L-γ-谷氨酰丙氨酸、天冬氨酸、甘氨酸含量显著降低(P < 0.05)。L-精氨酸组与N-氨甲酰谷氨酸组相比,血浆色氨酸、5-羟色氨酸、犬尿氨酸、苏氨酸含量显著升高(P < 0.05),血浆乙酰精氨酸、谷氨酰胺、亮氨酸、组氨酸、胆红素、丙二醛含量显著降低(P < 0.05)。
|
|
表 4 补喂L-精氨酸或N-氨甲酰谷氨酸对伊犁马3 600 m速度赛赛前2 h血浆中代谢物的影响 Table 4 Effects of supplemented with L-arginine or NCG on plasma metabolites at 2 h before 3 600 m speed race of Yili horses (n=5) |
补喂L-精氨酸或N-氨甲酰谷氨酸对伊犁马3 600 m速度赛赛后即刻血浆中代谢物的影响见表 5。与对照组相比,L-精氨酸组血浆鸟氨酸、乙酰谷氨酸、脯氨酰胺、γ-亮氨酸、α-酮己二酸含量显著升高(P < 0.05),血浆乳酸含量显著降低(P < 0.05);N-氨甲酰谷氨酸组血浆乙酰谷氨酸、乙酰亮氨酸、甘氨酸含量显著升高(P < 0.05),血浆乳酸、胆红素含量显著降低(P < 0.05)。L-精氨酸组与N-氨甲酰谷氨酸组相比,血浆组氨酸、苯丙氨酸、α-酮己二酸含量显著升高(P < 0.05)。
|
|
表 5 补喂L-精氨酸或N-氨甲酰谷氨酸对伊犁马3 600 m速度赛赛后即刻血浆中代谢物的影响 Table 5 Effects of supplemented with L-arginine or NCG on plasma metabolites at immediately after 3 600 m speed race of Yili horses (n=5) |
补喂L-精氨酸或N-氨甲酰谷氨酸对伊犁马3 600 m速度赛后2 h血浆代谢物的影响见表 6。与对照组相比,L-精氨酸组血浆精氨酸、乙酰精氨酸、赖氨酸、酪氨酸、乙酰苯丙氨酸、胆红素、D-葡萄糖-6-磷酸含量显著升高(P < 0.05);NCG组血浆乙酰苯丙氨酸、乙酰色氨酸、L-苏氨酸含量显著升高(P < 0.05),血浆L-亮氨酸、乙酰亮氨酸、γ-谷氨酰亮氨酸、乙酰肉碱、半胱天冬酰胺含量显著降低(P < 0.05)。L-精氨酸组与N-氨甲酰谷氨酸组相比,血浆精氨酸、鸟氨酸、乙酰精氨酸、L-组氨酸含量显著升高(P < 0.05),血浆L-苏氨酸含量显著降低(P < 0.05)。
|
|
表 6 补喂L-精氨酸或N-氨甲酰谷氨酸对伊犁马3 600速度赛后2 h血浆代谢物的影响 Table 6 Effects of supplemented with L-arginine or NCG on plasma metabolites at 2 h after 3 600 m speed race of Yili horses (n=5) |
本试验采用非靶向代谢组学的方法对伊犁马3 600 m速度赛赛前2 h、赛后即刻、赛后2 h这3个时间点的血浆代谢小分子进行测定,各时间点两两对比,以VIP>1.0、FC>1.2或FC < 0.833且P < 0.05为阈值,筛选出L-精氨酸组、N-氨甲酰谷氨酸组伊犁马的血浆差异代谢小分子。结果显示,补喂L-精氨酸、N-氨甲酰谷氨酸主要影响了伊犁马血浆能量供应系统和氨基酸的代谢。
补喂L-精氨酸提高了伊犁马赛前2 h血浆柠檬酸、赛后即刻血浆α-酮己二酸、赛后2 h血浆D-葡萄糖-6-磷酸含量,降低了赛后即刻血浆乳酸含量。柠檬酸是机体三羧酸循环(TCA循环)的重要参与物质,而TCA循环是三大营养素(碳水化合物、脂类、蛋白质)的最终代谢通路,又是碳水化合物、脂类、蛋白质代谢联系的枢纽,与机体能量代谢密切相关。α-酮己二酸是机体能量代谢的中间产物。乳酸是碳水化合物不完全氧化的能量代谢产物,D-葡萄糖-6-磷酸是由葡萄糖经过激酶催化生成,既可进入糖酵解途径氧化,也可进入磷酸戊糖途径代谢,是各个糖代谢途径的交叉点。本试验结果说明补喂L-精氨酸能够影响伊犁马运动能量代谢,其中提高柠檬酸含量可促进TCA循环,提高D-葡萄糖-6-磷酸含量、降低乳酸含量证明加速了糖酵解途径的代谢,表明补喂L-精氨酸是正向促进伊犁马运动能量代谢,利于运动性能的发挥。补喂N-氨甲酰谷氨酸降低了伊犁马赛后即刻血浆乳酸含量,说明补喂N-氨甲酰谷氨酸也能够影响伊犁马的运动能量代谢。已有研究发现,在肉鸡饲粮中添加0.5%L-精氨酸可改善热应激状态下胸肌的能量代谢[15],饲喂含有1%精氨酸或0.01%N-氨甲酰谷氨酸的饲粮显著降低了大鼠尿液中β-葡萄糖、乳酸含量[13],证明了补喂L-精氨酸、N-氨甲酰谷氨酸可影响机体的能量代谢。
补喂L-精氨酸、N-氨甲酰谷氨酸显著影响了伊犁马的氨基酸代谢,补喂L-精氨酸显著提高了赛前2 h血浆精氨酸含量,并降低了谷氨酰胺含量,提高了乙酰谷氨酸、谷氨酰脯氨酸含量,表明补喂L-精氨酸促进了精氨酸向脯氨酸的代谢。L-精氨酸组赛后即刻血浆精氨酸含量与对照组无显著差异,但血浆鸟氨酸含量得到提升,表明运动使得精氨酸代谢加快,更多的代谢为鸟氨酸、乙酰谷氨酸和脯氨酰胺。此外,L-精氨酸组赛后2 h血浆精氨酸含量回升,显著高于对照组。综上,补喂L-精氨酸促进了伊犁马血浆精氨酸向脯氨酸的代谢。补喂N-氨甲酰谷氨酸只提高了赛前2 h血浆精氨酸的含量,表明补喂N-氨甲酰谷氨酸显著影响了精氨酸的合成途径,可提高精氨酸的内源性合成。
补喂L-精氨酸、N-氨甲酰谷氨酸显著提高了赛前2 h血浆亮氨酸、色氨酸、5-羟色氨酸含量,影响了血浆亮氨酸、色氨酸代谢。亮氨酸属于支链氨基酸,参与供能的物质之一。经过长时间运动,肌糖原下降,肌肉和肝脏通过从血液中摄取支链氨基酸(BCAA)氧化供能,导致运动后血浆中BCAA含量下降[16-17]。色氨酸是5-羟色胺(5-HT)的前体物质,脑内5-HT合成增加就是由于大脑吸收血液运输传递的游离色氨酸而引起的,5-HT具有很多的生理调节作用,尤其是对中枢神经系统的调节作用,可以引起机体中枢疲劳。而BCAA含量不仅与运动供能有关,也关系到脑中游离色氨酸的含量,因为BCAA能竞争结合色氨酸在血脑屏障上的载体——白蛋白通道[18-20],BCAA被氧化为骨骼肌收缩过程提供的能量,导致BCAA含量减少,减少竞争抑制使得更多游离色氨酸进入到大脑中,利于5-HT的合成,造成中枢疲劳[21-23]。
4 结论本试验应用非靶向代谢组学技术,筛选出了补喂L-精氨酸或N-氨甲酰谷氨酸后伊犁马3 600 m速度赛赛前赛后血浆中的差异性表达代谢物,揭示出补喂L-精氨酸或N-氨甲酰谷氨酸能够促进伊犁马运动能量代谢,影响氨基酸代谢,促进精氨酸内源性合成和精氨酸向脯氨酸的代谢。
| [1] |
YAO K, YIN Y L, CHU W Y, et al. Dietary arginine supplementation increases mTOR signaling activity in skeletal muscle of neonatal pigs[J]. The Journal of Nutrition, 2008, 138(5): 867-872. DOI:10.1093/jn/138.5.867 |
| [2] |
KIM J Y, BURGHARDT R C, WU G Y, et al. Select nutrients in the ovine uterine lumen.Ⅶ.Effects of arginine, leucine, glutamine, and glucose on trophectoderm cell signaling, proliferation, and migration[J]. Biology of Reproduction, 2011, 84(1): 62-69. DOI:10.1095/biolreprod.110.085738 |
| [3] |
KIM J, ERIKSON D W, BURGHARDT R C, et al. Secreted phosphoprotein 1 binds integrins to initiate multiple cell signaling pathways, including FRAP1/mTOR, to support attachment and force-generated migration of trophectoderm cells[J]. Matrix Biology, 2010, 29(5): 369-382. DOI:10.1016/j.matbio.2010.04.001 |
| [4] |
MCKNIGHT J R, SATTERFIELD M C, JOBGEN W S, et al. Beneficial effects of L-arginine on reducing obesity:potential mechanisms and important implications for human health[J]. Amino Acids, 2010, 39(2): 349-357. |
| [5] |
LI X J, LIU W H, WANG Q, et al. Emodin suppresses cell proliferation and fibronectin expression via p38MAPK pathway in rat mesangial cells cultured under high glucose[J]. Molecular and Cellular Endocrinology, 2009, 307(1/2): 157-162. |
| [6] |
田吉明, 丁树哲, 汪军. 补充L-精氨酸对力竭性游泳导致的小鼠骨骼肌氧化性损伤的保护作用[J]. 中国体育科技, 2007, 43(1): 125-127, 132. DOI:10.3969/j.issn.1002-9826.2007.01.033 |
| [7] |
WU G Y, KNABE D A, KIM S W. Arginine nutrition in neonatal pigs[J]. The Journal of Nutrition, 2004, 134(Suppl.10): 2783S-2790S. |
| [8] |
YAVUZ H U, TURNAGOL H, DEMIREL A H. Pre-exercise arginine supplementation increases time to exhaustion in elite male wrestlers[J]. Biology of Sport, 2014, 31(3): 187-191. DOI:10.5604/20831862.1111436 |
| [9] |
BAILEY S J, WINYARD P G, VANHATALO A, et al. Acute L-arginine supplementation reduces the O2 cost of moderate-intensity exercise and enhances high-intensity exercise tolerance[J]. Journal of Applied Physiology, 2010, 109(5): 1394-1403. DOI:10.1152/japplphysiol.00503.2010 |
| [10] |
黄彩华, 归予恒, 林东海. 代谢组学:运动人体科学研究的新工具[J]. 体育科学, 2011, 31(9): 77-84. DOI:10.3969/j.issn.1000-677X.2011.09.010 |
| [11] |
NICHOLSON J K, LINDON J C, HOLMES E. 'Metabonomics':understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data[J]. Xenobiotica, 1999, 29(11): 1181-1189. DOI:10.1080/004982599238047 |
| [12] |
XIAO L, CAO W, LIU G M, et al. Arginine, N-carbamylglutamate, and glutamine exert protective effects against oxidative stress in rat intestine[J]. Animal Nutrition, 2016, 2(3): 242-248. DOI:10.1016/j.aninu.2016.04.005 |
| [13] |
LIU G M, XIAO L, CAO W, et al. Changes in the metabolome of rats after exposure to arginine and N-carbamylglutamate in combination with diquat, a compound that causes oxidative stress, assessed by 1H NMR spectroscopy[J]. Food & Function, 2016, 7(2): 964-974. |
| [14] |
肖亮.精氨酸、N-氨甲酰谷氨酸、谷氨酰胺对大鼠营养代谢与抗氧化能力的影响[D].硕士学位论文.雅安: 四川农业大学, 2015.
|
| [15] |
杨书慧, 谭灵琳, 周建, 等. L-精氨酸对热应激肉鸡肌肉品质和抗氧化功能及能量代谢的影响[J]. 中国畜牧杂志, 2014, 50(19): 37-41. DOI:10.3969/j.issn.0258-7033.2014.19.009 |
| [16] |
赵稳兴, 王先远, 许志勤, 等. 运动小鼠心肌和骨骼肌对支链氨基酸的摄取及其对蛋白质合成的作用[J]. 中国应用生理学杂志, 1999, 15(2): 127-130. |
| [17] |
BLOMSTRAND E, ANDERSSON S, HASSMÉN P, et al. Effect of branched-chain amino acid and carbohydrate supplementation on the exercise-induced change in plasma and muscle concentration of amino acids in human subjects[J]. Acta Physiologica Scandinavica, 1995, 153(2): 87-96. DOI:10.1111/j.1748-1716.1995.tb09839.x |
| [18] |
LEITE L H R, RODRIGUES A G, SOARES D D, et al. Central fatigue induced by losartan involves brain serotonin and dopamine content[J]. Medicine & Science in Sports & Exercise, 2010, 42(8): 1469-1476. |
| [19] |
BAEK I H, LEE T, SONG M, et al. Effect of circuit class training for eight weeks on changes in ratios of F-Trp/BCAAs and depression in people with poststroke depression[J]. Journal of Physical Therapy Science, 2014, 26(2): 243-246. DOI:10.1589/jpts.26.243 |
| [20] |
SHARIEF M K, THOMPSON E J. In vivo relationship of tumor necrosis factor-α to blood-brain barrier damage in patients with active multiple sclerosis[J]. Journal of Neuroimmunology, 1992, 38(1/2): 27-33. |
| [21] |
DAVIS J M, ALDERSON N L, WELSH R S. Serotonin and central nervous system fatigue:nutritional considerations[J]. The American Journal of Clinical Nutrition, 2000, 72(Suppl.2): 573S-578S. |
| [22] |
MCMORRIS T, BARWOOD M, CORBETT J. Central fatigue theory and endurance exercise:toward an interoceptive model[J]. Neuroscience & Biobehavioral Reviews, 2018, 93: 93-107. |
| [23] |
MÁRQUEZ G, ROMERO-ARENAS S, MARÍN-PAGÁN C, et al. Peripheral and central fatigue after high intensity resistance circuit training[J]. Muscle & Nerve, 2017, 56(1): 152-159. |




