2. 农业部华南动物营养与饲料重点实验室, 广州 510640;
3. 广东省畜禽育种与营养研究重点实验室, 广州 510640
2. Key Laboratory of Animal Nutrition and Feed Science in South China of Ministry of Agriculture, Guangzhou 510640, China;
3. Guangdong Key Laboratory of Animal Breeding and Nutrition, Guangzhou 510640, China
精氨酸是鱼类的10种必需氨基酸之一[1]。研究表明,精氨酸参与调节机体多种生理生化过程,可以促进水产动物生长性能,提高机体免疫、抗氧化应激能力和维护肠道正常形态结构等[2-3]。N-氨甲酰谷氨酸(N-carbamylglutamate,NCG)是内源性精氨酸合成的必需辅助因子,能够促进尿素(UR)循环提高内源精氨酸的合成[4]。目前,NCG主要应用于畜禽动物,在抗氧化应激、生长繁殖、肠道健康、改善肌肉品质等方面有很好的效果[5-7]。
黄颡鱼(Pelteobagrus fulvidraco)属鲇形目,科,黄颡鱼属,是具较大开发价值的中高档名贵品种,近年来养殖规模增长迅速。然而,随着单位面积产量提高、放养密度增加及养殖规模扩大,黄颡鱼受到的环境胁迫因素增加,抗氧化应激能力降低。动物可利用NCG高效合成内源精氨酸[4],然而NCG在水生动物方面的应用报道较少,仅见NCG对尼罗罗非鱼(Oreochromis niloticus)[8]和大菱鲆(Scophthalmus maximus)[9]的研究,尚未见有关NCG在黄颡鱼中的应用报道。本试验室前期研究显示,饲料中添加适宜水平的精氨酸显著提高黄颡鱼幼鱼生长性能和抗氨氮应激能力[10]。为此,本试验以黄颡鱼为研究对象,研究NCG对黄颡鱼生长性能、体成分、血清生化指标和抗氨氮应激能力的影响,评估NCG在实用饲料中适宜添加量,为NCG在黄颡鱼配合饲料中的应用提供相关的理论依据。
1 材料与方法 1.1 试验饲料以鱼粉、豆粕、面粉、鱼油、豆油等为主要原料,采用丙氨酸调节饲料氮平衡,参照本实验室前期试验饲料配方[11]配制基础饲料(不添加NGG),并在基础饲料中分别添加250、500、1 000、2 000 mg/kg的NCG配制4种试验饲料,5种饲料等氮等脂(42%粗蛋白质和7%脂肪),记作N0、N250、N500、N1000、N2000。NCG含量≥98%,购自亚太兴牧(北京)科技有限公司。饲料原料粉碎过60目筛,称量各原料,经混匀后加入鱼油、豆油和水混匀,使用SLX-80型双螺杆挤压机(华南理工大学科技实业总厂)制成直径为1.5 mm颗粒饲料,55 ℃烘干后置于-20 ℃冰箱备用。饲料组成及营养水平和氨基酸组成分别见表 1和表 2。
|
|
表 1 饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of diets (air-dry basis) |
|
|
表 2 饲料氨基酸组成(风干基础) Table 2 Amino acid composition of diets (air-dry basis) |
黄颡鱼苗从广州市白云锦龙渔业有限公司采购。暂养期间投喂基础饲料(40%粗蛋白质和7%脂肪),每天饱食投喂2次,驯养2周。试验采用室内循环养殖系统,由20个圆柱形玻璃纤维桶组成。水桶容量350 L(直径80 cm,高70 cm),养殖用水达到300 L左右,养殖用水为进水速率1.5 L/min的曝气自来水。挑选健康无病、大小一致体重约为(0.99±0.02) g的黄颡鱼幼鱼800尾,投放到养殖水缸,每缸放鱼苗40尾。试验鱼随机分为5组,每组设置4个重复,分别投喂基础饲料和4种试验饲料,每天投喂2次,分别于08:30和18:30投喂,投饲量约为黄颡鱼体重的4%~6%,养殖期间根据黄颡鱼的生长调节投喂量。全天24 h不间断曝气,光照为自然光源,水温26~32 ℃,氨氮浓度 < 0.2 mg/L,溶氧浓度>6.0 mg/L,pH 7.4~7.9。养殖试验为期8周。
1.3 样品收集8周养殖试验结束时,试验鱼禁食24 h,每缸进行计数和称重,统计每个缸的存活率。每缸随机选取4尾置于-20 ℃保存,用于检测全鱼体组成。每缸再随机选取8尾鱼放入MS-222溶液进行麻醉,尾静脉采血,于4 ℃下4 000 r/min离心10 min,制备上清液样品,-78 ℃保存备用。采血后的鱼解剖采取肝脏和内脏,测定体长、体重、肝脏重和内脏重。
1.4 指标测定 1.4.1 生长性能计算特定生长率(specific growth rate,SGR,%/d)=100×(ln试验鱼末体重-ln试验鱼初体重)/试验天数;
存活率(survival rate,SR,%)=100×试验鱼终末尾数/试验鱼初始尾数;
饲料系数(feed conversion ratio,FCR)=摄食饲料干重/(试验鱼末总体重-试验鱼初总体重);
肥满度(condition factor,CF,g/cm3)=100×体重(g)/体长(cm)3;
肝体比(hepatosomatic index,HSI,%)=100×肝脏重(g)/体重(g);
脏体比(viscerosomatic index,VSI,%)=100×内脏重(g)/体重(g)。
1.4.2 饲料和试验鱼营养成分测定饲料和试验鱼全鱼营养成分的测定采用国标方法,水分含量采用10 ℃常压干燥法进行测定,粗蛋白质含量采取凯氏定氮法进行测定,粗脂肪含量采用乙醚抽提法测定,粗灰分含量采用550 ℃灼烧法进行测定[12],氨基酸含量在盐酸水解样品后使用安捷伦1260(德国)氨基酸分析仪测定。
1.4.3 血清生化指标测定血清总蛋白(TP)、甘油三酯(TG)、尿素、葡萄糖(GLU)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)含量及谷丙转氨酶(GPT)、谷草转氨酶(GOT)活性采用日立7600全自动生化分析仪检测。
1.5 氨氮应激试验56d养殖试验结束后,从N0、N2500、N500和N1000组的每个重复中随机选取10尾健康黄颡鱼,采用氯化铵进行应激试验;N2000组黄颡鱼养殖试验中死亡率较高,采集样品后有的重复黄颡鱼数目不足10尾,故未开展应激试验。150 L水体加入氯化铵,总氨氮浓度达到100 mg/L,非离子氨浓度为2.65 mg/L[10]。试验期间继续投喂试验饲料,观察并记录黄颡鱼0、24、48、72 h内各组死亡情况,计算72 h内的累积死亡率(cumulative mortality rate,CMR):
累积死亡率(%)=100×应激后试验鱼死亡尾数/应激前试验鱼尾数。
1.6 数据统计数据采用SPSS 20.0统计软件包中的单因素方差分析(one-way ANOVA)程序进行方差分析,若差异显著再进行多重比较(Dunnett’s procedure)。试验结果以平均值±标准误(mean±SE)表示,P < 0.05表示差异显著。
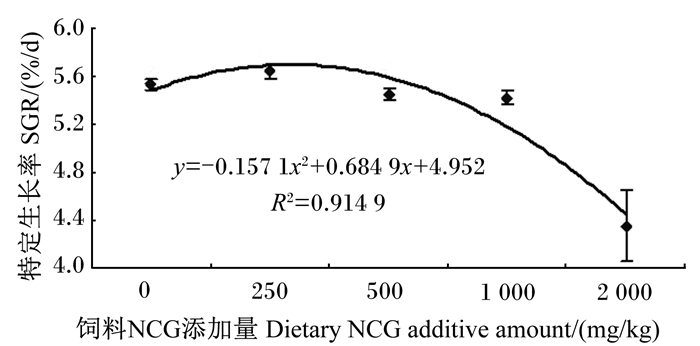
2 结果与分析 2.1 生长性能由表 3可见,随着饲料NCG添加量的增加,黄颡鱼SGR先升后降,FCR逐渐上升。SGR在N250组达到最大值,显著高于其他各组(P<0.05);FCR和SR分别在N2000组达到最大和最小值,与其他各组呈现显著差异(P<0.05)。黄颡鱼肝体比和脏体比呈现先上升后下降趋势,均在N2000组达到最低,显著低于N500和N1000组(P<0.05)。利用二次回归模型拟合特定生长率和饲料NCG添加量,通过分析表明黄颡鱼幼鱼饲料中NCG的适宜添加量为217.983 mg/kg(图 1)。
|
|
表 3 饲料添加NCG对黄颡鱼生长性能的影响 Table 3 Effects of dietary NCG on growth performance of yellow catfish (Pelteobagrus fulvidraco) |
|
图 1 饲料NCG添加量与黄颡鱼特定生长率的关系 Fig. 1 Relationship of dietary NCG additive amount and specific growth rate of yellow catfish(Pelteobagrus fulvidraco) |
由表 4可知,饲料中添加NCG对全鱼干物质、粗蛋白质、粗脂肪、粗灰分含量没有显著影响(P>0.05)。
|
|
表 4 饲料添加NCG对黄颡鱼体成分的影响(干物质基础) Table 4 Effects of dietary NCG on body composition of yellow catfish (Pelteobagrus fulvidraco) (DM basis) |
由表 5可知,饲料中添加NCG显著影响黄颡鱼血清总蛋白、甘油三酯、高密度脂蛋白、葡萄糖、尿素含量。N500、N1000和N2000组黄颡鱼血清总蛋白含量显著高于N0组(P<0.05)。黄颡鱼血清甘油三酯和葡萄糖含量均在N2000组达到最低,显著低于N0组(P<0.05)。血清尿素含量在N2000组达到最高,显著高于N0和N1000组(P<0.05)。血清高密度脂蛋白含量随着饲料中NCG添加量增加,呈现先上升后下降趋势,在N2000组达到最低,显著低于N500和N1000组(P<0.05)。饲料中添加NCG对黄颡鱼幼鱼血清低密度脂蛋白含量及谷丙转氨酶、谷草转氨酶活性无显著影响(P>0.05)。
|
|
表 5 饲料添加NCG对黄颡鱼血清生化指标的影响 Table 5 Effects of dietary NCG on serum biochemical indices of yellow catfish (Pelteobagrus fulvidraco) |
由表 6可知,随着饲料NCG添加量的增加,各组黄颡鱼氨氮应激24、48、72 h的累积死亡率均呈现先降低后升高的趋势,在N250组累积死亡率达到最低。应激48 h时,N250组黄颡鱼累积死亡率显著低于N0和N500组(P<0.05)。应激72 h时,N250组黄颡鱼累积死亡率显著低于N1000组(P<0.05)。
|
|
表 6 饲料添加NCG对黄颡鱼累积死亡率的影响 Table 6 Effects of dietary NCG on cumulative mortality rate of yellow catfish (Pelteobagrus fulvidraco) |
精氨酸是鱼类生长的必需氨基酸,具有多种生理功能,不仅参与蛋白质的合成,还是合成机体内尿素、谷氨酸、肌酸、脯氨酸、一氧化氮和多胺的前体物,参与动物生长和营养物质吸收转运等代谢过程。有研究表明,黄颡鱼饲料中精氨酸的适宜添加量为2.38%~2.74%[10, 13]。NCG作为N-乙酰谷氨酸(NAG)类似物,不易被降解,动物可利于NCG高效合成内源精氨酸[4]。关于NCG提高动物生长性能的报道多见于畜禽研究。饲料中添加0.03%~0.06%的NCG能够提高母猪的泌乳量、仔猪断奶均重和仔猪断奶窝重[14]。肉仔鸡饲料添加NCG可以明显改善摄食量、增重率和料重比[15]。饲粮添加0.1% NCG可提高舍饲滩羊生长性能,并能改善滩羊脂肪分配[7]。在水产动物的研究表明,大菱鲆饲料中NCG的适宜添加量为0.022 7%,罗非鱼饲料中NCG添加量达到0.2%时增重率和蛋白质效率显著高于其他组[8-9]。本试验中,饲料中添加250 mg/kg NCG显著提高了黄颡鱼特定生长率,通过二次回归模型拟合特定生长率和饲料NCG添加量,表明黄颡鱼幼鱼饲料中NCG的适宜添加量为217.98 mg/kg。黄颡鱼饲料中NCG的适宜添加量与大菱鲆相近,但低于罗非鱼饲料NCG的适宜添加量,造成这一差异的原因可能与鱼的种类、规格大小、精氨酸来源、饲料组成、养殖环境、养殖周期等有关。本试验发现,随着饲料中NCG添加量的升高,黄颡鱼特定生长率呈现先上升后下降趋势,当饲料中NCG添加量达到2 000 mg/kg时,黄颡鱼的生长性能显著下降。通过添加NCG培养小肠上皮细胞发现,精氨酸的合成量显著增加[16]。添加量为1.6 g/kg的NCG饲喂仔猪会导致仔猪的腹泻,这可能与合成了过多的一氧化氮产生了氧化应激的情况有关[17]。动物体内精氨酸的含量过高会与赖氨酸、组氨酸产生拮抗作用,影响这些必需氨基酸的吸收,从而限制动物体的生长[18]。因此,动物体内的精氨酸含量在一定范围内才能够促进动物体生长,适宜NCG添加量可以促进鱼体精氨酸内源性生成,提高生长性能,过量添加可能产生抑制作用。本试验中,随着饲料中NCG添加量增加,黄颡鱼肝体比和脏体比呈现先上升后下降,均在添加量为2 000 mg/kg时达到最低值。该结果与尼罗罗非鱼[8]、大菱鲆[9]的研究结果一致,饲料中添加一定剂量的NCG降低了尼罗罗非鱼的肝体比和大菱鲆的脏体比。饲粮中添加0.1%的NCG可提高舍饲滩羊肌肉脂肪含量,改善滩羊脂肪分配[7]。饲料中添加0.025%~0.500% NCG有助于增加尼罗罗非鱼全鱼脂肪含量[8]。然而,在大菱鲆的研究中,随着饲料中NCG添加量的提高,大菱鲆全鱼和肌肉脂肪含量呈现下降趋势[19]。本试验中,饲料中添加NCG对黄颡鱼的全鱼粗蛋白质、粗脂肪、粗灰分及干物质含量没有显著影响,但全鱼粗脂肪含量随着饲料中NCG添加的增加呈现上升趋势,说明NCG可能对黄颡鱼脂肪沉积具有调节作用。
3.2 饲粮添加NCG对黄颡鱼血清生化指标的影响鱼类的血清生化指标能够反映鱼体的代谢水平、器官状态、营养状态等,亦能反映鱼类在受到环境应激下的健康、营养和适应环境的状况[20]。血液中的蛋白质对维持血管渗透压和正常的生命活动有重要的生理作用,它维持着一种动态的平衡[21]。本试验中,随着饲料中NCG添加量的增加,黄颡鱼的血清总蛋白含量有升高趋势,说明饲料中添加NCG有助于黄颡鱼体内精氨酸生成,促进鱼体蛋白质的合成。血液尿素含量是反映鱼体蛋白质代谢状况和饲料氨基酸平衡的重要因子[22]。尿素含量高低能够说明鱼体蛋白质和氨基酸的代谢是否平衡,如果鱼类饲料的氨基酸含量不平衡则鱼体的氨基酸分解代谢提高,血清尿素含量也会提高[23]。牙鲆饲料中精氨酸添加量增加或减少,血清尿素含量也随之产生改变[24]。本研究发现,添加低剂量的NCG对血清尿素含量没有产生显著影响,但添加2 000 mg/kg的NCG显著提高了血清尿素含量。与本试验结果一致,饲料精氨酸满足斑节对虾需要量时,对虾血液尿素含量会显著提高[25]。在虹鳟中的研究发现,鱼体内尿素合成来源于过量的精氨酸代谢途径[26]。饲料中精氨酸过量,供给鱼类的氨基酸比例失衡,导致蛋白质利用效率下降,氮的排泄增加。血糖和甘油三酯含量能够反映鱼体能量和脂肪代谢状况,如果血液中的葡萄糖含量升高说明机体能量水平较高,葡萄糖将可能转化脂肪在机体内贮存;当机体脂肪水平上升时,血液甘油三酯含量亦可能随之上升[27]。高密度脂蛋白和低密度脂蛋白含量反映了脂类的分解与转运[28]。本试验发现,较低水平的NCG对血清葡萄糖、甘油三酯和高密度脂蛋白含量没有显著影响,当NCG添加量达到2 000 mg/kg时,黄颡鱼血清中葡萄糖、甘油三酯和高密度脂蛋白含量显著降低,说明饲料中添加高剂量的NCG对脂类的代谢具有调节作用。谷草转氨酶、谷丙转氨酶是鱼体内重要的氨基转移酶,正常情况下,动物体的转氨酶活性是保持在较低水平的,只有细胞病变或者通透性增加才会导致谷草转氨酶、谷丙转氨酶活性上升[29]。本研究显示,黄颡鱼血液中这2种酶活性并未由于NCG添加量的变化而出现显著性差异,表明NCG并未对黄颡鱼产生病理作用。
3.3 饲粮添加NCG对黄颡鱼抗氨氮应激能力的影响随着水产养殖密度不断提高,鱼类的残饵和排泄物通过氨化作用产生许多氨态氮,氨是导致鱼体发生病变的重要环境因素[30]。水环境中氨氮浓度通常用总氨氮浓度表示,主要含离子氨和非离子氨2种,其中非离子氨的毒性较大,一般氨氮是通过离子氨产生毒理作用[31]。环境中过多的氨氮对水生动物的毒性较大,会影响其免疫系统[32],氨氮水平升高可能对鱼鳃、肝脏、肾脏以及肠道等造成损伤[31],最终导致鱼虾发病和死亡。本研究发现,饲料中低剂量的NCG可以降低黄颡鱼对氨氮应激的累积死亡率,其改善效果与NCG促进黄颡鱼生长的作用效果相似,然而添加高剂量的NGG却降低黄颡鱼抗氨氮应激能力。这表明黄颡鱼抗氨氮应激能力的强弱与饲料中NCG添加量有关,而且黄颡鱼的生长状况也与其抗氨氮应激能力的强弱有关。这与Li等[33]研究结论“鱼类的生长速度往往与其抗病力的强弱有关”相似。研究表明,饲料中适宜添加量的精氨酸可以显著降低黄颡鱼对氨氮应激的累积死亡率[10]。NCG能够提高抗氨氮应激能力,可能是饲料NCG促进了鱼体内精氨酸及其代谢产物生成有关[34]。低剂量的L-精氨酸对大鼠具有保护作用,高剂量的L-精氨酸却对机体造成损伤,促进机体自由基生成[34]。适宜精氨酸可以缓解氧化鱼油对黄颡鱼生长的抑制作用,并增强其机体的抗氧化能力[35]。因此,饲料NCG降低黄颡鱼氨氮应激累积死亡率,可能是由于黄颡鱼体内合成的精氨酸提高了黄颡鱼的抗氧化防御能力。精氨酸及其代谢产物一氧化氮在机体的免疫和抗氧化方面发挥非常重要的作用,一氧化氮参与组织的氧化和免疫作用,还有利于伤口的复原[36]。有关NCG对机体免疫和抗氧化能力的影响还有待于进一步研究。
4 结论① 饲料中NCG添加量为250 mg/kg时,显著提高黄颡鱼特定生长率;饲料中NCG添加量为2 000 mg/kg时,黄颡鱼的饲料系数显著升高,存活率显著降低。
② 饲料中NCG添加量为500、1 000和2 000 mg/kg时,显著提高黄颡鱼血清总蛋白含量;饲料中NCG添加量为2 000 mg/kg时,黄颡鱼肝体比、脏体比及血清甘油三酯、葡萄糖、高密度脂蛋白含量显著降低,尿素含量显著升高。
③ 黄颡鱼氨氮应激24、48、72 h的累积死亡率随饲料NCG添加量增加均呈现先降低后升高趋势,饲料中NCG添加量为250 mg/kg时,黄颡鱼累积死亡率最低。
④ 以特定生长率为评价指标,通过二次回归分析计算出黄颡鱼幼鱼饲料中NCG的适宜添加量为217.98 mg/kg。
| [1] |
NRC.Nutrient requirements of fish and shrimp[S].Washington, D.C.: National Academy Press, 2011.
|
| [2] |
MASAGOUNDER K, HAYWARD R S, FIRMAN J D. Comparison of dietary essential amino acid requirements determined from group-housed versus individually-housed juvenile bluegill, Lepomis macrochirus[J]. Aquaculture Nutrition, 2011, 17(2): e559-e571. DOI:10.1111/j.1365-2095.2010.00797.x |
| [3] |
CHENG Z Y, GATLIN Ⅲ D M, BUENTELLO A. Dietary supplementation of arginine and/or glutamine influences growth performance, Immune responses and intestinal morphology of hybrid striped bass (Morone chrysops×Morone saxatilis)[J]. Aquaculture, 2012, 362-363: 39-43. DOI:10.1016/j.aquaculture.2012.07.015 |
| [4] |
WU X, YIN Y L, LIU Y Q, et al. Effect of dietary arginine and N-carbamoylglutamate supplementation on reproduction and gene expression of eNOS, VEGFA and PlGF1 in placenta in late pregnancy of sows[J]. Animal Reproduction Science, 2012, 132(3/4): 187-192. |
| [5] |
FRANK J W, ESCOBAR J, NGUYEN H V, et al. Oral N-carbamylglutamate supplementation increases protein synthesis in skeletal muscle of piglets[J]. The Journal of Nutrition, 2007, 137(2): 315-319. DOI:10.1093/jn/137.2.315 |
| [6] |
董晓静, 崔凯, 马泽芳, 等. N-氨甲酰谷氨酸对育成期水貂生长性能、营养物质消化率、氮代谢及血清生化指标的影响[J]. 畜牧兽医学报, 2018, 49(6): 1194-1203. |
| [7] |
王红梅, 牛文智, 张桂杰. 不同形态N-氨甲酰谷氨酸对滩羊生长性能、血清生化指标和脂肪分配的影响[J]. 中国畜牧兽医, 2016, 43(12): 3221-3226. |
| [8] |
程炜轩, 张丽, 许国焕, 等. N-氨甲酰谷氨酸对罗非鱼幼鱼生长、血液氨基酸组成及脂肪沉积的影响[J]. 水生生物学报, 2015, 39(3): 490-497. |
| [9] |
尚晓迪, 陈春秀, 贾磊, 等. N-氨甲酰谷氨酸对大菱鲆幼鱼生长性能的影响[J]. 饲料研究, 2017(3): 35-38. |
| [10] |
CHEN Q M, ZHAO H X, HUANG Y H, et al. Effects of dietary arginine levels on growth performance, body composition, serum biochemical indices and resistance ability against ammonia-nitrogen stress in juvenile yellow catfish (Pelteobagrus fulvidraco)[J]. Animal Nutrition, 2016, 2(3): 204-210. DOI:10.1016/j.aninu.2016.07.001 |
| [11] |
赵红霞, 陈启明, 黄燕华, 等. 饲料精氨酸水平对黄颡鱼幼鱼生长性能、消化吸收相关指标、免疫功能和抗氧化能力的影响[J]. 动物营养学报, 2018, 30(12): 5040-5051. DOI:10.3969/j.issn.1006-267x.2018.12.032 |
| [12] |
AOAC.Official methods of analysis[S].14th ed.Washington, D.C.: Association of Official Analytical Chemists, 1984: 152-163.
|
| [13] |
ZHOU Q C, JIN M, ELMADA Z C, et al. Growth, immune response and resistance to Aeromonas hydrophila of juvenile yellow catfish, Pelteobagrus fulvidraco, fed diets with different arginine levels[J]. Aquaculture, 2015, 437: 84-91. DOI:10.1016/j.aquaculture.2014.11.030 |
| [14] |
刘星达, 彭瑛, 吴信, 等. 精氨酸和精氨酸生素对母猪泌乳性能及哺乳仔猪生长性能的影响[J]. 饲料工业, 2011, 32(8): 14-16. |
| [15] |
汤智群, 周佳栋, 洪伟鸣, 等. N-氨甲酰谷氨酸和精氨酸对京海黄鸡肉仔鸡生长性能和血液指标的影响[J]. 中国畜牧兽医, 2015, 42(5): 1130-1136. |
| [16] |
WU G Y, JAEGER L A, BAZER F W. Arginine deficiency in preterm infants:biochemical mechanisms and nutritional implications[J]. The Journal of Nutritional Biochemistry, 2004, 15(8): 442-451. DOI:10.1016/j.jnutbio.2003.11.010 |
| [17] |
印遇龙, 吴信, 唐志如, 等. 不同水平精氨酸衍生物对断奶仔猪生长性能及腹泻的影响[J]. 农业现代化研究, 2008, 29(6): 723-725, 760. DOI:10.3969/j.issn.1000-0275.2008.06.020 |
| [18] |
沈勇, 邱其浚, 孙龙生, 等. 饲料精氨酸与赖氨酸配比对全雄黄颡鱼生长性能、体组成、血清生化指标及氨基酸沉积率的影响[J]. 动物营养学报, 2017, 29(7): 2575-2586. DOI:10.3969/j.issn.1006-267x.2017.07.043 |
| [19] |
尚晓迪, 陈春秀, 贾磊, 等. N-氨甲酰谷氨酸对大菱鲆幼鱼营养组成及免疫功能的影响[J]. 饲料工业, 2017, 38(18): 5-9. |
| [20] |
刘梅, 宓国强, 郭建林, 等. 池塘内循环流水养殖模式对黄颡鱼生长性能、形体指标、血清生化指标及肌肉营养成分的影响[J]. 动物营养学报, 2019, 31(4): 1704-1717. |
| [21] |
杨成辉, 蔡勋, 刘霞, 等. 饥饿和再投喂对哲罗鱼幼鱼血液生理生化指标的影响[J]. 淡水渔业, 2009, 39(1): 36-40. DOI:10.3969/j.issn.1000-6907.2009.01.007 |
| [22] |
BERGE G E, LIED E, SVEIER H. Nutrition of Atlantic salmon (Salmo salar):the requirement and metabolism of arginine[J]. Comparative Biochemistry and Physiology Part A:Physiology, 1997, 117(4): 501-509. DOI:10.1016/S0300-9629(96)00410-0 |
| [23] |
TANTIKITTI C, CHIMSUNG N. Dietary lysine requirement of freshwater catfish (Mystus nemurus Cuv. & Val.)[J]. Aquaculture Research, 2001, 32(S1): 135-141. |
| [24] |
ALAM M S, TESHIMA S I, KOSHIO S, et al. Arginine requirement of juvenile Japanese flounder Paralichthys olivaceus estimated by growth and biochemical parameters[J]. Aquaculture, 2002, 205(1/2): 127-140. |
| [25] |
CHEN H Y, LEU Y T, ROELANTS I. Quantification of arginine requirements of juvenile marine shrimp, Penaeus monodon, using microencapsulated arginine[J]. Marine Biology, 1992, 114(2): 229-233. DOI:10.1007/BF00349523 |
| [26] |
CHO C Y, KAUSHIK S, WOODWARD B. Dietary arginine requirement of young rainbow trout (Oncorhynchus mykiss)[J]. Comparative Biochemistry and Physiology Part A:Physiology, 1992, 102(1): 211-216. DOI:10.1016/0300-9629(92)90036-P |
| [27] |
刘迎隆, 麦康森, 徐玮, 等. 饲料脂肪含量对两种规格的军曹鱼生长、体组成和血清生化指标的影响[J]. 水生生物学报, 2019, 43(2): 233-242. |
| [28] |
OLSEN R E, SUNDELL K, MAYHEW T M, et al. Acute stress alters intestinal function of rainbow trout, Oncorhynchus mykiss (Walbaum)[J]. Aquaculture, 2005, 250(1/2): 480-495. |
| [29] |
潘杰, 陈荣军, 姚康, 等. 精氨酸对断奶仔猪生长性能、器官重及血液生化参数的影响[J]. 安徽农业科学, 2009, 37(7): 2981-2982, 2990. DOI:10.3969/j.issn.0517-6611.2009.07.064 |
| [30] |
黄云, 胡毅, 文华, 等. 维生素E对青鱼幼鱼生长、免疫及抗氨氮胁迫能力的影响[J]. 水生生物学报, 2013, 37(3): 507-514. |
| [31] |
张武肖, 孙盛明, 戈贤平, 等. 急性氨氮胁迫及毒后恢复对团头鲂幼鱼鳃、肝和肾组织结构的影响[J]. 水产学报, 2015, 39(2): 233-244. |
| [32] |
YUE F, PAN L Q, XIE P, et al. Immune responses and expression of immune-related genes in swimming crab Portunus trituberculatus exposed to elevated ambient ammonia-N stress[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2010, 157(3): 246-251. |
| [33] |
LI P, YIN Y L, LI D F, et al. Amino acids and immune function[J]. British Journal of Nutrition, 2007, 98(2): 237-252. DOI:10.1017/S000711450769936X |
| [34] |
徐伟风, 吴春宇. 精氨酸对动物的营养调节及免疫作用[J]. 养猪, 2018, 5: 32-35. |
| [35] |
卓丽欣, 赵红霞, 黄燕华, 等. 氧化鱼油对黄颡鱼生长性能和抗氧化指标的影响及精氨酸的干预作用[J]. 动物营养学报, 2017, 29(1): 147-157. DOI:10.3969/j.issn.1006-267x.2017.01.017 |
| [36] |
张漓, 徐建方, 冯连世, 等. 补充左旋精氨酸对耐力训练大鼠股外肌抗氧化酶系的影响[J]. 中国运动医学杂志, 2007, 26(3): 308-312. DOI:10.3969/j.issn.1000-6710.2007.03.012 |




