中国作为世界钼(Mo)矿最丰富的国家,大规模的Mo开采会对土壤及牧草造成一定的影响,并通过食物链富集作用导致动物Mo中毒,因此,研究Mo对动物的影响是十分必要的。Mo在动物机体内的存在形式主要是金属酶,含Mo酶的生物学功能是通过Mo原子的五价和六价之间转化传递电子来实现的。现有的研究显示含Mo酶都为氧化还原酶,参与并影响着机体内的核酸和蛋白质的代谢[1]。机体内Mo的含量处于动态平衡之中,如果打破这种平衡,则会出现机能障碍。细胞骨架是一种复杂且重要,并处于动态稳定的细胞成分,是细胞内蛋白质纤维聚合物构成的网状结构[2],在维持细胞形态、细胞运动、细胞凋亡和细胞分泌等生理和病理过程中起着重要作用[3]。王亚垒等[4]的研究结果证实,高剂量的Mo会引起骨皮质变薄、骨小梁变稀疏、骨密度降低,从而导致骨骼扭转及冲击韧性的下降。有相关研究表明,小鼠砷元素中毒会导致其骨骼肌的细胞骨架损伤[5],低浓度的砷可致肌纤维排列紊乱,高浓度的砷则可明显引起肌原纤维的凝聚、漂移、撕裂状况,重者呈现出锯齿状结构[6]。生产中发现过量的Mo可导致动物运动能力减退,但未见有Mo对骨骼肌细胞骨架影响的相关研究,作用机理不明确,因此,本试验以小鼠原代骨骼肌上皮细胞为材料进行细胞培养,在培养基中添加不同浓度的Mo,通过显微镜观察细胞形态以及检测细胞活力、相关氧化抗氧化指标、细胞骨架相关mRNA和蛋白表达的情况,探讨Mo对小鼠骨骼肌上皮细胞氧化损伤及细胞骨架的影响,为今后更加深入的探究Mo对动物骨骼肌毒性作用提供可靠的试验依据。
1 材料与方法 1.1 试验动物无特定病原体(SPF)级BALB/c雄性小鼠,5日龄,郑州大学实验动物中心提供。
1.2 主要试剂及仪器主要试剂:DMED培养基和胎牛血清购自上海拜力生物科技有限公司。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、乳酸脱氢酶(LDH)活性和丙二醛(MDA)含量以及总抗氧化能力(T-AOC)检测试剂盒购自南京建成生物工程研究所。动物组织/细胞RNA提取试剂盒、HiFiScript cDNA第一链合成试剂盒及UltraSYBR Mixture均购于宝瑞医疗科技(北京)有限公司。四甲基偶氮唑盐(MTT)细胞活力检测试剂盒、放射免疫沉淀(RIPA)法裂解液、二奎啉甲酸(BAC)蛋白定量试剂盒、超敏化学发光试剂(ECL)显色液、兔抗鼠α-肌动蛋白(α-actin)、β-肌动蛋白(β-actin)、波形蛋白(Vimentin)一抗和羊抗兔免疫球蛋白G(IgG)二抗为武汉博士德生物工程有限公司产品。钼酸钠(Na2MoO4)购自天津市化学试剂四厂。
主要仪器:普通倒置光学显微镜[CKX 31,奥林巴斯(中国)有限公司]、酶标仪[赛默飞世尔科技(中国)有限公司]、分光光度计(Uvmini-1240,日本岛津公司)、实时荧光定量PCR仪(FAST,ABI7500,上海普迪生物技术有限公司)、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳槽及槽式转印系统[伯乐生命医学产品(上海)有限公司]。
1.3 分离培养小鼠原代骨骼肌上皮细胞将小鼠脱臼处死,浸泡于酒精中1 min杀菌。无菌条件下,剪下四肢并切除爪子,将四肢置入磷酸盐缓冲液(PBS)中清洗,剔除脂肪并剥离骨骼。用眼科剪将肌肉组织剪成1 mm3左右的碎块,移到25 cm2细胞培养瓶中,排放均匀。加入含18%胎牛血清的DMEM细胞培养液,将培养瓶翻转并放入37 ℃、5%CO2的细胞培养箱中进行细胞贴壁预处理,2 h后翻转培养瓶正常培养。24 h后弃去培养基,PBS冲洗后加入DMEM细胞培养液。继续培养24 h,待骨骼肌细胞伸展并均匀贴于瓶壁后,将细胞消化、收集并调整细胞密度为1×106个/mL,将细胞分装至24孔细胞培养板中,每孔体积为500 μL。将细胞培养板置于CO2培养箱中培养24 h。待细胞完全贴壁变形后,弃培养液,PBS冲洗3次[7]。向各孔添加浓度分别为0(Ⅰ组)、0.1(Ⅱ组)、0.2(Ⅲ组)、0.4(Ⅳ组)、0.8 mmol/L(Ⅴ组)的含Mo无血清培养基培养24 h,收集细胞用于后续试验。
1.4 细胞活力的检测将培养的小鼠骨骼肌上皮细胞添加至96孔板中,调整每孔细胞数量为2 000个。利用MTT法,每孔内添加10 μL MTT,37 ℃条件下孵育4 h后弃去培养液,加入100 μL的Formanzan溶液并在室温下暗室中静置30 min显色。将酶标仪的波长设定为570 nm,测定各组的吸光度值,计算各组细胞的增殖率以反映其细胞活力。
1.5 抗氧化能力及氧化损伤的检测收集细胞培养基中的培养液,轻轻刮取出小鼠骨骼肌上皮细胞,转移到离心管中,加入PBS,以800 r/min的速度离心5 min,通过超声波裂解细胞1 min,随后收集细胞裂解液上清,通过比色法检测细胞裂解液中SOD、CAT活性和MDA含量以及T-AOC,并测定细胞培养液中的LDH活性。
1.6 cDNA合成和引物序列的设计依照RNA提取试剂盒说明书的具体步骤提取细胞总RNA。使用HiFiScript cDNA合成试剂盒对已提取的总RNA进行操作,合成cDNA。根据GenBank中小鼠Vimentin、α-actin、β-actin和甘油醛-3-磷酸脱氢酶(GAPDH)的mRNA序列,利用Primer Premier 5.0软件设计实时荧光定量PCR(qRT-PCR)引物,并使用Blast-Primer验证其特异性,qRT-PCR试验中有关基因的引物序列见表 1。
|
|
表 1 qRT-PCR试验中有关基因的引物序列 Table 1 Primer sequences of related genes in qRT-PCR test |
利用SYBR Green Ⅰ染色法,将荧光定量试剂Primix Ex Taq应用于ABI PRISM 7500 real-time PCR系统,测定小鼠骨骼肌上皮细胞中骨架蛋白相关基因α-actin、β-actin和Vimentin的mRNA表达情况。运用2-△△Ct法,计算每个基因的mRNA相对表达量,并以GAPDH作为内参基因进行校正。
1.8 蛋白质免疫印迹(Western-blot)检测相关细胞骨架蛋白的表达严格按照PIPA裂解液说明进行试验操作,将细胞裂解并提取蛋白质,BCA法测定蛋白浓度后调至同一浓度,按1 : 5的比例加入6×SDS-PAGE上样缓冲液中,煮沸10 min,离心,-80 ℃下冻存。取样进行SDS-PAGE凝胶电泳,转移至聚偏二氟乙烯(PVDF)膜上;含5%脱脂奶粉的TBST缓冲液封闭2 h,加一抗(α-actin、β-actin和GAPDH按1 : 2 000稀释,Vimentin按1 : 2 500稀释)4 ℃孵育过夜,TBST缓冲液洗涤5次,5 min/次,加入二抗(按1 : 2 000稀释)室温孵育2 h,TBST缓冲液洗涤5次,5 min/次。逐滴加入超敏ECL显影液,孵育2 min后,用胶片在暗室中曝光显影。
1.9 统计分析首先使用Excel 2010处理试验所得数据,然后使用统计软件SPSS 22.0对数据进行单因素方差分析(one-way ANOVA),统计结果表示为平均值±标准差,并使用Duncan氏检验法进行各组间多重比较。P<0.05表示差异显著,P<0.01表示差异极显著,P>0.05则表示差异不显著。
2 结果 2.1 Mo对小鼠骨骼肌上皮细胞形态的影响如图 1所示,正常状态下(Ⅰ组)的骨骼肌上皮细胞成纤维样梭形,细胞细长且细胞间排列致密,生长方向统一,移植的组织块一旦贴壁正常生长后,细胞延展速度会加快,还会在短时间内汇聚成单层细胞。Ⅱ组与Ⅰ组的细胞形态差距并不大,均呈纤维状梭形,且生长致密,具有一定的方向性。Ⅲ组与Ⅳ组细胞形态相似,细胞间隙明显有增大趋势,且细胞呈多足状,多数细胞生长明显凸起,轮廓明显,形态逐渐肿大。Ⅴ组细胞则明显出现较大幅的间隙,细胞形态明显肿大,且细胞呈无方向性的生长,多数细胞明显畸形,相同视野内细胞个数远少于Ⅰ和Ⅱ组。

|
图 1 Mo对小鼠骨骼肌上皮细胞形态的影响 Fig. 1 Effects of Mo on morphology in skeletal muscle epithelial cells of mouse |
如表 2所示,用不同浓度梯度的Mo培养24 h后,Ⅰ~Ⅴ组小鼠骨骼肌上皮细胞的增殖率分别为100.0%、90.9%、92.5%、78.5%和60.5%。随着培养基中Mo浓度的增加,小鼠骨骼肌上皮细胞的增殖率趋于下降,Ⅱ~Ⅴ组极显著低于Ⅰ组(P<0.01),其中Ⅱ和Ⅲ组之间差异不显著(P>0.05)。
|
|
表 2 Mo对小鼠骨骼肌上皮细胞活力的影响 Table 2 Effects of Mo on viability in skeletal muscle epithelial cells of mouse |
如表 2所示,用不同浓度梯度的Mo培养24 h后,与Ⅰ组相比,随着培养基中Mo浓度的增加,Ⅱ~Ⅴ组小鼠骨骼肌上皮细胞的SOD活性极显著下降(P<0.01),其中Ⅱ、Ⅲ和Ⅳ组之间差异不显著(P>0.05)。与Ⅰ组相比,随着培养基中Mo浓度的增加,Ⅱ~Ⅴ组小鼠骨骼肌上皮细胞的CAT活性先升高后降低,Ⅱ组差异不显著(P>0.05),Ⅲ组极显著升高(P<0.01),而Ⅳ和Ⅴ组极显著下降(P<0.01)。与Ⅰ组相比,随着培养基中Mo浓度的增加,Ⅱ~Ⅴ组小鼠骨骼肌上皮细胞的T-AOC均极显著下降(P<0.01),其中Ⅱ、Ⅲ和Ⅳ组之间差异不显著(P>0.05)。与Ⅰ组相比,随着培养基中Mo浓度的增加,Ⅱ~Ⅴ组小鼠骨骼肌上皮细胞的MDA含量极显著升高(P<0.01),其中Ⅱ、Ⅲ和Ⅳ组之间差异不显著(P>0.05)。与Ⅰ组相比,Ⅱ和Ⅲ组小鼠骨骼肌上皮细胞的LDH活性无显著差异(P>0.05),Ⅳ和Ⅴ组极显著升高(P<0.01)。
2.4 Mo对小鼠骨骼肌上皮细胞中α-actin、β-actin、VimentinmRNA表达的影响如图 2所示,与Ⅰ组相比,随着培养基中Mo浓度的增加,Ⅱ~Ⅴ组小鼠骨骼肌上皮细胞中α-actin、β-actin和Vimentin的mRNA相对表达量呈现出先上升后下降的变化趋势。Ⅱ和Ⅲ组小鼠骨骼肌上皮细胞中α-actin、β-actin和Vimentin的mRNA相对表达量均显著高于Ⅰ组(P<0.05),Ⅳ组与Ⅰ组差异不显著(P>0.05),而Ⅴ组显著低于Ⅰ组(P<0.05)。
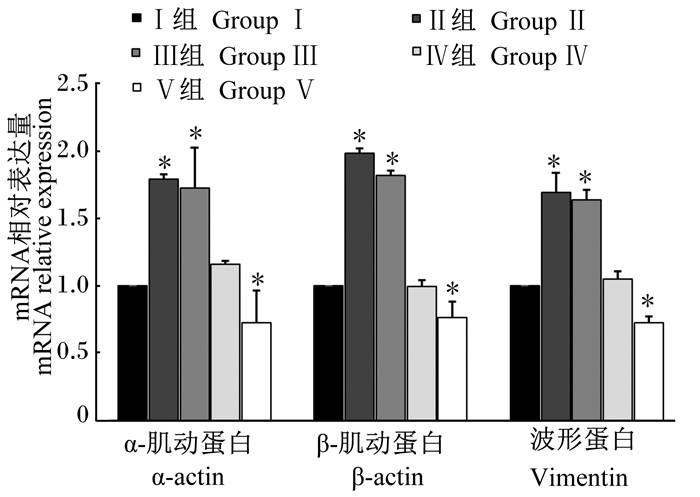
|
*表示与对照组相比差异显著(P<0.05)。下图同。 * represent significant difference compared with the control group (P < 0.05). The same as below. 图 2 Mo对小鼠骨骼肌上皮细胞中α-actin、β-actin和Vimentin mRNA表达的影响 Fig. 2 Effects of Mo on mRNA expression of α-actin, β-actin and Vimentin in skeletal muscle epithelial cells of mouse |
如图 3所示,与Ⅰ组相比,随着培养基中Mo浓度的增加,Ⅱ组小鼠骨骼肌上皮细胞中α-actin、β-actin和Vimentin的蛋白相对表达量差异不显著(P>0.05),而Ⅲ、Ⅳ和Ⅴ组均显著低于Ⅰ组(P<0.05)。
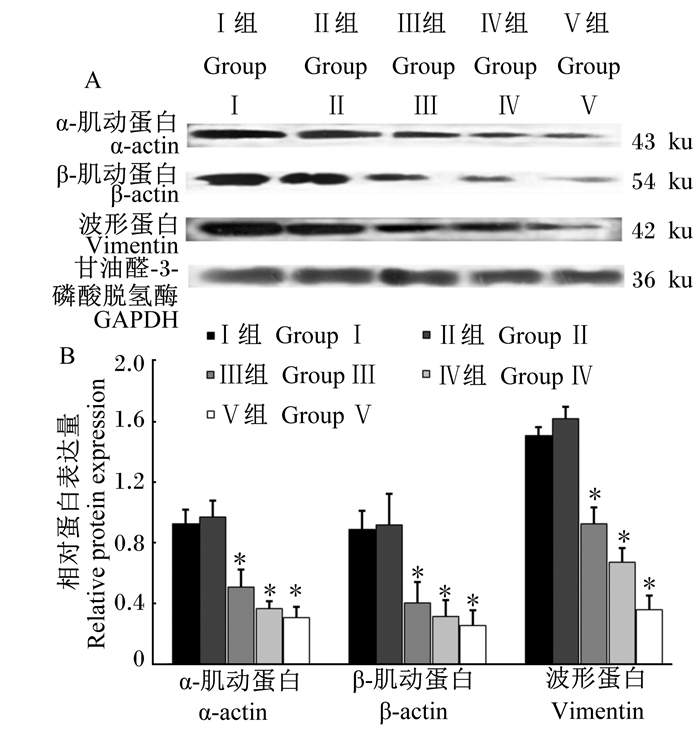
|
A:α-actin、β-actin、Vimentin和GAPDH的ECL显色条带;B:相对灰度值分析。 A:ECL chromogenic bands of Vimentin, α-actin, β-actin and GAPDH; B:relative gray value analysis. 图 3 Mo对小鼠骨骼肌上皮细胞中α-actin、β-actin和Vimentin蛋白表达的影响 Fig. 3 Effects of Mo on protein expression of α-actin, β-actin and Vimentin in skeletal muscle epithelial cells of mouse |
骨骼肌细胞作为影响机体运动的重要组成部分,起到缓冲外力、保护机体和维持协调运动的物理防护功能,并且还在血糖的利用方面起到重要的作用。电子显微镜观察显示,高浓度的Mo对大鼠骨骼肌上皮细胞的损伤主要集中在膜结构的破坏,从而使骨骼肌上皮细胞的细胞核膜和内质网扩张,线粒体收缩,基质内的电子密度增加或者空泡化[8]。本试验通过体外培养法,利用倒置显微镜对各组小鼠骨骼肌上皮细胞的形态观察发现,Ⅱ组与Ⅰ组差异不大,均呈纤维状梭形,且生长致密、具有一定的方向性,而当Mo浓度高于0.2 mmol/L时会引起细胞生长的延缓,同时细胞间隙明增大,形态轮廓突显且逐渐肿大,随着Mo浓度的升高,细胞逐渐呈现出无方向性的生长,并且形态逐渐变差,出现畸形。这说明在高浓度Mo的作用下,骨骼肌上皮细胞直接受到Mo刺激,引起直观的形态学变化,这与早期的动物体试验结果相似,均是在高浓度Mo组动物的骨骼肌组织最快出现形态学病理变化,同时会伴随着细胞凋亡、畸形并且严重空泡化。
|
|
表 3 Mo对小鼠骨骼肌上皮细胞SOD、CAT、LDH活性、MDA含量及T-AOC的影响 Table 3 Effects of Mo on SOD, CAT, LDH activities, MDA content and T-AOC in skeletal muscle epithelial cells of mouse (n=5) |
本试验通过不同浓度Mo对小鼠原代骨骼肌上皮细胞进行处理,细胞培养24 h后,利用MTT法检测细胞增殖率,反映其细胞活力,从而可以从细胞整体的生命状况层面体现出Mo对于小鼠骨骼肌上皮细胞的影响作用。从试验结果可以看出,小鼠骨骼肌上皮细胞的增殖率随着Mo浓度的增加而降低,这证明了高浓度的Mo对小鼠骨骼肌上皮细胞的增殖率具有显著的抑制作用。然而从其他相关的文献资料中我们了解到,对体外培养的细胞经适量的Mo处理后,可以明显抑制一些病毒微生物的繁殖能力,并且能够增强细胞的抵抗能力[9],这与本试验高浓度的Mo可以抑制骨骼肌上皮细胞的增殖率,同时影响细胞活力的结果有所差别,产生这种差异可能与本试验所设计的Mo浓度、处理时间或者细胞种类的不同有关。
3.3 Mo对小鼠骨骼肌上皮细胞抗氧化能力的影响本试验以体外培养小鼠原代骨骼肌上皮细胞为材料,测定了细胞中SOD、CAT、LDH活性和MDA含量及T-AOC,研究检测了不同浓度Mo处理后,细胞的抗氧化能力和氧化损伤状况。SOD可以有效去除生物体内代谢产生的有害超氧自由基,及时修复受损细胞,对减缓机体衰老起着很重要的调控作用[10],SOD的生理活性可以作为一个指标来反映生物机体对氧化自由基等有害物质的清除能力[11];广泛存在于细胞过氧化物酶中的CAT是过氧化物酶体的标志性酶,大约占过氧化物酶体酶总量的40%,其主要的功能是将代谢生成的过氧化氢分解为水(H2O)和氧气(O2),中断有害物质氢氧根离子的合成[12],起到机体抗氧化的功能;T-AOC反映了生物体总的抗氧化能力。自由基作用于脂质过氧化,最终的氧化产物是MDA,它可以引起生命大分子如蛋白质、核酸等的联结聚合,因此MDA具有细胞毒性,通过检测MDA的含量可以反映生物体组织细胞所受的氧化损伤程度[13]。LDH是一种糖酵解酶,在机体的正常状态下细胞内的LDH活性比细胞外高出1 000倍之多,而当细胞内、外环境发生改变时,细胞中的酶合成量、细胞的结构、膜通透性等发生变化,可导致细胞内的LDH释放到血液中,从而使血液中的LDH活性升高[14-15]。
以往的相关研究表明,外源有害物质会抑制生物体组织细胞内的抗氧化酶活性或大量消耗抗氧化物质,最终可以导致机体的抗氧化功能下降[16],如铜(Cu)和砷(As)联合可以诱导鸡骨骼肌的氧化损伤[17]。本试验的研究结果显示,高浓度的Mo导致了小鼠骨骼肌上皮细胞中SOD、CAT活性和T-AOC的降低,以及上皮细胞中MDA含量和LDH活性的升高。由此可知,小鼠骨骼肌上皮细胞经一定浓度的Mo处理后,细胞清除氧化自由基等有害物质的抗氧化能力会受到抑制,并且导致细胞的氧化损伤加剧。
3.4 Mo对小鼠骨骼肌上皮细胞细胞中α-actin、β-actin和Vimentin的mRNA和蛋白表达的影响细胞骨架分布在真核细胞上,参与细胞中遗传物质的转运和表达过程。对细胞骨架的研究显示,细胞骨架的功能障碍已经成为许多疾病的标志性病理过程[18]。α-actin是一种关键的细胞骨架蛋白,具有稳定细胞黏附、维持细胞形态、调节细胞运动的生物学功能。Jiang等[19]研究发现,心衰患者心肌细胞中α-actin的mRNA相对表达量相较于未患病人出现明显的下调,并证实此结果与心肌细胞的凋亡有关,由此可以看出α-actin在肌细胞的形成、发育和成熟过程中起着十分重要的作用。β-actin是细胞骨架的主要成分,参与淋巴细胞的迁移、浸润和凋亡等过程[20];其编码序列非常的保守,但非编码序列却有着比较大的差异[20-21]。相关的研究显示,高浓度的硒可以抑制软骨细胞β-actin的mRNA及蛋白的表达[21]。另有研究发现,喹乙醇可以通过干扰肌动蛋白分支蛋白复合物和肌动蛋白结合蛋白的表达来破坏小鼠睾丸支持细胞的细胞骨架结构[22]。Vimentin是细胞骨架蛋白中重要的中间丝蛋白,它能够结合细胞膜和核膜之间的许多膜结构,在确保细胞流动性的同时,在稳定细胞形态和传输物质的过程中起着重要的作用[23-24]。对内毒素血症大鼠心肌细胞骨架蛋白测定发现,随着疾病的发展,肌动蛋白的含量急剧下降,且呈不规则的排列状态。除具体病症能引起细胞骨架蛋白的改变外,机械性损伤也会对细胞骨架造成不可逆式的损害,例如随负重的加强,大鼠骨骼肌组织中α-actin的mRNA表达呈下降趋势[25]。本试验结果表明,当细胞培养基中Mo浓度高于0.2 mmol/L时,细胞骨架相关蛋白α-actin、β-actin和Vimentin的蛋白合成均受到抑制,可见过量的Mo破坏了其用于维持细胞膜力学稳定和功能的细胞骨架的完整性,从而导致细胞内环境稳态的失衡,细胞功能受损。
4 结论高浓度的Mo可导致小鼠骨骼肌上皮细胞形态发生异常,出现畸形,细胞活力下降;抑制小鼠骨骼肌上皮细胞的抗氧化能力,并产生脂质过氧化损伤;同时,还可下调小鼠骨骼肌上皮细胞的细胞骨架蛋白α-actin,β-actin和Vimentin的mRNA表达,抑制蛋白合成。
| [1] |
MENDEL R R. Cell biology of molybdenum[J]. Biofactors, 2009, 35(5): 429-434. DOI:10.1002/biof.55 |
| [2] |
GIRIDHARAN S S P, CAPLAN S. MICAL-family proteins:complex regulators of the actin cytoskeleton[J]. Antioxidants & Redox Signalling, 2014, 20(13): 2059-2073. |
| [3] |
STOURNARAS C, GRAVANIS A, MARGIORIS A N, et al. The actin cytoskeleton in rapid steroid hormone actions[J]. Cytoskeleton, 2014, 71(5): 285-293. DOI:10.1002/cm.21172 |
| [4] |
王亚垒, 杨自军, 张鹏, 等. 高钼对雄性绵羊骨骼X线特征及骨密度变化的影响[J]. 河南农业科学, 2013, 42(4): 145-148. DOI:10.3969/j.issn.1004-3268.2013.04.035 |
| [5] |
AUNG K H, TSUKAHARA S, MEAKAWA F, et al. Role of environmental chemical insult in neuronal cell death and cytoskeleton damage[J]. Biological and Pharmaceutical Bulletin, 2015, 38(8): 1109-1112. DOI:10.1248/bpb.b14-00890 |
| [6] |
孙宝飞, 王恒, 康朝胜, 等. 慢性砷中毒对骨骼肌超微结构的影响[J]. 黔南民族医专学报, 2015, 28(3): 165-167, 232. |
| [7] |
MUSARÒ A, CAROSIO S.Isolation and culture of satellite cells from mouse skeletal muscle[M]//DI NARDO P, DHINGRA S, SINGLA D.Adult stem cells.New York: Springer, 2017.
|
| [8] |
孙素玲, 刘明明, 后家蘅. 钼对大鼠致畸和致突变作用的研究[J]. 癌变·畸变·突变, 2007, 19(3): 250-252. DOI:10.3969/j.issn.1004-616X.2007.03.023 |
| [9] |
杨平, 惠起源. 钼及其化合物配合物与胃癌研究进展[J]. 微量元素与健康研究, 2012, 29(1): 65-67. |
| [10] |
YE N H, LIU S T, LIN Y Y, et al. Protective effects of intraperitoneal injection of TAT-SOD against focal cerebral ischemia/reperfusion injury in rats[J]. Life Sciences, 2011, 89(23/24): 868-874. |
| [11] |
CARILLON J, FOURET G, FEILLET-COUDRAY C, et al. Short-term assessment of toxicological aspects, oxidative and inflammatory response to dietary melon superoxide dismutase in rats[J]. Food and Chemical Toxicology, 2013, 55: 323-328. DOI:10.1016/j.fct.2013.01.021 |
| [12] |
TAMAYO D, MUÑOZ J F, ALMEIDA A J, et al. Paracoccidioides spp.catalases and their role in antioxidant defense against host defense responses[J]. Fungal Genetics and Biology, 2017, 100: 22-32. DOI:10.1016/j.fgb.2017.01.005 |
| [13] |
DRAGUN Z, MARIJI C ' V F, KRASNI C ' I N, et al. Malondialdehyde concentrations in the intestine and gills of Vardar chub (Squalius vardarensis Karaman) as indicator of lipid peroxidation[J]. Environmental Science and Pollution Research, 2017, 24(20): 16917-16926. DOI:10.1007/s11356-017-9305-x |
| [14] |
梁影. 血清乳酸脱氢酶检测在巨幼细胞性贫血诊断中的意义[J]. 临床医学研究与实践, 2016, 1(22): 32-33. |
| [15] |
SUN X R, SUN Z, ZHU Z, et al. Clinicopathological significance and prognostic value of lactate dehydrogenase A expression in gastric cancer patients[J]. PLoS One, 2014, 9(3): 91068. DOI:10.1371/journal.pone.0091068 |
| [16] |
SHICHIRI M. The role of lipid peroxidation in neurological disorders[J]. Journal of Clinical Biochemistry and Nutrition, 2014, 54(3): 151-160. |
| [17] |
WANG Y, ZHAO H J, SHAO Y Z, et al. Copper (Ⅱ) and/or arsenite-induced oxidative stress cascades apoptosis and autophagy in the skeletal muscles of chicken[J]. Chemosphere, 2018, 206: 597-605. DOI:10.1016/j.chemosphere.2018.05.013 |
| [18] |
KOROBOVA F, RAMABHADRAN V, HIGGS H N. An actin-dependent step in mitochondrial fission mediated by the ER-associated formin INF2[J]. Science, 2013, 339(6118): 464-467. DOI:10.1126/science.1228360 |
| [19] |
JIANG H K, QIU G R, LI L J, et al. Reduced ACTC1 expression might play a role in the onset of congenital heart disease by inducing cardiomyocyte apoptosis[J]. Circulation Journal, 2010, 74(11): 2410-2418. DOI:10.1253/circj.CJ-10-0234 |
| [20] |
CHEN X L, ZHENG J, CAI J Y, et al. The cytoskeleton protein β-actin may mediate T cell apoptosis during acute rejection reaction after liver transplantation in a rat model[J]. American Journal of Translational Research, 2017, 9(11): 4888-4901. |
| [21] |
李锦, 王加丽, 罗明秀, 等. NIV毒素对软骨细胞骨架蛋白的影响及硒的拮抗作用[J]. 国外医学(医学地理分册), 2013, 34(3): 146-150. DOI:10.3969/j.issn.1001-8883.2013.03.002 |
| [22] |
WU D, HUANG C J, JIAO X F, et al. Olaquindox disrupts tight junction integrity and cytoskeleton architecture in mouse Sertoli cells[J]. Oncotarget, 2017, 8(51): 88630-88644. |
| [23] |
韩婧, 潘燕, 李学军. 波形蛋白的结构、功能和与肿瘤的关系[J]. 医学分子生物学杂志, 2011, 8(3): 265-268. DOI:10.3870/j.issn.1672-8009.2011.03.017 |
| [24] |
BARRIÈRE G, TARTARY M, RIGAUD M. Metformin:a rising star to fight the epithelial mesenchymal transition in oncology[J]. Anticancer Agents Med Chem, 2013, 13(2): 333-340. DOI:10.2174/1871520611313020018 |
| [25] |
刘丰彬, 赵斌, 闫万军, 等. 负重训练和补充大豆多肽干预大鼠骨骼肌衰老过程的实验研究[J]. 天津体育学院学报, 2010, 25(1): 33-37. DOI:10.3969/j.issn.1005-0000.2010.01.009 |




