2. 浙江省兽药饲料监察所, 杭州 310018
2. Zhejiang Institute of Veterinary Drug and Feed Control, Hangzhou 310018, China
产肠毒素大肠杆菌(entertoxigenic Escherichia coli, ETEC)是一类引起人和幼畜发生腹泻的重要病原菌,初生幼畜感染ETEC后常出现剧烈水样腹泻,甚至会导致迅速脱水后死亡,发病率和死亡率均较高[1-2]。据估计,国内约有35%的仔猪腹泻是由ETEC感染引起的,美国等国家仔猪腹泻中由ETEC引起的约占45%,是导致养殖业经济损失的重要因素[3-4]。ETEC菌体表面含有纤毛样突出的菌毛,通过与肠上皮细胞受体结合黏附于肠黏膜,使细菌定植并大量繁殖,引起炎症反应,同时产生大量肠毒素,造成肠黏膜上皮细胞的病理性变化[1-2]。
丁酸梭菌(Clostridium butyrium, CB)为梭菌属的革兰氏阳性厌氧细菌,是调节动物肠道健康的益生菌饲料添加剂,能促进肠道双歧杆菌、乳酸菌等有益菌的增殖,抑制肠道内大肠杆菌、幽门螺杆菌、迟缓爱德华氏菌、沙门氏菌、产气荚膜梭菌等病原菌的生长和黏附[5-7]。Imase等[8]报道,丁酸梭菌可以治疗人因大肠杆菌和幽门螺杆菌引起的腹泻和炎症性肠炎;刘韶娜等[9]的研究表明,在饲粮中添加丁酸梭菌可提高断奶仔猪的免疫能力,抑制肠道有害菌的生长;郑有秀等[10]的研究也表明,在饲粮中添加丁酸梭菌可以通过改善肠道结构和提高血清免疫球蛋白A和免疫球蛋白G的含量来降低断奶仔猪的腹泻率,其中250和500 mg/kg丁酸梭菌组的腹泻率分别较对照组降低了40.99%和44.32%。丁酸梭菌的主要代谢产物丁酸是肠道上皮细胞再生和修复的营养物质,通过对消化道黏膜上皮细胞的营养调控起到促进增殖的作用,利于损伤上皮的修复[11]。目前对于丁酸梭菌防治仔猪腹泻的研究,主要通过饲养试验来进行[3, 9-11],但是针对丁酸梭菌防治ETEC引起的仔猪腹泻,在体内试验上开展首先需要建立ETEC感染模型,这易受到试验条件的限制,同时试验成本也相对较高。因此,本研究旨在体外细胞模型条件下,研究不同剂量的丁酸杆菌对ETEC感染的猪肠道细胞损伤脱落和炎症反应的抑制作用,对于阐明丁酸梭菌干预仔猪腹泻的作用机理具有重要的意义。
1 材料与方法 1.1 试验材料丁酸梭菌(MIYAIRI Ⅱ 588菌株)购自日本的米雅利桑株式会社;ETEC(K88菌株)购自中国菌种保藏中心;猪肠道上皮细胞(IPEC-J2细胞)由中国农业大学提供。
1.2 细胞与细菌培养采用含10%胎牛血清和1%抗生素的DMEM培养液(Gibco),在37 ℃、5% CO2、90%相对湿度的培养箱中培养IPEC-J2细胞,隔天换液,待细胞密度达到80%时用0.25%胰酶-乙二胺四乙酸(EDTA)(Solarbio)消化传代。丁酸梭菌和ETEC活化后分别接种于MRS和LB培养液(北京陆桥技术股份有限公司)培养。
1.3 试验处理和样品收集取对数生长期的IPEC-J2细胞接种于6孔板中,调整至1×106个/孔,待细胞贴壁生长至80%左右,参照Zhao等[12]的方法设置1×106、1×107和1×108 CFU/mL 3个丁酸梭菌浓度梯度进行如下处理:对照组,IPEC-J2细胞培养液中不添加ETEC和CB;ETEC组,IPEC-J2细胞培养液中加入1×108 CFU/mL ETEC;ETEC+CB 106组,IPEC-J2细胞培养液中加入1×108 CFU/mL ETEC和1×106 CFU/mL丁酸梭菌;ETEC+CB 107组,IPEC-J2细胞培养液中加入1×108 CFU/mL ETEC和1×107 CFU/mL丁酸梭菌;ETEC+CB 108组,IPEC-J2细胞培养液中加入1×108 CFU/mL ETEC和1×108 CFU/mL丁酸梭菌。每组3个重复,37 ℃培养2 h后,吸取培养液10 000×g离心5 min用于收集菌体;用磷酸盐缓冲液(PBS)洗涤细胞后,用荧光倒置显微镜(Nikon)观察细胞形态,并用细胞刮棒刮取细胞用于RNA提取。
1.4 RNA提取和逆转录采用TRIzol® Plus RNA Purification Kit(Invitrogen)和RNase-Free DNase Set(Qiagen)试剂盒提取细菌和IPEC-J2细胞的RNA,参照相应的说明书进行操作。用微量核酸蛋白质分析仪(Nanodrop-2000)检测提取的RNA的浓度和质量。将细菌和IPEC-J2细胞的mRNA均按照逆转录试剂盒SuperScriptTM Ⅲ First-Strand Synthesis SuperMix for qRT-PCR(Invitrogen)操作逆转录成cDNA。
1.5 基因引物设计与实时荧光定量PCR采用Primer Premier 6.0和Beacon designer 7.8软件设计ETEC的16S(内参基因)、FaeG、estA、estB基因引物和IPEC-J2细胞的18S(内参基因)、白细胞介素(IL)-1β、IL-2、IL-6、IL-8、IL-10基因引物,其引物序列分别见表 1和表 2。所有引物均由生工生物工程(上海)股份有限公司合成。
|
|
表 1 ETEC实时荧光定量PCR引物序列 Table 1 Primer sequences of ETEC for real-time quantitative PCR |
|
|
表 2 IPEC-J2细胞实时荧光定量PCR引物序列 Table 2 Primer sequences of IPEC-J2 cell for real-time quantitative PCR |
将逆转录所得cDNA按照Power SYBR® Green PCR Master Mix试剂盒(TaKaRa)操作,采用20 μL反应体系,在CFX384荧光定量PCR仪(Bio-Rad)中进行实时荧光定量PCR。PCR反应程序为:95 ℃预变性,1 min;40个循环(95 ℃变性,15 s,63 ℃退火,25 s,收集荧光);55~95 ℃绘制熔解曲线。
1.6 数据分析以内参基因为参照,各个基因的相对表达水平按照2-△△Ct法进行计算。试验数据采用SPSS 18.0软件进行统计分析,P<0.05表示差异显著。试验数据由平均值±标准误表示。
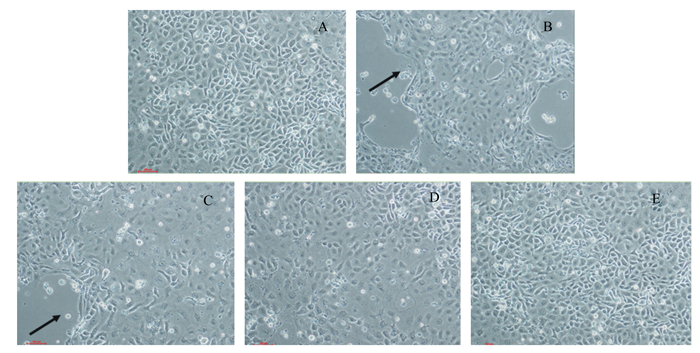
2 结果与分析 2.1 不同浓度丁酸梭菌对ETEC刺激IPEC-J2细胞形态的影响正常培养的IPEC-J2细胞贴壁生长良好,排列紧密,形态呈椭圆梭形(图 1-A)。ETEC处理后,IPEC-J2细胞贴壁的生长状态受到影响,排列相对松散,部分细胞已经损伤脱落(图 1-B)。在加入ETEC时同时加入不同浓度丁酸梭菌(1×106~1×108 CFU/mL)进行处理,IPEC-J2细胞的生长状态得以改善,且丁酸梭菌浓度越高,细胞贴壁生长情况越好,损伤脱落比例明显降低(图 1-C、图 1-D、图 1-E)。
|
A:对照组control group;B:ETEC组ETEC group;C:ETEC+CB 106组ETEC+CB 106 group;D:ETEC+CB 107组ETEC+CB 107group;E:ETEC+CB 108组ETEC+CB 108 group。 图 1 不同浓度丁酸梭菌对ETEC刺激IPEC-J2细胞形态的影响 Fig. 1 Effects of different concentrations of CB on morphology of IPEC-J2 cells challenged by ETEC (40×) |
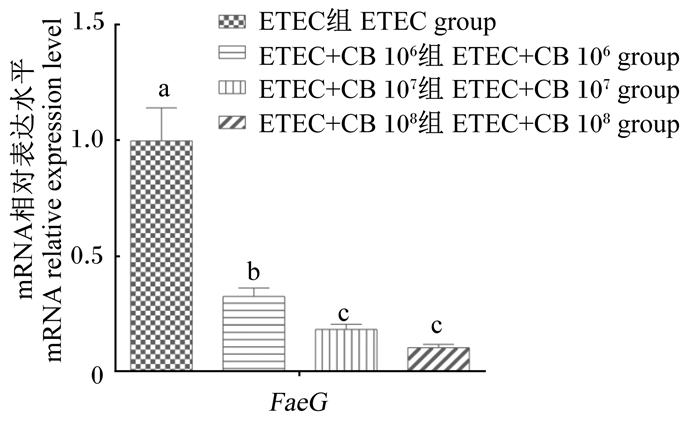
由图 2可知,在ETEC和IPEC-J2细胞共培养模型中,加入不同浓度的丁酸梭菌均可显著抑制ETEC黏附基因FaeG的表达(P<0.05)。与未加入丁酸梭菌的ETEC组相比,ETEC+CB 106组、ETEC+CB 107组和ETEC+CB 108组FaeG mRNA的相对表达水平分别降低了67%、82%和90%。同时,ETEC+CB 106组对FaeG表达的抑制效果显著低于ETEC+CB 107和ETEC+CB 108组(P<0.05)。
|
数据柱标注不同字母表示差异显著(P < 0.05)。下图同。 Data bars with different letters are significantly different (P < 0.05). The same as below. 图 2 不同浓度丁酸梭菌对ETEC黏附基因FaeG表达的影响 Fig. 2 Fig. 2 Effects of different concentrations of CB on expression of adhesion gene FaeG in ETEC |
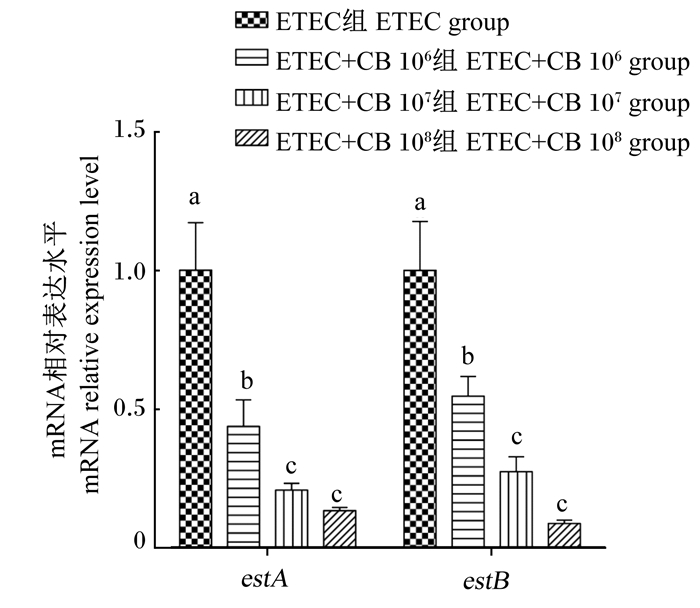
由图 3可知,在IPEC-J2细胞培养液中同时加入ETEC和不同浓度丁酸梭菌共培养后,ETEC产肠毒素基因estA、estB mRNA的相对表达水平相对于ETEC组均出现了极显著降低(P<0.01)。对比不同浓度的丁酸梭菌后发现,1×108 CFU/mL丁酸梭菌对2个产肠毒素基因表达的抑制效果最强,而ETEC+CB 106组对estA与estB表达的抑制效果显著弱于ETEC+CB 107组和ETEC+CB 108组(P<0.05)。
|
图 3 不同浓度丁酸梭菌对ETEC产肠毒素基因estA、estB表达的影响 Fig. 3 Effects of different concentrations of CB on expression of enterotoxigenic genes estA and estB in ETEC |
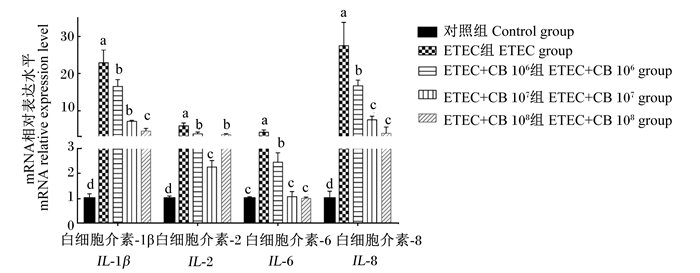
由图 4可知,与对照组相比,ETEC刺激使得IPEC-J2细胞中促炎性因子IL-1β、IL-2、IL-6和IL-8 mRNA的相对表达水平有4~20倍的显著升高(P<0.05);而同时加入不同浓度的丁酸梭菌后,所有促炎性因子mRNA的相对表达水平均较单纯加入ETEC时出现了显著下降(P<0.05)。其中,丁酸梭菌浓度为1×107 CFU/mL时对IL-2表达的抑制效果最强,而丁酸梭菌浓度为1×108 CFU/mL时对IL-6和IL-8表达的抑制作用最强。
|
图 4 不同浓度丁酸梭菌对ETEC刺激IPEC-J2细胞中促炎性因子IL-1β、IL-2、IL-6和IL-8表达的影响 Fig. 4 Effects of different concentrations of CB on expression of pro-inflammatory factors IL-1β, IL-2, IL-6 and IL-8 in IPEC-J2 cells challenged by ETEC |
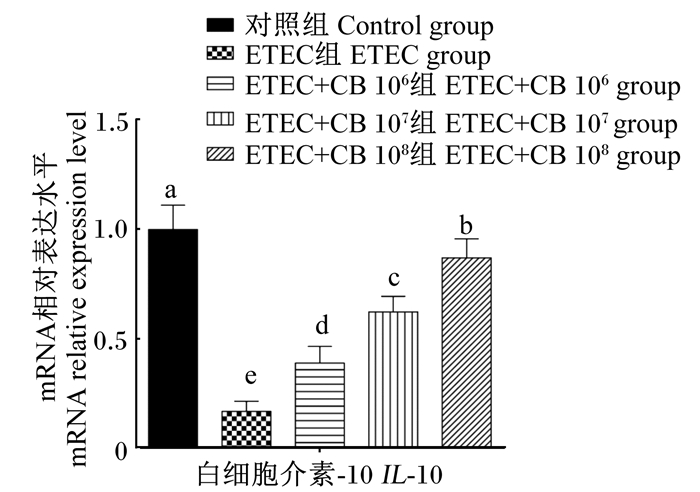
由图 5可知,与对照组相比,ETEC组IPEC-J2细胞中抗炎性因子IL-10 mRNA的相对表达水平降低了87%(P < 0.05),而加入1×106、1×107、1×108 CFU/mL丁酸梭菌使IL-10 mRNA的相对表达水平显著升高(P<0.05),且丁酸梭菌对IL-10表达的促进效果随浓度的增加而显著增强(P<0.05)。
|
图 5 不同浓度丁酸梭菌对大肠杆菌刺激IPEC-J2细胞中抗炎性因子IL-10表达的影响 Fig. 5 Effects of different concentrations of CB on expression of anti-inflammatory factor IL-10 in IPEC-J2 cells challenged by ETEC |
ETEC是导致新生和断奶仔猪腹泻或死亡最常见的病原菌,给养猪业带来了巨大的危害和经济损失[2-4]。Johnson等[13]研究发现,大肠杆菌致病机理中诱导细胞凋亡是其致病的重要因素,当IPEC-J2细胞被大肠杆菌感染1~4 h后,钙黄绿素呈阴性和膜联蛋白V呈阳性的细胞数逐渐增加,IPEC-J2细胞的代谢活性和活细胞数量逐渐降低。在本试验中,IPEC-J2细胞感染ETEC 2 h后出现大量的脱落,表明IPEC-J2细胞被ETEC感染2 h后产生较多的细胞损伤;但是加入不同浓度的丁酸梭菌可以显著降低ETEC引起的细胞脱落损伤,且丁酸梭菌浓度越高,效果越显著。
ETEC致病过程的第1步就是黏附素与宿主肠道细胞受体相结合,因此抑制ETEC黏附素的表达可在一定程度上能抑制其在肠道上定植生长[1-2]。本试验发现添加不同浓度的丁酸梭菌对ETEC黏附基因FaeG的表达均具有显著的抑制效果,表明丁酸梭菌可以抑制ETEC在IPEC-J2细胞上的粘附定植,从而减少了ETEC对IPEC-J2细胞的直接刺激作用,这与Gao等[14]的研究结果一致。当ETEC在肠道上定植后,可分泌耐热肠毒素和不耐热肠毒素,耐热肠毒素a和肠道上皮细胞鸟苷酸环化酶C受体结合后,导致过多分泌的水分和电解质进入肠腔,最终引起腹泻[2];耐热肠毒素b会引起肠道上皮细胞质中钙离子浓度升高,导致血清胺的释放,血清胺介导肠道细胞中水和电解质的分泌导致腹泻[15]。不耐热肠毒素与肠上皮细胞膜上的受体的结合,可引起细胞内环磷酸腺苷水平的升高,激活环磷酸腺苷依赖性蛋白激酶A,刺激氯离子的分泌和钠离子吸收的减少,最终引发宿主腹泻[4],但是Johnson等[13]研究发现,ETEC引起IPEC-J2细胞凋亡与不耐热肠毒素无关。所以在本试验中仅针对ETEC产耐热肠毒素基因estA和estB的表达进行分析,发现在加入不同浓度的丁酸梭菌后,ETEC estA和estB mRNA的相对表达水平均显著降低,表明丁酸梭菌可以抑制ETEC产耐热肠毒素的产生。
肠道炎症通常是由细菌诱导的大量炎性因子表达造成的[1-2],丁酸梭菌等益生菌可以通过抑制炎性反应来发挥益生作用[7, 16-17]。本试验发现,IPEC-J2细胞经过ETEC处理后,促炎性因子IL-1β、IL-2、IL-6、IL-8 mRNA的相对表达水平均显著升高,而在加入不同浓度丁酸梭菌后,这些促炎性因子mRNA的相对表达水平均显著降低;同时,抗炎性因子IL-10 mRNA的相对表达水平在ETEC处理后显著降低,而在添加不同浓度丁酸梭菌后IL-10 mRNA的相对表达水平则显著增加,且丁酸梭菌浓度越高,IL-10 mRNA的相对表达水平越高,表明丁酸梭菌可以通过提高IPEC-J2细胞的抗炎作用来减少ETEC引起的肠道炎症反应。丁酸梭菌的细胞壁成分磷壁酸能够特异性激活宿主细胞的Toll样受体2信号传导通路,诱发一系列免疫应答反应,在致病菌诱发炎症的调控过程中发挥重要作用[18]。因此,在ETEC、丁酸梭菌和猪肠道细胞互作的过程中,丁酸梭菌的细胞壁成分磷壁酸可能是抑制肠道上皮细胞炎症反应的重要因子。
4 结论丁酸梭菌可以通过降低ETEC黏附基因和产肠毒素基因的表达,促进猪肠道上皮细胞抗炎性因子的表达和抑制促炎性因子的表达,来降低ETEC引起的猪肠道上皮细胞炎症反应和损伤脱落,且丁酸梭菌浓度为1×107和1×108 CFU/mL时对细胞结构形态的保护作用和炎症反应的抑制作用效果较好。
| [1] |
ROY K, HILLIARD G M, HAMILTON D J, et al. Enterotoxigenic Escherichia coli EtpA mediates adhesion between flagella and host cells[J]. Nature, 2009, 457(7229): 594-598. |
| [2] |
黄登桂, 周加义, 高春起, 等. 产肠毒素大肠杆菌对仔猪肠道黏膜屏障功能的影响及其损伤修复研究进展[J]. 动物营养学报, 2019, 31(1): 48-56. |
| [3] |
FAIRBROTHER J M, NADEAU E, GYLES C L. Escherichia coli in postweaning diarrhea in pigs:an update on bacterial types pathogenesis and prevention strategies[J]. Animal Health Research Reviews, 2005, 6(1): 17-39. |
| [4] |
ZHANG W P, ZHAO M J, RUESCH L, et al. Prevalence of virulence genes in Escherichia coli strains recently isolated from young pigs with diarrhea in the US[J]. Veterinary Microbiology, 2007, 123(1/2/3): 145-152. |
| [5] |
TAKAHASHI M, TAGUCHI H, YAMAGUCHI H, et al. The effect of probiotic treatment with Clostridium butyricum on enterohemorrhagic Escherichia coli O157 : H7 infection in mice[J]. FEMS Immunology & Medical Microbiology, 2004, 41(3): 219-226. |
| [6] |
曹广添, 刘婷婷, 周琳, 等. 丁酸梭菌对致病菌和有益菌的体外作用效果研究[J]. 中国饲料, 2012(4): 16-19. |
| [7] |
赵敏孟, 单昊书, 沈永华, 等. 丁酸梭菌在畜禽生产中的应用研究进展[J]. 动物营养学报, 2018, 30(7): 2467-2472. |
| [8] |
IMASE K, TAKAHASHI M, TANAKA A, et al. Efficacy of Clostridium butyricum preparation concomitantly with Helicobacter pylori eradication therapy in relation to changes in the intestinal microbiota[J]. Microbiology Immunology, 2008, 52(3): 156-161. |
| [9] |
刘韶娜, 朱石安, 赵彦光, 等. 丁酸梭菌对滇陆猪断奶仔猪日增重、血清生化免疫和肠道菌群的影响[J]. 中国饲料, 2018(24): 49-53. |
| [10] |
郑有秀, 王超, 邹晓庭, 等. 丁酸梭菌对断奶仔猪生长性能、肠道结构和免疫功能的影响[J]. 动物营养学报, 2018, 30(7): 2683-2689. |
| [11] |
桂国弘, 徐娥, 杨华, 等. 丁酸梭菌调节肠道健康的作用机制[J]. 饲料研究, 2016(22): 42-46. |
| [12] |
ZHAO X, GUO Y M, LIU H B, et al. Clostridium butyricum reduce lipogenesis through bacterial wall components and butyrate[J]. Applied Microbiology and Biotechnology, 2014, 98(17): 7549-7557. |
| [13] |
JOHNSON A M, KAUSHIK R S, ROTELLA N J, et al. Enterotoxigenic Escherichia coli modulates host intestinal cell membrane asymmetry and metabolic activity[J]. Infection and Immunity, 2009, 77(1): 341-347. |
| [14] |
GAO Q X, QI L L, WU T X, et al. Ability of Clostridium butyricum to inhibit Escherichia coli-induced apoptosis in chicken embryo intestinal cells[J]. Veterinary Microbiology, 2012, 160(3/4): 395-402. |
| [15] |
VAANDRAGER A B. Structure and function of the heat-stable enterotoxin receptor/guanylyl cyclase C[J]. Molecular and Cellular Biochemistry, 2002, 230(1/2): 73-83. |
| [16] |
吴杰, 邓波, 李孝辉, 等. 丁酸梭菌抑制脂多糖致急性应激大鼠肠道损伤的效果研究[J]. 动物营养学报, 2018, 30(4): 1530-1537. |
| [17] |
LI H H, LI Y P, ZHU Q, et al. Dietary supplementation with Clostridium butyricum helps to improve the intestinal barrier function of weaned piglets challenged with enterotoxigenic Escherichia coli K88[J]. Journal of Applied Microbiology, 2018, 125(4): 964-975. |
| [18] |
TIAN Y G, ZHANG X L, ZHANG K, et al. Effect of Enterococcus faecalis lipoteichoic acid on apoptosis in human osteoblast-like cells[J]. Journal of Endodontics, 2013, 39(5): 632-637. |




