2. 河北科技师范学院动物科技学院, 河北省特色动物种质资源挖掘与创新重点实验室, 秦皇岛 066004
2. Hebei Key Laboratory of Specialty Animal Germplasm Resources Innovation and Utilization, Qinhuangdao 066004, China
铜在机体中主要以辅酶形式存在,参与动物毛皮生长、毛色形成、造血、繁殖和免疫等生命活动[1]。有报道,饲粮中添加铜可以提高家畜生长性能[2],但微量元素铜对乌苏里貉生长性能影响的研究鲜有报道。目前市场上可用于饲料添加剂的铜源种类繁多,研究并明确铜源对育成期雄性乌苏里貉生长性能的影响,对指导生产具有重要意义。研究发现,饲粮中添加适宜的铜能够提高动物的生长性能,但不同动物种类对不同铜源的吸收利用有一定的差异[3-6]。胡二永[7]研究表明,在仔猪饲粮中添加60 mg/kg甘氨酸铜与200 mg/kg硫酸铜具有相似的促生长效果,但添加甘氨酸铜组猪粪中铜含量较低,更有利于环保。也有学者证实,在仔鸡养殖中蛋氨酸铜的利用效率高于碱式氯化铜和硫酸铜[8]。李向辉等[9]研究发现,北京鸭饲粮中添加氨基酸螯合铜的促生长效果高于硫酸铜,并明显改善了铜排泄量与沉积量。毛皮动物铜源利用规律与传统家畜相似,Wu等[10]和刘志等[11]在水貂和蓝狐的研究中表明,蛋氨酸铜的促生长效果优于碱式氯化铜和硫酸铜。乌苏里貉作为我国饲养的主要毛皮动物,关于铜方面研究较少,其对不同铜源的利用与其他动物相比是否存在差异仍不清楚。目前,硫酸铜被饲养者广泛使用,但在实践生产中,硫酸铜存在易潮解、铜含量低等缺点,碱式氯化铜是其良好的替代品,随着加工工艺的优化以及环保意识的提升,氨基酸铜、柠檬酸铜等有机铜的应用也逐渐增加。因此,本试验拟选用硫酸铜、碱式氯化铜及蛋氨酸铜作为铜源,研究不同铜源对育成期乌苏里貉生长性能、营养物质消化率和血清生化指标的影响,为貉健康养殖生产实践提供理论参考。
1 材料与方法 1.1 试验动物及分组试验选择农业部长白山野生生物资源重点野外科学观测试验站饲养的乌苏里貉。选取(60±5)日龄、健康、体重相近的雄性乌苏里貉60只,随机分成4组(Ⅰ~Ⅳ组),每组15只,每只单笼饲养,各组间初重差异不显著(P>0.05)。
1.2 试验设计与试验饲粮采用单因素试验设计,在基础饲粮中分别添加硫酸铜(Ⅰ组)、碱式氯化铜(Ⅱ组)、混合铜(Ⅲ组,碱式氯化铜和蛋氨酸铜,添加比例为1:1,以铜元素计)和蛋氨酸铜(Ⅳ组),添加水平均为40 mg/kg。
参考NRC(1982)[12]、鲍坤等[13]、白玉妍等[14]以及生产实践中饲喂效果较好的育成期乌苏里貉饲粮配方配制基础饲粮,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验开始前,按常规免疫程序对动物进行免疫。预试期7 d,正试期55 d,试验于2018年7月25日至2018年9月25进行。每日定时定量饲喂,07:00与15:30各饲喂1次,自由饮水,定时清洁打扫笼舍。
1.4 消化代谢试验消化代谢试验于2018年9月2日至2018年9月4日进行,共计3 d。采用全收粪法,使用粪尿分离的集粪盘和集尿器收集每日的粪、尿。收集的粪便按照鲜重5%喷洒10%硫酸溶液,进行固氮处理。尿液每100 mL添加10 mL的10%硫酸溶液。粪便与尿液都保存于-20 ℃备用。将3 d的粪便混合均匀、称重并取样,尿液混合均匀、称量体积并取样。粪便样品在65 ℃烘干至恒重,制成风干样品,粉碎过40目筛,检测各营养成分含量。
1.5 测定指标及方法 1.5.1 生长性能指标正试期开始后第1天,晨饲前称量乌苏里貉初重,试验结束前1天空腹体重作为末重,计算每只乌苏里貉日增重以及平均日增重(ADG)。每天记录每只乌苏里貉采食量和残余料量,计算日采食量以及平均日采食量(ADFI),根据ADG和ADFI计算料重比(F/G)。
1.5.2 营养物质消化率干物质含量参照GB/T 6435—2006测定;粗蛋白质含量采用凯氏定氮法,参考GB/T 6432—1994测定;粗脂肪含量采用索氏浸提法,参考GB/T 6433—2006测定;钙含量采用乙二胺四乙酸(EDTA)络合滴定法,参考GB/T 6436—2002测定;磷含量采用钒钼酸铵比色法,参考GB/T 6437—2002测定;铜含量采用火焰原子吸收光谱法,参考GB 5009.13—2017测定。营养物质消化率计算公式如下:
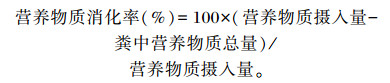
|
摄入氮、粪氮与尿氮含量采用凯氏定氮法测定,摄入铜、粪铜与尿铜含量采用火焰原子吸收光谱法测定。氮、铜沉积计算公式如下:

|
饲养试验结束前1天,每组随机选取8只健康乌苏里貉,后肢静脉采血10 mL,置于促凝采血管中,3 500 r/min离心8 min,分离血清,分装于1.5 mL编好号的Eppendorf管中,检测血清中的总蛋白(TP)、白蛋白(ALB)、甘油三酯(TG)、胆固醇(CHO)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、尿素氮(UN)含量。使用VITALIB-E全自动生化分析仪测定,所有试剂盒购于中生北控生物科技股份有限公司,操作过程严格按照试剂盒说明进行。
1.6 数据统计结果以“平均值±标准差”表示,试验数据通过SAS 9.4中单因素方差分析(one-way ANOVA)进行显著性检验,采用Duncan氏法进行多重比较,P < 0.05为差异显著。
2 结果 2.1 不同铜源对育成期乌苏里貉生长性能的影响由表 2可知,在试验结束时,Ⅲ组末重显著高于Ⅰ组(P < 0.05),其中Ⅲ组获得最大体重。Ⅲ组ADG显著高于Ⅰ组(P < 0.05),其余各组间差异不显著(P>0.05)。ADFI和F/G各组间差异不显著(P>0.05),但Ⅲ、Ⅳ组的F/G数值低于Ⅰ、Ⅱ组。
|
|
表 2 不同铜源对育成期乌苏里貉生长性能的影响 Table 2 Effects of different copper sources on growth performance of growing raccoon dogs |
由表 3可知,Ⅱ组的粗脂肪消化率显著高于Ⅰ、Ⅲ、Ⅳ组(P < 0.05)。Ⅲ组的铜消化率显著高于Ⅰ、Ⅱ和Ⅲ组(P < 0.05)。干物质消化率、粗蛋白质消化率各组间差异不显著(P>0.05),但Ⅱ、Ⅲ、Ⅳ组的粗蛋白质消化率与Ⅰ组相比分别提高了3.56%、2.22%、4.43%。
|
|
表 3 不同铜源对育成期乌苏里貉营养物质消化率的影响 Table 3 Effects of different copper sources on nutrient digestibility of growing racoon dogs |
由表 4可知,不同铜源对育成期乌苏里貉食入氮、粪氮、尿氮含量和氮沉积的影响差异不显著(P>0.05),Ⅰ、Ⅲ、Ⅳ组的粪氮、尿氮含量低于Ⅰ组,氮沉积高于Ⅰ组,其中Ⅳ组的氮沉积最高。不同组间铜摄入没有显著差异(P>0.05),Ⅰ、Ⅱ、Ⅳ组的粪铜含量显著高于Ⅲ组(P < 0.05)。Ⅳ组尿铜含量显著高于Ⅰ、Ⅱ、Ⅲ组(P < 0.05)。Ⅲ组的铜沉积显著高于Ⅰ、Ⅱ、Ⅳ组(P < 0.05)。
|
|
表 4 不同铜源对育成期乌苏里貉氮和铜代谢的影响 Table 4 Effects of different copper sources on copper and nitrogen metabolism of growing raccoon dogs |
由表 5可知,不同铜源对血清中TG、LDL、CHO、HDL和ALB含量的影响差异不显著(P> 0.05)。Ⅱ组血清中TP含量显著高于Ⅲ、Ⅳ组(P < 0.05)。Ⅲ、Ⅳ组血清中UN含量显著低于Ⅰ组(P < 0.05),其余各组间差异不显著(P>0.05)。
|
|
表 5 不同铜源对育成期乌苏里貉血清生化指标的影响 Table 5 Effects of different copper sources on serum biochemical indices of growing racoon dogs |
微量元素铜在机体代谢中具有重要作用,饲粮中添加适宜的铜有利于提高动物的生长性能和营养物质消化率,并且不同铜源的促生长效果也不同[15-16]。国内外学者研究表明,在猪、鸡等饲粮中添加不同形式铜,如碱式氯化铜、硫酸铜、柠檬酸铜或蛋氨酸铜发现,有机铜促进生长效果更为明显[17-20]。本试验中,添加相同水平、不同铜源对乌苏里貉生长性能的影响差异不显著,但与硫酸铜组(硫酸铜为100%)相比,碱式氯化铜铜、混合铜和蛋氨酸铜组的末重分别提高了1.75%、3.83%、3.35%,ADG分别提高了4.94%、7.50%、6.95%,F/G分别降低了3.68%、5.88%、6.25%。碱式氯化铜对于育成期乌苏里貉生长性能的影响优于硫酸铜,但是低于蛋氨酸铜,当碱式氯化铜与蛋氨酸铜混合使用时,其生长性能优于蛋氨酸铜。国内外多名学者研究发现,蛋氨酸铜、碱式氯化铜和硫酸铜对猪、鸡和水貂等单胃动物的生长性能的影响差异不显著,但都具有促生长效果,其中蛋氨酸铜的功能优于碱式氯化铜,也优于硫酸铜[21-24]。碱式氯化铜和硫酸铜都有促生长作用,但是由于阴离子基团不同,其物理性质和化学性质存在明显差异[25]。无机铜进入体内后以铜离子的形式和氨基酸形成螯合盐能被机体吸收,而有机铜通过细胞的胞饮作用进入,降低了微量元素之间的拮抗作用,减少了体内转化途径,提高能量的利用率和饲料利用率[26]。本试验中混合铜组乌苏里貉获得最佳生长性能可能是由于混合铜源中的铜通过2种不同方式被机体吸收,拮抗作用低于碱式氯化铜,吸收速率高于蛋氨酸铜,因此对于铜的吸收利用效率也比较高,但具体原因还有待进一步研究。
3.2 不同铜源对育成期乌苏里貉营养物质消化率的影响高剂量铜可以改善肠黏膜形态,提高酶的活性改善肠道菌群结构,可间接地提升营养物质消化利用率[27-29]。同一种动物对不同铜源的需要量不同,李家奎等[30]研究发现,122.5 mg/kg蛋氨酸螯合铜对仔猪的促生长效果与250.0 mg/kg硫酸铜无显著差异。Kirchgessner等[31]研究发现,适宜的铜离子可以激活胃蛋白酶活性,提高蛋白质的利用率,促进蛋白质的吸收。Luo等[32]研究表明,高铜能够促进仔猪小肠脂肪酶和磷脂酶A的活性,从而提高对必需脂肪酸的吸收。本试验发现,各组间粗蛋白质消化率差异不显著,但是硫酸铜组粗蛋白质和粗脂肪消化率低于其他组。硫酸铜的稳定性低,容易与小肠黏膜发生刺激性反应,易结成块状,易水解,易分解为铜离子,破坏饲粮中的营养物质。碱式氯化铜、蛋氨酸铜不易溶解,还原性、腐蚀性低,在中性条件下比较稳定,不易与饲粮中物质发生氧化还原反应,其中蛋氨酸螯合物的形式在消化道中能够保护铜而不形成难溶性的化合物,有利铜的快速转运[33],并且一定程度上可提高粗脂肪和粗蛋白质的消化率。动物对不同铜源的消化利用率存在差异,有机铜的消化利用率高于无机铜,混合铜源的消化利用率最高,但机体对同时饲喂的不同铜源的代谢途径仍需进一步研究确定。
3.3 不同铜源对育成期乌苏里貉氮代谢与铜代谢的影响氮代谢受内源尿氮和食入氮的影响,尿氮随着饲粮蛋白质水平的变化而变化,当饲粮蛋白质水平过高时,过量的氨基酸经过肝脏转化为尿素,排出体外[34-35]。Barber等[36]发现铜可以提高猪的氮代谢和氮沉积。Liu等[37]研究发现饲粮中添加铜对蓝狐的食入氮、尿氮、氮沉积、氮利用率和氮生物学价值有极显著影响,对粪氮和氮表观消化率有显著影响。在水貂的研究中也同样发现铜可以提高氮的利用率,但是不同形式铜对水貂氮代谢影响较小,蛋氨酸铜效果略高于碱式氯化铜和硫酸铜[38]。本试验发现,不同铜源对于乌苏里貉的氮代谢没有显著影响,但是蛋氨酸铜、碱式氯化铜和混合铜组的氮沉积高于硫酸铜组。蛋白质的合成受生长因子和生长激素调控,铜离子可以通过刺激促生长轴激素的合成与分泌,进而减少氨基酸的分解,增加机体氮的储存,达到促进机体生长的效果[39]。黄元龙[40]也在研究中发现,随着饲粮中铜水平的上升,血清中生长激素与胰岛素样生长因子1的含量呈现先升高后下降的趋势。本试验采用4种铜源,发现蛋氨酸铜、碱式氯化铜和混合铜更利于提高乌苏里貉的氮沉积。不同铜源对貉的铜代谢有着显著影响,混合铜组粪铜含量明显低于无机铜组。未经处理的高铜粪便作为肥料,会在土壤中蓄积,造成污染,因此减少铜的排放量对环境保护具有重要意义,混合铜可以减少铜排放,提高生长性能和营养物质利用率。这进一步证明混合铜源的添加方式更适合育成期乌苏里貉的生长。
3.4 不同铜源对育成期乌苏里貉血清生化指标的影响血清UN是蛋白质水解的最终产物,是反映蛋白质代谢的重要指标[41]。饲粮铜添加水平对长毛兔、仔猪血清中UN含量有显著影响,随着添加水平的升高,血清UN含量呈现先升高再降低的趋势[42-43]。本试验中,混合铜对提升蛋白质的合成效率没有显著效果,但是可以降低蛋白质分解,从而提升蛋白质的利用率。血清中的蛋白类指标可以反映动物对饲粮中的蛋白质利用程度。血清蛋白分为ALB和球蛋白,ALB主要由肝脏细胞合成,具有维持血液正常pH和胶体渗透压、营养和运输等多种功能,也可作为当肝受损害时判断肝功能的指标[44-45]。本次试验中,血清中ALB含量没有显著变化,但碱式氯化铜组血清TP含量显著升高,这可能是由于球蛋白含量升高所导致,具体原因还有待进一步探究。血清中CHO含量是衡量肝脏功能的一项重要指标,CHO主要在肝脏合成,同样肝脏也是CHO的代谢场所。TG是脂肪的主要成分,血清TG含量可以衡量动物体的脂代谢情况,当血清TG含量降低的时候,说明脂肪合成增强或者分解减弱[46]。血清HDL和LDL是运载CHO的重要载体,HDL能消除外周组织CHO,防止动脉硬化的危险。LDL主要功能是运载CHO进入外周组织,当LDL被氧化时,容易和携带的CHO一起吸附在动脉壁上,造成动脉硬化。本试验中不同铜源并不会对动物机体健康造成风险,添加混合铜有降低动脉硬化的潜力。
4 结论饲粮中添加铜会改善育成期乌苏里貉生长性能。与硫酸铜相比,添加碱式氯化铜、混合铜和蛋氨酸铜对乌苏里貉生长性能、营养物质消化率和氮沉积有更积极的影响,其中混合铜综合效果最佳,更利于育成貉的生长,因此建议在育成期乌苏里貉生产中铜的适宜添加方式为碱式氯化铜和蛋氨酸铜混合添加。
| [1] |
张思聪, 马德磊, 李福昌. 铜的代谢及营养生理作用[J]. 饲料研究, 2012(6): 17-19. DOI:10.3969/j.issn.1002-2813.2012.06.006 |
| [2] |
晏家友, 张纯, 唐凌, 等. 不同铜源在畜禽养殖生产中的研究与应用[J]. 中国畜牧兽医, 2016, 43(12): 3227-3231. |
| [3] |
ARMSTRONG T A, COOK D R, WARD M M, et al. Effect of dietary copper source (cupric citrate and cupric sulfate) and concentration on growth performance and fecal copper excretion in weanling pigs[J]. Journal of Animal Science, 2004, 82(4): 1234-1240. DOI:10.2527/2004.8241234x |
| [4] |
COBLE K F, DRITZ S S, USRY J, et al. Effects of copper source (IntelliBond C or copper sulfate) on growth performance, carcass characteristics, pen cleanliness, and economics in finishing pigs[J]. Kansas Agricultural Experiment Station Research Reports, 2013(10): 168-180. DOI:10.4148/2378-5977.7042 |
| [5] |
晏家友, 张纯, 李书伟, 等. 不同铜源对仔猪生长性能、腹泻率及血清免疫和抗氧化功能的影响[J]. 中国畜牧杂志, 2018, 54(11): 93-95, 100. |
| [6] |
李红雪, 吕林, 计成, 等. 不同铜源和铜水平对肉仔鸡前期生长性能和组织中维生素E氧化稳定性的影响[J]. 中国畜牧杂志, 2010, 46(17): 58-61. |
| [7] |
胡二永.甘氨酸铜对仔猪生长性能、养分消化率以及粪便微生物区系的影响[D].硕士学位论文.扬州: 扬州大学, 2012. http://d.wanfangdata.com.cn/Thesis/Y2258729
|
| [8] |
富超, 燕磊, 牛自康, 等. 日粮中添加不同铜源对肉仔鸡生长性能及粪便金属含量的影响[J]. 黑龙江畜牧兽医, 2019(10): 128-131. |
| [9] |
李向辉, 张立恒, 马霞, 等. 不同铜源及添加水平对北京鸭生长性能和脂代谢的影响[J]. 中国饲料, 2019(18): 80-84. |
| [10] |
WU X Z, Liu Z, ZHANG T, et al. Effects of dietary copper on nutrient digestibility, tissular copper deposition and fur quality of growing-furring mink (Mustela vison)[J]. Biological Trace Element Research, 2014, 158(2): 166-175. DOI:10.1007/s12011-014-9933-7 |
| [11] |
刘志.生长期蓝狐饲粮适宜铜水平和铜源的研究[D].博士学位论文.北京: 中国农业科学院, 2016. http://cdmd.cnki.com.cn/Article/CDMD-82101-1016174605.htm
|
| [12] |
National Research Council. Nutrient requirements of mink and foxes[M]. Washington, D.C.: National Academies Press, 1982.
|
| [13] |
鲍坤, 李光玉, 刘佰阳, 等. 饲粮锰水平对冬毛期乌苏里貉生长性能和营养物质消化率及氮代谢的影响[J]. 中国畜牧杂志, 2014, 50(23): 58-61. DOI:10.3969/j.issn.0258-7033.2014.23.014 |
| [14] |
白玉妍, 叶纯子, 吴炳懿, 等. 膨化大豆替代鱼粉对育成期乌苏里貉体质量的影响[J]. 东北林业大学学报, 2010, 38(2): 73-75, 90. DOI:10.3969/j.issn.1000-5382.2010.02.026 |
| [15] |
CROMWELL G L, STAHLY T S, MONEGUE H J. Effects of source and level of copper on performance and liver copper stores in weanling pigs[J]. Journal of Animal Science, 1989, 67(11): 2996-3002. DOI:10.2527/jas1989.67112996x |
| [16] |
MONDAL M K, DAS T K, BISWAS P, et al. Influence of dietary inorganic and organic copper salt and level of soybean oil on plasma lipids, metabolites and mineral balance of broiler chickens[J]. Animal Feed Science and Technology, 2007, 139(3/4): 212-233. |
| [17] |
ANGELOV L, VRABCHEVA V, PETRICHEV M, et al. The effect of copper complex of methionine compared with copper sulfate in growing pigs[J]. Turkish Journal of Veterinary & Animal Sciences, 2010, 34(1): 1-5. |
| [18] |
侯杰, 车向荣. 不同铜源对生长猪生产性能的影响[J]. 饲料广角, 2008(19): 25-26. DOI:10.3969/j.issn.1002-8358.2008.19.010 |
| [19] |
DAS T K, MONDAL M K, BISWAS P, et al. Influence of level of dietary inorganic and organic copper and energy level on the performance and nutrient utilization of broiler chickens[J]. Asian-Australasian Journal of Animal Sciences, 2010, 23(1): 82-89. |
| [20] |
ARMSTRONG T A, SPEARS J W, VAN HEUGTEN E, et al. Effect of copper source (cupric citrate vs cupric sulfate) and level on growth performance and copper metabolism in pigs[J]. Asian-Australasian Journal of Animal Sciences, 2000, 13(8): 1154-1161. DOI:10.5713/ajas.2000.1154 |
| [21] |
张湘琪.铜来源和水平对肉鸡生产性能、脚胫着色和组织铜沉积的影响[D].硕士学位论文.雅安: 四川农业大学, 2009. http://d.wanfangdata.com.cn/Thesis/Y1580692
|
| [22] |
JEGEDE A V, ODUGUWA O O, BAMGBOSE A M, et al. Growth response, blood characteristics and copper accumulation in organs of broilers fed on diets supplemented with organic and inorganic dietary copper sources[J]. British Poultry Science, 2011, 52(1): 133-139. DOI:10.1080/00071668.2010.544714 |
| [23] |
高凤仙, 杨仁斌, 何河, 等. 不同铜源及其水平对猪生产性能和血液生化指标的影响[J]. 湖南农业大学学报(自然科学版), 2007, 33(5): 595-598. |
| [24] |
ZOUBEK G L, PEO JR E R, MOSER B D, et al. Effects of source on copper uptake by swine[J]. Journal of Animal Science, 1975, 40(5): 880-884. DOI:10.2527/jas1975.405880x |
| [25] |
MILES R D, O'KEEFE S F, HENRY P R, et al. The effect of dietary supplementation with copper sulfate or tribasic copper chloride on broiler performance, relative copper bioavailability, and dietary prooxidant activity[J]. Poultry Science, 1998, 77(3): 416-425. DOI:10.1093/ps/77.3.416 |
| [26] |
陈鑫珠, 刘远, 张晓佩, 等. 铜源饲料添加剂的研究进展[J]. 中国畜牧兽医文摘, 2014, 30(11): 192. |
| [27] |
王亚君, 陶聪, 李奎, 等. 无铜饲料对小鼠肠道菌群的影响[J]. 中国畜牧兽医, 2017, 44(10): 2886-2896. |
| [28] |
李向辉, 张立恒, 马霞, 等. 不同铜源及添加水平对北京鸭生长性能和脂代谢的影响[J]. 中国饲料, 2019(18): 80-84. |
| [29] |
RADECKI S V, KU P K, BENNINK M R, et al. Effect of dietary copper on intestinal mucosa enzyme activity, morphology, and turnover rates in weanling pigs[J]. Journal of Animal Science, 1992, 70(5): 1424-1431. DOI:10.2527/1992.7051424x |
| [30] |
李家奎, 郑鑫, 杨连玉, 等. 不同形态的铜对猪生长性能及血清GH、血浆NPY水平的影响[J]. 中国兽医学报, 2004, 24(5): 488-489, 503. DOI:10.3969/j.issn.1005-4545.2004.05.024 |
| [31] |
KIRCHGESSNER M, BEYER M G, STEINHART H. Activation of pepsin (EC 3.4.4.1) by heavy-metal ions including a contribution to the mode of action of copper sulphate in pig nutrition[J]. British Journal of Nutrition, 1976, 36(1): 15-22. DOI:10.1079/BJN19760054 |
| [32] |
LUO X G, DOVE C R. Effect of dietary copper and fat on nutrient utilization, digestive enzyme activities, and tissue mineral levels in weanling pigs[J]. Journal of Animal Science, 1996, 74(8): 1888-1896. DOI:10.2527/1996.7481888x |
| [33] |
乔永刚, 谭北平, 麦康森, 等. 军曹鱼对饲料中铜需要量的研究[J]. 中国海洋大学学报, 2013, 43(4): 34-41. |
| [34] |
DABIRI N, THONNEY M L. Source and level of supplemental protein for growing lambs[J]. Journal of Animal Science, 2004, 82(11): 3237-3244. DOI:10.2527/2004.82113237x |
| [35] |
NENNICH T D, HARRISON J H, VAN WIERINGEN L M, et al. Prediction of manure and nutrient excretion from dairy cattle[J]. Journal of Dairy Science, 2005, 88(10): 3721-3733. DOI:10.3168/jds.S0022-0302(05)73058-7 |
| [36] |
BARBER R S, BRAUDE R, MITCHELL K G. Studies on various potential growth stimulants for growing pigs with particular reference to their activity in supplementing that of copper sulphate[J]. British Journal of Nutrition, 1965, 19(1): 575-579. DOI:10.1079/BJN19650051 |
| [37] |
LIU Z, WU X, ZHANG T, et al. Effects of dietary copper and zinc supplementation on growth performance, tissue mineral retention, antioxidant status, and fur quality in growing-furring blue foxes (Alopex lagopus)[J]. Biological Trace Element Research, 2015, 168(2): 401-410. DOI:10.1007/s12011-015-0376-6 |
| [38] |
吴学壮.水貂饲粮适宜铜源及铜水平研究[D].博士学位论文.北京: 中国农业科学院, 2015.
|
| [39] |
YANG W Y, WANG J G, LIU L, et al. Effect of high dietary copper on somatostatin and growth hormone-releasing hormone levels in the hypothalami of growing pigs[J]. Biological Trace Element Research, 2011, 143(2): 893-900. DOI:10.1007/s12011-010-8904-x |
| [40] |
黄元龙.日粮铜水平对绵羊生长激素释放调节多肽的影响[D].硕士学位论文.长春: 吉林农业大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10193-1019811438.htm
|
| [41] |
李道林.铜源和铜水平对生长獭兔的生长性能、毛皮品质及理化指标的影响[D].硕士学位论文.长春: 中国人民解放军军需大学, 2002. http://cdmd.cnki.com.cn/Article/CDMD-90029-2003060503.htm
|
| [42] |
张永翠, 王恩玲, 李燕舞, 等. 饲粮中铜添加水平对2~4月龄长毛兔生长性能、产毛性能、血清生化指标与含铜酶活性及内脏器官发育的影响[J]. 动物营养学报, 2019, 31(10): 4622-4629. |
| [43] |
郝贵增, 靳玉芬, 田萍, 等. 蛋氨酸铜对仔猪的生长性能及血清生化指标的影响[J]. 中国兽医学报, 2009, 29(3): 346-349. |
| [44] |
李晶. 血清总蛋白测定方法及临床意义[J]. 中国现代药物应用, 2012, 6(9): 28-29. DOI:10.3969/j.issn.1673-9523.2012.09.019 |
| [45] |
陈静, 刘显军, 王彤, 等. 饲粮必需脂肪酸组成对育肥猪生长性能和血清生化指标的影响[J]. 动物营养学报, 2019, 31(8): 3543-3550. |
| [46] |
李清宏, 罗绪刚, 刘彬, 等. 饲粮甘氨酸铜对断奶仔猪血液生理生化指标和组织铜含量的影响[J]. 畜牧兽医学报, 2004, 35(1): 23-27. DOI:10.3321/j.issn:0366-6964.2004.01.005 |




