我国反刍动物饲养过程中由于优质粗饲料资源供给不足,常添加大量的精料以满足动物生长及生产的需要,但这也引起了一系列问题的发生。其中亚急性瘤胃酸中毒(subacute ruminal acidosis,SARA)作为一种常见的疾病,会导致瘤胃微生物区系失衡、上皮损伤、消化机能紊乱并伴有蹄叶炎、肝脓肿、瘤胃炎以及乳脂下降综合征等,严重的甚至会引起动物死亡[1]。瘤胃上皮作为机体吸收营养物质的重要通道,其生理结构的健康完整,特别是屏障功能正常的发挥在抵御疾病的发生发展过程中不可或缺。如图 1所示,当发生SARA时,由于瘤胃内较低的pH以及细菌崩解死亡所释放的内毒素与组胺会刺激瘤胃上皮,导致上皮的通透性增加,细胞间的紧密连接破坏,上皮组织自我修复能力减弱,屏障功能遭受破坏,且随着SARA进程的加快,这种损伤也进一步加剧,直至屏障功能完全丧失,瘤胃内的代谢产物及毒素异位进入血液,最终导致机体出现严重病理反应[2]。因此,维持瘤胃上皮结构与功能的完整性也是预防与控制SARA发生的重要举措。
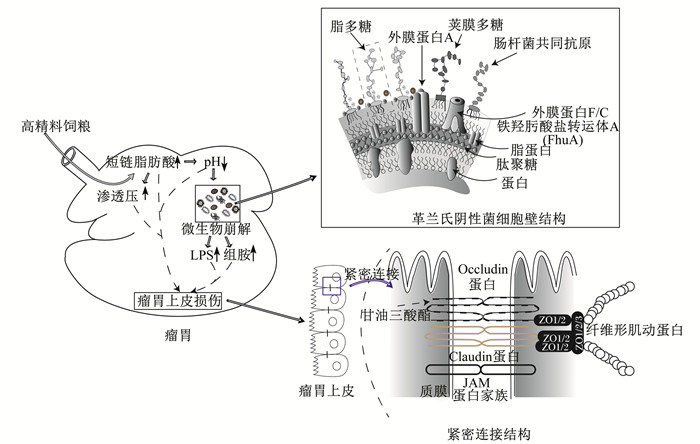
|
LPS:脂多糖lipopolysaccharide;Occludin:闭锁蛋白;Claudin:闭合蛋白; ZO1/2:紧密连接蛋白1/2。 图 1 瘤胃酸中毒对瘤胃上皮的损伤 Fig. 1 Rumen acidosis damage to rumen epithelium[8-9] |
硫胺素作为体内一种重要的水溶性维生素,正常生理条件下可由瘤胃微生物自身合成,并不需要额外供给就能满足需要。但Miller等[3]研究发现,逐渐提高饲粮中非纤维性碳水化合物(NFC)/中性洗涤纤维(NDF),硫胺素的生物合成量将降低,这就提示在反刍动物发生SARA时可能存在硫胺素的缺乏。硫胺素参与体内碳水化合物的代谢是以其磷酸化形式——焦磷酸硫胺素(TPP)实现的,TPP作为丙酮酸脱氢酶以及α-酮戊二酸脱氢酶的重要辅酶,当饲粮能量水平较高时其需要量迅速增加,主要是因为此时期瘤胃微生物迅速生长繁殖,特别是一些丙酸产生菌需要大量的TPP来完成能量代谢活动,而反刍动物瘤胃内的微生物虽然其合成硫胺素的能力有所增加,但仍不能满足其需要量的急剧变化,因而造成硫胺素的缺乏[4]。此外,高精料条件瘤胃微生物区系遭到改变,硫胺素的生物合成能力受到限制。Pan等[5]的研究表明,高精料可能引起瘤胃上皮硫胺素转运能力的降低,从而抑制硫胺素的吸收,这些因素都进一步加剧了SARA发生时瘤胃内硫胺素的缺乏。研究表明,添加一定量的硫胺素可以缓解上皮损伤,维持上皮生理结构的完整性[6-7]。目前SARA条件下添加硫胺素对反刍动物的研究主要集中在瘤胃发酵生理、生产性能以及血液生化指标的变化上,关于硫胺素对于维持瘤胃上皮屏障功能方面的研究报道还不深入。因此,本文从硫胺素与上皮屏障的关系入手,总结添加硫胺素对于维持高精料诱导的瘤胃上皮屏障功能的作用,为进一步了解硫胺素在SARA过程中发挥的作用提供依据。
1 硫胺素缺乏引起上皮组织屏障功能损伤硫胺素作为一种功能性的维生素,在医学上进行了大量的研究。其中,硫胺素及其衍生物已显示出具有改善内皮功能并减少氧化损伤的作用[10]。Neri等[11]在对人的韦尼克脑病进行研究时发现,该病的进程中伴随着硫胺素的缺乏,从而引起脑组织内的促炎因子表达量增加,并对大脑造成炎性损伤。此外,Beauchesne等[12]以小鼠为模型验证硫胺素缺乏是否会引起血脑屏障通透性的变化,结果显示硫胺素缺乏会使得脑血管内皮紧密连接蛋白中的闭锁蛋白(Occludin)以及紧密连接蛋白-1(ZO-1)、紧密连接蛋白-2(ZO-2)基因和蛋白表达量降低,血管内皮渗透性增加,血脑屏障遭到破坏。上述研究都表明,在机体缺乏硫胺素的条件下,会引起上皮炎症并破坏上皮组织屏障功能。在对人的心脑血管疾病进行研究时,Hazell等[13]总结了前人的研究,指出缺乏硫胺素会引起大脑中活性氧含量的增加,并诱导内皮型一氧化氮合成酶分泌,使得脑血管内皮细胞一氧化氮增加,并与超氧阴离子结合生成对神经元有毒性的过氧硝酸盐,造成血管内皮的氧化损伤,导致内皮细胞的凋亡。最近的研究表明,与心脑血管疾病一样,糖尿病的发生发展过程中同样伴随着硫胺素的缺乏现象。由于高血糖会导致血管发生炎症的风险增加,硫胺素的添加同样可以减缓氧化应激,改善内皮功能,降低心血管疾病及其并发症发生的风险[14],但有待进一步的试验验证。在反刍动物生产中,高谷物饲料诱发的SARA同样伴随着硫胺素的缺乏与上皮组织屏障的损伤,大量的研究表明,硫胺素可以通过调节瘤胃微生物区系的变化,维持瘤胃内环境的稳定,从而缓解瘤胃上皮的损伤,但瘤胃上皮的损伤是一个复杂的持续性过程,在此过程中硫胺素的缺乏是否会直接作用于宿主自身,从而引起上皮组织屏障的破坏仍未可知。
2 硫胺素维持反刍动物上皮屏障功能的途径 2.1 硫胺素通过调节瘤胃内环境稳定维持上皮屏障功能大量的研究证实,长期的高精料饲喂会引起反刍动物上皮屏障功能的损伤,且这种损伤与瘤胃内的低pH环境引起的微生物的变化具有一定相关性[15-16]。瘤胃内的微生物对于pH的耐受不一,其中的纤维分解菌对于pH变化较为敏感,当pH低于6.2时瘤胃内的纤维分解菌的丰度会降低,但淀粉利用菌及乳酸产生菌对低pH较耐受,在低pH环境中仍能生长繁殖[17]。Pinloche等[18]表示瘤胃内环境的改善主要归因于瘤胃内微生物群落的稳定。因此,通过调控瘤胃微生物区系来间接维持上皮组织的屏障功能是一种可行的手段。前期的研究表明,在高精料饲粮中添加硫胺素可以提高瘤胃pH,降低瘤胃液中总挥发性脂肪酸(TVFA)及乳酸的含量,同时降低乙酸和丙酸的比例,从而维持瘤胃内环境的稳定[19-20]。同时潘晓花[21]的研究显示,高精料饲粮中添加硫胺素可以显著降低瘤胃液中牛链球菌的丰度,促进埃氏巨型球菌的生长。为进一步研究硫胺素饲喂时瘤胃内微生物的变化,Pan等[22]采用Illumina测序的手段分析对比高精料饲粮下添加硫胺素与未添加组的奶山羊瘤胃微生物区系的变化,发现补充硫胺素可以显著增加纤维分解菌在瘤胃内中的分布并促进乳酸利用菌的生长,从而提高瘤胃pH和乙酸的含量,并使得瘤胃内的微生物分布趋于正常水平。与此同时,Xue等[23]采用宏基因组学分析饲喂含有硫胺素饲粮的瘤胃内真菌分布时发现,硫胺素可以显著改善高精料饲喂条件下引起的真菌丰度的降低,提高反刍动物对纤维的分解消化能力。瘤胃内不仅存在着微生物代谢产生的大量挥发性脂肪酸,还包含着低含量的生物胺,正常生理条件下并不会对机体产生危害,但当反刍动物采食大量易发酵碳水化合物时,生物胺在瘤胃内的含量会迅速增加,与革兰氏阴性菌裂解产生的脂多糖一起刺激瘤胃上皮,会增加上皮的通透性。Xue等[24]利用代谢组学技术,发现硫胺素的添加可以降低瘤胃内生物胺的含量,并在一定程度上保护了瘤胃上皮,减少上皮炎症的发生。上述的研究均表明,高精饲粮中添加硫胺素可以改善瘤胃内环境,减少瘤胃内的代谢紊乱,从而维持上皮屏障正常功能的发挥。
2.2 硫胺素通过修复瘤胃上皮损伤维持上皮屏障功能长期高精料饲喂反刍动物会引起瘤胃上皮机械屏障的损伤。通过组织学观察发现,瘤胃上皮在高精料诱导下的变化主要表现为上皮的过度角化、乳头的损伤以及上皮颗粒层厚度降低[25]。王龙[7]比较瘤胃上皮形态结构发现,饲喂高精料饲粮的犊牛其瘤胃上皮呈现黑褐色,瘤胃乳头受损并出现异常脱落,但添加硫胺素可增加犊牛瘤胃乳头的大小、扩大比表面积并提高乳头密度,此外还可以改善由高精料引起的犊牛瘤胃上皮角化不全现象。Zhang等[26]的研究同样指出,高精料饲粮中添加硫胺素可以缓解上皮角质层的脱落,加强细胞间的连接,提高上皮细胞层的厚度,维持上皮组织形态结构。上述研究表明,硫胺素对高精料诱导的瘤胃上皮机械性损伤有一定的修复作用,而这可能与硫胺素调控胰岛素样生长因子(IGF)系统有关。Molina等[27]的试验表明,硫胺素的缺乏会引起小鼠体内IGF含量的降低,且Steele等[28]研究也发现高精料饲粮饲喂时反刍动物体内IGF含量会产生适应性的变化,同时Baldwin等[29]研究表示,IGF-1可以促进瘤胃上皮的增殖,因此高精料饲粮中添加硫胺素可以一定程度上促进瘤胃上皮的增殖,修复SARA引起的瘤胃上皮损伤,从而维持屏障功能,但仍有待深入的研究探讨。
2.3 硫胺素通过缓解瘤胃上皮炎症反应维持上皮屏障功能在研究瘤胃上皮屏障功能时发现,瘤胃内的脂多糖并不能自由穿透瘤胃壁易位进入血液,因此,脂多糖等毒性物质是否进入血液是衡量瘤胃上皮屏障功能损伤程度的重要指标[25]。Emmanuel等[30]的研究证实,瘤胃内脂多糖与pH协同破坏瘤胃上皮屏障。同时瘤胃上皮炎症的发生往往与上皮结构的完整性及屏障功能遭到破坏有关。因此,通过降低瘤胃内的脂多糖含量是保护瘤胃上皮屏障的一个重要举措。Pan等[5]的研究显示,在饲喂含高谷物的奶牛饲粮中添加硫胺素,可以降低瘤胃内脂多糖的含量并下调促炎因子[白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)以及肿瘤坏死因子-α(TNF-α)]的基因及蛋白表达量,从而减缓上皮炎症的发生。为进一步了解硫胺素缓解上皮炎症的分子机理,Pan等[5]对瘤胃乳头进行活检,并发现硫胺素可以抑制Toll样受体4介导的核因子-κB(NF-κB)信号通路从而缓解上皮炎症的发生。Zhang等[26]最近研究SARA状态下添加硫胺素对山羊瘤胃上皮损伤的缓解作用时发现,高精料饲喂时山羊体内CD8+ T细胞含量增加,这反映了发生SARA时山羊T细胞发育受损,研究同时指出,与Pan等[5]的结论相似,添加硫胺素同样可以降低IL-1β的表达,且上调了CD4+/CD8+,而CD4+/CD8+可以反映动物机体在营养应激以及自身免疫性疾病发生时,细胞的免疫功能是否正常[31]。上述研究都表明,添加硫胺素对于缓解SARA状态下的瘤胃上皮损伤及炎症具有一定的作用,但其机理的研究仍不深入,需进一步的试验验证。
3 小结瘤胃上皮屏障功能的正常发挥,对于维持反刍动物消化道健康具有重要的意义。大量的研究已经证实,当反刍动物发生SARA时,瘤胃乳头以及上皮形态功能会发生变化,且上皮细胞间的紧密连接也会受到破坏,造成上皮吸收率降低、通透性增加、屏障功能减弱,瘤胃内的代谢产物及毒素异位,给动物的健康带来威胁。添加硫胺素以缓解血管内皮损伤的研究已相当深入,但作为瘤胃发酵调控剂的硫胺素,在作用于微生物的同时是否也对酸中毒时瘤胃上皮的损伤具有缓解作用仍缺乏有力的证据,仅少量的研究结果显示,添加硫胺素可以缓解由高精料诱导的SARA所引起的上皮损伤,降低上皮炎性基因表达并提高机体的免疫力,但其作用机制仍不明确。因此,硫胺素与瘤胃上皮屏障的关系以及作用机制需要更加深入的研究,为硫胺素在缓解酸中毒中的运用提供有力的依据。
| [1] |
PLAIZIER J C, KRAUSE D O, GOZHO G N, et al. Subacute ruminal acidosis in dairy cows:the physiological causes, incidence and consequences[J]. The Veterinary Journal, 2008, 176: 21-31. DOI:10.1016/j.tvjl.2007.12.016 |
| [2] |
STEELE M A, CROOM J, KAHLER M, et al. Bovine rumen epithelium undergoes rapid structural adaptations during grain-induced subacute ruminal acidosis[J]. American Journal of Physiology:Regulatory, Integrative and Comparative Physiology, 2011, 300(6): R1515-R1523. DOI:10.1152/ajpregu.00120.2010 |
| [3] |
MILLER B L, MEISKE J C, GOODRICH R D. Effects of grain source and concentrate level on B-vitamin production and absorption in steers[J]. Journal of Animal Science, 1986, 62(2): 473-483. DOI:10.2527/jas1986.622473x |
| [4] |
SILVERMAN M, WERKMAN C H. Adaptation of the propionic-acid bacteria to vitamin B1 synthesis including a method of assay[J]. Journal of Bacteriology, 1939, 38(1): 25-32. DOI:10.1128/JB.38.1.25-32.1939 |
| [5] |
PAN X H, YANG L, BECKERS Y, et al. Thiamine supplementation facilitates thiamine transporter expression in the rumen epithelium and attenuates high-grain-induced inflammation in low-yielding dairy cows[J]. Journal of Dairy Science, 2017, 100(7): 5329-5342. DOI:10.3168/jds.2016-11966 |
| [6] |
WEN L M, FENG L, JIANG W D, et al. Thiamin deficiency induces impaired fish gill immune responses, tight junction protein expression and antioxidant capacity:roles of the NF-κB, TOR, p38 MAPK and Nrf2 signaling molecules[J]. Fish & Shellfish Immunology, 2016, 51: 373-383. |
| [7] |
王龙.硫胺素对犊牛瘤胃组织形态及其生长发育影响的研究[D].硕士学位论文.扬州: 扬州大学, 2013. http://d.wanfangdata.com.cn/Thesis/y2419792
|
| [8] |
ULLUWISHEWA D, ANDERSON R C, MCNABB W C, et al. Regulation of tight junction permeability by intestinal bacteria and dietary components[J]. The Journal of Nutrition, 2011, 141(5): 769-776. DOI:10.3945/jn.110.135657 |
| [9] |
ALEXANDER C, RIETSCHEL E T. Bacterial lipopolysaccharides and innate immunity[J]. Journal of Endotoxin Research, 2001, 7(3): 167-202. |
| [10] |
CALDERÓN-OSPINA C A, NAVA-MESA M O. B Vitamins in the nervous system:current knowledge of the biochemical modes of action and synergies of thiamine, pyridoxine, and cobalamin[J]. CNS Neuroscience & Therapeutics, 2019, 26(1): 5-13. |
| [11] |
NERI M, CANTATORE S, POMARA C, et al. Immunohistochemical expression of proinflammatory cytokines IL-1β, IL-6, TNF-α and involvement of COX-2, quantitatively confirmed by Western blot analysis, in Wernicke's encephalopathy[J]. Pathology-Research and Practice, 2011, 207(10): 652-658. DOI:10.1016/j.prp.2011.07.005 |
| [12] |
BEAUCHESNE E, DESJARDINS P, HAZELL A S, et al. Altered expression of tight junction proteins and matrix metalloproteinases in thiamine-deficient mouse brain[J]. Neurochemistry International, 2009, 55(5): 275-281. DOI:10.1016/j.neuint.2009.03.014 |
| [13] |
HAZELL A S, BUTTERWORTH R F. Update of cell damage mechanisms in thiamine deficiency:focus on oxidative stress, excitotoxicity and inflammation[J]. Alcohol and Alcoholism, 2009, 44(2): 141-147. |
| [14] |
PAGE G L J, LAIGHT D, CUMMINGS M H. Thiamine deficiency in diabetes mellitus and the impact of thiamine replacement on glucose metabolism and vascular disease[J]. International Journal of Clinical Practice, 2011, 65(6): 684-690. DOI:10.1111/j.1742-1241.2011.02680.x |
| [15] |
PENNER G B, OBA M, GÄBEL G, et al. A single mild episode of subacute ruminal acidosis does not affect ruminal barrier function in the short term[J]. Journal of Dairy Science, 2010, 93(10): 4838-4845. DOI:10.3168/jds.2010-3406 |
| [16] |
GAEBEL G, MARTENS H, BELL M. The effect of low mucosal pH on sodium and chloride movement across the isolated rumen mucosa of sheep[J]. Quarterly Journal of Experimental Physiology, 1989, 74(1): 35-44. DOI:10.1113/expphysiol.1989.sp003237 |
| [17] |
冯仰廉. 反刍动物营养学[M]. 北京: 科学出版社, 2004.
|
| [18] |
PINLOCHE E, MCEWAN N, MARDEN J P, et al. The effects of a probiotic yeast on the bacterial diversity and population structure in the rumen of cattle[J]. PLoS One, 2013, 8(7): e67824. DOI:10.1371/journal.pone.0067824 |
| [19] |
张红伟.硫胺素(VB1)对瘤胃内营养物质消化代谢的影响[D].硕士学位论文.扬州: 扬州大学, 2010. http://d.wanfangdata.com.cn/Thesis/Y1702109
|
| [20] |
董淑红.硫胺素对山羊瘤胃代谢的影响及其与亚急性瘤胃酸中毒关系的研究[D].硕士学位论文, 扬州: 扬州大学, 2011. http://d.wanfangdata.com.cn/Thesis/Y2050126
|
| [21] |
潘晓花.硫胺素对SARA状态下奶牛瘤胃发酵及瘤胃菌群结构的影响[D].硕士学位论文.扬州: 扬州大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-11117-1014112020.htm
|
| [22] |
PAN X H, XUE F G, NAN X M, et al. Illumina sequencing approach to characterize thiamine metabolism related bacteria and the impacts of thiamine supplementation on ruminal microbiota in dairy cows fed high-grain diets[J]. Frontiers in Microbiology, 2017, 8: 1818. DOI:10.3389/fmicb.2017.01818 |
| [23] |
XUE F G, NAN X M, SUN F Y, et al. Metagenome sequencing to analyze the impacts of thiamine supplementation on ruminal fungi in dairy cows fed high-concentrate diets[J]. AMB Express, 2018, 8(1): 159. DOI:10.1186/s13568-018-0680-6 |
| [24] |
XUE F G, PAN X H, JIANG L S, et al. GC-MS analysis of the ruminal metabolome response to thiamine supplementation during high grain feeding in dairy cows[J]. Metabolomics, 2018, 14: 67. DOI:10.1007/s11306-018-1362-8 |
| [25] |
刘军花.亚急性瘤胃酸中毒对山羊瘤胃上皮屏障功能的影响及其机制[D].硕士学位论文.南京: 南京农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10307-1016040143.htm
|
| [26] |
ZHANG H, PENG A L, ZHAO F F, et al. Thiamine ameliorates inflammation of the ruminal epithelium of Saanen goats suffering from subacute ruminal acidosis[J]. Journal of Dairy Science, 2019, 103(2): 1931-1943. |
| [27] |
MOLINA P E, FAN J, BOXER R, et al. Modulation of insulin-like growth factor-Ⅰ:a specific role for vitamin B1 (thiamine)[J]. The Journal of Nutritional Biochemistry, 1996, 7(4): 207-213. DOI:10.1016/0955-2863(96)00011-3 |
| [28] |
STEELE M A, ALZAHAL O, WALPOLE M E, et al. Short communication:grain-induced subacute ruminal acidosis is associated with the differential expression of insulin-like growth factor-binding proteins in rumen papillae of lactating dairy cattle[J]. Journal of Dairy Science, 2012, 95(10): 6072-6076. DOI:10.3168/jds.2011-4864 |
| [29] |
BALDWIN R L. The proliferative actions of insulin, insulin-like growth factor-Ⅰ, epidermal growth factor, butyrate and propionate on ruminal epithelial cells in vitro[J]. Small Ruminant Research, 1999, 32(3): 261-268. DOI:10.1016/S0921-4488(98)00188-6 |
| [30] |
EMMANUEL D G V, DUNN S M, AMETAJ B N. Feeding high proportions of barley grain stimulates an inflammatory response in dairy cows[J]. Journal of Dairy Science, 2008, 91(2): 606-614. DOI:10.3168/jds.2007-0256 |
| [31] |
DENG Y X, CUI H M, PENG X, et al. Effect of dietary vanadium on cecal tonsil T cell subsets and IL-2 contents in broilers[J]. Biological Trace Element Research, 2011, 144(1/2/3): 647-656. |




