2. 中国农业科学院北京畜牧兽医研究所, 北京 100193
2. Institute of Animal Science, Chinese Academy of Agricultural Sciences, Beijing 100193, China
葡聚糖是谷物类生物中极为重要的一类膳食纤维,分为α-葡聚糖(α-glucan)和β-葡聚糖(β-glucan)[1]。其中,β-葡聚糖又称右旋糖酐,是一类非淀粉多糖,在自然界中含量丰富,广泛存在于植物、细菌及真菌中。β-葡聚糖分子内含有β-1,3、β-1,4等多种糖苷键,且来源不同的β-葡聚糖具有的结构与组成成分不同[2]。近年来的研究表明,β-葡聚糖具有调整肠道菌群结构和促进肠道发育[3-5]、增强机体抗氧化能力[6]、抑制肿瘤[7]、降低血糖和血脂[8]以及增强机体免疫应答[9]等生物学功能。β-葡聚糖在生物体内的降解机理和代谢途径也逐渐明晰。本文将在前人研究与报道的基础上,总结β-葡聚糖的化学结构和链构象、降解机理和代谢途径以及生物学作用,并简单介绍β-葡聚糖在反刍动物饲养中的应用现状,以期为β-葡聚糖未来的研究应用提供理论依据。
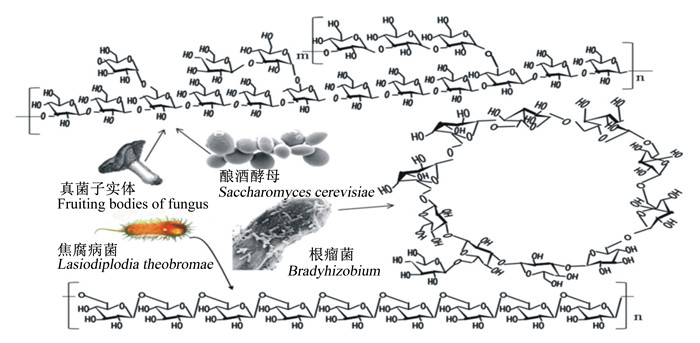
1 β-葡聚糖的化学结构和链构象不同来源的β-葡聚糖的化学结构和链构象不同,如图 1所示[10]。酵母β-葡聚糖是使用最广泛的β-葡聚糖,因其制备原料酿酒酵母(Saccharomyces cerevisiae)来源于啤酒的酿造,资源极其丰富。酵母细胞壁中的多糖含量占80%~90%,其中以β-葡聚糖及甘露寡糖为主。
|
图 1 不同来源的β-葡聚糖的化学结构和链构象 Fig. 1 Chemical structure and chain conformation of β-glucan from different sources |
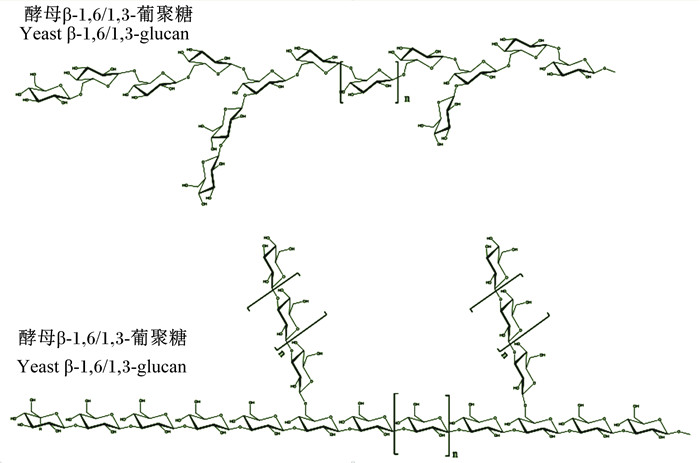
酵母β-葡聚糖一般有2种类型:分支的β-(1,3)-D-葡聚糖和β-(1,6)-D-葡聚糖,二者物理性质不同。β-(1,3)-D-葡聚糖由1个高分子质量的线性主链和随意分散的β-(1,6)-D-葡萄糖基侧链组成,且侧链通常连接在O-6上,不溶于碱;由β-(1,6)-D-葡聚糖作为主链的多糖较短(10~100 ku),有1或2个β-(1,3)连接单元作为侧链,可溶于碱,如图 2所示[11-12]。通常情况下β-葡聚糖能够进入细胞组织,通过免疫系统对其立体螺旋结构的识别发挥免疫佐剂功能[13]。由于复杂的糖苷键连接、分支结构和频率、多个分子内和分子间氢键的相互作用等,不同分支度的葡萄糖残基的化学结构表现出丰富的多样性,为其多样生理学功能的发挥奠定了结构基础[12]。
|
图 2 酵母β-葡聚糖的2种结构类型 Fig. 2 Two structural types of yeast β-glucan |
由于不同来源的β-葡聚糖在结构(如分子质量、糖链长度、糖苷键类型及比例、支链、聚合形态等)上存在诸多差异,因而其在肠道微生物的降解过程及机制也不同。微生物降解β-葡聚糖的能力由其葡糖苷酶的种类及活性决定,而这些酶又由相应的基因编码而成,因而肠道微生物的基因决定了其代谢特征。反之,膳食纤维的不同也会影响微生物的菌落结构[14]。目前,将肠道微生物降解β-葡聚糖及其他多糖的基因归于碳水化合物基因家族(carbohydrate-active enzymes,CAZymes)成员之一,其中降解β-葡聚糖的酶系统可分为结合家族、降解家族及转运家族3类[15-16]。研究表明,谷物β-葡聚糖的降解场所位于细菌细胞表面,主要由碳水化合物结合组件(carbohydrate-binding modules,CBM)家族、糖苷水解酶(glycoside hydrolase,GH)家族及转运家族完成。以卵形拟杆菌(B.ovatus)为例,该类微生物具有一套相对完整的β-糖苷酶系统,这套系统类似于原型多形类杆菌(Bacteroides thetaiotaomicron)的淀粉利用系统(starch utilization system,SUs),谷物β-葡聚糖在B. ovatus细胞表面,首先与CBM家族蛋白质特异性结合,再由GH家族降解为葡萄糖,最终经转运蛋白将葡萄糖分子转入细胞内。
β-葡聚糖被降解为葡萄糖、二糖及低聚糖并进入微生物细胞内后,并不会立即被微生物直接利用,而是需要进一步参与微生物细胞内的代谢作用才能产生微生物自身所需要的能量和营养物质。其中,葡萄糖可参与糖酵解(EMP)等多条途径,或与其他微生物之间的共生关系产生短链脂肪酸(SCFAs)[17]。目前,关注较多的SCFAs为乙酸、丙酸和丁酸,其中乙酸含量可占总SCFAs的1/2以上,丰度最高,其代谢主要有2条途径:1)肠原杆菌通过乙酸辅酶途径(acetyl-CoA pathway)将氢气(H2)和二氧化碳(CO2)或蚁酸合成乙酸,该路径合成的乙酸占多数;2)多聚乙酰细菌(acetogenic bacteria)通过Wood-Ljungdahl途径(Wood-Ljungdahl pathway)将低聚糖降解为乙酸,该途径合成的乙酸约占1/3。
3 β-葡聚糖的生物学作用 3.1 影响肠道发育肠道病原菌(大肠杆菌、沙门氏菌)可以通过细胞表面受体凝集素与肠道受体识别作用,附着于肠壁上,进而诱发肠道微生态区系平衡失调。而β-葡聚糖可通过对肠道沙门氏菌等病原菌的吸附作用干扰肠道致病菌的附殖,增加益生菌的比例,从而改善动物胃肠道功能,保障动物机体健康[3-5]。崔艺燕等[18]报道指出,β-葡聚糖可以通过肠上皮通透性的提高和紧密连接结构完整性的改善影响肠道形态的变化;同时指出,β-葡聚糖可作为代谢营养物,对肠道乳酸菌等有益菌产生积极作用,同时,有效减少上皮细胞有害菌附着,从而调节肠道菌群平衡。周怿等[19]报道,β-葡聚糖不仅可以增加犊牛小肠绒毛的高度,而且还有助于增大小肠绒毛高度与隐窝深度比值,这大大增强了犊牛肠道对营养代谢物的消化吸收能力,继而能够加快犊牛的生长发育。周怿等[20]报道,β-葡聚糖在弱碱性环境下具有一定的抑菌效果,其作用机制可能是β-葡聚糖可以在肠道微生物的作用下生成SCFAs,进而促进肠黏膜的增长,抑制病原菌增殖。此外,β-葡聚糖能够通过促进肠道免疫球蛋白A(IgA)的分泌抑制有害菌增殖。总的来说,β-葡聚糖能够促进肠道发育,改善肠道菌群结构。
3.2 调节动物机体免疫力良好的免疫系统决定着畜禽健康。β-葡聚糖作为一种为人熟知的免疫调节剂,具有很好的免疫增强作用,尤其在激活并提高幼龄动物机体免疫力、缓解断奶造成的应激方面具有显著效果[21]。β-葡聚糖通过2种机制发挥其免疫调节作用。作用机制1:β-葡聚糖能够激活免疫细胞(淋巴细胞、巨噬细胞等), 促进细胞因子的分泌,强化机体免疫;作用机制2:β-葡聚糖能够活化自然杀伤(NK)细胞等免疫细胞,并利用活化的免疫细胞增强对“免疫-神经-内分泌”信号通路的调控,提高机体抗应激能力[22-24]。刘影等[25]通过体外饲养试验发现,在肉仔鸡饲粮中添加β-葡聚糖能够有效提高21日龄肉仔鸡法氏囊指数,提高肉仔鸡对新城疫病毒(NDV)的抗体水平,最佳添加剂量为25.0 mg/kg。此外,许冰莹等[26]报道β-葡聚糖可增加多种鱼类的免疫应答能力及对恶劣环境的抵御能力。
3.3 增强抗氧化能力研究发现,β-葡聚糖可以通过2种机制发挥其提高机体抗氧化的作用,机制1是β-葡聚糖通过清除或抑制机体内的自由基作用达到抗氧化作用;机制2是β-葡聚糖可以提高血清中抗氧化酶[超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)等]的活性发挥抗氧化作用[6]。刘蓝天等[27]试验发现,注射了酵母葡聚糖后的小鼠血清中SOD活性升高,且研究结果表现出效应与剂量的正相关性,即作用效果随着添加量的增加而更加明显。顾鲲涛等[28]报道,β-葡聚糖能够提高围产期奶牛体内血清中SOD、GSH-Px等活性,清除体内自由基,减少细胞损伤及组织损害;此外,顾鲲涛[28]等还发现β-葡聚糖可以显著降低围产前期奶牛血清中丙二醛(MDA)含量。这表明β-葡聚糖能够有效抑制氧自由基诱发的脂质过氧化反应,从而缓解了奶牛应激。康雨芳等[29]报道,胶红酵母细胞壁多糖对羟自由基和超氧阴离子自由基等自由基具有很好的清除效果,且效果优于维生素C的清除效果。
3.4 降低胆固醇、血糖、血脂作用由于动物机体无法分泌β-葡聚糖酶,因此摄入的β-葡聚糖不能被自身分解,只能以纤维的形式被胃肠道内的微生物降解。杜杰[30]指出,燕麦β-葡聚糖结合有氧运动具有显著降低血浆中胆固醇含量的效用,其作用机制是通过降低胆固醇合成限速酶甾醇14α-去甲基化酶(CYP51)活性降低胆固醇的合成速率,提高肝脏转化胆固醇的能力。彭灿阳等[31]报道,β-葡聚糖可通过表面的活性基团吸附胆固醇与胆汁酸以及抑制肝脏对二者的重吸收降低血浆胆固醇含量。β-葡聚糖还具有降低动物血脂、血糖的功能。β-葡聚糖还具有增加食糜黏度的物理特性,可以有效延长肠道对代谢营养物的吸收,尤其是外源性血糖的吸收。此外,β-葡聚糖还能够通过作用于胰岛细胞调节胰岛素的分泌降低血糖。
3.5 抗肿瘤作用研究发现,葡聚糖具抗肿瘤的效用。β-葡聚糖对肿瘤细胞具有细胞毒性,可直接杀伤癌细胞。陶佳等[32]在显微镜下观察到经过糙皮侧耳多糖处理的S180腹水瘤细胞的体积逐渐变大并于1 h内完全破碎,而肝脏细胞、肾细胞等完好无损。此外,β-葡聚糖也可以通过刺激免疫系统、提升机体抗病能力来实现抗肿瘤作用[33]。张海坡等[34]报道,高剂量酵母β-葡聚糖可显著增强小鼠的细胞免疫,中、高剂量酵母β-葡聚糖能够显著影响巨噬细胞活性,激活并增强体液免疫。近年来,又有研究人员发现β-葡聚糖还可以通过诱导肿瘤细胞凋亡达到抗肿瘤的目的,β-葡聚糖可以上调肿瘤抑制蛋白p53、细胞周期蛋白p21、促凋亡蛋白白B淋巴细胞瘤-2相关X蛋白(Bax)、半胱氨酸天冬氨酸蛋白酶(Caspase)3/9的表达,下调肿瘤组织中聚腺苷二磷酸核糖聚合酶1(PARP1)、抗凋亡蛋白B淋巴细胞瘤-2(Bcl-2)的表达[35-37]。
3.6 抗营养特性研究发现,燕麦β-葡聚糖是饲料原料中的一种抗营养因子,能够降低饲料利用率,影响养殖场效益。β-葡聚糖能够通过降低胃肠道中食糜的流通速率及与酶和底物相结合起到抑制营养代谢物消化吸收的抗营养作用。因此,在饲粮中添加燕麦作为饲粮组成时,应特别注意不能过量添加,否则不能充分发挥β-葡聚糖的生物学功效。
4 β-葡聚糖在反刍动物饲养中的应用概况 4.1 犊牛酵母β-葡聚糖可明显改善早期断奶犊牛生长性能,增强机体免疫功能。周泽等[19]研究发现,β-葡聚糖可有效增强犊牛肠道的免疫机能,提高饲料转化率,从而加快犊牛生长速度。周泽等[19]同时指出,在早期断奶犊牛代乳品中添加β-葡聚糖可显著降低血清白蛋白含量及白蛋白与球蛋白的比值。这表明酵母β-葡聚糖能够调节机体组织蛋白质代谢,增加蛋白质利用率,提高免疫力,促进生长。Ma等[37]在断奶犊牛饲粮中添加β-葡聚糖,发现其能够提高荷斯坦犊牛的平均日增重、饲料有效利用率及饲粮养分的表观消化率,并显著提高了犊牛空肠和回肠的绒毛高度、隐窝深度以及绒毛高度与隐窝深度比值,研究也表明在犊牛饲粮中添加β-葡聚糖后,血清中免疫球蛋白G(IgG)含量增加。这表明添加β-葡聚糖可提高荷斯坦犊牛的体液免疫能力。
4.2 围产期奶牛围产期是影响乳品质的一个重要阶段。泌乳奶牛围产期严重的代谢变化,免疫力降低,饲料转化率、利用率降低,这些都将严重影响奶牛的繁殖和泌乳性能。近年来研究发现,在围产期奶牛饲粮中添加β-葡聚糖可明显提高其抗应激能力。顾鲲涛等[28]研究发现,围产期奶牛饲粮中添加β-葡聚糖能够刺激瘤胃发育,降低瘤胃液pH,提高奶牛干物质采食量及产奶性能;顾鲲涛等[28]同时也指出,β-葡聚糖能够显著增加血清中GSH-Px活性,减少产前血清中MDA含量,在某种程度上,促进了围产期奶牛抗氧化能力,减轻了围产期奶牛氧化应激。
4.3 羔羊为了达到母羊1年2产或者2年3产的目的,养殖场往往将羔羊断奶期提前。由于哺乳期羔羊的机体器官还未发育健全,机体的免疫系统还未建立与成熟,因此,早期断奶往往造成羔羊营养摄入不足,免疫力降低,严重抑制羔羊生长。此外,作为广谱的免疫调节剂,β-葡聚糖能够显著促进羔羊免免疫力,缓解断奶应激对其产生的负面作用。李冲等[38]研究发现,在饲粮中添加75.00 mg/kg的β-葡聚糖可提高羔羊血清中尿素氮含量,表明β-葡聚糖可提高蛋白质代谢水平,降低氨态氮含量,促进瘤胃发育,提高羔羊的生长性能。魏占虎等[39]报道,β-葡聚糖能够降低羔羊的料重比,提高日增重;此外,该研究结果表明羔羊饲粮中β-葡聚糖的适宜添加量为75.00 mg/kg,这与李冲等[38]的研究结果相一致。
5 小结与展望β-葡聚糖广泛存在于真菌、酵母及植物中。相关研究表明,β-葡聚糖具有调整胃肠道微生态区系、提高动物机体免疫应答、增强抗氧化等生物学功效,且作用显著,其在反刍动物的应用方面具有美好前景。但我们还需做进一步研究,尤其是β-葡聚糖对泌乳奶牛在泌乳期生产性能方面的研究还很少,其在不同泌乳阶段奶牛饲粮中的适宜添加量还有待研究。
致谢:
感谢北京农学院动物科学技术学院王慧老师、童津津老师对文稿所提的宝贵意见。
| [1] |
ANDERSSON A A M, ARMÖ E, GRANGEON E, et al. Molecular weight and structure units of (1-3, 1-4)-β-glucans in dough and bread made from hull-less barley milling fractions[J]. Journal of Cereal Science, 2004, 40(3): 195-204. DOI:10.1016/j.jcs.2004.07.001 |
| [2] |
ZHU F M, DU B, XU B J. A critical review on production and industrial applications of beta-glucans[J]. Food Hydrocolloids, 2016, 52: 275-288. DOI:10.1016/j.foodhyd.2015.07.003 |
| [3] |
龚阿琼, 周小辉, 胡骏鹏, 等. 酵母多糖在禽类的应用研究[J]. 国外畜牧学(猪与禽), 2014, 34(11): 76-77. |
| [4] |
黄鑫, 贺淼, 陈中平, 等. 酵母细胞壁多糖在家禽生产中的应用[J]. 国外畜牧学(猪与禽), 2014, 34(4): 62-63. |
| [5] |
TIAN X Y, SHAO Y J, WANG Z, et al. Effects of dietary yeast β-glucans supplementation on growth performance, gut morphology, intestinal Clostridium perfringens population and immune response of broiler chickens challenged with necrotic enteritis[J]. Animal Feed Science and Technology, 2016, 215: 144-155. DOI:10.1016/j.anifeedsci.2016.03.009 |
| [6] |
李永娟, 曹俊明, 赵红霞, 等. β-葡聚糖在水产动物营养生理中的作用研究进展[J]. 广东农业科学, 2014, 41(21): 128-134, 143. DOI:10.3969/j.issn.1004-874X.2014.21.027 |
| [7] |
HUSSAIN P R, RATHER S A, SURADKAR P P. Structural characterization and evaluation of antioxidant, anticancer and hypoglycemic activity of radiation degraded oat (Avena sativa) β-glucan[J]. Radiation Physics and Chemistry, 2017, 144: 218-230. |
| [8] |
BORCHANI C, FONTEYN F, JAMIN G, et al. Physical, functional and structural characterization of the cell wall fractions from baker's yeast Saccharomyces cerevisiae[J]. Food Chemistry, 2016, 194: 1149-1155. DOI:10.1016/j.foodchem.2015.08.106 |
| [9] |
MORENO-MENDIETA S, GUILLÉN D, HERNÁNDEZ-PANDO R, et al. Potential of glucans as vaccine adjuvants:a review of the α-glucans case[J]. Carbohydrate Polymers, 2017, 165: 103-114. DOI:10.1016/j.carbpol.2017.02.030 |
| [10] |
谢勇, 覃小丽, 金剑波, 等.来源与加工方式对β-葡聚糖理化特性的影响及其在肠道的降解机理[J/OL].食品与发酵工业: 1-15.(2019-08-27)[2019-11-23].http://kns.cnki.net//KXReader/Detail?TIMESTAMP=637124503546188750&DBCODE=CJFD&TABLEName=CAPJLAST&FileName=SPFX20190822001&RESULT=1&SIGN=v%2bmBVgEN8dVtO1m7BnZgUjUHhD0%3d.
|
| [11] |
SAMUELSEN A B C, SCHREZENMEIR J, KNUTSEN S H. Effects of orally administered yeast-derived beta-glucans:a review[J]. Molecular Nutrition & Food Research, 2014, 58(1): 183-193. |
| [12] |
LESAGE G, BUSSEY H. Cell wall assembly in Saccharomyces cerevisiae[J]. Microbiology and Molecular Biology Reviews, 2006, 70(2): 317-343. DOI:10.1128/MMBR.00038-05 |
| [13] |
WILLIAMS D L, MCNAMEE R B, JONES E L, et al. A method for the solubilization of a (1→3)-β-D-glucan isolated from Saccharomyces cerevisiae[J]. Carbohydrate Research, 1991, 219: 203-213. |
| [14] |
LIU Q Y, DUAN B C, XU X J, et al. Progress in rigid polysaccharide-based nanocomposites with therapeutic functions[J]. Journal of Materials Chemistry B, 2017, 5(29): 5690-5713. DOI:10.1039/C7TB01065F |
| [15] |
GONG L X, CAO W Y, CHI H L, et al. Whole cereal grains and potential health effects:involvement of the gut microbiota[J]. Food Research International, 2018, 103: 84-102. DOI:10.1016/j.foodres.2017.10.025 |
| [16] |
TAMURA K, HEMSWORTH G R, DÉJEAN G, et al. Molecular mechanism by which prominent human gut bacteroidetes utilize mixed-linkage beta-glucans, major health-promoting cereal polysaccharides[J]. Cell Reports, 2017, 21(7): 417-430. |
| [17] |
RÍOS-COVIÁN DAVID, RUAS-MADIEDO P, MARGOLLES A, et al. Intestinal short chain fatty acids and their link with diet and human health[J]. Frontiers in Microbiology, 2016, 185. |
| [18] |
崔艺燕, 马现永. 酵母多糖的生物学功能及其对仔猪肠道健康的影响[J]. 动物营养学报, 2018, 30(3): 857-864. DOI:10.3969/j.issn.1006-267x.2018.03.007 |
| [19] |
周怿, 刁其玉, 屠焰, 等. 酵母β-葡聚糖对早期断奶犊牛胃肠道发育的影响[J]. 动物营养学报, 2009, 21(6): 846-852. DOI:10.3969/j.issn.1006-267x.2009.06.007 |
| [20] |
周怿, 刁其玉, 屠焰, 等. 日粮中添加酵母β-葡聚糖对早期断奶犊牛体内大肠杆菌数量的影响[J]. 现代畜牧兽医, 2014(3): 15-20. DOI:10.3969/j.issn.1672-9692.2014.03.006 |
| [21] |
周怿, 刁其玉, 屠焰, 等. 酵母β-葡聚糖对早期断奶犊牛生产性能和血液生理生化指标的影响[J]. 中国畜牧杂志, 2010, 46(13): 47-51. |
| [22] |
唐茂妍, 林冬梅. 酵母细胞壁多糖在饲料中的应用研究进展[J]. 畜牧与饲料, 2016(3): 44-48. |
| [23] |
毕小艳. 酵母β-葡聚糖在动物免疫上的调节作用[J]. 国外畜牧学(猪与禽), 2014, 33(4): 77-78. |
| [24] |
陈中平, 李彪, 戴晋军. 酵母β-葡聚糖的作用机制及其在养猪中的应用[J]. 国外畜牧学(猪与禽), 2011, 31(4): 78. |
| [25] |
刘影, 呙于明, 袁建敏, 等. β-1, 3/1, 6-葡聚糖对肉仔鸡生产性能和免疫功能的影响[J]. 中国农业大学学报, 2003, 8(1): 91-94. |
| [26] |
许冰莹, 邵庆均. β-葡聚糖对鱼类免疫调节作用的研究进展[J]. 动物营养学报, 2019, 31(7): 2971-2980. |
| [27] |
刘蓝天, 何艳, 邵现磊, 等. 酵母β-葡聚糖的研究进展及应用[J]. 食品工业, 2017, 38(7): 238-242. |
| [28] |
顾鲲涛, 赵连生, 王留香, 等. 饲粮中添加酵母β-葡聚糖对围产期奶牛生产性能、血清生化指标及抗氧化能力的影响[J]. 动物营养学报, 2018, 30(6): 2164-2171. DOI:10.3969/j.issn.1006-267x.2018.06.019 |
| [29] |
康雨芳, 陈雪峰, 常相娜, 等. 胶红酵母胞外多糖镇痛及抗氧化作用的研究[J]. 食品科技, 2018, 43(2): 212-217. |
| [30] |
杜杰. 有氧运动结合燕麦β-葡聚糖对高脂仓鼠降低胆固醇的作用及机制[J]. 中国体育科技科技, 2017, 53(1): 97-103. |
| [31] |
彭灿阳, 曲湘勇, 杨序, 等. β-葡聚糖生理功能及其在畜禽生产中的应用[J]. 饲料博览, 2016(6): 32-35. DOI:10.3969/j.issn.1001-0084.2016.06.010 |
| [32] |
陶佳, 崔进. β-葡聚糖(β-glucan)抗肿瘤作用的研究进展[J]. 中外医疗, 2010, 29(20): 187. DOI:10.3969/j.issn.1674-0742.2010.20.142 |
| [33] |
李培培, 王建华, 杨培培, 等. β-葡聚糖及其在猪营养中的应用研究[J]. 养猪, 2015(4): 19-22. DOI:10.3969/j.issn.1002-1957.2015.04.012 |
| [34] |
张海坡, 张彦. 酵母葡聚糖及其应用前景[J]. 精细与专用化学品, 2009, 17(16): 16-19. DOI:10.3969/j.issn.1008-1100.2009.16.005 |
| [35] |
XU H, ZOU S, XU X J, et al. Anti-tumor effect of β-glucan from Lentinus edodes and the underlying mechanism[J]. Scientific Reports, 2016, 6: 28802. DOI:10.1038/srep28802 |
| [36] |
LI M, CHEN Y F, LI W J, et al. Anti-tumor effects of(1→3)-β-D-glucan from Saccharomyces cerevisiae in S180 tumor-bearing mice[J]. International Journal of Biological Macromolecules, 2017, 95: 385-392. DOI:10.1016/j.ijbiomac.2016.10.106 |
| [37] |
MA T, TU Y, ZHANG N F, et al. Effects of dietary yeast β-glucan on nutrient digestibility and serum profiles in pre-ruminant Holstein calves[J]. Journal of Integrative Agriculture, 2015, 14(4): 749-757. DOI:10.1016/S2095-3119(14)60843-1 |
| [38] |
李冲, 魏占虎, 李发第, 等. 酵母β-葡聚糖对早期断奶羔羊瘤胃氮代谢的影响[J]. 甘肃农业科技, 2013(10): 11-13. DOI:10.3969/j.issn.1001-1463.2013.10.004 |
| [39] |
魏占虎, 李冲, 李发弟, 等. 酵母β-葡聚糖对早期断奶羔羊生产性能和采食行为的影响[J]. 草业学报, 2013, 22(4): 212-219. |




