2. 陕西石羊农业科技股份有限公司, 西安 710021;
3. 齐全农牧集团股份有限公司, 遂宁 629000
2. Shaanxi Shiyang Agriculture Technology Co., Ltd., Xi'an 710021, China;
3. Qiquan Nongmu Group Co., Ltd., Suining 629000, China
随着近几年社会经济的发展,人们对于家畜产品在量的需求上又增加了质的要求。原本作为饲料添加剂的抗生素,在提高动物生长性能的同时,会造成动物产生耐药性,并产生超级细菌,导致畜禽产品存在药物残留并危害食品安全[1]。随着全世界禁抗力度的加大,我国也已将限制抗生素使用提上日程。2020年我国将全面禁止抗生素作为饲料添加剂使用,因此对抗生素替代物的研究越来越重要。益生菌又被称为活菌制剂、微生态制剂,是目前重要的抗生素替代物之一。益生菌能够在肠道内生长繁殖并产生大量的生物活性成分,促进仔猪的生长发育[2];并且使用益生菌有助于促进仔猪早期的免疫发育以及肠道微生物环境稳态的建立[3]。益生菌中应用较为普遍的是粪链球菌和枯草芽孢杆菌,但是前人大多只是研究单独添加粪链球菌和枯草芽孢杆菌对断奶仔猪的影响[4-5]。因此,本试验旨在探究单独添加粪链球菌、枯草芽孢杆菌及二者混合添加对断奶仔猪生长性能和肠道健康的影响,旨在为粪链球菌和枯草芽孢杆菌在断奶仔猪饲粮中的应用提供科学依据。
1 材料与方法 1.1 试验材料粪链球菌和枯草芽孢杆菌制剂由某公司提供。粪链球菌制剂中粪链球菌活菌数≥1×108 CFU/g,适宜添加量为4×108 CFU/kg;枯草芽孢杆菌制剂中枯草芽孢杆菌活菌数≥1×109 CFU/g,适宜添加量为5×109 CFU/kg。
1.2 试验设计试验选取21日龄断奶的“杜×长×大”三元杂交猪240头,随机分为4组,每组6个重复,每个重复10头猪,相同重复养在同一圈舍。对照组饲喂基础饲粮,粪链球菌组饲喂基础饲粮+粪链球菌制剂(粪链球菌活菌数4×108 CFU/kg),枯草芽孢杆菌组饲喂基础饲粮+枯草芽孢杆菌制剂(枯草芽孢杆菌活菌数5×109 CFU/kg),混合组饲喂基础饲粮+粪链球菌制剂+枯草芽孢杆菌制剂(粪链球菌活菌数4×108 CFU/kg,枯草芽孢杆菌活菌数5×109 CFU/kg)。试验期为28 d。基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets (air-dry basis) |
本试验在齐全农牧集团股份有限公司自有猪场进行。每个重复的10头猪养在同一圈舍,采用全进全出饲养管理模式,猪舍温度在25~30 ℃。每个圈(1.5 m×2.0 m)均配有2个乳头式饮水器和1个4孔料槽,自由采食和饮水。半漏缝地面饲养,定时清理粪便。按照猪场常规管理程序进行免疫和保健。
1.4 检测指标 1.4.1 生长性能在21、49日龄以重复(圈)为单位测定断奶仔猪初始体重(IBW)、终末体重(FBW)、耗料量,并计算平均日增重(ADG)、平均日采食量(ADFI)、料重比(F/G)。
1.4.2 肠道发育在仔猪49日龄时,每个重复取1头屠宰,采集十二指肠、空肠、回肠3个肠段各2 cm组织样,生理盐水冲洗干净,放入4%多聚甲醛溶液固定,采用常规石蜡切片的制作方法对肠道样品进行组织切片制作。每张切片选取3个典型视野(走向平直、伸展良好、绒毛完整),取6个典型绒毛测量绒毛高度(VH)和隐窝深度(CD),计算绒隐比(VH/CD),并将具有代表性的视野拍照记录。
1.4.3 氨基酸表观消化率用外源指示剂法,在饲粮中混入0.3%三氧化二铬,在仔猪49日龄时采集粪样与饲粮样。每个重复随机取1头猪通过肛门按摩法收集粪便样品,之后置于-20 ℃冰箱保存。氨基酸表观消化率计算公式如下:
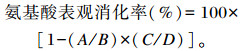
|
式中:A为粪中氨基酸含量;B为饲粮中氨基酸含量;C为饲粮中三氧化二铬含量;D为粪中三氧化二铬含量。
1.4.4 宏基因组学仔猪49日龄时进行屠宰采样,分别取对照组、粪链球菌组、枯草芽孢杆菌组的十二指肠、空肠、回肠、盲肠食糜样品,送至赛哲生物科技股份有限公司进行宏基因测序分析。
1.4.4.1 数据质控此步骤由赛哲生物科技股份有限公司完成,首先测序得到原始数据(raw data),原始数据会存在一定比例的低质量数据需要进行过滤处理,得到有效数据(clean data),具体步骤包括:1)去除含接头(adapter)的Reads。2)去除含氮(N)比例高的Reads。3)去除低质量Reads[质量值(Q)≤20的碱基数占整条Read的50%以上]。然后对各样品的有效数据进行Metagenome单样品组装,具体步骤包括:1)选取多个K-mer进行迭代组装。2)过滤掉1 000 bp以下的Contigs/Scaffold。3)把有效数据(质控以及过滤掉宿主后的序列)全部样品组装结果进行比对,得到未被利用的Reads(unmap Reads)。4)为了组装结果的有效性,进行了Contigs/Scaffold去冗余。之后将各样品未被利用上的Reads放在一起进行混合组装,以期发现样品中的低丰度物种信息。
1.4.4.2 物种注释组装出来的Contigs/Scaffold可认为是1个微生物的(不完全)基因组,将得到的Contigs/Scaffold序列与数据库比对得到Contigs/Scaffold属于哪个已知的微生物。把Contigs/Scaffold与从NCBI的NR数据库中抽提出的细菌(bacteria)、真菌(fungi)、古菌(archaea)和病毒(viruses)数据进行比对(设定阈值为E-value<=1e-5)。以Contigs/Scaffold作为1个生物,对注释物种进行定量分析。
1.4.4.3 功能注释运用BLAST将基因集与KEGG的基因数据库(GENES)进行比对,然后进行后续分析将筛选出的基因,进行KEGG注释,并标注到KEGG通路中,可以直观地显示基因在通路中的作用。将差异基因与碳水化合物活性酶类数据库(carbohydrate-active enzymes databases,CAZy)对比分析,得到碳水化合物活性酶类的物种来源。
1.4.5 挥发性脂肪酸含量取空肠食糜1 g,解冻后加入1 mL水混合均匀,4 ℃、10 000 r/min离心15 min;取1.5 mL上清液加入0.2 mL的8.2%偏磷酸;混合均匀,水浴30 min,之后4 ℃、10 000 r/min离心10 min,取上清1 mL加入200 μL的0.245%巴豆酸;取1 mL上清,5 ℃静置1 h;过滤并移至气相瓶中。
色谱条件为:载气为氮气(N2),分流比40 : 1,流量2.0 mL/min,平均线速度38 cm/s,柱压11.3 psi (1 psi≈6.89 kPa),采用程序升温,初始温度为120 ℃(3 min),以10 ℃/min升温至180 ℃(1 min),氢焰检测器温度为250 ℃,氢气(H2)流量40 mL/min,空气流量450 mL/min,柱流量+尾吹气流量45 mL/min,进样口温度为210 ℃,进样量为0.6 μL。
1.5 数据统计分析应用SPSS 20.0统计软件一般线性模型(GLM)程序进行双因素方差分析,用LSD法多重比较,生长性能数据以P < 0.10表示差异显著,其他数据以P < 0.05表示差异显著。
2 结果 2.1 粪链球菌与枯草芽孢杆菌对断奶仔猪生长性能的影响由表 2可知,与粪链球菌组、枯草芽孢杆菌组相比,混合组的终末体重显著增加(P < 0.10);与粪链球菌组、枯草芽孢杆菌组相比,混合组的平均日增重和平均日采食量显著增加(P < 0.10)。其他各指标组间差异均不显著(P>0.10)。
|
|
表 2 粪链球菌与枯草芽孢杆菌对断奶仔猪生长性能的影响 Table 2 Effects of Streptococcus faecalis and Bacillus subtilis on growth performance of weaned piglets |
由表 3可知,与粪链球菌组和枯草芽孢杆菌组相比,混合组的十二指肠隐窝深度显著降低(P < 0.05);与对照组相比,粪链球菌组的回肠绒毛高度显著增加(P < 0.05)。其他各指标组间差异均不显著(P>0.05)。
|
|
表 3 粪链球菌与枯草芽孢杆菌对断奶仔猪仔猪肠道绒毛形态的影响 Table 3 Effects of Streptococcus faecalis and Bacillus subtilis on intestinal villus morphology of weaned piglets |
由图 1可知,与对照组相比,枯草芽孢杆菌组和混合组的十二指肠绒毛密度增加,粪链球菌组、枯草芽孢杆菌组和混合组的空肠、回肠的绒毛完整性提高。

|
图 1 粪链球菌与枯草芽孢杆菌对断奶仔猪肠道绒毛形态的影响 Fig. 1 Effects of Streptococcus faecalis and Bacillus subtilis on intestinal villus morphology of weaned piglets(400×) |
由表 4可知,与对照组相比,粪链球菌组必需氨基酸中的赖氨酸、组氨酸、异亮氨酸、亮氨酸、苏氨酸的表观消化率显著提高(P < 0.05),枯草芽孢杆菌组必需氨基酸中的赖氨酸、异亮氨酸、亮氨酸、苯丙氨酸、缬氨酸以及总氨基酸的表观消化率显著提高(P < 0.05);与粪链球菌组和枯草芽孢杆菌组相比,混合组的组氨酸、天冬氨酸、谷氨酸的表观消化率显著提高(P < 0.05)。与对照组相比,粪链球菌组非必需氨基酸中的丝氨酸、谷氨酸、甘氨酸+丙氨酸的表观消化率显著提高(P < 0.05),枯草芽孢杆菌组非必需氨基酸中的天冬氨酸、甘氨酸+丙氨酸、酪氨酸、脯氨酸以及总氨基酸的表观消化率显著提高(P < 0.05)。
|
|
表 4 粪链球菌与枯草芽孢杆菌对断奶仔猪氨基酸表观消化率的影响 Table 4 Effects of Streptococcus faecalis and Bacillus subtilis on amino acid apparent digestibility of weaned piglets |
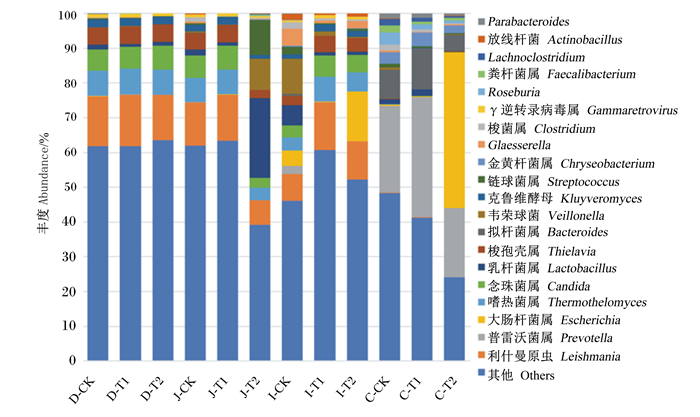
由图 2可知,对照组、粪链球菌组和枯草芽孢杆菌组十二指肠中优势菌属为梭孢壳属、嗜热菌属、利什曼原虫属、念珠菌属。对照组与粪链球菌组空肠中优势菌属同为梭孢壳属、嗜热菌属、利什曼原虫属、念珠菌属;枯草芽孢杆菌组空肠中优势菌属为韦荣球菌属、链球菌属、利什曼原虫属、乳杆菌属。对照组回肠中优势菌属为利什曼原虫属、乳杆菌属、韦荣球菌属、Glaesserella;粪链球菌组回肠中优势菌属为利什曼原虫属、嗜热菌属、念珠菌属、梭孢壳属;枯草芽孢杆菌组回肠中优势菌属为利什曼原虫、大肠杆菌属、嗜热菌属、念珠菌属、梭孢壳属。对照组盲肠中优势菌属为普雷沃菌属、拟杆菌属;粪链球菌组盲肠中优势菌属为普雷沃菌属、拟杆菌属,枯草芽孢杆菌组盲肠中优势菌属为普雷沃菌属、大肠杆菌属、拟杆菌属。
|
D-CK:对照组十二指肠duodenum of control group;D-T1:粪链球菌组十二指肠duodenum of Streptococcus faecalis group;D-T2:枯草芽孢杆菌组十二指肠duodenum of Bacillus subtilis group;J-CK:对照组空肠jejunum of control group;J-T1:粪链球菌组空肠jejunum of Streptococcus faecalis group;J-T2:枯草芽孢杆菌组空肠jejunum of Bacillus subtilis group;I-CK:对照组回肠ileum of control group;I-T1:粪链球菌组回肠ileum of Streptococcus faecalis group;I-T2:枯草芽孢杆菌组回肠ileum of Bacillus subtilis group;C-CK:对照组盲肠cecum of control group;C-T1:粪链球菌组盲肠cecum of Streptococcus faecalis group;C-T2:枯草芽孢杆菌组盲肠cecum of Bacillus subtilis group。下图同The same as below。 图 2 优势菌属丰度堆叠图 Fig. 2 Abundance of dominant genus stacked diagram |
与对照组相比,枯草芽孢杆菌组中乳杆菌属占比由1.6%增加至23.0%,利士曼原虫属占比由12.0%降低为7.0%。
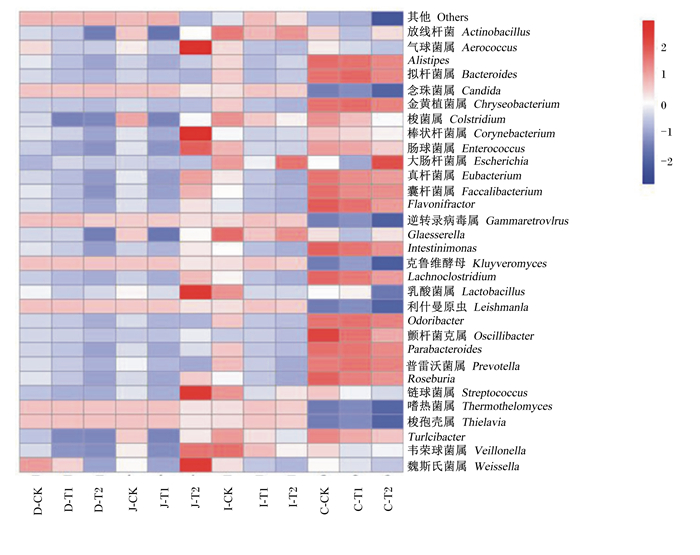
2.4.2 肠道高丰度菌群差异由图 3可知,与对照组相比,枯草芽孢杆菌组空肠中的魏斯氏菌属、韦荣球菌属、链球菌属、乳酸菌属、粪杆菌属、真杆菌属、肠球菌属、棒状杆菌、气球菌属丰度升高,利士曼原虫属丰度降低。与对照组相比,粪链球菌组和枯草芽孢杆菌组十二指肠、盲肠高丰度菌属变化不大。
|
图 3 优势菌属丰度热图 Fig. 3 Abundance of dominant genus heat map |
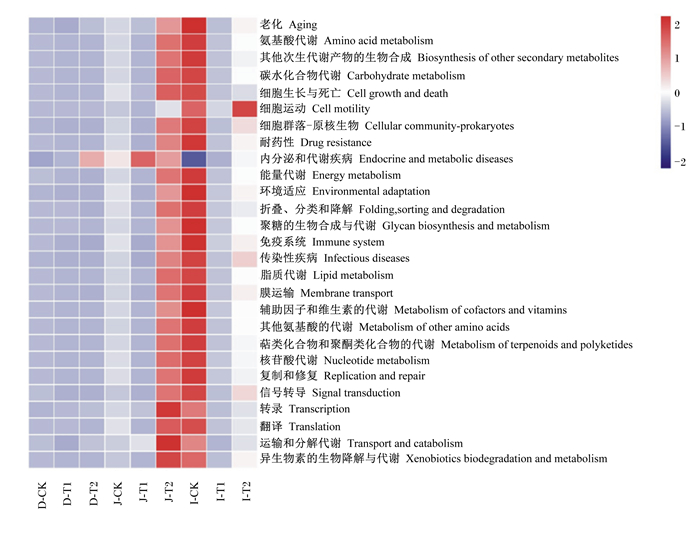
由图 4可知,与对照组相比,枯草芽孢杆菌组空肠中微生物的氨基酸代谢、碳水化合物代谢、能量代谢、聚糖的生物合成与代谢、免疫系统、脂质代谢等活动增强。与对照组相比粪链球菌组和枯草芽孢杆菌组回肠中微生物的内分泌和代谢疾病、耐药性、氨基酸代谢、碳水化合物代谢、能量代谢、聚糖的生物合成与代谢、免疫系统、脂质代谢等活动减弱。
|
图 4 KEGG功能预测level B分析结果 Fig. 4 KEGG function prediction result in level B |
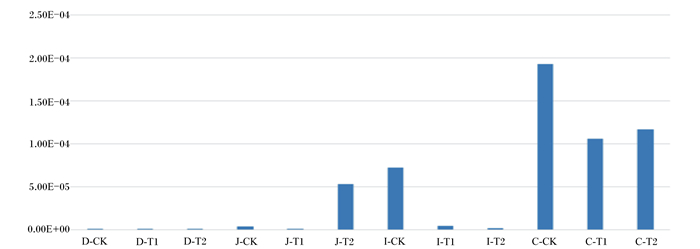
由图 5可知,与对照组相比,枯草芽孢杆菌组仔猪空肠中微生物纤维素代谢水平提高。与对照组相比,粪链球菌组和枯草芽孢杆菌组回肠与盲肠中微生物的纤维素代谢水平降低。
|
图 5 Cazy纤维素代谢 Fig. 5 Cazy cellulose metabolism |
由表 5可知,与对照组相比,粪链球菌组丙酸与异丁酸含量显著提高(P < 0.05);与对照组相比,枯草芽孢杆菌组异戊酸含量显著提高(P < 0.05)。其他各指标组间差异均不显著(P>0.05)。
|
|
表 5 粪链球菌与枯草芽孢杆菌对空肠食糜中短链脂肪酸含量的影响 Table 5 Effects of Streptococcus faecalis and Bacillus subtilis on short-chain fatty acid contents in jejunal chyme of weaned piglets |
粪链球菌是动物体内普遍存在的菌种。侯璐[5]研究表明,粪链球菌所具有的耐酸、耐胆盐特性使其可以在肠道内顺利存活,从而保证其在肠道内发挥作用。已有研究表明益生菌可以提高仔猪的饲料转化率并促进其生长[6]。魏立民等[7]研究发现,饲粮中添加0.2%枯草芽孢杆菌可以显著提高断奶仔猪的体增重与耗料量,对料重比无显著影响。但是辛娜等[8]研究表明,在断奶仔猪饲粮中添加芽孢杆菌对断奶仔猪的生长性能无显著影响。本试验研究结果表明,粪链球菌与枯草芽孢杆菌混合添加与二者单独添加相比,平均日增重和平均日采食量显著增加。结合Gardiner等[9]研究结果,饲粮中益生菌的添加量应达到106 CFU/g方能对生长性能造成显著影响。这应当是本试验中益生菌添加量不足,未使断奶仔猪生长性能产生显著变化,另外由结果可以得出2种益生菌的混合添加可以促进仔猪的采食,应当是由于2种益生菌的混合添加对仔猪的消化性能有一定的促进作用。另外,结合方美琪[10]的研究结果,益生菌的促生长作用与益生菌对肠道菌群的调节有关。因此,后续试验会将目光聚焦到肠道发育以及肠道微生物等一些微观指标。
3.2 粪链球菌与枯草芽孢杆菌对断奶仔猪肠道发育以及氨基酸消化率的影响小肠是动物体内重要的消化器官,对营养物质的消化、吸收、转运有着重要作用。小肠的绒毛高度、隐窝深度以及绒隐比是反映肠道消化吸收能力的重要指标[11]。绒毛越高表明小肠对营养物质吸收能力越强;隐窝越浅表明细胞成熟率越高,分泌能力越强;绒隐比越大表明小肠吸收能力越强[12]。肠上皮的完整结构与营养物质消化吸收以及肠道发挥屏障功能密切相关[13]。仔猪断奶后饲粮形态由液体变为固体,固体饲料易磨损肠道,导致消化道出现损伤,小肠绒毛断裂、脱落,隐窝深度增加[14]。陈彩文等[15]报道,在鸡饲粮中添加枯草芽孢杆菌,回肠的绒毛长度显著增加,十二指肠隐窝深度显著降低。本研究结果表明,饲粮中单独添加粪链球菌可提高回肠绒毛高度,并且粪链球菌与枯草芽孢杆菌混合添加相比于单独添加会显著降低十二指肠隐窝深度;饲粮中单独添加粪链球菌与枯草芽孢杆菌以及二者混合添加会提高空肠和回肠上皮完整性,这与上述文献结果相一致。这可能是由于粪链球菌与枯草芽孢杆菌的添加使肠道内有益菌数量增加,有害菌数量减少,进而抑制有害菌对肠道的损伤[16]。并且益生菌的代谢产物如乳酸、挥发性脂肪酸等可刺激黏膜层血管,进而促进肠道绒毛发育[17]。因此,本试验表明饲粮单独添加粪链球菌与枯草芽孢杆菌以及二者混合添加可促进断奶仔猪小肠的发育,提高小肠上皮完整性,提高小肠消化吸收能力,并且粪链球菌与枯草芽孢杆菌混合添加效果要好于单独添加。
目前还未见到饲粮添加粪链球菌或枯草芽孢杆菌对猪氨基酸消化率影响的报道。本研究结果表明,饲粮中单独添加粪链球菌可显著提高仔猪必需氨基酸中的赖氨酸、组氨酸、异亮氨酸、亮氨酸、苯丙氨酸、苏氨酸的表观消化率;饲粮中单独添加枯草芽孢杆菌可显著提高仔猪必需氨基酸中赖氨酸、异亮氨酸、亮氨酸、苯丙氨酸、缬氨酸的表观消化率;饲粮中粪链球菌与枯草芽孢杆菌混合添加相比于单独添加可显著提高组氨酸、天冬氨酸、谷氨酸的表观消化率。这可能与粪肠球菌、枯草芽孢杆菌可以改变肠道菌群结构[18],而微生物的菌群变化会影响氨基酸在肠道内的吸收利用有关[19]。结合本试验结果可知,饲粮添加粪链球菌与枯草芽孢杆菌可促进氨基酸在肠道内的吸收利用。另外,氨基酸代谢可以产生短链脂肪酸,因此后续试验将探究饲粮中添加粪链球菌与枯草芽孢杆菌对仔猪肠道中短链脂肪酸含量的影响。
3.3 粪链球菌与枯草芽孢杆菌对断奶仔猪肠道微生物的影响动物肠道中的菌群可以帮助宿主消化代谢,促进肠道的发育,同时抵御病原体,防止病原体在肠道内定植,参与机体免疫相关活动的进行[20]。枯草芽孢杆菌为需氧菌,可消耗动物肠道内大量的游离氧,制造低氧环境,进而抑制肠道内需氧有害菌的生长繁殖,并且枯草芽孢杆菌可分泌多种抗生素,抑制肠道内的病原菌[21]。粪链球菌可产生有机酸和细菌素,抑制肠道内病原菌的生长,降低肠道pH,优化肠道环境[22]。郑婷婷等[23]报道,枯草芽孢杆菌可提高肉鸡肠道内双歧杆菌、乳酸菌的数量。本试验结果表明,饲粮中单独添加枯草芽孢杆菌可提高断奶仔猪空肠中乳杆菌属占比,并且降低利士曼原虫属占比,说明枯草芽孢杆菌可优化肠道菌群。并且,乳酸菌可改善仔猪生长性能、肠道免疫功能,维持紧密连接的完整性,降低病原菌对仔猪造成的损伤[24]。根据本试验中KEGG与Cazy结果可知,饲粮中单独添加枯草芽孢杆菌会明显提高空肠中微生物的免疫系统、碳水化合物代谢、纤维素代谢。这可能是由于枯草芽孢杆菌的添加消耗了肠道内的大量游离氧,制造了厌氧环境进而促进了乳酸菌的丰度,并且该菌分泌的代谢产物抑制了利士曼原虫属的相对丰度。因此,本试验表明2种益生菌的添加可优化肠道菌群,增强肠道微生物屏障,促进肠道健康,进而提高了仔猪的消化吸收能力。此外,Brown等[25]报道,肠道微生物发酵膳食纤维或复合碳水化合物可产生短链脂肪酸如醋酸盐、丙酸盐和丁酸盐。因此,后续试验将探究饲粮添加粪链球菌、枯草芽孢杆菌对仔猪空肠食糜中短链脂肪酸含量的影响。
3.4 粪链球菌与枯草芽孢杆菌对断奶仔猪空肠食糜短链脂肪酸含量的影响氨基酸代谢以及细菌分解纤维素、碳水化合物都可以产生短链脂肪酸[25]。短链脂肪酸可参与机体氧化功能、调节肠道平衡并改善肠道功能[26]。丙酸可参与三羧酸循环为机体供能,丁酸可促进细胞的生长代谢。丁洪涛等[27]报道,通过体外瘤胃发酵试验,添加枯草芽孢杆菌可显著提高丙酸、丁酸的浓度。本试验结果表明,饲粮中单独添加粪链球菌显著提高了空肠食糜中丙酸、异丁酸含量;饲粮中单独添加枯草芽孢杆菌显著提高了空肠食糜中异戊酸含量。结合前面氨基酸消化率的结果猜测,可能是由于饲粮中添加枯草芽孢杆菌改善了空肠中菌群结构,进而促进了肠道微生物的纤维素代谢、碳水化合物代谢以及氨基酸代谢,导致空肠中短链脂肪酸含量增加,并且短链脂肪酸可促进肠道绒毛发育[17],提高仔猪的消化能力。本试验可以得出,2种益生菌的添加可以促进肠道中短链脂肪酸的含量,从而有益于仔猪的肠道健康以及营养物质的代谢,促进了肠道发育,提高了仔猪消化代谢能力,进而促进仔猪的生长发育。
4 结论① 饲粮中单独添加枯草芽孢杆菌可改善断奶仔猪空肠菌群,促进肠道发育,提高氨基酸消化率,提高空肠短链脂肪酸含量。
② 饲粮中单独添加粪链球菌可促进断奶仔猪肠道发育,提高氨基酸消化率,提高空肠短链脂肪酸含量。
③ 饲粮中粪链球菌与枯草芽孢杆菌混合添加可促进断奶仔猪肠道发育,提高氨基酸消化率,增加仔猪采食量。
| [1] |
BARTON M D. Impact of antibiotic use in the swine industry[J]. Current Opinion in Microbiology, 2014, 19: 9-15. |
| [2] |
HARDING S V, FRASER K G, WYKES L J. Probiotics stimulate liver and plasma protein synthesis in piglets with dextran sulfate-induced colitis and macronutrient restriction[J]. The Journal of Nutrition, 2008, 138(11): 2129-2135. |
| [3] |
庞敏.益生菌制剂对断奶仔猪肠道黏膜屏障功能的影响及其机理的研究[D].硕士学位论文.北京: 中国农业科学院, 2016. http://cdmd.cnki.com.cn/Article/CDMD-82101-1016171311.htm
|
| [4] |
刘江坤, 芦春莲, 李同洲, 等. 枯草芽孢杆菌(PB6株)制剂对断奶仔猪生产性能的影响[J]. 畜牧与兽医, 2014, 46(2): 37-39. |
| [5] |
侯璐.猪源粪肠球菌的特性及对仔猪生长性能和免疫力影响的研究[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10129-2010150262.htm
|
| [6] |
华洵璐, 钱仁界, 张宪中, 等. 芽孢杆菌复合制剂对断奶仔猪生长、腹泻和饲料消化率的影响[J]. 安徽农业科学, 2015(3): 166-170. |
| [7] |
魏立民, 孙瑞萍, 刘海隆, 等. 枯草芽孢杆菌对断奶仔猪生长性能和血清生化指标的影响[J]. 中国畜牧兽医, 2017, 44(6): 1720-1725. |
| [8] |
辛娜, 张乃锋, 习其玉, 等. 芽孢杆菌制剂对断奶仔猪生长性能、胃肠道发育的影响[J]. 畜牧兽医学报, 2012, 43(6): 901-908. |
| [9] |
GARDINER G E, CASEY P G, GASEY G, et al. Relative ability of orally administered Lactobacillus murinus to predominate and persist in the porcine gastrointestinal tract[J]. Applied and Environment Microbiology, 2004, 70(4): 1895-1906. |
| [10] |
方美琪. 益生菌的研究进展及其对断奶仔猪的影响[J]. 畜牧兽医科技信息, 2016(2): 10-11. |
| [11] |
贺永康.中草药添加剂对肉鸡生产性能及肠道结构的影响[D].硕士学位论文.保定: 河北农业大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-11920-2010138753.htm
|
| [12] |
DUNSFORD B R, KNABE D A, HAENSLY W E. Effect of dietary soybean meal on the microscopic anatomy of the small intestine in the early-weaned pig[J]. Journal of Animal Science, 1989, 67(7): 1855-1863. |
| [13] |
OSWALD I P. Role of intestinal epithelial cells in the innate immune defence of the pig intestine[J]. Veterinary Research, 2006, 37(3): 359-368. |
| [14] |
黄启权. 断奶仔猪的生理特点、营养要求及饲养管理[J]. 养殖技术顾问, 2011(8): 20. |
| [15] |
陈彩文, 张晓慧, 曹赞, 等. 枯草芽孢杆菌对1~21日龄AA鸡生长性能、血液生化指标及肠道组织结构的影响[J]. 饲料工业, 2015, 36(19): 10-14. |
| [16] |
马治宇.乳酸菌及其培养液对肉鸡生产性能、肠道菌群及肠道结构的影响[D].硕士学位论文.杨凌: 西北农林科技大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10712-2008102804.htm
|
| [17] |
龚胜, 邓树勇, 甘凌秀. 不同水平的植物乳杆菌代谢产物对肉鸡生长性能、粪微生物菌群及绒毛形态的影响[J]. 中国饲料, 2019, 624(04): 39-43. |
| [18] |
JAYARAMAN S, THANGAVEL G, KURIAN H, et al. Bacillus subtilis PB6 improves intestinal health of broiler chickens challenged with Clostridium perfringens-induced necrotic enteriti[J]. Poultry Science, 2013, 92(2): 370-374. |
| [19] |
WILLIAMS P E V. Digestible amino acids for non-ruminant animals:theory and recent challenges[J]. Animal Feed Science and Technology, 1995, 53(2): 173-187. |
| [20] |
ROUND J L, MAZMANIAN S K. The gut microbiota shapes intestinal immune responses during health and disease[J]. Nature Reviews Immunology, 2009, 9(5): 313-323. |
| [21] |
STEIN T. Bacillus subtilis antibiotics:structures, syntheses and specific functions[J]. Molecular Microbiology, 2005, 56(4): 845-857. |
| [22] |
HUGAS M, GARRIGA M, AYMERICH M T. Functionalty of Enterococci in meat products[J]. International Journal of Food Microbiology, 2003, 88(2/3): 223-233. |
| [23] |
郑婷婷, 王苇, 秦瑶, 等.日粮添加耐受性枯草芽孢杆菌Q04对肉鸡肠道菌群、生产性能、部分血液生化指标和免疫指标的影响[C]//中国畜牧兽医学会动物微生态学分会第十一次全国学术研讨会暨第五届会员代表大会论文集.重庆: 中国畜牧兽医学会动物微生态学分会, 2014: 147.
|
| [24] |
XIN J G, ZENG D, WANG H S, et al. Probiotic Lactobacillus johnsonii BS15 promotes growth performance, intestinal immunity, and gut microbiota in piglets[J]. Probiotics and Antimicrobial Proteins, 2019, 1-10. |
| [25] |
BROWN A J, GOLDSWORTHY S M, BARNES A A, et al. The orphan G protein-coupled receptors gpr41 and gpr43 are activated by propionate and other short chain carboxylic acids[J]. Journal of Biological Chemistry, 2003, 278(13): 11312-11319. |
| [26] |
KONG X F, JI Y J, LI H W, et al. Colonic luminal microbiota and bacterial metabolite composition in pregnant Huanjiang mini-pigs:effects of food composition at different times of pregnancy[J]. Scientific Reports, 2016, 6: 37224. |
| [27] |
丁洪涛, 夏冬华, 秦珊珊, 等. 枯草芽孢杆菌对奶牛体外瘤胃发酵的影响[J]. 饲料研究, 2012(1): 57-59. |




