玉米赤霉烯酮(zearalenone, ZEA)是一种由镰刀菌次级代谢产生的雌激素类霉菌毒素,是我国污染程度最广泛的霉菌毒素之一[1-2]。ZEA对动物和人类都会产生危害,它能导致人或动物(特别是猪)的生殖系统紊乱,临床表现为雌激素过多症,给养殖业带来直接的经济损失[1, 3]。截止目前,添加霉菌毒素吸附剂仍然是缓解饲料中ZEA毒副作用最直接、最具可操作性和可行性的方法。霉菌毒素吸附剂是一类具有吸附霉菌毒素能力的饲料添加剂,能够在动物消化道内与饲料中的霉菌毒素相结合,从而达到减少动物胃肠道对霉菌毒素吸收,增加霉菌毒素通过粪便排出的目的[4]。对特定霉菌毒素的吸附率是评价霉菌毒素吸附剂质量优劣的重要指标。目前市场上常用的霉菌毒素吸附剂种类繁多,质量参差不齐,也无统一的国家或行业标准,迫切需要建立可靠的霉菌毒素吸附剂脱毒效果评价方法。目前针对霉菌毒素吸附剂脱毒效果的评价方法主要有体外法和体内法2种。体外法一般以水溶液或消化道模拟液作为反应介质,测定脱毒剂对某种霉菌毒素的吸附能力[5-6]。安亚南等[6]采用单浓度体外吸附试验评价了4种霉菌毒素吸附剂分别在纯水、猪胃和小肠食糜上清液介质中对ZEA的吸附效果,发现不同吸附剂在不同介质中对ZEA的吸附效果均有较大差异。体内试验通常是基于非特异性参数进行的,评估动物的生产性能、血液生化或血液参数、器官重量、对免疫功能的影响和组织学变化等[7-8]。但由于这些标准都具有非特异性,处理和未处理的动物之间产生的差异不能完全归因于吸附剂的功效。这中间有可能涉及到很多混合效应,如β-葡聚糖免疫调节活性及其他饲料成分的抗氧化作用。霉菌毒素吸附剂是在动物肠道中吸附霉菌毒素的,因此可以预期其在肠道中的吸收率较低。根据欧洲食品安全局(EFSA)的要求,评估脱毒剂有效性的最相关参数是能够增加排泄物/降低血浆或组织中霉菌毒素原型或其主要代谢产物的浓度[9]。此外,非特异性参数也需进行监测。ZEA在动物体内的代谢产物主要有α-玉米赤霉烯醇(α-zearalenol, α-ZOL)、β-玉米赤霉烯醇(β-zearalenol, β-ZOL)、α-玉米赤霉醇(α-zearalanol, α-ZAL)和β-玉米赤霉醇(β-zearalanol, β-ZAL),且具有物种差异性[10]。体外法因其简单快速而被广泛使用,但是体外试验不能完全模拟动物体内具有的复杂酶活性、pH剧烈波动等特点的消化道环境,不能充分说明吸附剂对霉菌毒素的结合效果,因此需要与动物试验相结合,更合理地评价脱毒剂的安全性和作用效果。罗丹等[11]研究了凹凸棒石吸附剂对蛋鸡生产性能、血清生化指标及蛋黄中ZEA残留的影响,发现不同添加量的凹凸棒石对这些指标均没有显著影响,这可能与蛋鸡对ZEA不敏感,且饲粮中ZEA含量较低有关。因此,本研究采用体外和体内试验相结合的方法,首先利用体外法初步筛选体外吸附效果较好的霉菌毒素吸附剂,再选取对ZEA较为敏感的青年母猪为试验动物,将血浆中ZEA及其代谢产物的含量作为特异性的生物标记物(biomarker)用于评价ZEA吸附剂在动物体内的脱毒效果,并同时监测了相关非特异性指标。以期建立1套通过体外法在较宽pH环境下初筛吸附效果较好的吸附剂,再通过体内法监测试验动物血浆中ZEA及其代谢产物含量变化作为主要脱毒效果评价指标的ZEA吸附剂有效性评价方法,为制定相关有效性评价标准提供理论依据。
1 材料与方法 1.1 试验材料试验所用12种霉菌毒素吸附剂均为市场购买,分别编号为A1、A2、A3……A12,其中A1、A2和A12为酵母细胞壁类吸附剂,A5、A7、A10和A11为硅铝酸盐类吸附剂,A3、A8和A9为改性硅铝酸盐类吸附剂,A4和A6为复合型吸附剂(主要为改性高纯纳米硅铝酸盐、酵母细胞壁提取物和酯化葡甘露聚糖)。ZEA标准品购自加拿大TripleBond公司(纯度≥98%),甲醇、乙腈均为色谱纯,超纯水,其他试剂均为分析纯。
1.2 ZEA缓冲液的配制柠檬酸缓冲液(pH 3.0):将20.55%的0.2 mol/L磷酸氢二钠溶液与79.45%的0.1 mol/L柠檬酸溶液混合,调节pH至3.0。
磷酸盐缓冲液(pH 6.5):将31.50%的0.2 mol/L的磷酸氢二钠溶液与68.50%的0.2 mol/L磷酸二氢钠溶液混合,调节pH至6.5。
以柠檬酸缓冲液和磷酸盐缓冲液为基础,配制这2种pH的ZEA缓冲液,使得缓冲液中ZEA的终浓度为1 000 μg/L。
1.3 体外吸附试验试验参考Phillips等[5]的方法,分别取10 mL上述不同pH的ZEA缓冲液,加入0.2%(即20 mg)的吸附剂,涡旋振荡15~20 s,置于37 ℃,150 r/min的恒温振荡水浴摇床中避光反应2 h,以不添加吸附剂的ZEA缓冲液作为对照,每个处理3个平行。反应结束后,8 000 r/min离心5 min,取0.8 mL上清液与0.8 mL甲醇混合,涡旋20 s,过0.22 μm的滤膜到2 mL进样小瓶中,通过高效液相色谱(high performance liquid chromatography, HPLC)法检测ZEA的含量,计算吸附率。
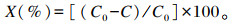
|
式中:X表示吸附率(%);C0表示对照组中ZEA的含量(μg/L);C表示吸附剂组中ZEA的含量(μg/L)。
1.4 高效液相色谱法检测ZEA含量体外吸附试验中ZEA含量的检测采用HPLC法,检测条件为:LC-20AD型HPLC仪(日本岛津),配备RF-20A vx型荧光检测器(日本岛津),Agilent ZORBAX SB-C18反相色谱柱(4.6 mm×150 mm, 5 μm),流动相为乙腈-水-甲醇(V乙腈 : V水 : V甲醇=46 : 46 : 8),流速为1.0 mL/min,进样量为10 μL,柱温35 ℃。荧光检测器波长为:Ex=235 nm,Em=460 nm。
1.5 动物试验试验在河北省保定市唐县河北汉唐牧业有限公司进行,试验时间为2016年12月9日—2017年1月6日。选择日龄相近、健康的三元杂交(杜×长×大)青年母猪40头,根据日龄[(75±2)日龄]和平均体重[(29.19±0.76) kg]相近原则随机分为5组,对照组饲喂基础饲粮,ZEA组在基础饲粮中添加1 mg/kg ZEA,ZEA测定值为(1.00±0.02) mg/kg,试验E1、E2和E3组在ZEA组饲粮基础上分别添加质量分数为0.2%的吸附剂A3、A4和A6,每组8个重复,每个重复1头猪。
基础饲粮参考NRC(1998)推荐标准配制,其组成及营养水平见表 1。每天饲喂3次(07:30、14:30和20:30),保证饲槽中有剩料,试验开始前全猪舍清扫并消毒,试验期间每周进行1次猪舍消毒,单笼饲养,猪只自由采食和饮水。预试期7 d,正式期21 d,共28 d,预试期所有猪只均饲喂基础饲粮,以便试验动物适应环境,摸清其采食量。管理和免疫按常规进行。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
ZEA污染饲粮的配制参考杨立杰[12]的研究方法。具体为:将1.0 g色谱纯度(98%)粉末状ZEA溶解在1 L乙酸乙酯中,再将含有ZEA的乙酸乙酯溶液喷洒到1 kg滑石粉载体上,放置过夜使乙酸乙酯挥发,用玉米粉稀释成10 mg/kg ZEA的含毒素玉米粉,然后按照E1组饲粮中ZEA设计水平,用含毒素玉米粉替代配方中的玉米粉制成试验饲粮。试验所需饲粮于试验正式开始前1周1次性配完,装袋后储存于通风干燥处。在试验前后分别取样,检测饲粮中养分含量和霉菌毒素含量。取样按照《饲料采样方法》(GB/T 14699.1—1993)的方法进行,各营养物质含量按照实验室常规方法分析[13]。
饲粮霉菌毒素含量测定:饲粮中ZEA、黄曲霉毒素B1、呕吐毒素的含量委托中国农业科学院农业质量标准与检测技术研究所测定。采用多功能净化柱净化超高效液相色谱-串联质谱法同时测定3种霉菌毒素含量,外标法定量。基础饲粮中ZEA的含量为(30.2±2.1) μg/kg,呕吐毒素含量为(169.5±5.2) μg/kg,黄曲霉毒素B1未检出(< 0.5 μg/kg)。
1.7 样品采集与指标测定 1.7.1 生长性能测定每天记录猪采食量和剩料量,试验前后对每头猪进行空腹称重,计算平均日增重、平均日采食量和料重比。
1.7.2 阴户测量与计算试验正试期开始第1天和第21天观察并记录猪只阴户肿胀情况,用游标卡尺测量阴户横向最长宽度,计算猪只的阴户变化量,比较各组猪只的阴户增大及恢复效果。

|
正试期结束后第2天清晨每组随机选取5头猪进行前腔静脉空腹采血,使用真空采血管和肝素化抗凝管分别采集前腔静脉血10 mL。真空采血管采集的血液样品在37 ℃水浴静置30 min,转入离心机离心(3 000 r/min离心10 min),分离出血清;肝素化抗凝管采集的血液样品于低温冷冻离心机离心(4 ℃, 3 000 r/min, 10 min),分离出血浆。所有血清和血浆样品分装到1.5 mL离心管中,保存于-20 ℃至分析。
1.7.4 血清生化指标测定血清中总蛋白(TP)、白蛋白(ALB)、免疫球蛋白G(IgG)含量及碱性磷酸酶(ALP)、谷氨酸脱氢酶(GLDH)、谷草转氨酶(AST)、谷酰转肽酶(GGT)和肌酸激酶(CK)活性采用COBAS MIRA Plus全自动生化分析仪测定。血清中雌二醇含量采用放射免疫试剂盒(南京建成生物工程研究所)测定。
1.7.5 血浆中ZEA及其主要代谢产物的含量测定血浆中ZEA及其主要代谢产物α-ZOL和β-ZOL的含量测定委托中国农业科学院农业质量标准与检测技术研究所,参照王瑞国等[14]的方法测定。
1.7.6 器官的采集与处理每组随机选取4头猪进行放血屠宰,打开体腔,迅速取出肝脏、肾脏、脾脏和生殖器官(包括卵巢、子宫角、子宫颈和阴道),除去其表面脂肪等异物后随即称重,计算器官指数。
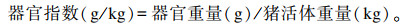
|
试验数据分析采用SPSS 19.0统计软件的one-way ANOVA程序进行方差分析,差异显著性分析采用Duncan氏法进行多重比较,以P < 0.05作为各项差异显著的检验水平,结果以平均值±标准差表示。
2 结果与分析 2.1 不同pH缓冲介质中吸附剂对ZEA的吸附效果在pH 3.0的柠檬酸缓冲液和pH 6.5的磷酸盐缓冲液中,12种吸附剂的吸附效果如表 2所示,吸附剂A1、A5、A7、A10、A11和A12对ZEA的吸附效果较差,在2种pH反应介质中对ZEA的吸附率均低于50%。吸附剂A3、A4、A6和A8对ZEA的吸附效果较好,在2种pH缓冲介质中对ZEA的吸附率可达到85%以上。吸附剂A9在pH 3.0的缓冲介质中吸附效果较差,仅为61.01%,但在pH 6.5的缓冲介质中吸附率则可达到100%。吸附剂A3、A4和A6在pH 3.0和pH 6.5的反应介质中吸附率均达到90%以上,因此选取以上3种吸附剂进行动物试验。
|
|
表 2 不同pH缓冲介质中吸附剂对ZEA的体外吸附效果 Table 2 In vitro binding efficacy of adsorbent on ZEA in buffer media of different pH |
由表 3可知,对照组与添加各吸附剂组之间青年母猪的平均日增重、平均日采食量和料重比均没有显著差异(P>0.05)。
|
|
表 3 ZEA攻毒饲粮添加霉菌毒素吸附剂对青年母猪生长性能的影响 Table 3 Effects of ZEA diets with mycotoxin absorbents on growth performance of prepubertal gilts (n=8) |
由表 4可知,各组猪只之间初始阴户宽度无显著差异(P>0.05)。在试验周期第2周,可观察到饲粮中添加了ZEA的青年母猪阴户出现不同程度的红肿。在试验结束的第21天,相对于对照组,饲粮中添加1 mg/kg ZEA显著增加了青年母猪的阴户宽度和阴户宽变化量(P < 0.05)。与ZEA组相比,E1和E3组阴户宽度和阴户宽变化量无显著恢复(P>0.05),而E2组则有显著恢复效果(P < 0.05),但仍显著高于对照组(P < 0.05)。
|
|
表 4 ZEA攻毒饲粮添加霉菌毒素吸附剂对青年母猪阴户宽度的影响 Table 4 Effects of ZEA diets with mycotoxin absorbents on vulva width of prepubertal gilts (n=8) |
由表 5可知,与对照组相比,饲粮中添加1 mg/kg ZEA对青年母猪的肝脏、脾脏和肾脏指数均没有显著影响(P>0.05),但能够显著增加生殖器官指数(P < 0.05)。而添加了吸附剂A4和A6的试验组生殖器官指数则基本恢复至对照组水平。
|
|
表 5 ZEA攻毒饲粮添加霉菌毒素吸附剂对青年母猪器官指数的影响 Table 5 Effects of ZEA diets with mycotoxin absorbents on organ index of prepubertal gilts (n=4) |
由表 6可知,与对照组相比,在饲粮中添加1 mg/kg ZEA对青年母猪血清中TP、ALB、IgG含量及ALP、GLDH、AST、GGT和CK活性均没有显著影响(P>0.05),但显著降低了血清中雌二醇的含量(P < 0.05)。而添加不同霉菌毒素吸附剂后,血清中的雌二醇含量均有一定程度恢复。
|
|
表 6 ZEA攻毒饲粮添加霉菌毒素吸附剂对青年母猪血清生化指标的影响 Table 6 Effects of ZEA diets with mycotoxin absorbents on serum biochemical indexes of prepubertal gilts (n=5) |
由表 7可知,与对照组相比,3个试验组血浆ZEA含量和ZEA、α-ZOL、β-ZOL含量之和均显著降低(P < 0.05),其中E2组降低程度最大。与ZEA组相比,E2组血浆中α-ZOL含量显著降低(P < 0.05),E1和E2组血浆中β-ZOL含量显著降低(P < 0.05)。
|
|
表 7 ZEA攻毒饲粮添加霉菌毒素吸附剂对青年母猪血浆中ZEA及其代谢产物含量的影响 Table 7 Effects of ZEA diets with mycotoxin absorbents on contents of ZEA and its metabolites in plasma of prepubertal gilts (n=5) |
动物试验虽然可以比较真实地评价霉菌毒素吸附剂在动物体内的效果[7-8, 15],但由于体内动物试验的成本高、周期长、采样及分析复杂,因此体外试验方法仍然是评价吸附剂吸附效果的常用方法,可用于对吸附剂的初筛。纯水介质条件简单,易于操作,但无法反映动物胃肠道的pH环境,只适合对吸附剂进行快速的初步筛选。有研究采用动物消化道的食糜上清液或添加酶模拟胃肠道消化液作为反应介质,虽然可以比较真实地反映动物胃肠道的环境,但反应介质成分复杂且容易受多种因素影响,难以重复和标准化[6, 16]。本研究采用pH 3.0的柠檬酸盐缓冲溶液和pH 6.5的磷酸盐缓冲溶液分别模拟动物胃和肠道的pH环境,固定温度和反应时长,易于控制反应条件。本研究选取了12种市售霉菌毒素吸附剂,评价其对ZEA的体外吸附效果,结果表明,不同吸附剂在不同pH反应介质中对ZEA的吸附效果不同,其中绝大部分吸附剂在pH 6.5条件下的吸附效率高于pH 3.0,这主要是因为酸性环境下ZEA只以疏水力结合在吸附剂的表面,中性或碱性环境下,ZEA阴离子增加了与土层边缘羟基以静电作用结合的吸附位点[17]。没有经过改性的硅铝酸盐对ZEA的吸附活性普遍低于改性后的硅铝酸盐吸附剂,原因可能是因为经过改性后的硅铝酸盐层间电荷特性、分散性能等更利于ZEA与其相结合[18]。酵母细胞壁类吸附剂对ZEA也有较好的吸附能力,酵母细胞壁是一种多孔的碳水化合物,其有效成分是酵母细胞内壁的葡甘露聚糖(glucomannan, GM)。GM是一种高分子质量多糖,可以通过离子键、氢键以及疏水作用力对霉菌毒素产生吸附力,在pH 3~8内均能吸收霉菌毒素。张丽霞等[19]利用啤酒酵母β-D-葡聚糖吸附ZEA,发现最大可以吸附2.29 μg/mg的毒素。复合型霉菌毒素吸附剂A4和A6对ZEA均有非常好的吸附效果,复合型吸附剂综合了单一吸附剂的优点,具有适应范围广、能吸附多种霉菌毒素等优点。吸附剂A4和A6均为以高纯纳米层状铝镁硅酸盐晶体、酵母细胞壁和酯化葡甘露聚糖为主要成分的复合型吸附剂,其中高纯纳米层状铝镁硅酸盐晶体具有十分优异的分散性能,对ZEA有较好的吸附能力,而酯化葡甘露聚糖是一种天然的霉菌毒素吸附剂,其表面有许多小孔,表面积大,研究表明其对ZEA有较好的吸附作用[3]。许静[20]的研究也发现将不同吸附剂按一定比例混合后,对ZEA的吸附效率大大提高。
3.2 不同吸附剂对ZEA的体内吸附效果评价体外吸附效果较好的吸附剂仍需要结合动物试验来验证其真实的吸附效果。为了单独探讨霉菌毒素吸附剂对ZEA的吸附效果,动物试验饲粮中采用添加高纯度的ZEA,以避免自然污染饲料原料中其他霉菌毒素的干扰。
3.2.1 ZEA攻毒饲粮添加霉菌毒素吸附剂对青年母猪生长性能的影响整个试验期间所有猪只健康状况良好,没有出现死亡现象。本研究表明,饲粮中添加1 mg/kg的ZEA对青年母猪的生长性能没有显著影响,饲粮中添加吸附剂也没有显著影响青年母猪的生长性能。杨立杰等[12]在研究ZEA对断奶小母猪生长性能、血清抗氧化功能和免疫功能的影响时发现,饲粮中添加0.5~1.5 mg/kg ZEA对小母猪的平均日增重、平均日采食量和料重比均没有显著影响。Marcela等[21]和赵虎[22]也有类似报道,饲粮中添加1~3 mg/kg纯品ZEA不会显著影响断奶仔猪的生长性能,与本文研究结果一致。
3.2.2 ZEA攻毒饲粮添加霉菌毒素吸附剂对青年母猪阴户宽度的影响ZEA是一种非甾醇类雌激素,与体内雌二醇受体具有特殊亲和力,能够引发雌激素过多症,典型症状表现为阴户红肿、乳腺增大和假发情等[1]。姚宝强等[7]研究发现,饲粮中添加1 mg/kg的ZEA引起了仔猪阴户宽度、长度和面积的显著增大,而添加吸附剂则没有影响阴户发育。而本研究中,添加相同水平的ZEA,亦引起了青年母猪阴户宽度的显著增大,添加了吸附剂A3和A6后对猪只阴户宽度的增大无显著改善,添加吸附剂A4则可显著降低阴户宽度。该结果表明吸附剂A4对ZEA毒性作用的缓解效果要优于吸附剂A3和A6。
3.2.3 ZEA攻毒饲粮添加霉菌毒素吸附剂对青年母猪器官指数的影响ZEA具有雌激素活性,生殖器官是其主要靶器官。王定发[23]的研究表明,添加2 mg/kg的ZEA不会引起青年母猪心脏、肺脏、肝脏、脾脏和肾脏指数的显著变化,但显著增加了阴户宽度和生殖器官重。赵虎[22]研究亦表明,饲粮中添加1 mg/kg的ZEA不会显著影响仔猪心脏、肺脏、肝脏、脾脏和肾脏指数,但添加3 mg/kg的ZEA则会显著增加肝脏、脾脏和肾脏指数。Underhill等[24]报道,用添加6 mg/kg ZEA的饲粮饲喂小鼠5 d,会显著提高其子宫重量。本试验中,在饲粮中添加1 mg/kg的ZEA不会显著引起青年母猪肝脏、脾脏和肾脏指数的改变,但是显著增加了生殖器官指数,与先前研究结果具有一致性。添加吸附剂后,对青年母猪的肝脏、脾脏和肾脏指数无显著影响,但是可以使生殖器官指数恢复到对照组水平,其中E2和E3组的恢复效果最显著。
3.2.4 ZEA攻毒饲粮添加霉菌毒素吸附剂对青年母猪血清生化指标的影响血清蛋白与动物代谢和免疫功能有密切关系,肝脏是血清蛋白合成的主要场所,其含量的高低反映了肝脏蛋白合成功能的高低。本研究表明,饲粮中添加1 mg/kg ZEA和吸附剂对青年母猪血清中的TP、ALB和IgG的含量无显著影响。Abbès等[25]发现在小鼠饲粮中添加高剂量的ZEA,会降低小鼠血清中TP和ALB含量,并对小鼠免疫功能产生不利影响。姜淑贞[8]的研究发现,在仔猪饲粮中添加1 mg/kg的ZEA,会显著降低血清中IgG的含量。而赵虎[22]研究发现,在断奶仔猪饲粮中添加1~3 mg/kg的ZEA不会影响仔猪血清中TP、ALB和球蛋白的含量。本试验结果显示在青年母猪饲粮中添加1 mg/kg ZEA并不影响青年母猪的肝脏蛋白合成功能,这可能是因为剂量、动物种类的差异。王慧容[26]在发霉饲粮中分别添加水合硅铝酸盐、酯化葡甘露聚糖和复合型霉菌毒素吸附剂,但对肉鸡血清中IgG含量的升高没有缓解作用,与本试验结果相同。
ZEA被动物吸收后主要在肝脏进行转化,动物采食ZEA可能会引起肝脏损伤[27]。AST、ALP、GGT和GLDH等酶都是评价肝脏损伤的酶。CK活性是雌激素受诱导产生的,因此可将CK作为雌激素受体应答的标记。本研究发现,与对照组相比,添加1 mg/kg ZEA对青年母猪血清中AST、ALP、GGT、GLDH和CK等酶的活性没有显著影响。而姚宝强[7]研究发现,饲粮中添加1 mg/kg ZEA会显著增加仔猪血清中AST、ALP、GGT和CK的活性,这可能与本试验采用的动物为免疫力更强的青年母猪有关。此外,本试验正试期为21 d,持续时间较其更短,对血清酶活性可能也有一定影响。
ZEA具有类雌激素活性,能通过与雌激素受体相互作用,干扰类固醇激素的合成与代谢[28]。本研究中,与对照组相比,ZEA组血清雌二醇的含量显著降低,这与姜淑贞[8]的研究结果一致,添加0.2%的吸附剂后,雌二醇的含量有所提高,但提高程度不显著。
3.2.5 ZEA攻毒饲粮添加霉菌毒素吸附剂对青年母猪血浆中ZEA及其代谢产物含量的影响人和动物血液、尿液、胆汁、乳汁和粪便中的真菌毒素的原型及其代谢产物可作为真菌毒素生物标记物,通过测定其含量来评价人和动物暴露于真菌毒素的频率和水平[29-30]。ZEA在不同动物体内代谢产物有所不同,在猪体内,ZEA主要转化为α-ZOL和少量β-ZOL[10]。本研究通过分析血浆中ZEA及其主要代谢产物的残留水平,作为评价吸附剂脱毒效果的一个特异性指标。研究发现,饲粮中添加1 mg/kg的ZEA可以显著增加血浆中ZEA、α-ZOL和β-ZOL的含量,而通过添加吸附剂,均一定程度降低了血浆中ZEA及其代谢物的含量,其中E2组降低效果最明显,说明吸附剂A4在动物体内能够有效吸附ZEA。而在体外评价试验中,吸附剂A6对ZEA的吸附效果优于A4,说明体外吸附效果不能完全代表体内脱毒效果,霉菌毒素吸附剂的脱毒效果评价需要体内与体外试验相结合进行。
4 结论① 不同类型的吸附剂在体外对ZEA的吸附效果有较大差异,其中复合型霉菌毒素吸附剂(A4和A6)和部分改性硅铝酸盐吸附剂(A3)对ZEA的体外吸附效果最佳。
② 饲粮中添加1 mg/kg ZEA对母猪的阴户宽度、生殖器官指数、血清中雌二醇的含量等非特异性指标有显著影响,并能显著增加血浆中ZEA及其代谢产物的含量,添加吸附剂A3、A4和A6均能一定程度的缓解ZEA的毒性作用,降低血浆中ZEA及其代谢产物的含量,其中吸附剂A4对各项指标的恢复效果最好,说明体外吸附效果不能完全代表体内脱毒效果。
③ 本试验建立了一种体外和体内联合评价吸附剂对ZEA脱毒效果的方法,首先通过体外法对吸附剂进行初筛,再通过体内法监测动物血浆中ZEA及其代谢产物含量变化作为主要特异性指标,同时结合部分非特异性指标共同评价霉菌毒素吸附剂的脱毒效果。
| [1] |
ZINEDINE A, SORIANO J M, MOLTÓ J C, et al. Review on the toxicity, occurrence, metabolism, detoxification, regulations and intake of zearalenone:an oestrogenic mycotoxin[J]. Food and Chemical Toxicology, 2007, 45(1): 1-18. DOI:10.1016/j.fct.2006.07.030 |
| [2] |
SHI H T, LI S L, BAI Y Y, et al. Mycotoxin contamination of food and feed in China:occurrence, detection techniques, toxicological effects and advances in mitigation technologies[J]. Food Control, 2018, 91: 202-215. DOI:10.1016/j.foodcont.2018.03.036 |
| [3] |
何学军, 齐德生. 玉米赤霉烯酮的毒性研究进展[J]. 中国饲料, 2006(10): 2-5. DOI:10.3969/j.issn.1004-3314.2006.10.002 |
| [4] |
EFSA.Review of mycotoxin-detoxifying agents used as feed additives: mode of action, efficacy and feed/food safety[EB/OL].(2014-08-29).http://www.efsa.europa.eu/en/scdocs/scdoc/22e.htm.
|
| [5] |
PHILLIPS T D, KUBENA L F, HARVEY R B, et al. Hydrated sodium calcium aluminosilicate:a high affinity sorbent for aflatoxin[J]. Poultry Science, 1988, 67(2): 243-247. |
| [6] |
安亚南, 王丹阳, 丁立人, 等. 猪胃肠道食糜中黄曲霉毒素B1和玉米赤霉烯酮检测方法的改进及其在霉菌毒素吸附剂吸附效果评价中的应用[J]. 动物营养学报, 2015, 27(6): 1823-1831. |
| [7] |
姚宝强.玉米赤霉烯酮和吸附剂对断奶仔猪生殖发育、血液生化指标和组织形态学的影响[D].硕士学位论文.泰安: 山东农业大学, 2009.
|
| [8] |
姜淑贞.玉米赤霉烯酮对断奶仔猪的毒性初探及改性蒙脱石的脱毒效应研究[D].博士学位论文.泰安: 山东农业大学, 2010.
|
| [9] |
EFSA Panel on Additives and Products or Substances Used in Animal Feed (FEEDAP). Statement on the establishment of guidelines for the assessment of additives from the functional group 'substances for reduction of the contamination of feed by mycotoxins'[J]. EFSA Journal, 2010, 8(7): 1693. DOI:10.2903/j.efsa.2010.1693 |
| [10] |
MALEKINEJAD H, MAAS-BAKKER R, FINK-GREMMELS J. Species differences in the hepatic biotransformation of zearalenone[J]. Veterinary Journal, 2006, 172(1): 96-102. DOI:10.1016/j.tvjl.2005.03.004 |
| [11] |
罗丹, 廖祉亦, 温超, 等. 凹凸棒石吸附剂对蛋鸡生产性能、血清生化指标、抗氧化功能及玉米赤霉烯酮残留的影响[J]. 中国家禽, 2018, 40(20): 28-32. |
| [12] |
杨立杰.玉米赤霉烯酮对断奶仔猪免疫毒性及生殖毒性的影响[D].硕士学位论文.泰安: 山东农业大学, 2018.
|
| [13] |
张丽英. 饲料分析及饲料质量检测技术[M]. 3版. 北京: 中国农业大学出版社, 2007: 48-96.
|
| [14] |
王瑞国, 苏晓鸥, 王培龙, 等. 液相色谱-串联质谱法同时测定动物血浆中21种霉菌毒素或其代谢物残留[J]. 分析化学, 2017, 45(2): 231-237. |
| [15] |
DEVREESE M, ANTONISSEN G, DE BACKER P, et al. Efficacy of active carbon towards the absorption of deoxynivalenol in pigs[J]. Toxins, 2014, 6(10): 2998-3004. DOI:10.3390/toxins6102998 |
| [16] |
王瑞国, 苏晓鸥, 樊霞, 等. 液相色谱-串联质谱法测定人工模拟猪消化液中3种霉菌毒素[J]. 分析化学, 2015, 43(1): 1-6. DOI:10.3969/j.issn.2095-1035.2015.01.001 |
| [17] |
LEMKE S L, GRANT P G, PHILLIPS T D. Adsorption of zearalenone by organophilic montmorillonite clay[J]. Journal of Agricultural and Food Chemistry, 1998, 46(9): 3789-3796. DOI:10.1021/jf9709461 |
| [18] |
姚志成, 叶盛群, 许家亮, 等. 改性蒙脱石对霉菌毒素体外吸附脱毒效果试验[J]. 山东畜牧兽医, 2012(9): 19-20. |
| [19] |
张丽霞, 徐学明. 啤酒酵母β-D-葡聚糖吸附毒素玉米赤霉烯酮(ZEA)的研究[J]. 食品科学, 2006, 27(4): 75-78. DOI:10.3321/j.issn:1002-6630.2006.04.014 |
| [20] |
许静.玉米赤霉烯酮脱毒剂的筛选及其脱毒机制初步研究[D].硕士学位论文.武汉: 华中农业大学, 2014.
|
| [21] |
MARCELA Š, LIKER B, ŠPERANDA T, et al. Haematological and biochemical parameters of weaned piglets fed on fodder mixture contaminated by zearalenone with addition of clinoptilolite[J]. Acta Veterinaria, 2006, 56(2): 121-136. |
| [22] |
赵虎.玉米赤霉烯酮对断奶仔猪生产性能、免疫功能和器官发育影响的研究[D].硕士学位论文.泰安: 山东农业大学, 2008.
|
| [23] |
王定发.玉米赤霉烯酮联合大豆异黄酮对青年母猪生殖器官发育、肝脏损伤和组织玉米赤霉烯酮残留的影响及其机制研究[D].博士学位论文.武汉: 华中农业大学, 2011.
|
| [24] |
UNDERHILL K L, ROTTER B A, THOMPSON B K, et al. Effectiveness of cholestyramine in the detoxification of zearalenone as determined in mice[J]. Bulletin of Environmental Contamination and Toxicology, 1995, 54(1): 128-134. |
| [25] |
ABBÈS S, OUANES Z, BEN SALAH-ABBẼS J, et al. The protective effect of hydrated sodium calcium aluminosilicate against haematological, biochemical and pathological changes induced by zearalenone in mice[J]. Toxicon, 2006, 47(5): 567-574. DOI:10.1016/j.toxicon.2006.01.016 |
| [26] |
王慧容.三种霉菌毒素吸附剂对复合霉菌毒素中毒肉鸡解毒效果的研究[D].硕士学位论文.武汉: 武汉工业学院, 2008.
|
| [27] |
National Toxicology Program. Carcinogenesis bioassay of zearalenone (CAS No.17924-92-4) in F344/N rats and B6C3F1 mice (feed study)[J]. National Toxicology Program Technical Report, 1982, 235: 1-155. |
| [28] |
LEBLANC G A, BAIN L J, WILSON V S. Pesticides:multiple mechanisms of demasculinization[J]. Molecular and Cellular Endocrinology, 1997, 126(1): 1-5. DOI:10.1016/S0303-7207(96)03968-8 |
| [29] |
SONGSERMSAKUL P, BÖHM J, AURICH C, et al. The levels of zearalenone and its metabolites in plasma, urine and faeces of horses fed with naturally, Fusarium toxin-contaminated oats[J]. Journal of Animal Physiology and Animal Nutrition, 2013, 97(1): 155-161. DOI:10.1111/j.1439-0396.2011.01253.x |
| [30] |
VIDAL A, MENGELERS M, YANG S P, et al. Mycotoxin biomarkers of exposure:a comprehensive review[J]. Comprehensive Reviews in Food Science and Food Safety, 2018, 17(5): 1127-1155. DOI:10.1111/1541-4337.12367 |




