2. 老挝科技部生物技术与生态研究所, 万象 2279
2. Biotechnology and Ecology Institute, Ministry of Science and Technology, Vientiane 2279, Laos
肉鸡汗腺不发达、机体代谢率高,极易受到高温环境的负面影响,造成典型的热应激生理反应[1-3]。热应激肉鸡表现出激素(皮质酮)分泌亢进、体温升高、营养代谢紊乱、生长抑制,这些生理、生产现象与热应激肉鸡的机体氧化损伤和过高的炎症反应相关[3-5]。随着全球温室效应加剧及肉鸡规模化高密度养殖的发展,热应激对肉鸡养殖业的危害日益受到关注。
鉴于全球很多发展中国家的家禽养殖业设施化水平不高,尤其是养殖户、中小养殖企业在客观无法改善养殖硬件基础条件下[2, 5-6],通过营养调控策略,例如饲粮中添加饲用益生菌[5, 7]、天然植物提取物[3, 8]等抗热应激安全饲料添加剂,已经证明是一个有效的措施。现有研究表明,饲粮添加单一枯草芽孢杆菌[9]、乳酸菌[10]、酵母菌[11]或它们的复合益生菌产品[12-13],具有改善热应激肉鸡生长性能的显著效果。然而,以上试验报道偏重作用效果,对饲用益生菌改善热应激肉鸡生长性能的作用机理,例如热应激造成的氧化损伤和炎症反应等尚无深入研究[9, 14]。
凝结芽孢杆菌(Bacillus coagulans)是芽孢杆菌属、乳酸菌类益生菌,具备乳酸菌抑菌与芽孢杆菌耐热适合饲料制粒的共同优势,2013年正式列入我国《饲料添加剂品种目录》,是一新型饲用益生菌产品[15-16]。本课题组前期试验发现,凝结芽孢杆菌具有降低热应激肉鸡皮质酮分泌以及改善生长性能的作用[17]。鉴于凝结芽孢杆菌改善热应激肉鸡的明确作用效果,本试验通过测定血清相关氧化应激指标及炎症细胞因子含量,研究凝结芽孢杆菌减轻热应激肉鸡氧化损伤和炎症反应的可能机理。这些研究有利于拓展营养策略缓解肉鸡热应激反应的作用效果及其机理。
1 材料与方法 1.1 试验材料和试验设计试验用凝结芽孢杆菌制剂(总活菌数量1.12×1010 CFU/g,推荐添加量1.3 kg/t,菌株编号YNAU 5517)由云南农业大学提供[17]。
选择体重接近、健康的28日龄爱拔益加(AA)肉公鸡240只,随机分为3个组,每组8个重复,每个重复10只鸡。正常温度组(Ⅰ组)肉鸡饲养于(22±1) ℃正常温度环境,饲喂基础饲粮;热应激组(Ⅱ组)肉鸡全天饲养于(35±1) ℃的极端高温环境,饲喂基础饲粮;热应激+凝结芽孢杆菌组(Ⅲ组)肉鸡全天饲养于(35±1) ℃的极端高温环境,饲喂基础饲粮+1.3 kg/t凝结芽孢杆菌(制粒后凝结芽孢杆菌数量检测值为1.04×107 CFU/g)。
1.2 试验饲粮和饲养管理基础饲粮组成及营养水平参考我国《鸡饲养标准》(NY/T 33—2004)配制,见表 1,不添加饲用抗生素及化学合成抑菌药物,80 ℃制成颗粒料。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验在云南农业大学试验鸡场选用同栋2间雏鸡脱温室(长×宽×高=7.5 m×4.0 m×2.5 m),一间脱温室温度保持(22±1) ℃,饲养Ⅰ组肉鸡;另一间脱温室温度维持(35±1) ℃高温,饲养Ⅱ和Ⅲ组肉鸡,电控锅炉供暖控温。试验肉鸡3层笼养,单笼规格为长×宽×高=140 cm×70 cm×50 cm。试验期间自由采食,充足供水,24 h光照。试验期14 d。
1.3 生长性能与直肠温度测定42日龄时,在07:30以重复为单位测定肉鸡体重,统计采食量,计算平均日增重、平均日采食量、料重比。同时,每重复随机抽取1只鸡,用数显温度计(精确度0.01 ℃)从泄殖腔插入约3 cm处,测定直肠温度[18]。
1.4 血清指标测定 1.4.1 血清样品制备测定直肠温度后,该鸡用于采血。5 mL真空采血管翅下静脉采血2管(4~5 mL/管),3 000 r/min离心15 min制备血清。血清分成5份,每份不少于500 μL,分别用于血清指标测定。
1.4.2 血清皮质酮含量血清皮质酮含量采用酶联免疫吸附测定(ELISA)试剂盒的酶联免疫竞争法测定,在450 nm波长下检测[19]。试剂盒购自南京建成生物工程研究所。
1.4.3 血清生化指标血清总蛋白(TP)、白蛋白(ALB)、葡萄糖(GLU)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)含量采用全自动生化分析仪(型号DIRUICS-4008,长春迪瑞医疗科技股份有限公司)测定[20]。试剂盒均购自南京建成生物工程研究所。
1.4.4 血清部分酶活性血清肌酸激酶(CK)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、γ-谷氨酰转移酶(GGT)活性采用全自动生化分析仪(型号DIRUICS-4008,长春迪瑞医疗科技股份有限公司)测定[20]。试剂盒均购自南京建成生物工程研究所。
1.4.5 血清抗氧化指标血清丙二醛(MDA)含量采用硫比妥(TBA)法测定[21],血清总超氧化物歧化酶(T-SOD)活性采用亚硝酸盐显色法测定[21],血清谷胱甘肽过氧化物酶(GSH-Px)活性通过定量还原谷胱甘肽氧化为氧化谷胱甘肽的速率测定[21],血清过氧化氢酶(CAT)活性采用钼酸铵法测定[21]。试剂盒均购自南京建成生物工程研究所。
1.4.6 血清细胞因子含量血清白细胞介素-10(IL-10)、干扰素-γ(IFN-γ)含量采用ELISA检测试剂盒的酶免竞争法测定[22]。试剂盒购自美国MyBioSource公司。
1.5 统计分析试验数据使用SPSS 17.0统计软件进行单因素方差分析和Duncan氏法多重比较,结果用“平均值±标准差”表示,P < 0.05表示差异显著。
2 结果 2.1 凝结芽孢杆菌对热应激肉鸡血清皮质酮含量和直肠温度的影响由图 1可知,Ⅰ、Ⅱ和Ⅲ组的血清皮质酮含量分别为(813.98±89.00) pg/mL、(1 497.47±257.55) pg/mL、(1 281.95±180.37) pg/mL,Ⅱ和Ⅲ组的血清皮质酮含量显著高于Ⅰ组(P < 0.05),Ⅲ组显著低于Ⅱ组(P < 0.05)。Ⅰ、Ⅱ和Ⅲ组的直肠温度分别为40.90、42.46、42.41 ℃,Ⅱ和Ⅲ组的直肠温度显著高于Ⅰ组(P < 0.05),Ⅱ组和Ⅲ组之间与差异不显著(P>0.05)。
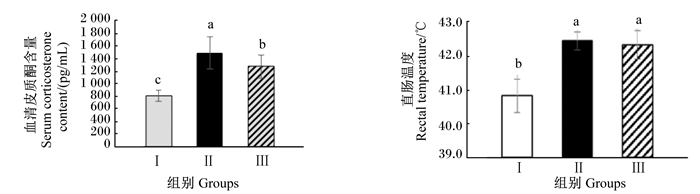
|
数据柱标相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下图同。 Value columns with the same small letter mean no significant difference (P > 0.05), while with different small letters mean significant difference (P < 0.05). The same as below. 图 1 凝结芽孢杆菌对热应激肉鸡血清皮质酮含量和直肠温度的影响 Fig. 1 Effects of Bacillus coagulans on serum corticosterone content and rectal temperature of broiler chickens under heat stress |
由表 2可知,Ⅱ和Ⅲ组的末重、平均日增重、平均日采食量显著低于Ⅰ组(P < 0.05),料重比显著高于Ⅰ组(P < 0.05)。与Ⅱ组相比,Ⅲ组的平均日增重显著增加(P < 0.05),料重比显著降低(P < 0.05)。
|
|
表 2 凝结芽孢杆菌对热应激肉鸡生长性能的影响 Table 2 Effects of Bacillus coagulans on growth performance of broiler chickens under heat stress |
由表 3可知,Ⅱ和Ⅲ组的血清TP、ALB、HDL-C含量显著低于Ⅰ组(P < 0.05),血清尿酸和LDL-C含量显著高于Ⅰ组(P < 0.05)。与Ⅱ组相比,Ⅲ组的血清尿酸、甘油三脂、低密度脂蛋胆固醇含量显著降低(P < 0.05)。各组之间的血清GLU和TC含量差异不显著(P>0.05)。
|
|
表 3 凝结芽孢杆菌对热应激肉鸡血清生化指标的影响 Table 3 Effects of Bacillus coagulans on serum biochemical indices of broiler chickens under heat stress |
由表 4可知,Ⅱ组的血清CK、ALT、AST、GGT活性显著高于Ⅰ组(P < 0.05)。Ⅲ组的血清CK、ALT、AST、GGT活性显著低于Ⅱ组(P < 0.05)。
|
|
表 4 凝结芽孢杆菌对热应激肉鸡血清部分酶活性影响 Table 4 Effects of Bacillus coagulans on serum some enzyme activities of broiler chickens under heat stress |
由表 5可知,Ⅱ和Ⅲ组的血清GSH-Px和CAT活性显著低于Ⅰ组(P < 0.05),Ⅱ组的血清MDA含量显著高于Ⅰ组(P < 0.05),Ⅱ组的血清T-SOD活性显著低于Ⅰ组(P < 0.05)。与Ⅱ组相比,Ⅲ组的血清MDA含量显著降低(P < 0.05),血清CAT活性显著升高(P < 0.05)。
|
|
表 5 凝结芽孢杆菌对热应激肉鸡血清抗氧化指标的影响 Table 5 Effects of Bacillus coagulans on serum antioxidant indices of broiler chickens under heat stress |
由图 2可知,Ⅱ和Ⅲ组的血清IFN-γ含量显著高于Ⅰ组(P < 0.05),血清IL-10含量显著低于Ⅰ组(P < 0.05)。与Ⅱ组相比,Ⅲ组的血清TNF-α含量显著降低(P < 0.05),血清IL-10含量显著提高(P < 0.05)。
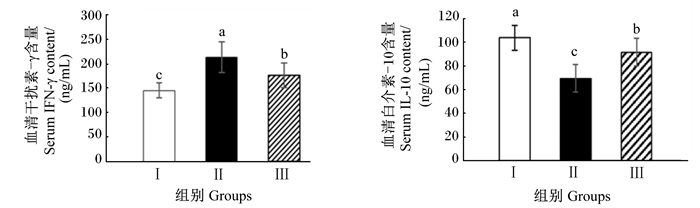
|
图 2 凝结芽孢杆菌对热应激肉鸡血清细胞因子含量的影响 Fig. 2 Effects of Bacillus coagulans on serum cytokine contents of broiler chickens under heat stress |
血清皮质酮是肾上腺分泌的糖皮质激素,是反映肉鸡热应激最直接、最重要的指标之一[2, 7, 23]。本试验结果表明,与正常温度饲养的Ⅰ组相比,35 ℃极度高温环境饲养的Ⅱ和Ⅲ组肉鸡血清皮质酮含量显著升高,这与前人的试验报道结果[24-26]一致。大量试验与综述表明,血清皮质酮含量越高,肉鸡热应激越严重,对生长性能有显著的负面影响[2, 23, 25, 27]。
本试验发现,饲用益生菌凝结芽孢杆菌能够显著降低35 ℃极度高温环境下肉鸡的血清皮质酮含量,与Ⅱ组相比,饲粮添加凝结芽孢杆菌的Ⅲ组血清皮质酮含量下降了约14.5%。目前,有关饲用益生菌对热应激肉鸡血清皮质酮含量影响的试验报道较少。Sohail等[24, 28]报道,饲粮添加复合乳酸菌能够显著降低热应激肉鸡血清皮质酮含量。Haldar等[29]研究显示,饲用酵母菌能够显著降低热应激肉鸡血清皮质酮含量。以上仅有的3篇报道与本试验结果一致,提示饲粮添加凝结芽孢杆菌降低了热应激条件下肉鸡的血清皮质酮含量,这对缓解肉鸡热应激生理反应以及通过饲料途径改善热应激肉鸡的生长性能可能具有积极意义。
直肠温度表征了肉鸡体温,是机体产热和散热的平衡结果[30]。热应激往往显著升高肉鸡直肠温度,因此直肠温度可以作为肉鸡热应激的评价指标[4, 30]。本试验结果显示,与Ⅰ组相比,35 ℃极度高温环境下Ⅱ和Ⅲ组肉鸡的直肠温度显著升高,这与前人的试验报道结果[31-34]基本一致。此外,Ⅱ组与Ⅲ组之间的直肠温度差异不显著,表明凝结芽孢杆菌没能影响极度高温环境下热应激肉鸡的直肠温度。Al-Fataftah等[18]试验报道显示,在35 ℃极度高温热应激模型下,枯草芽孢杆菌不能降低热应激肉鸡的直肠温度,与本试验结果一致。然而,Aluwong等[11]试验表明,在32 ℃高温热应激模型下,与不添加酵母菌的对照组相比,饲喂酵母菌的热应激肉鸡直肠温度降低了0.85 ℃。以上直肠温度结果差异的主要原因可能包括:其一,本试验与Al-Fataftah等[18]均采用了35 ℃极度高温热应激模型,而Aluwong等[11]试验的32 ℃高温热应激模型温度相对较低。肉鸡皮肤汗腺不发达,高温环境下排热效率低,养殖环境温度越高,机体热平衡越易失衡,因此过高的环境温度可能影响了益生菌降低直肠温度的作用效果。其二,3个试验所用益生菌的菌株均不同,这一明显的试验条件差异提示不同益生菌的菌株特性与益生功能存在差异,可能对热应激肉鸡排热的作用机理与作用效果也不同,从而影响直肠温度的测定结果。
3.2 凝结芽孢杆菌对热应激肉鸡生长性能的影响本试验结果显示,与Ⅰ组相比,Ⅱ和Ⅲ组的平均日采食量、平均日增重显著下降,且料重比显著升高。大量的试验与综述报道表明,热应激显著降低了肉鸡生长性能,表现在采食量、增重、饲料转化效率显著下降[4-5, 7, 9-10, 18]。进一步分析发现,与Ⅱ组相比,Ⅲ组的平均日增重显著增加了11.0%,且料重比显著降低。过去已有其他单一或复合益生菌改善热应激肉鸡生长性能的报道[9-10, 18, 24],因此结合本试验血清皮质酮含量的结果,表明饲粮添加凝结芽孢杆菌能够一定程度缓解肉鸡热应激生理反应,有利于改善热应激肉鸡的生长性能。尽管这一效果未能使热应激肉鸡恢复至正常养殖温度的生长性能,但考虑到全球养禽业大量无法改善养殖设施设备的中小企业及养殖户的实际需求,饲粮添加凝结芽孢杆菌缓解肉鸡热应激的营养策略与措施,更具普遍性和推广价值。
3.3 凝结芽孢杆菌对热应激肉鸡血清生化指标的影响血清TP、ALB和UA含量反映了肉鸡对饲料蛋白质的摄入与代谢利用状况,且血清TP和ALB含量与肉鸡的生长性能呈正比,血清UA含量与肉鸡的生长性能呈反比[4, 27, 35]。本试验结果显示,与Ⅰ组相比,Ⅱ和Ⅲ组的血清TP和ALB含量显著下降,血清UA含量显著上升,这些结果与前人报道结果[21, 36]一致。进一步分析发现,Ⅱ组与Ⅲ组之间血清TP含量无显著差异,而Ⅲ组血清UA含量显著低于Ⅱ组。这一结果提示,热应激条件下饲粮添加凝结芽孢杆菌虽未增加热应激肉鸡蛋白质摄入量,却明显提高了肉鸡对饲粮蛋白质的代谢利用率,这可能是凝结芽孢杆菌改善热应激肉鸡料重比的重要原因之一。Attia等[13]研究热应激肉鸡的饲粮表观代谢率结果显示,复合益生菌显著增加了热应激肉鸡对饲粮蛋白质的代谢利用率,进而改善了饲料转化效率。
极度高温干扰肉鸡机体脂质代谢的作用十分突出,本试验中,Ⅱ组血清TG和LDL-C含量显著高于Ⅰ组,这易造成热应激肉鸡肝脏组织脂质的过度沉积和过氧化损伤,不利于肝脏正常的营养代谢,进而影响生长性能[1, 4, 36]。由此可见,与Ⅱ组相比,Ⅲ组血清TG和LDL-C含量显著下降的作用效果,也与饲用凝结芽孢杆菌改善热应激肉鸡生长性能的结果相符。
3.4 凝结芽孢杆菌对热应激肉鸡血清部分酶活性的影响血液中检测到的CK主要来源于动物肌肉、胃肠道、脑等组织细胞的分泌,CK主要在细胞的细胞质和线粒体中发挥调控细胞能量运转与利用的重要功能[37]。血清CK活性上升,标志着高温环境下肉鸡增强了散热作用,已尽快降低及恢复体温,因此血清CK是反映肉鸡热应激的常用指标之一[21, 37]。本试验结果显示,与Ⅰ组相比,Ⅱ组血清CK活性显著升高,这与热应激肉鸡直肠温度显著升高的结果相符,也与前人的报道结果[21]一致。与Ⅱ组相比,Ⅲ组血清CK活性显著降低了20.4%,这与血清皮质酮含量的结果共同证明,凝结芽孢杆菌有效地降低了肉鸡热应激反应。
ALT、AST是机体所有细胞中蛋白质、氨基酸代谢的关键酶,尤其在肝脏、心脏组织细胞中含量丰富[38]。正常生理与营养代谢条件下血清ALT、AST活性不高,一旦应激原、抗原及自由基等造成了肝脏等组织细胞的破损或凋亡,则ALT、AST大量释放进入血液,因此血清ALT和AST活性是表征肝脏损伤的重要指标[1, 4, 38]。此外,血清中GGT是催化γ-谷氨酰基转换的代谢酶,主要来源于动物的肝脏、肾脏和胰脏,也有研究将GGT作为肝细胞损伤的指标之一[21, 39]。本试验结果显示,与Ⅰ组相比,Ⅱ组的血清ALT、AST、GGT活性显著升高。Sahin等[39]和Luo等[21]研究显示,热应激对肉鸡肝脏有一定程度损伤,检测到血清ALT、AST、GGT活性显著升高,这与本试验结果一致。本试验结果显示,与Ⅱ组相比,Ⅲ组血清ALT、AST、GGT活性分别显著降低了13.7%、13.2%、8.6%。目前,饲用益生菌对热应激肉鸡血清ALT、AST、GGT活性及肝脏损伤影响的试验报道十分罕见。Attia等[13]研究显示,在36 ℃极度高温条件下,与不添加复合益生菌的对照组相比,饲喂复合益生菌的热应激肉鸡血清AST活性显著降低了11.0%,这与本试验结果十分接近。以上结果说明,饲粮添加凝结芽孢杆菌一定程度上减轻了热应激肉鸡肝脏的损伤,这可能是改善热应激肉鸡营养代谢和生长性能的重要原因之一。
3.5 凝结芽孢杆菌对热应激肉鸡血清抗氧化指标的影响正常生理条件下,机体氧化(自由基、MDA的产生)与主要抗氧化酶系统,包括超氧化物歧化酶(SOD)、GSH-Px、CAT等,处于动态平衡状态[3, 40]。MDA是机体各个组织细胞膜脂质过氧化最重要的终产物之一,干扰细胞膜的流动性和通透性[4, 40]。血清MDA含量过高,反映了脂质过氧化自由基对组织细胞的损伤,因此检测血清MDA含量是评价机体氧化应激的重要指标之一[3-4, 40]。相反,SOD、GSH-Px、CAT构成的抗氧化系统,通过清除自由基、干扰脂质过氧化反应等过程,缓解细胞膜的氧化损伤,是反映机体抗氧化能力的重要指标[3-4, 40]。本试验结果显示,与Ⅰ组相比,Ⅱ和Ⅲ组的血清MDA含量显著升高,且血清GSH-Px和CAT活性显著降低。这一结果与前人研究结果[1, 21, 37]一致,表明热应激逐步消耗了肉鸡的抗氧化能力,氧化应激的作用及损伤增强,不利于机体的正常代谢,这是热应激肉鸡生长性能下降的重要原因之一[2-3, 40]。
有关饲用益生菌对肉鸡氧化损伤作用与机理的试验报道十分罕见。Ogbuagu等[14]研究报道了在36 ℃极度高温条件下,与不添加酵母菌的对照组相比,饲喂饲用酵母菌显著降低了热应激肉鸡血清MDA含量,显著提高了血清SOD活性。本试验发现,与Ⅱ组相比,饲粮添加凝结芽孢杆菌的Ⅲ组血清MDA含量显著降低,血清CAT活性显著提高,血清T-SOD活性有增加的趋势。本试验结果与Ogbuagu等[14]的报道基本一致。以上结果表明,饲用益生菌凝结芽孢杆菌具有缓解热应激肉鸡氧化损伤的作用,然而具体的抗氧化靶器官及作用机理有待于深入研究。
3.6 凝结芽孢杆菌对热应激肉鸡血清细胞因子含量的影响IL-10是目前公认的机体主要抗炎细胞因子,而IFN-γ是主要的促炎细胞因子之一,已有报道表明这2个细胞因子在热应激导致的肉鸡炎症反应中发挥重要的调控作用[2, 8-9]。本试验结果显示,与Ⅰ组相比,Ⅱ和Ⅲ组的血清IFN-γ含量显著升高,血清IL-10含量显著降低。李秋粉[41]报道,与常温组肉鸡相比,35 ℃高温热应激的肉鸡血清中抗炎细胞因子IL-10含量显著降低,且促炎细胞因子TNF-α、白细胞介素-6(IL-6)含量显著升高。Alhenaky等[42]同样发现,35 ℃极度高温显著增加了肉鸡血清中其他2个促炎细胞因子肿瘤坏死因子-α(TNF-α)、白细胞介素-2(IL-2)的含量。本试验结果与上述报道共同证明,热应激诱导了肉鸡机体的炎症反应,这是热应激导致肉鸡生长性能下降的重要原因。本试验结果显示,与Ⅱ组相比,Ⅲ组的血清IFN-γ含量显著降低了17.2%,血清IL-10含量显著增加了32.0%。李秋粉[41]报道,与不添加益生菌的热应激肉鸡相比,饲喂复合益生菌的热应激肉鸡血清抗炎细胞因子IL-10含量显著增加,且促炎细胞因子TNF-α、IL-6含量显著下降,这与本试验结果基本一致。由此可见,饲喂益生菌凝结芽孢杆菌可以通过调节和恢复机体内促炎与抗炎细胞因子的平衡,缓解热应激肉鸡的炎症反应,改善肉鸡生长性能,减少热应激条件下的肉鸡养殖损失。然而,凝结芽孢杆菌调控细胞因子的具体靶器官及作用机理尚不清晰,值得进一步研究。
4 结论本试验条件下,热应激导致肉鸡血清皮质酮含量、直肠温度显著上升,热应激反应明显,导致了肉鸡营养代谢紊乱、生长抑制。饲粮添加凝结芽孢杆菌通过减轻机体氧化损伤和炎症反应,一定程度上改善了热应激肉鸡的生长性能。
致谢:
感谢云南农业大学动物科学技术学院葛长荣教授对文稿所提的宝贵意见。
| [1] |
WAN X L, JIANG L Y, ZHONG H R, et al. Effects of enzymatically treated Artemisia annua L. on growth performance and some blood parameters of broilers exposed to heat stress[J]. Animal Science Journal, 2017, 88(8): 1239-1246. |
| [2] |
NAWAB A, IBTISHAM F, LI G H, et al. Heat stress in poultry production:mitigation strategies to overcome the future challenges facing the global poultry industry[J]. Journal of Thermal Biology, 2018, 78: 131-139. |
| [3] |
HU R Z, HE Y J, AROWOLO M, et al. Polyphenols as potential attenuators of heat stress in poultry production[J]. Antioxidants, 2019, 8(3): 67. |
| [4] |
FARAG M R, ALAGAWANY M. Physiological alterations of poultry to the high environmental temperature[J]. Journal of Thermal Biology, 2018, 76: 101-106. |
| [5] |
葛长荣, 程志斌. 饲用微生态制剂对热应激肉鸡生产性能影响的研究进展[J]. 饲料工业, 2019, 40(3): 1-9. |
| [6] |
PAWAR S S, BASAVARAJ S, DHANSING L V, et al. Assessing and mitigating the impact of heat stress in poultry[J]. Advances in Animal and Veterinary Sciences, 2016, 4(6): 332-341. |
| [7] |
SUGIHARTO S, YUDIARTI T, ISROLI I, et al. Dietary supplementation of probiotics in poultry exposed to heat stress—a review[J]. Annals of Animal Science, 2017, 17(3): 591-604. DOI:10.1515/aoas-2016-0062 |
| [8] |
SONG Z H, CHENG K, ZHANG L L, et al. Dietary supplementation of enzymatically treated Artemisia annua could alleviate the intestinal inflammatory response in heat-stressed broilers[J]. Journal of Thermal Biology, 2017, 69: 184-190. |
| [9] |
WANG W C, YAN F F, HU J Y, et al. Supplementation of Bacillus subtilis-based probiotic reduces heat stress-related behaviors and inflammatory response in broiler chickens[J]. Journal of Animal Science, 2018, 96(5): 1654-1666. |
| [10] |
FASELEH JAHROMI M, WESAM ALTAHER Y, SHOKRYAZDAN P, et al. Dietary supplementation of a mixture of Lactobacillus strains enhances performance of broiler chickens raised under heat stress conditions[J]. International Journal of Biometeorology, 2016, 60(7): 1099-1110. |
| [11] |
ALUWONG T, SUMANU V O, AYO J O, et al. Daily rhythms of cloacal temperature in broiler chickens of different age groups administered with zinc gluconate and probiotic during the hot-dry season[J]. Physiological Reports, 2017, 5(12): e13314. DOI:10.14814/phy2.13314 |
| [12] |
SONG J, XIAO K, KE Y L, et al. Effect of a probiotic mixture on intestinal microflora, morphology, and barrier integrity of broilers subjected to heat stress[J]. Poultry Science, 2014, 93(3): 581-589. |
| [13] |
ATTIA Y A, AL-HARTHI M A, EL-SHAFEY A S, et al. Enhancing tolerance of broiler chickens to heat stress by supplementation with vitamin E, vitamin C and/or probiotics[J]. Annals of Animal Science, 2017, 17(4): 1155-1169. |
| [14] |
OGBUAGU N E, ALUWONG T, AYO J O, et al. Effect of fisetin and probiotic supplementation on erythrocyte osmotic fragility, malondialdehyde concentration and superoxide dismutase activity in broiler chickens exposed to heat stress[J]. Journal of Veterinary Medical Science, 2018, 80(12): 1895-1900. |
| [15] |
BERNARDEAU M, LEHTINEN M J, FORSSTEN S D, et al. Importance of the gastrointestinal life cycle of Bacillus for probiotic functionality[J]. Journal of Food Science and Technology, 2017, 54(8): 2570-2584. |
| [16] |
夏涛, 白华毅, 王乙茹, 等. 饲用凝结芽孢杆菌在肉鸡生产中的应用研究进展[J]. 黑龙江畜牧兽医, 2018(23): 35-38. |
| [17] |
王乙茹, 柳成东, 白华毅, 等. 一株凝结芽孢杆菌YNAU 5517对热应激肉鸡生长性能影响的初探[J]. 饲料工业, 2019, 40(5): 16-22. |
| [18] |
AL-FATAFTAH A R, ABDELQADER A. Effects of dietary Bacillus subtilis on heat-stressed broilers performance, intestinal morphology and microflora composition[J]. Animal Feed Science and Technology, 2014, 198: 279-285. |
| [19] |
杨梅梅.中药复方与益生素对热应激下肉鸡肠道菌群及生长的影响[D].硕士学位论文.广州: 华南农业大学, 2016.
|
| [20] |
GHAREEB K, AWAD W A, ZEBELI Q, et al. Deoxynivalenol in chicken feed alters the vaccinal immune response and clinical biochemical serum parameters but not the intestinal and carcass characteristics[J]. Journal of Animal Physiology and Animal Nutrition, 2016, 100(1): 53-60. |
| [21] |
LUO J X, SONG J, LIU L Z, et al. Effect of epigallocatechin gallate on growth performance and serum biochemical metabolites in heat-stressed broilers[J]. Poultry Science, 2018, 97(2): 599-606. |
| [22] |
MOHAMMED A A, JIANG S, JACOBS J A, et al. Effect of a synbiotic supplement on cecal microbial ecology, antioxidant status, and immune response of broiler chickens reared under heat stress[J]. Poultry Science, 2019, 98(10): 4408-4415. |
| [23] |
LARA L J, ROSTAGNO M H. Impact of heat stress on poultry production[J]. Animals, 2013, 3(2): 356-369. |
| [24] |
SOHAIL M U, HUME M E, BYRD J A, et al. Effect of supplementation of prebiotic mannan-oligosaccharides and probiotic mixture on growth performance of broilers subjected to chronic heat stress[J]. Poultry Science, 2012, 91(9): 2235-2240. |
| [25] |
KAMEL N N, AHMED A M H, MEHAISEN G M K, et al. Depression of leukocyte protein synthesis, immune function and growth performance induced by high environmental temperature in broiler chickens[J]. International Journal of Biometeorology, 2017, 61(9): 1637-1645. |
| [26] |
SHI D Y, BAI L, QU Q, et al. Impact of gut microbiota structure in heat-stressed broilers[J]. Poultry Science, 2019, 98(6): 2405-2413. |
| [27] |
HE S P, LI S, AROWOLO M A, et al. Effect of resveratrol on growth performance, rectal temperature and serum parameters of yellow-feather broilers under heat stress[J]. Animal Science Journal, 2019, 90(3): 401-411. |
| [28] |
SOHAIL M U, IJAZ A, YOUSAF M S, et al. Alleviation of cyclic heat stress in broilers by dietary supplementation of mannan-oligosaccharide and Lactobacillus-based probiotic:dynamics of cortisol, thyroid hormones, cholesterol, C-reactive protein, and humoral immunity[J]. Poultry Science, 2010, 89(9): 1934-1938. DOI:10.3382/ps.2010-00751 |
| [29] |
HALDAR S, GHOSH T K, TOSHIWATI, et al. Effects of yeast (Saccharomyces cerevisiae) and yeast protein concentrate on production performance of broiler chickens exposed to heat stress and challenged with Salmonella enteritidis[J]. Animal Feed Science and Technology, 2011, 168(1/2): 61-71. |
| [30] |
CHEN X Y, WEI P P, XU S Y, et al. Rectal temperature as an indicator for heat tolerance in chickens[J]. Animal Science Journal, 2013, 84(11): 737-739. |
| [31] |
VAN GOOR A, ASHWELL C M, PERSIA M E, et al. Unique genetic responses revealed in RNA-seq of the spleen of chickens stimulated with lipopolysaccharide and short-term heat[J]. PLoS One, 2017, 12(2): e0171414. |
| [32] |
SELVAM R, SURESH S, SARAVANAKUMAR M, et al. Alleviation of heat stress by a polyherbal formulation, PhytoceeTM:impact on zootechnical parameters, cloacal temperature, and stress markers[J]. Pharmacognosy Research, 2018, 10(1): 1-8. DOI:10.4103/pr.pr_138_17 |
| [33] |
AL-ZGHOUL M B, ALLIFTAWI A R S, SALEH K M M, et al. Expression of digestive enzyme and intestinal transporter genes during chronic heat stress in the thermally manipulated broiler chicken[J]. Poultry Science, 2019, 98(9): 4113-4122. DOI:10.3382/ps/pez249 |
| [34] |
INOUE H, SHIMAMOTO S, TAKAHASHI H, et al. Effects of astaxanthin-rich dried cell powder from Paracoccus carotinifaciens on carotenoid composition and lipid peroxidation in skeletal muscle of broiler chickens under thermo-neutral or realistic high temperature conditions[J]. Animal Science Journal, 2019, 90(2): 229-236. |
| [35] |
ZANGENEH S, TORKI M, LOTFOLLAHIAN H, et al. Effects of dietary supplemental lysophospholipids and vitamin C on performance, antioxidant enzymes, lipid peroxidation, thyroid hormones and serum metabolites of broiler chickens reared under thermoneutral and high ambient temperature[J]. Journal of Animal Physiology and Animal Nutrition, 2018, 102(6): 1521-1532. |
| [36] |
EL-DEEP M H, DAWOOD M A O, ASSAR M H, et al. Dietary Moringa oleifera improves growth performance, oxidative status, and immune related gene expression in broilers under normal and high temperature conditions[J]. Journal of Thermal Biology, 2019, 82: 157-163. DOI:10.1016/j.jtherbio.2019.04.016 |
| [37] |
TANG S, YIN B, XU J, et al. Rosemary reduces heat stress by inducing CRYAB and HSP70 expression in broiler chickens[J]. Oxidative Medicine and Cellular Longevity, 2018, 2018: 7014126. DOI:10.1155/2018/7014126 |
| [38] |
NYBLOM H, BERGGREN U, BALLDIN J, Et al. High AST/ALT ratio may indicate advanced alcoholic liver disease rather than heavy drinking[J]. Alcohol and Alcoholism, 2004, 39(4): 336-339. |
| [39] |
SAHIN N, HAYIRLI A, ORHAN C, et al. Effects of the supplemental chromium form on performance and oxidative stress in broilers exposed to heat stress[J]. Poultry Science, 2017, 96(12): 4317-4324. |
| [40] |
AKBARIAN A, MICHIELS J, DEGROOTE J, et al. Association between heat stress and oxidative stress in poultry; mitochondrial dysfunction and dietary interventions with phytochemicals[J]. Journal of Animal Science and Biotechnology, 2016, 7: 37. |
| [41] |
李秋粉.益生菌对热应激肉鸡肠道屏障功能的影响[D].硕士学位论文.南昌: 江西农业大学, 2017.
|
| [42] |
ALHENAKY A, ABDELQADER A, ABUAJAMIEH M, et al. The effect of heat stress on intestinal integrity and Salmonella invasion in broiler birds[J]. Journal of Thermal Biology, 2017, 70: 9-14. |




