2. 南阳市宛城区动物卫生监督所, 南阳 473000
2. Nanyang Wancheng District Animal Health Supervision, Nanyang 473000, China
蛋鸡产蛋率高,但生长速度慢;乌鸡是一种中国传统医用鸡,具有皮肤黑、生长缓慢等特点;肉鸡具有生长速度快、产蛋率低等特点。不同品种鸡生长速度的巨大差异可能与其不同的葡萄糖和食欲代谢机制有关。了解注射胰岛素对不同品种鸡血糖浓度和采食情况的影响,可为深入研究家禽血糖和采食调控机制提供理论基础,对促进家禽食欲和畜牧业发展有重要意义。与哺乳动物相比,家禽的空腹血糖浓度较高,约为哺乳动物的2倍[1-2],鸡被认为是胰岛素抵抗性动物[3]。胰岛素抵抗是指正常浓度的胰岛素生理效应低于正常生物反应,主要表现为胰岛素作用的靶组织对胰岛素作用的敏感性及反应性降低[4]。据报道,全球糖尿病患者人数已超过4亿,其中以胰岛素抵抗并伴有胰岛素分泌不足为特征的Ⅱ型糖尿病患者约占90%[5-7]。随着人们对糖尿病的关注,鸡也被认为是研究人类糖尿病的良好模型[8]。
胰岛素由胰岛β细胞分泌[9],是体内唯一能降低血糖浓度的蛋白质激素[10]。胰岛素的主要生理作用包括促进细胞对葡萄糖的摄取和吸收及促进脂肪和蛋白质的合成[11]。胰岛素对食欲调控和葡萄糖代谢有重要作用,但胰岛素对禽类食欲的调控作用一直存有争议。研究表明,给鸡脑室注射胰岛素能够抑制其采食量,并影响食欲相关基因的表达[12-13]。Smith等[14]研究指出,给鸡外周腹腔注射胰岛素能够抑制其采食量,肌肉注射鱼精蛋白锌胰岛素也能够降低其采食量[15],静脉注射免疫中和胰岛素能够降低其采食量却未改变涉及采食和代谢的下丘脑转录物[16]。Shanawany等[17]研究指出,给肉仔鸡长期皮下注射胰岛素能够提高其采食量。但Liu等[18]研究认为,注射胰岛素并没有影响肉鸡的食欲。
尽管一些研究已经揭示鸡的高血糖浓度和相对的胰岛素耐受性,但胰岛素调控禽类葡萄糖动态平衡的作用及其对不同品种鸡血糖浓度和食欲的影响仍不清楚。鸡的食欲和血糖的调控是一个高度复杂的过程。本试验旨在探究注射胰岛素对不同品种鸡血糖浓度和采食情况的影响,揭示胰岛素对不同品种鸡血糖和采食的调控特点,为进一步探究家禽血糖和食欲调控机制提供理论依据。
1 材料与方法 1.1 试验动物试验于河南农业大学动物试验房进行,选取1日龄海兰蛋鸡(简称蛋鸡)、丝毛乌骨鸡(简称乌鸡)和爱拔益加(AA)肉鸡(简称肉鸡)雄性雏鸡各200只,每个品种鸡各分为5个重复,每个重复40只鸡,随机分配在3层笼养架进行单笼饲养,每个笼子10只鸡,用来统计不同品种鸡不同日龄的体重和采食量。各品种鸡自由采食、自由饮水,光照时间为23 h/d,第1周控制鸡舍温度为33~35 ℃,以后每周温度递减2~3 ℃,每周带鸡消毒2次,按照鸡的常规免疫程序进行免疫。记录鸡只每天的采食量,于1、7、14、21和44日龄时称量鸡只的体重,并做好日常记录工作(各品种鸡只的采食情况、精神状态等)。试验期44 d。饲粮配制参照《鸡饲养标准》(NY/T 33—2004),基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验1:随机选取上述相同体重的21日龄蛋鸡、乌鸡和肉鸡各120只,各品种鸡试验组(n=84)注射5 IU/kg胰岛素(该剂量是根据本课题组前期摸索,大剂量的胰岛素在鸡上是耐受的,能有效引起血糖浓度的变化),对照组(n=36)注射相同剂量的磷酸盐缓冲液(PBS);各品种鸡根据注射后是否喂食随机各分为4组:胰岛素禁食组(n=60,其中12只鸡用来测定血糖浓度的动态变化,其余48只鸡在胰岛素注射后0、15、120和240 min时,每个时间点各屠宰12只鸡,收集颈静脉血液10 mL,用来测定血清胰岛素浓度)、PBS禁食组(n=12)、胰岛素喂食组(n=24)、PBS喂食组(n=24)。试验前所有鸡只禁食16 h,禁食各组在注射后继续保持禁食,喂食各组在注射后立即恢复自由采食(1/2用于测定血糖浓度的动态变化,1/2用于统计采食情况)。试验期间所有鸡只保持自由饮水。在探究喂食状态下胰岛素对不同品种鸡血糖浓度和采食情况的影响时,所用鸡只为不同的鸡,避免测定血糖浓度对鸡造成应激进而影响其采食量。
试验2:选取体况相近的44日龄蛋鸡、乌鸡和肉鸡各48只,各品种鸡试验组(胰岛素组,n=24)注射2.3 IU/kg胰岛素(该剂量是参照本课题组前期摸索和Sumners等[19]探究大日龄鸡胰岛素敏感性所使用的剂量),对照组(PBS组,n=24)注射相同剂量的PBS;注射120 min后恢复自由饮食,试验前所有试验鸡禁食16 h,自由饮水,各组鸡1/2用于测定血糖浓度的动态变化,1/2用于统计采食情况,所用鸡只为不同的鸡,为了避免测定血糖浓度对鸡造成应激进而影响其采食量。试验2的目的是在试验1的基础上进一步探究胰岛素对注射后120~240 min试验鸡采食量的影响,试验2在注射后120 min恢复喂食,避免了前120 min的采食对后面120~240 min采食的影响,更直观的研究胰岛素对注射后120~240 min采食量的影响。
1.3 血糖浓度的测定分别于注射胰岛素后0、15、30、60、120和240 min时,用采血针采集试验鸡翅下血,用罗氏血糖仪(罗氏®Accu-Chek performa卓越精采型,美国罗氏公司)进行全血血糖浓度的实时检测。试验所用胰岛素为短效胰岛素,规格为3 mL= 300 IU,由诺和锐德(中国)制药有限公司生产,用PBS稀释(胰岛素: PBS=1 : 10)后使用。
1.4 采食量的测定用于统计采食情况的试验鸡,在注射胰岛素或PBS后分别放进1个笼子里后,试验1立刻恢复自由采食,试验前称量每只鸡所给饲粮重量,并于注射后30、60、120、180和240 min时依次称量每只鸡所剩饲粮重量,并记录每只鸡恢复采食的时间;试验2于注射后120 min时恢复自由采食,试验前称量每只鸡所给饲粮重量,并于恢复喂食后120 min时(即注射后240 min)称量每只鸡所剩饲粮重量,并记录每只鸡恢复采食的时间;通过计算得出各组鸡在不同时间点的累积采食量和不同时间段的采食量,以及不同时间段恢复采食的比率(恢复采食鸡只数/该组总鸡只数)。
1.5 血清胰岛素浓度的测定将采集的血样于室温(20~25 ℃)静置2~3 h,4 ℃下1 500~2 000 r/min离心10 min,收集血清保存于-20 ℃,用于血清胰岛素浓度的测定,采用胰岛素酶联免疫检测试剂盒(南京建成生物工程研究所)。
1.6 数据处理试验数据采用SPSS 21.0软件进行分析,不同品种鸡的体重、平均日采食量、注射胰岛素后同一时间点血糖浓度的比较及同一品种鸡注射后不同时间点血糖浓度的比较均采用单因素方差分析,当组间差异显著时,用Duncan氏法对各组平均值进行多重比较;同一品种鸡注射后同一时间点禁食组与喂食组(胰岛素禁食组与胰岛素喂食组或PBS禁食组与PBS喂食组)血糖浓度的比较及同一品种鸡胰岛素组与PBS组采食量的比较采用独立样本t检验;不同品种鸡血清胰岛素浓度采用双因素[不同品种(蛋鸡、乌鸡和肉鸡)和注射后不同时间(0、15、120和240 min)]方差分析和单因素(同一时间点不同品种或同一品种注射后不同时间点)方差分析,结合Duncan氏法进行组间多重比较;21日龄鸡注射后不同时间段内的血糖浓度变化与采食量之间的关系采用相关性分析。数据以平均值±标准误(mean±SD)表示,以P < 0.05作为差异显著性判断标准。结果运用Graphpad Prism 5软件制图。
2 结果与分析 2.1 不同品种鸡的体重和平均日采食量由表 2可知,肉鸡不同日龄时的体重均显著高于蛋鸡和乌鸡(P < 0.05);乌鸡1日龄时的体重显著低于蛋鸡(P < 0.05),但其余不同日龄时的体重均显著高于蛋鸡(P < 0.05)。肉鸡不同生长阶段的平均日采食量均显著高于蛋鸡和乌鸡(P < 0.05),乌鸡不同生长阶段的平均日采食量均显著高于蛋鸡(P < 0.05)。
|
|
表 2 不同品种鸡的体重和平均日采食量 Table 2 Body weight and average daily feed intake of different breed chickens |
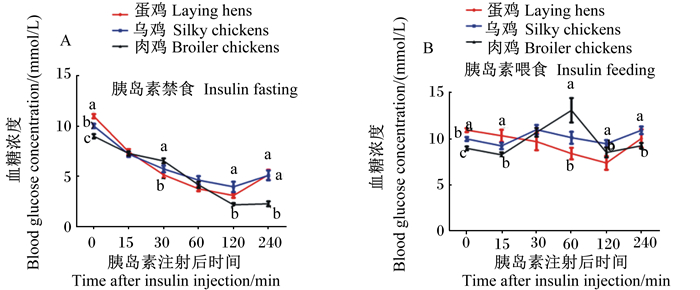
由图 1和图 2可知,21日龄蛋鸡的基础(0 min)血糖浓度显著高于肉鸡和乌鸡(P < 0.05),乌鸡的基础血糖浓度显著高于肉鸡(P < 0.05);21日龄不同品种鸡胰岛素禁食组中,注射胰岛素后蛋鸡、乌鸡和肉鸡的血糖浓度均显著降低(P < 0.05),且在注射后15 min时已经显著低于基础血糖浓度(P < 0.05);而不同品种鸡PBS禁食组中,不同时间点的血糖浓度均无显著差异(P>0.05)。在禁食状态下,注射胰岛素后21日龄肉鸡的血糖浓度下降幅度大于蛋鸡和乌鸡,且各品种鸡的血糖浓度均在注射后120 min时降到最低,在这个时间点肉鸡的血糖浓度最低且显著低于蛋鸡和乌鸡(P < 0.05);21日龄各品种鸡的血糖浓度均在注射120 min后开始回升,蛋鸡和乌鸡比肉鸡的血糖浓度回升速度快,注射后240 min时蛋鸡和乌鸡的血糖浓度均显著高于肉鸡(P < 0.05)。
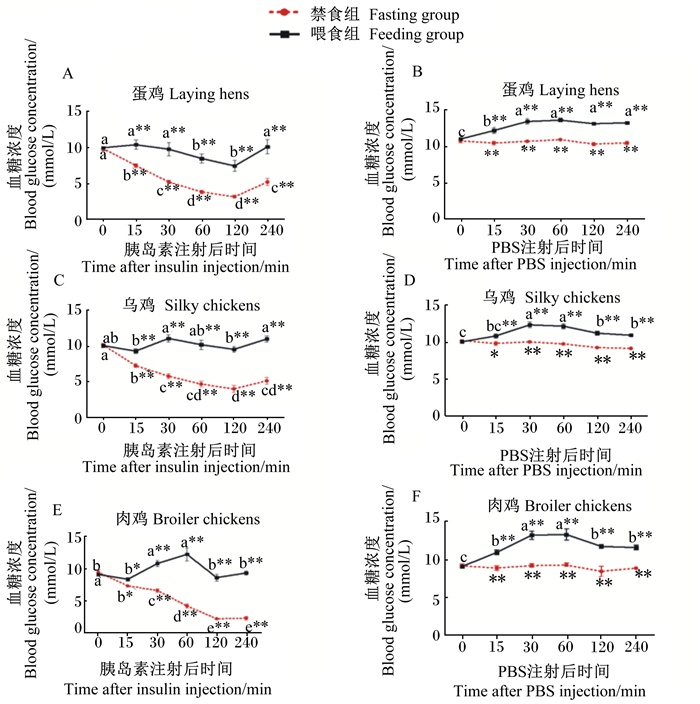
|
数据图同一品种同组不同时间点标注无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P < 0.05);同一品种同一时间点不同组标注*表示差异显著(P < 0.05),* *表示差异极显著(P < 0.01)。 In the same breed and different time points in the same group, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P < 0.05); in the same breed and different groups at the same time point, values with * mean significant difference (P < 0.05), while with * * mean extremely significant difference(P < 0.01). 图 1 注射胰岛素对21日龄不同品种鸡全血血糖浓度的影响 Fig. 1 Effects of insulin injection on whole blood glucose concentration of different breed chickens at 21 days of age |
|
数据图同一时间点不同品种标注无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P < 0.05)。 In different breeds at the same time point, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P < 0.05). 图 2 注射胰岛素后21日龄不同品种鸡全血血糖浓度变化比较 Fig. 2 Comparison of whole blood glucose concentration changes of different breed chickens at 21 days of age after insulin injection |
21日龄不同品种鸡喂食组中,注射PBS后血糖浓度从15 min时开始升高,30~60 min时达到峰值,并在整个试验期均显著高于基础血糖浓度(P < 0.05)。与基础血糖浓度相比,注射胰岛素后显著降低21日龄蛋鸡60和120 min时的血糖浓度(P < 0.05);乌鸡不同时间点的血糖浓度无显著差异(P>0.05);注射后30和60 min时肉鸡的血糖浓度显著高于基础血糖浓度(P < 0.05),分别为基础血糖浓度的1.19和1.34倍,注射后120 min时才恢复到基础血糖浓度。总体来说,在注射胰岛素后保持喂食状态下,21日龄肉鸡的血糖浓度仍呈现较大升幅,60 min时的血糖浓度显著高于蛋鸡(P < 0.05)。
21日龄不同品种鸡PBS喂食组的血糖浓度在注射后不同时间点均显著高于基础血糖浓度(P < 0.05),不同品种鸡胰岛素喂食组的血糖浓度在注射后不同时间点均显著高于胰岛素禁食组(P < 0.05),不同品种鸡胰岛素禁食组的血糖浓度下降幅度及速率都大于胰岛素喂食组。
2.3 注射胰岛素对21日龄不同品种鸡血清胰岛素浓度的影响由图 3可知,在胰岛素注射后禁食状态下,不同时间点肉鸡的血清胰岛素浓度均高于蛋鸡和乌鸡,且肉鸡的基础血清胰岛素浓度显著高于蛋鸡和乌鸡(P < 0.05),15和240 min时的血清胰岛素浓度显著高于蛋鸡(P < 0.05)。注射胰岛素后120 min时蛋鸡的血清胰岛素浓度显著高于15 min时(P < 0.05),注射后240 min时肉鸡的血清胰岛素浓度显著高于15 min时(P < 0.05),不同时间点乌鸡的血清胰岛素浓度均无显著差异(P>0.05)。
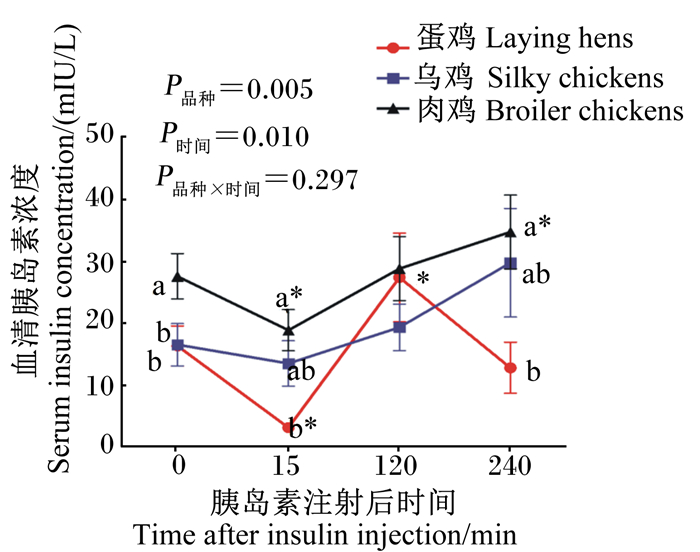
|
数据图同一时间点不同品种标注无字母或数标相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P < 0.05);同一品种不同时间点标注*表示差异显著(P < 0.05)。图 5同。 In different breeds at the same time point, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P < 0.05); at different time points in the same breed, values with * mean significant difference (P < 0.05). The same as Fig. 5. 图 3 注射胰岛素对21日龄不同品种鸡血清胰岛素浓度的影响 Fig. 3 Effects of insulin injection on serum insulin concentration of different breed chickens at 21 days of age |
由表 3可知,在注射胰岛素或PBS后立即恢复喂食,0~30 min时乌鸡和肉鸡全部恢复采食,蛋鸡的PBS组也全部恢复采食;而蛋鸡的胰岛素组在0~30 min时有66.7%恢复采食,30~240 min时有25%恢复采食,8.3%在注射240 min后尚未恢复采食。
|
|
表 3 注射胰岛素后不同时间段21日龄不同品种鸡恢复采食的比率 Table 3 Recovery feeding rate of different breed chickens at 21 days of age in different time periods after insulin injection |
由图 4可知,不同品种鸡不同时间点胰岛素组的累积采食量与PBS组相比均无显著差异(P>0.05),且累计采食量为肉鸡>乌鸡>蛋鸡。注射后120~240 min时蛋鸡(P=0.041)、乌鸡(P=0.022)和肉鸡(P=0.090)胰岛素组的采食量均低于PBS组,注射30~60 min后肉鸡胰岛素组的采食量显著高于PBS组(P < 0.05)。
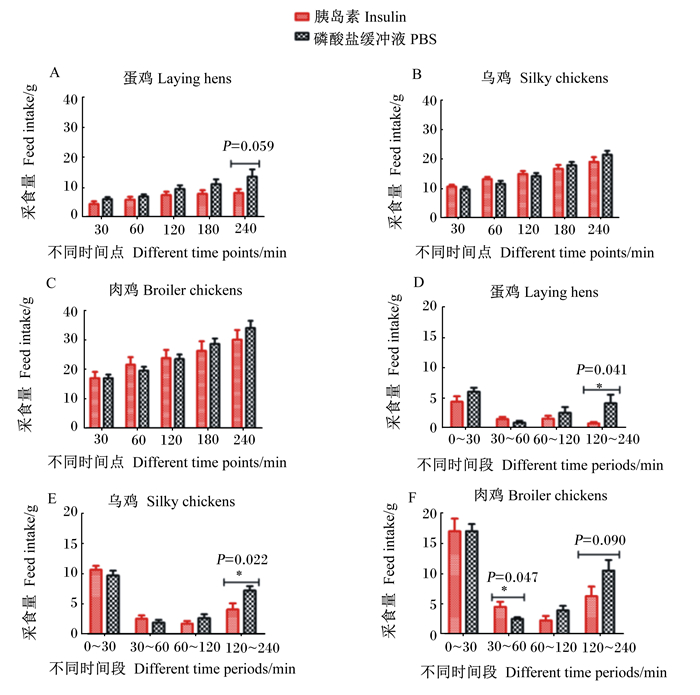
|
A、B和C为不同品种鸡不同时间点的累计采食量,D、E和F为不同品种鸡不同时间段的采食量。数据柱不同组别标注*表示差异显著(P < 0.05),* *表示差异极显著(P < 0.01)。图 6同。 A, B and C were cumulative feed intakes of different breed chickens at different time points, D, E and F were feed intakes of different breed chickens at different time periods. In different groups, values with *mean significant difference (P < 0.05), while with * *mean extremely significant difference (P < 0.01). The same as Fig. 6. 图 4 注射胰岛素后立即恢复喂食对21日龄不同品种鸡采食量的影响 Fig. 4 Effects of feeding immediately after insulin injection on feed intake of different breed chickens at 21 days of age |
由表 4可知,注射胰岛素后30~60 min时,21日龄鸡血糖浓度变化与采食量呈显著正相关(P=0.029),120~240 min时呈显著负相关(P=0.011)。
|
|
表 4 注射胰岛素后不同时间段21日龄鸡血糖浓度变化与采食量之间的相关性分析 Table 4 Correlation analysis between blood glucose concentration changes and feed intake of chickens at 21 days of age in different time periods after insulin injection |
由图 5可知,44日龄蛋鸡的基础血糖浓度显著高于乌鸡和肉鸡(P < 0.05);注射胰岛素后肉鸡的血糖浓度下降幅度大于蛋鸡和乌鸡,且各品种鸡的血糖浓度均在注射后120 min时降到最低,120 min时恢复喂食,蛋鸡和乌鸡与肉鸡相比血糖浓度回升速度较快,肉鸡血糖浓度回升速度缓慢,240 min时蛋鸡和乌鸡的血糖浓度均显著高于肉鸡(P < 0.05)。
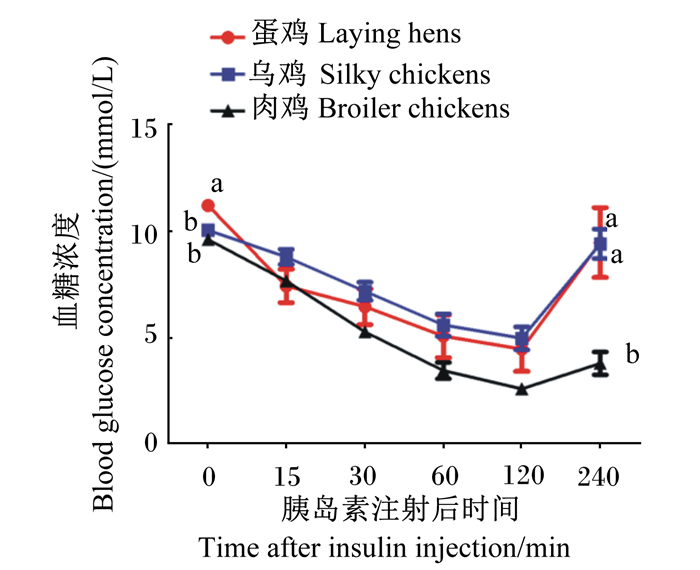
|
图 5 注射胰岛素对44日龄不同品种鸡全血血糖浓度的影响 Fig. 5 Effects of insulin injection on whole blood glucose concentration of different breed chickens at 44 days of age |
由表 5可知,在注射胰岛素或PBS 120 min后恢复喂食后,0~30 min时蛋鸡的PBS组全部恢复采食,乌鸡的PBS组有91.7%恢复采食,而肉鸡的PBS组仅58.4%恢复采食;恢复喂食120 min后,乌鸡的PBS组仍有8.3%未恢复采食,而肉鸡的PBS组有高达33.3%未恢复采食,蛋鸡的胰岛素组有66.7%未恢复采食,乌鸡的胰岛素组有58.4%未恢复采食,肉鸡的胰岛素组有66.8%未恢复采食。
|
|
表 5 注射胰岛素120 min后恢复喂食不同时间段44日龄不同品种鸡恢复采食的比率 Table 5 Recovery feeding rate of different breed chickens at 44 days of age in different time periods feeding after insulin injection 120 min |
由图 6可知,蛋鸡(P < 0.01)、乌鸡(P < 0.01)和肉鸡(P < 0.05)在注射胰岛素120 min后恢复采食120 min内的采食量均显著低于PBS组,蛋鸡胰岛素组的采食量为PBS组的31%,乌鸡胰岛素组的采食量为PBS组的11%,肉鸡胰岛素组的采食量为PBS组的17%。
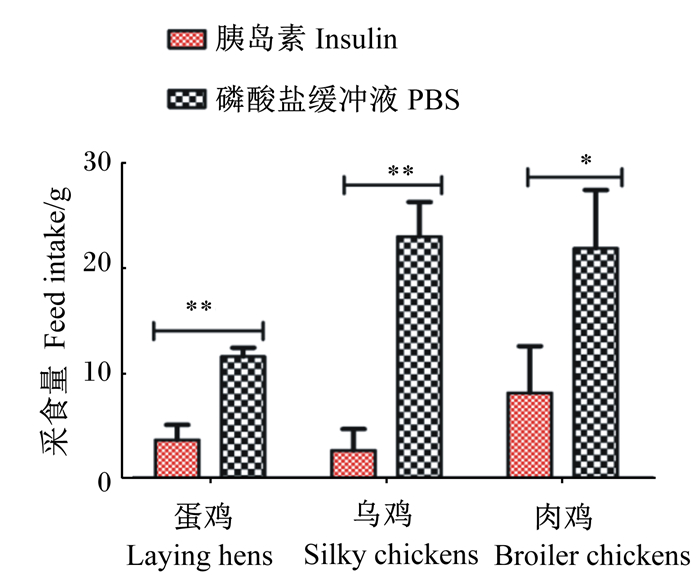
|
图 6 44日龄不同品种鸡注射胰岛素后120 min恢复喂食120 min内的采食量 Fig. 6 Feed intake of different breed chickens at 44 days of age within 120 min of resuming feeding after insulin injection 120 min |
在脊椎动物中,鸟类通常表现出较高的空腹血糖浓度[20],且鸡在生理状态下对胰岛素的降血糖有抵抗作用[21]。本试验结果显示,21日龄蛋鸡的基础血糖浓度(10.42 mmol/L)显著高于乌鸡(10.07 mmol/L)和肉鸡(9.13 mmol/L),且乌鸡的基础血糖浓度显著高于肉鸡,这与谢德彪等[22]蛋鸡血糖浓度高于AA肉鸡的试验结果相一致。
21日龄注射胰岛素后禁食和44日龄注射胰岛素120 min后恢复采食,蛋鸡、乌鸡和肉鸡均在注射后120 min时血糖浓度降到最低,且肉鸡血糖浓度的下降幅度大于蛋鸡和乌鸡,这与Rice等[23]的研究结果相似,即腹部注射胰岛素后大体重鸡的血糖浓度降低幅度比小体重鸡更大;蛋鸡和乌鸡注射120 min后血糖浓度回升速度要快于肉鸡,且注射后240 min时蛋鸡和乌鸡的血糖浓度有大幅度的回升,但肉鸡的血糖浓度与120 min时相比几乎没有变化,表明注射胰岛素后蛋鸡和乌鸡的血糖调控能力要强于肉鸡。Sumners等[19]研究也表明,小体重鸡的血糖调控能力要强于大体重鸡,以应对外源胰岛素的干扰。鸡的基础血糖浓度不同,其胰岛素敏感性也会不同[24]。禁食条件下注射胰岛素时,肉鸡对胰岛素的敏感性较强,血糖调节能力差,所以血糖浓度下降幅度较大且恢复较慢,而蛋鸡和乌鸡血糖调节能力较强,可通过分泌胰高血糖素使机体血糖浓度较快恢复到正常水平。本试验结果表明,21日龄肉鸡注射胰岛素后即刻喂食血糖浓度的稳定性也低于蛋鸡和乌鸡,肉鸡前期血糖浓度下降幅度和速度都大于蛋鸡和乌鸡,但注射120 min后血糖浓度回升能力差,说明肉鸡血糖回升调节能力差,这与肉鸡血清胰岛素浓度较高相一致。肥胖是人胰岛素抵抗和发展Ⅱ型糖尿病最危险的因素[25-26],糖尿病患者维持血糖稳态的能力较差,而肉鸡血糖调节能力差可能与其体重大有关。
3.2 注射胰岛素对不同日龄和品种鸡采食情况的影响研究表明,胰岛素与其相应受体结合,可以参与调控血糖稳态、葡萄糖中枢转运及营养物质代谢[27]。进入中枢的胰岛素可与下丘脑弓状核神经元上相应受体结合,激活胰岛素受体信号,抑制神经肽Y(NPY)或刺鼠相关蛋白(AgRP)神经元表达,促进前阿黑皮素原(POMC)神经元合成及分泌,抑制动物的采食[28]。胰岛素还能与瘦素共同作用,抑制下丘脑中腺苷一磷酸激活蛋白激酶的活性,增加细胞中乙酰辅酶A活性,降低家禽的采食量[29-30]。Smith等[14]研究指出,给肉鸡外周腹腔注射胰岛素能够抑制其采食量,静脉注射免疫中和胰岛素也可降低其采食量[16],肌肉注射鱼精蛋白锌胰岛素也能降低其采食量[15]。给蛋雏鸡和肉雏鸡脑室注射胰岛素,发现胰岛素对蛋雏鸡的食欲有显著的抑制作用,而对肉雏鸡食欲的抑制作用不显著[31],蛋鸡和肉鸡食欲神经肽的表达相似,但能量稳态和肥胖相关基因的表达不同[32]。本试验研究表明,注射胰岛素后立即恢复喂食对21日龄各品种鸡的累积采食量无显著影响,显著降低注射后120~240 min时蛋鸡和乌鸡的采食量,显著提高注射后30~60 min时肉鸡的采食量;注射胰岛素120 min后恢复喂食显著抑制44日龄各品种鸡注射后120 min内的累积采食量。
本研究发现,注射胰岛素后立即喂食,蛋鸡和乌鸡60 min时的血糖浓度均低于30 min时,但肉鸡60 min时的血糖浓度高于30 min时;肉鸡的胰岛素组在30~60 min时的采食量显著高于PBS组,说明肉鸡在注射胰岛素后30~60 min时采食量增多,导致血糖浓度升高,而蛋鸡和乌鸡没有这种现象,也说明肉鸡对胰岛素的响应规律与蛋鸡和乌鸡有很大差异,具体的调控机制需要进一步探究。
探究注射胰岛素120 min后恢复喂食对44日龄不同品种鸡采食情况的影响结果表明,肉鸡的胰岛素组和PBS组恢复喂食后120 min内恢复采食的比率都小于蛋鸡和乌鸡。此外,本试验中肉鸡的胰岛素组有3只鸡死亡,PBS组有1只鸡死亡,蛋鸡和乌鸡中均没有鸡只死亡。肉鸡低血糖死亡病症是肉鸡养殖过程中的常见病[33],这也说明肉鸡体重较大,与蛋鸡和乌鸡相比所受应激较大,注射胰岛素后血糖调节能力较差,血糖浓度恢复慢,所以低血糖浓度和抗应激能力差可能是造成肉鸡死亡的主要原因。
糖是机体重要的能量来源,是维持细胞能量代谢和生命活动的重要原料[34]。糖代谢水平反映了机体的能量代谢水平,并直接关系到畜禽生产过程中的饲料转化率及经济效益。目前,关于鸡的体内代谢研究正在逐步深化,理解禽类特别是鸡体内葡萄糖的平衡,可以促进畜牧业的健康发展。
4 结论① 在21日龄不同品种鸡禁食组中,注射胰岛素可显著降低各品种鸡的血糖浓度,且持续降低直到注射后120 min时,肉鸡的血糖浓度与蛋鸡和乌鸡相比下降幅度较大,但注射120 min后血糖浓度的恢复能力较蛋鸡和乌鸡差。
② 注射胰岛素显著降低21日龄蛋鸡喂食后60和120 min时的血糖浓度,维持乌鸡各时间点的血糖浓度,而肉鸡30和60 min时的血糖浓度仍显著高于基础血糖水平,显示胰岛素在维持肉鸡喂食后血糖浓度的稳定性上也低于蛋鸡和乌鸡。
③ 注射胰岛素后立即恢复喂食对21日龄各品种鸡的累积采食量无显著影响,显著降低蛋鸡和乌鸡120~240 min时的采食量,显著提高肉鸡30~60 min时的采食量;注射胰岛素120 min后恢复喂食显著降低44日龄各品种鸡120 min内的采食量。
| [1] |
BRAUN E J, SWEAZEA K L. Glucose regulation in birds[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2008, 151(1): 1-9. DOI:10.1016/j.cbpb.2008.05.007 |
| [2] |
SCANES C G, BRAUN E. Avian metabolism:its control and evolution[J]. Frontiers inBiology, 2013, 8(2): 134-159. |
| [3] |
AKIBA Y, CHIDA Y, TAKAHASHI T, et al. Persistent hypoglycemia induced by continuous insulin infusion in broiler chickens[J]. British Poultry Science, 1999, 40(5): 701-705. DOI:10.1080/00071669987124 |
| [4] |
SINAIKO A R, CAPRIO S. Insulin resistance[J]. Journal of Pediatrics, 2012, 161(1): 11-15. DOI:10.1016/j.jpeds.2012.01.012 |
| [5] |
YU J C, ZHANG Y Q, BOMBA H, et al. Stimuli-responsive delivery of therapeutics for diabetes treatment[J]. Bioengineering & Translational Medicine, 2016, 1(3): 323-337. |
| [6] |
REUSCH J E B, MANSON J A E. Management of Type 2 diabetes in 2017 getting to goal[J]. JAMA, 2017, 317(10): 1015-1016. DOI:10.1001/jama.2017.0241 |
| [7] |
VANDENBERG M A, WEBBER M J. Biologically inspired and chemically derived methods for glucose-responsive insulin therapy[J]. Advanced Healthcare Materials, 2019, 8(12): 1801466. DOI:10.1002/adhm.201801466 |
| [8] |
DATAR S P, BHONDE R R. Modeling chick to assess diabetes pathogenesis and treatment[J]. The Review of Diabetic Studies, 2011, 8(2): 245-253. DOI:10.1900/RDS.2011.8.245 |
| [9] |
HENQUIN J C. Regulation of insulin secretion:a matter of phase control and amplitude modulation[J]. Diabetologia, 2009, 52(5): 739-751. DOI:10.1007/s00125-009-1314-y |
| [10] |
ZHAO N, LIU CC, VAN INGELGOM A J, et al. Apolipoprotein E4 impairs neuronal insulin signaling by trapping insulin receptor in the endosomes[J]. Neuron, 2017, 96(1): 115-129. DOI:10.1016/j.neuron.2017.09.003 |
| [11] |
兰红. 胰岛素的生理作用[J]. 中学生物学, 2007, 23(11): 6. DOI:10.3969/j.issn.1003-7586.2007.11.003 |
| [12] |
HONDA K, KAMISOYAMA H, SANEYASU T, et al. Central administration of insulin suppresses food intake in chicks[J]. Neurosci Lett, 2007, 423(2): 153-157. DOI:10.1016/j.neulet.2007.07.004 |
| [13] |
SHIRAISHI J I, YANAGITA K, FUJITA M, et al. Central insulin suppresses feeding behavior via melanocortins in chicks[J]. Domest Anim Endocrinol, 2008, 34(3): 223-228. |
| [14] |
SMITH C J V, BRIGHT-TAYLOR B. Does a glucostatic mechanism for food intake control exist in chickens?[J]. Poultry Science, 1974, 53(5): 1720-1724. DOI:10.3382/ps.0531720 |
| [15] |
LEPKOVSKY S, LEN R, KOIKE T, et al. Effects of protamine zinc insulin on chickens[J]. American Journal of Physiology-Legacy Content, 1965, 208(3): 589-592. DOI:10.1152/ajplegacy.1965.208.3.589 |
| [16] |
PROSZKOWIEC-WEGLARZ M, DUPONT J, RIDEAU N, et al. Insulin immuno-neutralization decreases food intake in chickens without altering hypothalamic transcripts involved in food intake and metabolism[J]. Poultry Science, 2017, 96(12): 4409-4418. DOI:10.3382/ps/pex247 |
| [17] |
SHANAWANY M M, AL-KHAZRAJI A K, HAMED O, et al. Effect of protamine zinc insulin on feed intake and weight gain in broiler chicks[J]. Experimental Physiology, 1979, 64(4): 291-295. DOI:10.1113/expphysiol.1979.sp002483 |
| [18] |
LIU L, XU S H, WANG X J, et al. Peripheral insulin doesn't alter appetite of broiler chicks[J]. Asian-Australasian Journal of Animal Sciences, 2016, 29(9): 1294-1299. DOI:10.5713/ajas.15.0674 |
| [19] |
SUMNERS L H, ZHANG W, ZHAO X, et al. Chickens from lines artificially selected for juvenile low and high body weight differ in glucose homeostasis and pancreas physiology[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2014, 172: 57-65. |
| [20] |
MCMURTRY J P, ROSEBROUGH R W, STEELE N C. A homologous radioimmunoassay for chicken insulin[J]. Poultry Science, 1983, 62(4): 697-701. DOI:10.3382/ps.0620697 |
| [21] |
SCANES C G. Perspectives on the endocrinology of poultry growth and metabolism[J]. General and Comparative Endocrinology, 2009, 163(1/2): 24-32. |
| [22] |
谢德彪, 陈鹭江. 鸡血糖含量变化特点的研究[J]. 中国畜牧杂志, 1996, 32(1): 26-28. |
| [23] |
RICE B B, ZHANG W, BAI S P, et al. Insulin-induced hypoglycemia associations with gene expressionchanges in liver and hypothalamus of chickens from lines selected for low or high body weight[J]. General and Comparative Endocrinology, 2014, 208: 1-4. DOI:10.1016/j.ygcen.2014.08.010 |
| [24] |
SIMON J, GUILLAUMIN S, CHEVALIER B, et al. Plasma glucose-insulin relationship in chicken lines selected for high or low fasting glycaemia[J]. British Poultry Science, 2000, 41(4): 424-429. DOI:10.1080/713654969 |
| [25] |
DESPRÉS J P, LEMIEUX I. Abdominal obesity and metabolic syndrome[J]. Nature, 2006, 444(7121): 881-887. DOI:10.1038/nature05488 |
| [26] |
WILMOT E, IDRIS I. Early onset type 2 diabetes:risk factors, clinical impact and management[J]. Therapeutic Advances in Chronic Disease, 2014, 5(6): 234-244. DOI:10.1177/2040622314548679 |
| [27] |
GARCÍA-CÁCERES C, QUARTA C, VARELA L, et al. Astrocytic insulin signaling couples brain glucose uptake with nutrient availability[J]. Cell, 2016, 166(4): 867-880. DOI:10.1016/j.cell.2016.07.028 |
| [28] |
孙永波, 王亚, 萨仁娜, 等. 家禽采食量调控机制及主要调控因子研究进展[J]. 动物营养学报, 2018, 30(1): 22-29. DOI:10.3969/j.issn.1006-267x.2018.01.004 |
| [29] |
WOLFGANG M J, LANE M D. Control of energy homeostasis:role of enzymes and intermediates of fatty acid metabolism in the central nervous system[J]. Annual Review of Nutrition, 2006, 26: 23-44. DOI:10.1146/annurev.nutr.25.050304.092532 |
| [30] |
徐运杰. 神经和激素对家禽采食量的调控[J]. 江西饲料, 2011(4): 1-4. DOI:10.3969/j.issn.1008-6137.2011.04.001 |
| [31] |
SHIRAISHI J I, YANAGITA K, FUKUMORI R, et al. Comparisons of insulin related parameters in commercial-type chicks:evidence for insulin resistance in broiler chicks[J]. Physiology & Behavior, 2011, 103(2): 233-239. |
| [32] |
YUAN LX, NI Y D, BARTH S, et al. Layer and broiler chicks exhibit similar hypothalamic expression of orexigenic neuropeptides but distinct expression of genes related to energy homeostasis and obesity[J]. Brain Research, 2009, 1273: 18-28. DOI:10.1016/j.brainres.2009.03.052 |
| [33] |
宋庆华. 肉鸡低血糖-尖峰死亡综合征的防治[J]. 养殖与饲料, 2017(10): 88-90. DOI:10.3969/j.issn.1671-427X.2017.10.055 |
| [34] |
ZHANG K Y, XIE N, YE H Q, et al. Function of glucose transporter in the regulation of blood glucose homeostasis[J]. Current Biotechnology, 2019, 9(1): 27-33. |




