2. 中国水产科学研究院淡水渔业研究中心, 无锡 214081;
3. 南京农业大学无锡渔业学院, 无锡 214081;
4. 农业农村部淡水水产生物技术与遗传育种重点实验室, 中国水产科学研究院黑龙江水产研究所, 哈尔滨 150070
2. Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, China;
3. Wuxi Fishery College Nanjing Agricultural University, Wuxi 214081, China;
4. Key Laboratory of Freshwater Aquatic Biotechnology and Breeding, Ministry of Agriculture and Rural Affairs, Heilongjiang Fisheries Research Institute, Chinese Academy of Fishery Sciences, Harbin 150070, China
抗生素是人工或自然合成的能够杀灭或抑制某些有害病原微生物的活性物质。21世纪80年代,人们证实抗生素具有促进畜禽动物生长及提高增重率和饲料转化率的作用[1]。自此,抗生素开始被大量使用,而我国每年大约有1/2生产的抗生素添加于畜禽和水产饲料[2],特别是抗生素对水产动物的影响是当前国内外最受关注的环境问题之一。鉴于抗生素在使用之后大量未被代谢的抗生素经不同途径最终进入养殖水体[3],威胁人类健康,因此,无抗化健康养殖是我国水产养殖业的发展方向。
迄今为止,已有学者相继评估了抗生素在水产动物上的应用效果,如叶继丹等[4]对不同剂量喹乙醇对鲤鱼(Cyprinus carpio)肝脏抗氧化能力做了评估;He等[5]研究表明抗生素会诱导斑马鱼(Danio rerio)肠道菌群失调;Zhao等[6]发现饲料中添加诺氟沙星会抑制海参(Apostichopus japonicus)免疫学参数和抗病力;Limbu等[7]研究表明饲料中添加抗生素会抑制罗非鱼(Oreochroms mossambcus)肠道分泌杯状细胞。现有权威统计数据表明四环素类抗生素是当前水产养殖水体中被检出最多且污染最为严重的抗生素种类[8],而磺胺类药物在美国广泛应用于水产养殖的病害防治,近年来被认为对鱼类具有危害且在实际生产中需要控制用量[9],但是个别水产养殖地区仍然上述2类抗生素用作饲料添加剂并作为病害防控的主要手段。不少学者也探明了抗生素在中国对虾(Penaeus chinensis)[10]、大菱鲆(Scophthalmus maximus)[11]、大西洋鲑(Salmo salar)[12]、鲈鱼(Lateolabrax japonicus)[13]、罗非鱼[14]、鲤[15]等水产动物体内的残留剂量,而饲料中长期添加抗生素对团头鲂造成的健康风险至今未见报道。
团头鲂(Megalobrama amblycephala)又名武昌鱼,是我国最主要的淡水经济养殖鱼类之一[16],根据《中国渔业统计年鉴》数据显示,2018年中国团头鲂淡水养殖产量为78.35万t[17],探明饲料中添加抗生素对团头鲂健康的危害可为实现团头鲂无抗养殖的提供理论基础。基于上述2类抗生素均对环境和鱼体造成巨大危害及其在生产上广泛运用的背景,本文研究饲料中添加治疗安全剂量的磺胺甲恶唑和土霉素对团头鲂幼鱼生长性能、血清生化指标、抗氧化能力和组织结构的影响,研究结果将明确水产养殖中抗生素的违规“预防性使用”与疾病治疗结束后的违规超期使用所蕴含的危害,这为继续加强水产养殖中抗生素的使用监管、遏制抗生素滥用提供了直接而有力的科学证据。
1 材料与方法 1.1 试验设计与试验饲料以鱼粉、酪蛋白和玉米淀粉等为主要原料配制基础饲料,依据已有参考文献[18-19]在基础饲粮中添加治疗浓度的抗生素来配制3种试验饲料,试验饲料组成及营养水平见表 1。对照组不添加抗生素,试验组分别添加0.20%磺胺甲恶唑(SMZ组)和0.25%土霉素(OTC组)。饲料原料经过粉碎过60目孔径分筛,少量的组分采用逐级扩大法混合制粒(粒径1.0 mm),沉性颗粒饲料50 ℃烘干后于4 ℃冰箱中保存备用。
|
|
表 1 试验饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
试验用鱼购自常州市武进区水产养殖场,在实验室条件下暂养驯化2周,然后挑选出平均体重为(3.20±0.09) g的健康活泼团头鲂270尾,随机分成3组,每组3个重复,每个重复30尾鱼,饲养于室内循环水养殖桶(500 L)中,整个试验周期均人工定时(08:00、12:00、17:00)投喂饲料,直至明显饱食,每天记录实际投喂量,试验期为56 d。养殖水体溶解氧含量>6.0 mg/L,水温(27.0±1.5) ℃,pH 7.0~8.0,氨氮含量 < 0.5 mg/L,亚硝酸盐氮含量 < 0.06 mg/L,光照周期为自然光照周期。
1.3 样品采集试验结束禁食24 h后,每桶鱼麻醉后称重鱼体和测量体长,并立即剖开腹部,剥离出肝脏和内脏并称重,分离出肠道一部分置于无菌离心管中并转入-80 ℃超低温冰箱中保存,用于测定肠道消化酶活性;分离出肝脏并置于离心管内于-80 ℃超低温冰箱中保存,用于测定丙二醛(MDA)、还原型谷胱甘肽(GSH)含量以及超氧化歧化酶(SOD)、过氧化氢酶(CAT)活性;肠道和肝脏用4%多聚甲醛溶液固定后用于组织结构分析。每个养殖桶随机取3尾鱼,迅速抽血2~3 mL,用台式离心机4 ℃离心15 min(3 000 r/min),分离出血清,置于-20 ℃冰箱中保存。
1.4 样品测定方法 1.4.1 生长性能测定增重率(weight gain rate, WGR)、特定生长率(specific growth rate, SGR)、成活率(survival rate, SR)、饲料效率(feed efficiency rate, FER)、摄食率(feed rate, FR)、肝体比(hepatosomatic index, HSI)、脏体比(viscerasomatic index, VSI)用以下公式求得:

|
饲料中的水分、粗灰分、粗蛋白质和粗脂肪含量分别采用105 ℃常压干燥法(GB/T 6435—2006)、550 ℃灼烧法(GB/T 6438—2007)、凯氏定氮法(GB/T 6432—1994)和全脂肪测定法(GB/T 6433—2006)进行测定。收集2组抗生素饲料样品,分别称取5.0 g饲料样品于50 mL匀浆器中匀浆后取部分上清液,在试管中加入一定体积的石油醚(沸程30~60 ℃,样液与石油醚体积比为2 : 1)振荡1 min,静置分层后弃去醚层,在4 000 r/min离心机上离心2 min,取1~2 mL溶液过碳18(C18)预处理小柱,用0.5 mL流动相甲醇洗脱,最后采用液相色谱仪分析磺胺甲恶唑和土霉素含量,分析条件为:流速分别为1.00和0.65 mL/min,检测波长分别为270和365 nm,柱温分别为40和30 ℃[20-21]。
1.4.3 肝脏抗氧化指标和肠道消化酶活性测定肝脏和肠道组织匀浆液的制备:准确称取组织湿重量,分别按重量(g) :体积(mL)=1 : 9的比例和重量(g) :体积(mL)=1 : 4的比例,分别加入9倍体积的生理盐水,冰水浴条件下机器匀浆,制成10%的组织匀浆,3 000 r/min低温离心10 min后取上清,分管保存于-80 ℃冰箱以备待测。肝脏丙二醛、还原型谷胱甘肽含量以及超氧化歧化酶、过氧化氢酶活性均采用南京建成生物工程研究所的试剂盒进行测定,具体的测定方法按照试剂盒的说明进行操作,肝脏中蛋白质含量的测定采用考马斯亮蓝法。肠道中蛋白酶、淀粉酶、脂肪酶活性定分别采用福林-酚试剂法、碘-淀粉比色法和化学比浊法,通过南京建成生物工程研究所生产的试剂盒进行测定。
1.4.4 血清生化测定血清碱性磷酸酶(alkaline phosphatase, AKP)、谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate transaminase, AST)和溶菌酶(lysozyme, LZM)活性均按照试剂盒说明书测定,所用试剂盒均购自南京建成生物工程研究所。
1.4.5 组织结构分析4%多聚甲醛溶液固定24 h后的样品用手术刀修整,再进行酒精梯度脱水,用包埋机进行石蜡包埋,然后用组织切片机切成厚度5 μm,最后采用苏木精-伊红染色法制作团头鲂肠道石蜡组织切片,并于连续变倍摄影显微镜下对肠道和肝胰腺组织结构变化情况进行观察和拍照。
1.5 数据统计试验数据以平均值±标准误(mean±SE)表示,采用SPSS 19.0统计软件包中的单因素方差分析(one-way ANOVA),若差异显著时,采用Turkey法进行多重比较,显著水平为P < 0.05。
2 结果与分析 2.1 饲料中添加抗生素对团头鲂幼鱼生长性能的影响由表 2可知,与对照组相比,SMZ组和OTC组团头鲂幼鱼的存活率、脏体比和肝体比均无显著差异(P>0.05),但SMZ组和OTC组团头鲂幼鱼的终末体重、增重率、摄食率和饲料效率显著降低(P < 0.05),OTC组团头鲂幼鱼的特定生长率显著降低(P < 0.05)。由此可见,饲料中添加2种抗生素均对团头鲂幼鱼的生长产生抑制作用。
|
|
表 2 饲料中添加抗生素对团头鲂幼鱼生长性能的影响 Table 2 Effects of dietary antibiotic on growth performance of juvenile Megalobrama amblycephala (n=3) |
由表 3可知,SMZ组和OTC组血清中谷丙转氨酶和谷草转氨酶活性显著高于对照组(P < 0.05),说明饲料中添加过量的抗生素会导致团头鲂肝脏功能异常。SMZ组和OTC组血清中碱性磷酸酶活性显著低于对照组(P < 0.05),说明饲料中添加过量的抗生素会引起团头鲂幼鱼免疫力减弱。
|
|
表 3 饲料中添加抗生素对团头鲂幼鱼血清生化指标的影响 Table 3 Effects of dietary antibiotic on serum biochemical indexes of juvenile Megalobrama amblycephala (n=3) |
由表 4可知,SMZ组和OTC组的肝脏中超氧化物歧化酶、过氧化氢酶活性和谷胱甘肽含量显著低于对照组(P < 0.05),SMZ组和OTC组的肝脏中丙二醛含量显著高于对照组(P < 0.05)。
|
|
表 4 饲料中添加抗生素对团头鲂幼鱼肝脏抗氧化指标的影响 Table 4 Effects of dietary antibiotic on liver antioxidant indexes of juvenile Megalobrama amblycephala (n=3) |
由表 5可知,SMZ组和OTC组的肠道蛋白酶和脂肪酶活性显著低于对照组(P < 0.05),但各组的肠道淀粉酶活性无显著差异(P>0.05),表明饲料中添加过量的抗生素会抑制鱼体的消化酶活性。
|
|
表 5 饲料中添加抗生素对团头鲂幼鱼肠道消化酶活性的影响 Table 5 Effects of dietary antibiotic on digestive enzyme activities of juvenile Megalobrama amblycephala (n=3) |
由图 1可见,对照组团头鲂幼鱼的肠道黏膜结构完整,绒毛簇形状规整且杯状细胞丰富,但SMZ组和OTC组团头鲂幼鱼的黏膜绒毛高度、绒毛宽度以及肌层厚度明显减少,同时形状不规则,部分有黏连,伴随着杯状细胞明显减少。
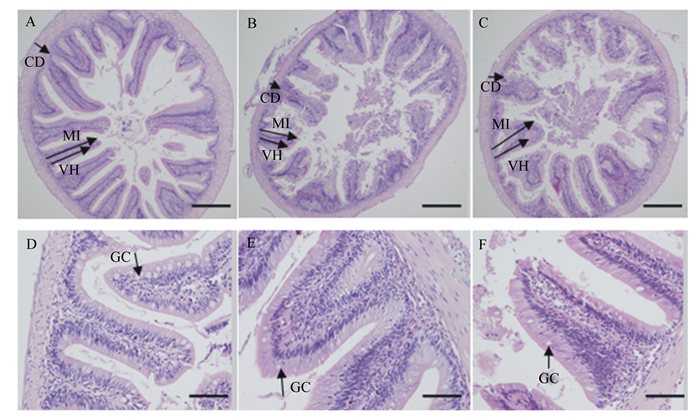
|
A:对照组(100×);B:磺胺甲恶唑组(100×);C:土霉素组(100×);D:对照组(200×);E:磺胺甲恶唑组(200×);F:土霉素组(200×)。VH:绒毛高度;CD:隐窝深度;MT:黏膜厚度;GC:杯状细胞。A~C:标尺50 μm,D~F:标尺20 μm。 A: control group (100×); B: SMZ group (100×); C: OTC group (100×); D: control group (200×); E: SMZ group (200×); F: OTC group (200×). VH: villus height; CD: crypt depth; MT: mucosal thickness; GC: goblet cell. A to C: bar scale is 50 μm, D to F: bar scale is 20 μm. 图 1 饲料中添加抗生素对团头鲂幼鱼肠道组织结构的影响 Fig. 1 Effects of dietary antibiotics on intestine tissue structure of juvenile Megalobrama amblycephala (n=3) |
由图 2可见,对照组团头鲂幼鱼的肝细胞排列较为整齐,细胞界限较为明显,细胞核清晰可见,而SMZ组和OTC组团头鲂幼鱼的部分肝细胞胞浆疏松或空泡状,肝窦微充血。
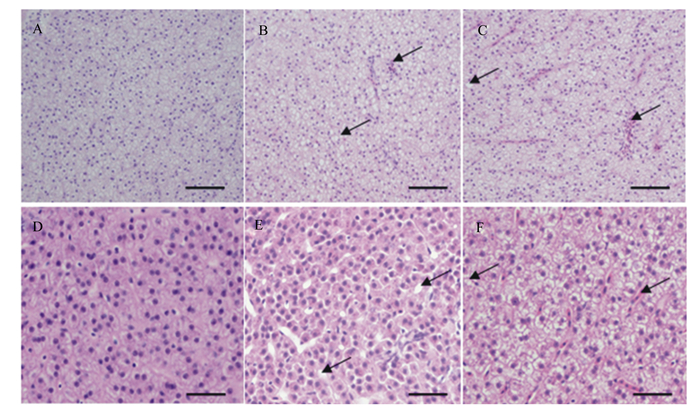
|
A:对照组(100×);B:磺胺甲恶唑组(100×);C:土霉素组(100×)。部分肝细胞胞浆疏松或空泡、肝窦微充血,如黑色箭头所示。A~C:标尺50 μm;D~F:标尺20 μm。 A: control group (100×); B: SMZ group (100×); C: OTC group (100×). As indicated by the black arrow, the partial hepatic cell were loose or vacuolated, slight congestion. A to C: bar scale is 50 μm; D to F: bar scale is 20 μm. 图 2 饲料中添加抗生素对团头鲂幼鱼肝脏组织结构的影响 Fig. 2 Effects of dietary antibiotics on liver tissue structure of juvenile Megalobrama amblycephala (n=3) |
抗生素作为一类非营养性饲料添加剂,研究表明其在畜禽生长过程中有不可忽视的积极作用[1],甚至在鱼类养殖中也具有类似促进作用[22],这与本研究结果相反,其主要原因是抗生素促生长的添加量与本试验治疗添加量相比极低,且养殖周期相对较短。本试验研究结果显示,SMZ组和OTC组的增重率、特定生长率、饲料效率都显著低于未添加抗生素的对照组,这说明饲料中长期过量添加抗生素显著抑制了团头鲂的生长性能,分析其原因有如下:首先是因为饲料中添加抗生素的试验组摄食量显著低于对照组,说明饲料中添加磺胺甲恶唑和土霉素后团头鲂有厌食现象,这与在鲤鱼[23]的研究结果相吻合;其次是因为肠道是鱼类营养物质消化吸收的主要场所[24],饲料中添加抗生素能够抑制肠道消化酶活性从而降低机体消化吸收营养物质的能力;再次,已有研究报道,抗生素会导致小鼠肠道菌群失调[25],通过破坏肠黏膜屏障,进而抑制动物生长。
3.2 饲料中添加抗生素对团头鲂幼鱼血清生化指标和抗氧化能力的影响正常生理条件下,血清中谷丙转氨酶和谷草转氨酶活性很低,只有当细胞膜通透性增强或细胞坏死时才会大量进入血液,使血清中2种酶活性增加。因此,血清谷丙转氨酶和谷草转氨酶活性可作为反映肝脏功能的重要指标[26-27]。本试验中,SMZ组和OTC组血清中谷丙转氨酶和谷草转氨酶活性显著高于对照组,提示饲料中长期过量添加磺胺甲恶唑和土霉素会造成团头鲂幼鱼肝细胞损伤,在随后的肝组织显微观察也证实部分肝细胞具有胞浆疏松或空泡化等现象。众所周知,机体的抗氧化防御系统可以在需氧生物体内清除活性氧自由基,防止组织过氧化损伤,并且负责清除组织细胞代谢产生的活性氧自由基,使其始终维持在较低水平,以保持机体正常的生理功能[4, 28]。本试验中,SMZ组和OTC组团头鲂幼鱼的肝脏中谷胱甘肽含量显著低于对照组,机体内产生的谷胱甘肽不能满足正常的生理功能,而超氧化物歧化酶和过氧化氢酶活性显著低于对照组,表明饲料中添加抗生素会抑制清除活性氧自由基的抗氧化酶活性,从而导致机体的氧化损伤。丙二醛是脂质过氧化作用的主要产物,反映了机体受氧自由基攻击的程度[28]。本试验中,SMZ组和OTC组团头鲂幼鱼的肝脏中丙二醛含量显著高于对照组,且OTC组更为突出,说明机体在长期摄入抗生素的过程中肝脏组织产生了氧化应激,这也是血清中谷草转氨酶和谷丙转氨酶活性显著升高的原因。血清中溶菌酶是一类广泛存在于动物、植物和微生物中具有免疫保护作用的天然抗菌肽,在非特异性免疫防御中起着重要作用[29]。本研究发现,饲料中添加抗生素对团头鲂幼鱼血清溶菌酶活性无显著影响,表明长期过量使用抗生素未增强鱼类机体的抗菌能力。
3.3 饲料中添加抗生素对团头鲂幼鱼肠道消化酶活性及组织结构的影响碱性磷酸酶是一种经糖基磷脂酰肌醇键锚定于肠上皮细胞顶膜上的糖蛋白,在肠黏膜屏障的维护中发挥着重要作用[30],已有报道表明其在大黄鱼(Larimichthys crocea)、草鱼(Ctenopharyngodon idellus)机体免疫防御中发挥重要作用[31-32]。本试验结果显示,长期摄食抗生素的团头鲂幼鱼血清碱性磷酸酶活性显著降低,推测与肠屏障结构的完整性有关,肠道的切片结果证实,饲料中添加抗生素会造成团头鲂小肠杯状细胞减少,这与在斑马鱼[33]和罗非鱼[7]中的研究结果相吻合。已有研究表明,肠道杯状细胞分泌黏液到肠上皮细胞形成黏液层填补细胞间隙,黏液层使得杯状细胞能在肠黏膜抵御内外源侵袭时发挥重要作用[34],因此,饲料添加抗生素促使团头鲂肠道杯状细胞的减少,进而抑制肠道免疫功能。本研究也发现饲料中添加磺胺甲恶唑和土霉素会抑制团头鲂幼鱼肠道蛋白酶和脂肪酶活性,其原因可能是长期摄食抗生素的团头鲂幼鱼肠道菌群紊乱,这已经在鱼类[35]和昆虫[36]研究中证实。本研究结果提示,长期过量摄食抗生素不利于团头鲂幼鱼的肠道健康。
4 结论① 饲料中长期添加治疗浓度的磺胺甲恶唑和土霉素均对团头鲂幼鱼生长性能和肝脏抗氧化能力产生抑制作用。
② 饲料中长期添加治疗浓度的磺胺甲恶唑和土霉素均导致团头鲂幼鱼肠道消化酶活性下降,并改变肠道组织结构。
| [1] |
伊风军. 抗生素添加剂在饲料中的应用历史和现状[J]. 中国畜牧兽医文摘, 2017, 33(11): 221. |
| [2] |
叶文红. 抗生素渔药的使用情况及其替代品发展简介[J]. 河北渔业, 2018(12): 55-57. DOI:10.3969/j.issn.1004-6755.2018.12.015 |
| [3] |
GUO J H, SELBY K, BOXALL A B A. Assessment of the risks of mixtures of major use veterinary antibiotics in European surface waters[J]. Environmental Science & Technology, 2016, 50(15): 8282-8289. |
| [4] |
叶继丹, 韩友文, 赵吉伟, 等. 喹乙醇对鲤肝胰脏抗氧化酶系统的影响[J]. 水产学报, 2004, 28(3): 231-235. |
| [5] |
HE S X, WANG Q M, LI S N, et al. Antibiotic growth promoter olaquindox increases pathogen susceptibility in fish by inducing gut microbiota dysbiosis[J]. Science China Life Sciences, 2017, 60(11): 1260-1270. DOI:10.1007/s11427-016-9072-6 |
| [6] |
ZHAO Y, LIU H, WANG Q, et al. The influence of three antibiotics on the growth, intestinal enzyme activities, and immune response of the juvenile sea cucumber Apostichopus japonicus selenka[J]. Fish & Shellfish Immunology, 2019, 84: 434-440. |
| [7] |
LIMBU S M, ZHOU L, SU S X, et al. Chronic exposure to low environmental concentrations and legal aquaculture doses of antibiotics cause systemic adverse effects in Nile tilapia and provoke differential human health risk[J]. Environment International, 2018, 115: 205-219. DOI:10.1016/j.envint.2018.03.034 |
| [8] |
曾巧云, 丁丹, 檀笑. 中国农业土壤中四环素类抗生素污染现状及来源研究进展[J]. 生态环境学报, 2018, 27(9): 1774-1782. |
| [9] |
肖贺.复方磺胺嘧啶在罗非鱼体内的药代动力学研究[D].硕士学位论文.上海: 上海海洋大学, 2014: 6-8. http://cdmd.cnki.com.cn/Article/CDMD-10264-1014051867.htm
|
| [10] |
范克俭.土霉素和新诺明在中国明对虾体内的药代动力学研究[D].硕士学位论文.青岛: 中国海洋大学, 2005: 1-13. http://cdmd.cnki.com.cn/Article/CDMD-10423-2005139613.htm
|
| [11] |
郑增忍, 赵思俊, 邹明, 等. 土霉素在大菱鲆体内药代动力学及残留消除规律研究[J]. 中国农学通报, 2008, 24(10): 559-563. |
| [12] |
ELEMA M O, HOFF K A, KRISTENSEN H G. Bioavailability of oxytetracycline from medicated feed administered to Atlantic salmon (Salmo salar L.) in seawater[J]. Aquaculture, 1996, 143(1): 7-14. DOI:10.1016/0044-8486(96)01253-7 |
| [13] |
王群, 孙修涛, 刘德月, 等. 复方新诺明在鲈鱼体内的药物代谢动力学研究[J]. 海洋科学, 2001, 25(2): 35-38. DOI:10.3969/j.issn.1000-3096.2001.02.012 |
| [14] |
张石云, 宋超, 张敬卫, 等. 微塑料暴露对罗非鱼肌肉中磺胺甲唑残留的影响[J]. 生态与农村环境学报, 2018, 34(9): 857-864. |
| [15] |
原盛广, 崔艳芳, 张文婧. 北京农贸市场常见淡水鱼体内抗生素残留调查研究[J]. 生态毒理学报, 2015, 10(3): 311-317. |
| [16] |
任鸣春, 周群兰, 缪凌鸿, 等. 团头鲂营养需求与健康研究进展[J]. 水产学报, 2015, 39(5): 761-768. |
| [17] |
中华人民共和国农业部渔业局. 2019年中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2019: 25-35.
|
| [18] |
LIU X, STEELE J C, MENG X Z. Usage, residue, and human health risk of antibiotics in Chinese aquaculture:a review[J]. Environmental Pollution, 2017, 223: 161-169. DOI:10.1016/j.envpol.2017.01.003 |
| [19] |
YONAR E M, YONAR M S, SILICI S. Protective effect of propolis against oxidative stress and immunosuppression induced by oxytetracycline in rainbow trout (Oncorhynchus mykiss, W.)[J]. Fish & Shellfish Immunology, 2011, 31(2): 318-325. |
| [20] |
辛福言, 李晓川, 陈四清, 等. 高效液相色谱法分析鲤鱼体内土霉素残留的研究[J]. 海洋水产研究, 1996, 17(1): 71-75. |
| [21] |
张博翔, 班龙科, 周睿, 等. 6种磺胺类抗生素的液相色谱法分析条件及优化[J]. 安徽建筑大学学报, 2018, 26(6): 51-55. |
| [22] |
郑宗林, 周玉岩, 龚哲宇. 几种抗生素对异育银鲫生长性能及饲料利用的影响[J]. 粮食与饲料工业, 2008(4): 31-33. DOI:10.3969/j.issn.1003-6202.2008.04.013 |
| [23] |
陈四清, 辛福言, 李晓川, 等. 饲喂土霉素对鲤鱼生长及代谢残留的研究[J]. 饲料工业, 1997, 18(5): 20-21. |
| [24] |
胡俊茹, 王国霞, 莫文艳, 等. 黑水虻幼虫粉替代鱼粉对鲈鱼幼鱼生长性能、体组成、血浆生化指标和组织结构的影响[J]. 动物营养学报, 2018, 30(2): 613-623. DOI:10.3969/j.issn.1006-267x.2018.02.026 |
| [25] |
李娜, 赵玉民, 陈正元, 等. 抗生素诱导肠道菌群失调对肠黏膜屏障和肝脏功能的动态影响[J]. 动物营养学报, 2019, 31(3): 1278-1287. |
| [26] |
NYBLOM H, BERGGREN U, BALLDIN J, et al. High AST/ALT ratio may indicate advanced alcoholic liver disease rather than heavy drinking[J]. Alcohol and Alcoholism, 2004, 39(4): 336-339. |
| [27] |
时博, 郁欢欢, 梁晓芳, 等. 酵母水解物对大口黑鲈生长性能、血浆生化指标以及肝脏组织健康的影响[J]. 动物营养学报, 2018, 30(7): 2772-2781. DOI:10.3969/j.issn.1006-267x.2018.07.038 |
| [28] |
WINSTON G W, DI GIULIO R T. Prooxidant and antioxidant mechanisms in aquatic organisms[J]. Aquatic Toxicology, 1991, 19(2): 137-161. |
| [29] |
徐永平, 汪婷婷, 孙永欣, 等. 水产动物溶菌酶研究的最新进展[J]. 水产科学, 2011, 30(5): 307-310. DOI:10.3969/j.issn.1003-1111.2011.05.013 |
| [30] |
毕景成. 肠碱性磷酸酶在肠屏障中作用的研究进展[J]. 肠外与肠内营养, 2015, 22(4): 244-247. |
| [31] |
冯建军, 姚志刚, 张子平, 等. 大黄鱼碱性磷酸酶基因的克隆及表达特征分析[J]. 水产学报, 2014, 38(9): 1243-1254. |
| [32] |
黄莹, 姚远, 朱晓鸣, 等. 饲喂不同浓度黄曲霉毒素B1饲料对草鱼幼鱼生长和毒素积累的影响[J]. 水产学报, 2019, 43(4): 723-730. |
| [33] |
ZHOU L, LIMBU S M, QIAO F, et al. Influence of long-term feeding antibiotics on the gut health of zebrafish[J]. Zebrafish, 2018, 15(4): 340-348. DOI:10.1089/zeb.2017.1526 |
| [34] |
刘玥宏, 丁悦, 徐敬东. 肠道杯状细胞及其功能研究进展[J]. 世界华人消化杂志, 2017, 25(14): 1279-1286. |
| [35] |
KIM A, KIM N, ROH H J, et al. Administration of antibiotics can cause dysbiosis in fish gut[J]. Aquaculture, 2019, 512: 734330. DOI:10.1016/j.aquaculture.2019.734330 |
| [36] |
刘莉, 王中康, 俞和韦, 等. 饲喂四环素和链霉素对贡嘎蝠蛾幼虫生长和肠道消化酶的影响[J]. 昆虫知识, 2008, 45(2): 272-275. DOI:10.3969/j.issn.0452-8255.2008.02.022 |



