2. 浙江省海洋水产研究所, 舟山 316021
2. Marine Fisheries Research Institute of Zhejiang Province, Zhoushan 316021, China
糖类物质作为鱼类三大重要营养素和能源之一,对于鱼类营养具有重要意义[1]。与蛋白质和脂质相比,糖类物质是鱼类配合饲料中最廉价的饲料组分[2],但是不同鱼类对糖类物质的利用率存在差异,通常认为杂食性和草食性鱼类对糖类物质的利用率要高于肉食性鱼类[3],淡水性、温水性鱼类可耐受的饲料糖水平高于冷水性及海水性鱼类[4]。饲料中适宜的糖水平不仅可以促进鱼体生长,而且能够降低饲料成本、节约蛋白质、减少水体污染[5]。而过低或过高的糖水平会造成鱼体代谢紊乱、脂肪沉积、血糖含量过高,严重时会导致鱼类生长缓慢、损害肝脏正常功能、死亡率升高等[6]。因此,探究饲料中适宜糖水平具有重要的经济意义和生态意义。
梭鱼(Liza haematocheila),又名鳆、赤眼鲻,隶属于鲈形目,鲻科,梭鱼属,属于广温、广盐性鱼类,在全球范围内均有分布,在中国主要分布于东海和渤海海域[7]。梭鱼具有生长速度快、繁殖能力强、病害少、肉质鲜美、经济效益高等优点,为联合国粮农组织推荐养殖的鱼类,现今在中国已得到普遍养殖[8]。目前,关于梭鱼的营养学研究已有一些报道,Yoshimatsu等[9]研究发现,梭鱼幼鱼对饲料蛋白质的适宜需求量为40%~45%;张春暖等[10]研究表明,梭鱼对饲料脂肪的适宜需求量为9.30%~9.64%,而关于梭鱼对糖类物质的适宜需求量的研究却未见报道。因此,本试验通过探究饲料糖水平对梭鱼生长及体组成的影响,旨在为梭鱼营养的进一步研究和饲料研发提供理论依据。
1 材料与方法 1.1 试验饲料以酪蛋白为蛋白质源,玉米淀粉为糖源,鱼油和豆油为脂肪源,配制6种不同糖水平的等氮等脂饲料,糖水平依次为0.50%、8.50%、16.50%、24.50%、32.50%和40.50%。将饲料干粉原料称重、混匀后,加入鱼油和豆油再次混匀,并加入适量的水混合。使用双螺杆挤条机制成颗粒直径为1.50和2.50 mm的试验饲料,所有颗粒饲料经50 ℃干燥后,贮藏于-20 ℃冰箱中备用。试验饲料组成及营养水平如表 1所示。
|
|
表 1 试验饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
试验所用梭鱼均来自浙江省海水增养殖重点实验室孵化车间孵出的同一批鱼苗。试验开始前,用商用饲料暂养2周,以使鱼逐渐适应养殖环境。正式开始试验前,梭鱼幼鱼被禁食24 h,挑选规格一致、体格健壮、有活力的幼鱼,平均初始体重为(3.44±0.15) g,随机分为6组,每组设3个重复,然后以重复为单位将它们分配到18个200 L的养殖桶中,每桶20尾鱼。饲养试验持续56 d。所有梭鱼每天饱食投喂2次(08:00和16:00)。试验期间提供过滤海水,水流量保持在2 L/min,溶解氧含量>(5.2±0.1) mg/L,氨氮含量 < 0.5 mg/L,亚硝酸盐含量 < 0.05 mg/L,盐度(25.1±0.9) g/L,水温(27.5±1.0) ℃,采用自然光照。
1.3 样品收集和指标测定试验开始前,随机选取30尾梭鱼用作全鱼营养成分分析。试验结束后,对梭鱼禁食24 h,并对其称重。从每个养殖桶内分别挑取6尾鱼用MS-222麻醉后单独称重。随后从尾静脉处抽取血液,加入肝素抗凝,置于离心机中离心10 min(4 ℃,4 000×g)。将鱼体解剖,剔除肠脂后称量肠脂重,并将分离后的肠道放入离心管中标号。此外,每个养殖桶内随机挑取3尾梭鱼用于全鱼营养成分分析。所有组织样品经液氮冷冻后保存于-80 ℃冰箱用于随后的分析。
饲料和全鱼营养成分根据AOAC(1995)[11]方法进行测定。在105 ℃的烘箱中干燥至恒重测定水分含量;采用凯氏定氮法测定粗蛋白质含量(氮×6.25);采用索氏抽提法(乙醚为抽提液)测定粗脂肪含量。
肠道脂肪酶(LPS)和淀粉酶(AMS)活性采用黎军胜等[12]的方法测定。血清谷丙转氨酶(ALT)活性采用Reutman等[13]的方法测定;血清葡萄糖(Glu)含量采用Tiffany等[14]的方法测定;血清总胆固醇(TC)含量采用陈文祥等[15]的方法测定;血清甘油三酯(TG)含量采用叶应妩等[16]的方法测定。所有指标均根据南京建成生物工程研究所提供的商品试剂盒进行检测。
1.4 计算公式

|

|
数据以饲料糖水平为独立变量进行回归分析。采用SPSS 20.0软件进行单因子方差分析,Duncan氏法比较得出各组间的差异,P < 0.05为显著差异。基于WGR和FCR的二阶多项式回归模型得出饲料中适宜的糖水平。
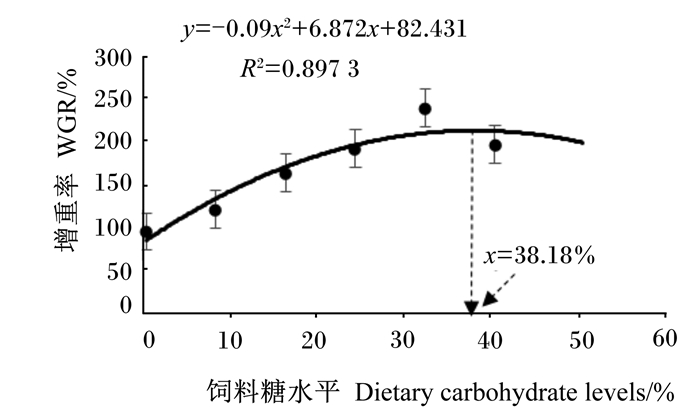
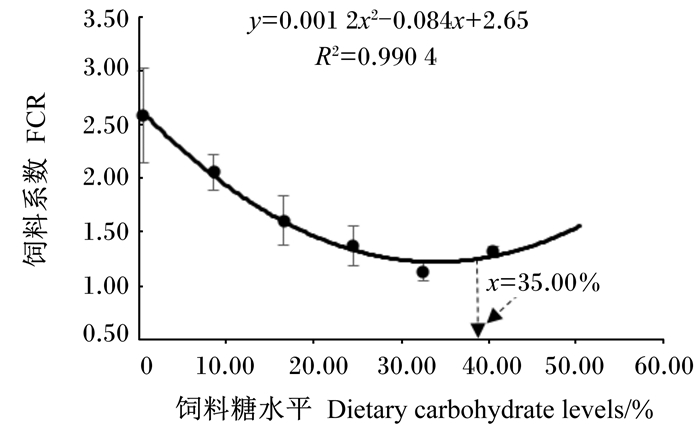
2 结果 2.1 饲料不同糖水平对梭鱼幼鱼生长性能、饲料利用和形态学指标的影响由表 2可知,随着饲料糖水平的升高,32.50%组WGR、SGR达到最大值,显著高于0.50%、8.50%、16.50%组(P < 0.05)。饲料不同糖水平显著影响FCR、DFI(P < 0.05),在32.50%组有最低值。饲料不同糖水平显著影响PER、IPF(P < 0.05)。HSI未随饲料糖水平升高而显著变化(P>0.05)。通过二次多项式对饲料糖水平与WGR进行分析,得出梭鱼幼鱼饲料的适宜糖水平为38.18%(图 1);同时对饲料糖水平与FCR进行回归分析,得出梭鱼幼鱼饲料糖水平在35.00%时,梭鱼幼鱼对饲料的利用率最佳(图 2)。
|
|
表 2 饲料不同糖水平对梭鱼幼鱼生长性能、饲料利用和形态学指标的影响 Table 2 Effects of dietary different carbohydrate levels on growth performance, feed utilization and morphometrical parameters of juvenile mullet |
|
图 1 饲料糖水平与梭鱼幼鱼增重率的关系 Fig. 1 Relationship between dietary carbohydrate level and weight gain rate of juvenile mullet |
|
图 2 饲料糖水平与梭鱼幼鱼饲料系数的关系 Fig. 2 Relationship between dietary carbohydrate level and feed conversion ratio of juvenile mullet |
由表 3可知,饲料不同糖水平显著影响DNI、DEI和DLI(P < 0.05),0.50%和8.50%组DNI、DEI显著高于16.50%、32.50%和40.50%组(P < 0.05),0.50%和8.50%组DLI显著高于其余各组(P < 0.05)。DNG、DEG、DLG随饲料糖水平的升高出现显著性变化(P < 0.05),三者的变化趋势相似,都在0.50%~32.50%组呈上升趋势。饲料不同糖水平显著影响NR、ER、LR(P < 0.05),24.50%、32.50%、40.50%组NR显著高于0.50%、8.50%组(P < 0.05),16.50%、24.50%、32.50%、40.50%组ER显著高于0.50%、8.50%组(P < 0.05),32.50%组LR显著高于其他5组(P < 0.05)。
|
|
表 3 饲料不同糖水平对氮、能量、脂肪的利用 Table 3 Effects of dietary different carbohydrate levels on nitrogen, energy and lipid utilization of juvenile mullet |
由表 4可知,饲料糖水平对全鱼水分、粗蛋白质、粗脂肪的含量均没有产生显著影响(P>0.05),但粗脂肪含量在0.50%~32.50%组有上升趋势。
|
|
表 4 饲料不同糖水平对梭鱼幼鱼体组成的影响 Table 4 Effects of dietary different carbohydrate levels on body composition of juvenile mullet |
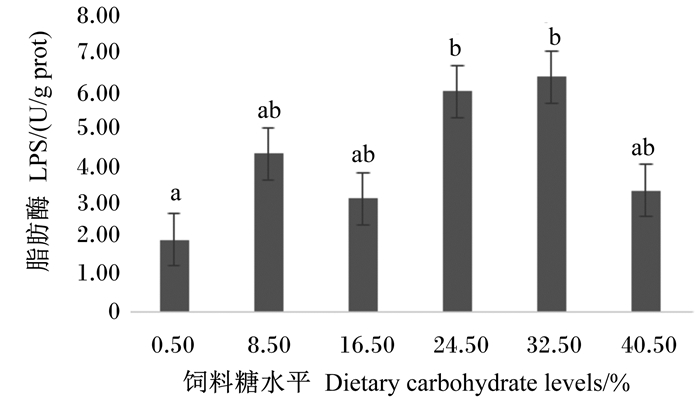
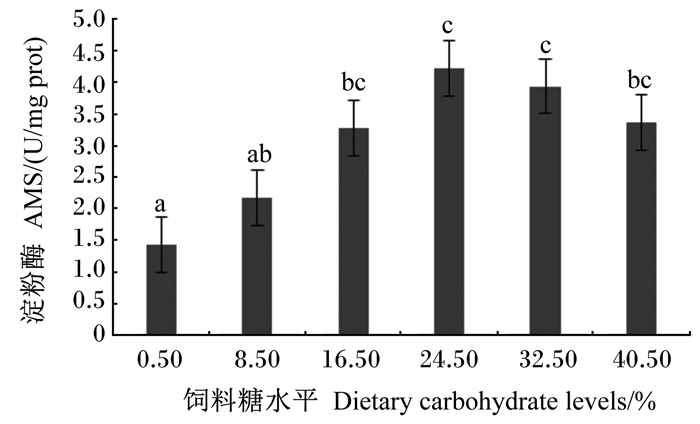
由图 3可见,0.50%组肠道LPS活性显著低于24.50%和32.50%组(P < 0.05)。由图 4可见,随着饲料糖水平的升高,0.50%~24.50%组肠道AMS活性显著上升(P < 0.05),32.50%和40.50%组有所下降,但与16.50%和24.50%组相比差异不显著(P>0.05)。
|
数据柱标注不同小写字母表示差异显著(P < 0.05)。下图同。 Value columns with different small letters mean significant difference (P < 0.05). The same as below. 图 3 饲料不同糖水平对肠道脂肪酶活性的影响 Fig. 3 Effects of dietary different carbohydrate levels on intestinal lipase activity of juvenile mullet |
|
图 4 饲料不同糖水平对肠道淀粉酶活性的影响 Fig. 4 Effects of dietary different carbohydrate levels on intestinal amylase activity of juvenile mullet |
由表 5可见,0.50%组血清ALT活性显著低于16.50%、24.50%、32.50%、40.50%组(P < 0.05),但后4组间无显著差异(P>0.05)。血清Glu含量未随饲料糖水平的升高呈现显著变化(P>0.05)。40.50%组血清TC含量显著低于0.50%~24.50%组(P < 0.05),但0.50%~32.50%组间无显著差异(P>0.05)。0.50%~24.50%组血清TG含量呈上升趋势,其值在24.50%组为最高值,24.50%组显著高于32.50%和40.50%组(P < 0.05),但0.50%、8.50%、16.50%、32.50%和40.50%组间无显著差异(P>0.05)。
|
|
表 5 饲料不同糖水平对梭鱼幼鱼血清生化指标的影响 Table 5 Effects of dietary different carbohydrate levels on serum biochemical indices of juvenile mullet |
通常饲料中适宜的糖水平可以改善杂食性鱼类的生长。此外,最佳或推荐的饲料糖水平因养殖水温和物种而异[17]。在本试验中,不同糖水平饲料处理对梭鱼幼鱼的生长性能和饲料利用产生显著影响。随着饲料糖水平的升高,梭鱼幼鱼的WGR和SGR整体呈先上升后下降趋势。在其他一些鱼类研究中也观察到类似的现象,如点篮子鱼(Siganus guttatus)[4]、淡水黑鲷(Hephaestus fuliginosus)[17]及斑点叉尾(Ictalurus punctatus)[18]。本研究中,梭鱼幼鱼在饲喂糖水平为32.50%和总能为18.78 kJ/g的饲料时观察到最大的WGR(240.07%),显著高于0.50%~16.50%组,与40.50%组的WGR无显著性差异。同时,随着饲料糖水平的升高,FCR总体呈现下降趋势,变化趋势与WGR相反;同样,在饲喂糖水平为32.50%的饲料组中观察到FCR的最佳值(1.13)。通过对WGR和SGR进行二次多项式回归分析,得出梭鱼幼鱼饲料的适宜糖水平为35.00%~38.18%,相似的结果也出现在对其他杂食性鱼类的研究中,例如厚唇弱棘鯻(Hephaestus fuliginosus)[19]、吉富罗非鱼(Oreochromis niloticus)[20]以及宝石鲈(Scortum barcoo)[21]。目前关于梭鱼饲料营养的报道相对较少。张春暖等[10]研究结果显示,饲喂脂肪水平为8.23%的饲料,梭鱼生长性能最佳,WGR为176.74%(终末体重为15.25 g;养殖周期为60 d)。Yang等[22]研究结果显示,饲喂脂肪水平为7.50%的饲料,梭鱼WGR最高,为235.48%(终末体重为31.7 g;养殖周期为60 d)。祝焱彬等[23]研究结果表明,梭鱼饲料中发酵豆粕替代鱼粉的比例不宜超过40.00%,全鱼粉饲料组梭鱼生长性能最佳,其对应的WGR为304.07%(终末体重为8.61 g;养殖周期为60 d)。这些研究均表明本试验中梭鱼的生长结果是在可接受范围内的。
在本研究中,DFI随饲料糖水平的升高呈显著变化。与梭鱼幼鱼饲喂糖水平为32.50%的饲料相比,糖水平为0.50%和8.50%组的梭鱼幼鱼具有更高的DFI、DNI、NEI和DLI,但在这2组中也观察到显著降低的WGR、PER、NR和ER。通常鱼类可调节其摄食量以满足其能量代谢需求[24]。饲料中糖类物质主要用作能量来源,所以其水平应根据饲料中的蛋白质和能量水平来确定[24-25]。众所周知,饲料中蛋白质水平满足鱼类所需的适宜量时,过多的能量会导致脂肪沉积并降低饲料消耗[24-27],而在能量不足的情况下,蛋白质将被用作能源并增加氨排泄[25]。在本试验中,饲料糖源为玉米淀粉,用微晶纤维素补足差额部分的设计导致不同组的能量和氮能比(P/E)不同。当饲喂含有0.50%和8.50%玉米淀粉的较低能量饲料时,梭鱼摄入的较高比例的蛋白质并没有沉积在体内,而更可能是作为能源被利用。由于饲料处理中能量水平的增加仅源于玉米淀粉含量的增加,因此,随着饲料中糖水平的增加,生长性能得以改善,说明梭鱼可以有效地将糖类物质用作能量,并节约蛋白质用于生长,这与在奥尼罗非鱼(Oreochromis niloticus×O.aureus)[26]上的研究结果相似。此外,在本试验中低糖饲料(0.50%和8.50%)中有较高的纤维素水平。一般而言,具有高纤维素水平的饲料可能具有较差的消化率[27]。这些假设与低糖饲料组中梭鱼幼鱼存在生长不良和饲料利用较低的结果一致。
P/E在鱼类营养中起着重要作用,不平衡的P/E通常会影响鱼类的生长性能、饲料效率和体组成[28]。本研究中,与32.50%组(P/E为21.44 mg/kJ)相比,0.50%和8.50%组具有较高的P/E(分别为31.07和27.95 mg/kJ),这可能导致0.50%和8.50%组有较差的生长性能以及较低的饲料利用率[28]。换言之,在饲料糖水平为0.50%和8.50%条件下,31.07和27.95 mg/kJ的P/E对于梭鱼幼鱼获得良好的生长性能是不够的。相似的结果也出现在对吉富罗非鱼[29]的研究中。在本研究中,当饲料糖水平从32.50%增加到40.50%时,尽管没有统计学上的显著性差异,但40.50%组的WGR、SGR、PER以及NR和ER在数值上还是明显低于32.50%组,这表明糖水平为40.50%的饲料在39.50%蛋白质水平和9.50%脂肪水平下不能使梭鱼获得更好的生长性能,这与在高首鲟(Acipenser transmontanus)[30]幼鱼中观察到的结果一致。对于大多数鱼类而言,最佳P/E在20~25 mg/kJ[31]。在本试验中,饲喂糖水平为32.50%的饲料,P/E为21.44 mg/kJ时梭鱼表现出良好的生长性能和饲料利用率。
饲料中糖水平对蛋白质节约作用的影响在不同物种中是不同的,饲料中的适宜糖水平有助于某些物种的蛋白质保留[32]。在本研究中,饲料不同糖水平显著影响PER、NR和ER。Monhanta等[33]研究表明,糖类物质对蛋白质的节约仅被发现在当鱼类摄食蛋白质水平略低于最适需要量的饲料处理中。本研究中饲料含有约39.50%的蛋白质,这略低于梭鱼对蛋白质的最佳需求量(40%~45%)[9]。这表明饲料中适宜糖水平能够提高蛋白质的利用率,起到节约蛋白质的作用,即适宜的糖水平可以减少蛋白质的能源消耗,更好地用于合成体蛋白质[18]。
3.2 饲料不同糖水平对梭鱼幼鱼体组成的影响鱼体组成与糖的利用情况相关,研究表明长期摄入高水平的糖类物质会对粗脂肪含量产生显著影响,造成体内脂质的积累[20, 26]。本研究结果显示,虽然各组间梭鱼幼鱼全鱼粗脂肪含量无统计学差异,但是其粗脂肪含量在0.50%~32.50%组随饲料糖水平升高而升高。这与奥尼罗非鱼[34]的研究结果相似。值得注意的是,本试验发现LR在0.50%~32.50%组随饲料糖水平的增加呈现显著升高趋势。这证明了适宜的糖水平可以转化为鱼体内的脂肪而蓄积。另外,本研究发现随着饲料糖水平的升高,IPF呈显著变化。这提示本试验合成的脂肪可能主要沉积在腹腔内。
3.3 饲料不同糖水平对梭鱼幼鱼形态学指标的影响HSI常被用于评价鱼类的营养状态,在糖类物质代谢中发挥着重要的作用[17]。蒋阳阳[35]在对团头鲂(Megalobrama amblycephala)的研究中发现,饲喂高糖水平饲料会导致鱼体内脏团质量变大、肝脏体积变大,并对鱼体造成不利影响。本研究中,HSI并未随着饲料糖水平的升高而出现显著性变化,这可能提示饲料糖水平未对梭鱼幼鱼肝脏造成负面影响。相似的结果也出现在对杂交条纹鲈(Murune chrysups×M.saxatilis)[36]及美国红鱼(Sciaenops ocellatus)[37]的研究中。ALT是衡量肝功能是否正常的主要指标之一,主要参与体内氨基酸的分解与合成[19]。本试验研究显示,随时饲料糖水平的升高,血清ALT活性在16.50%、24.50%、32.50%、40.50%组间无显著差异,这进一步表明升高的饲料糖水平并未对梭鱼幼鱼肝脏器官造成实质性损伤。
3.4 饲料不同糖水平对梭鱼幼鱼肠道消化酶活性的影响鱼类肠道消化酶活性与其食性和饲料营养成分密切相关,也反映了其对不同营养物质的利用能力[35, 38]。LPS能够催化TG及其他一些不溶性酯类的醇解、酯化、水解、转酯化及酯类的逆向合成反应,是一类具有多催化能力的酶类[38]。在本研究中,肠道LPS活性在0.50%~32.50%组呈显著上升趋势,这与胡毅等[38]对草鱼(Carassius auratus gibelio)的研究结果相似。肠道AMS活性可以反映鱼类对糖的利用率[35]。本试验结果显示,随着饲料糖水平的升高,肠道AMS活性在0.50%~32.50%组显著上升,说明饲料中适宜糖水平能够刺激肠道AMS的活性和分泌,有利于鱼体对糖类物质的消化和利用。尽管饲料中糖水平对肠道AMS的调节作用有限,但一定程度上能够反映AMS对底物的适应性。相似的结果也出现在对杂食性鱼类淡水黑鲷(Hephaestus fuliginosus)[17]的研究中。
3.5 饲料不同糖水平对梭鱼幼鱼血清生化指标的影响血液是机体内环境的组成部分,也是评价鱼体健康和对环境适应能力的重要指标[39]。鱼体的血糖常处于动态平衡状态,但又极易受环境因子如温度、潜水、运动、摄食和光周期等刺激而产生变化[18]。在本研究中,血清Glu含量虽然未随饲料糖水平升高呈显著性变化,但在0.50%~32.50%组有上升趋势,说明鱼体血清Glu含量在一定范围内与其摄食糖水平呈正相关,可能是饲料中高水平糖在一定程度上提高了鱼体部分糖代谢酶的活性[19]。血脂是血液中TG、磷脂、TC及其酯和游离脂肪酸等脂类的统称,它们具有供给能量、合成某些酶、维生素和激素等作用,在鱼类维持生命活动中担负着重要角色[19]。本研究中,血清TG含量在0.50%~24.50%组有上升趋势,说明饲料中一定范围内糖水平的升高增加了鱼体内的糖的代谢,脂肪合成速度加快,使得血脂含量显著上升[18-19]。但32.50%~40.50%组的血清TG含量下降,这可能提示该物种脂肪合成的能力并不会随着糖水平的进一步提高而上升。
4 结论① 梭鱼幼鱼在饲喂糖水平为32.5%的饲料时表现出最佳的生长性能和饲料利用。
② 随着饲料糖水平的升高,产生了蛋白质的节约效应。
③ 基于WGR和FCR的二次多项式回归分析,梭鱼幼鱼饲料中适宜的糖水平为35.00%~38.18%。
| [1] |
缪凌鸿, 刘波, 戈贤平, 等. 高碳水化合物水平日粮对异育银鲫生长、生理、免疫和肝脏超微结构的影响[J]. 水产学报, 2011, 35(2): 221-230. |
| [2] |
KROGDAHL Å, HEMRE G I, MOMMSEN T P. Carbohydrates in fish nutrition:digestion and absorption in postlarval stages[J]. Aquaculture Nutrition, 2015, 11(2): 103-122. |
| [3] |
赵旺, 牛津, 胡静, 等. 饲料糖水平对眼斑双锯鱼幼鱼生长性能和体成分的影响[J]. 南方水产科学, 2017, 13(3): 66-72. DOI:10.3969/j.issn.2095-0780.2017.03.009 |
| [4] |
李葳, 侯俊利, 章龙珍, 等. 饲料糖水平对点篮子鱼生长性能的影响[J]. 海洋渔业, 2012, 34(1): 64-70. DOI:10.3969/j.issn.1004-2490.2012.01.010 |
| [5] |
ASDUZZAMAN M, WAHAB M A, VERDEGEM M C J, et al. Effects of carbohydrate source for maintaining a high C:N ratio and fish driven re-suspension on pond ecology and production in periphyton-based freshwater prawn culture systems[J]. Aquaculture, 2010, 301(1/2/3/4): 37-46. |
| [6] |
DIXON D G, HILTON J W. Influence of available dietary carbohydrate content on tolerance of waterborne copper by rainbow trout, Salmo gairdneri Richardson[J]. Journal of Fish Biology, 2010, 19(5): 509-518. |
| [7] |
华建权, 沈爱苗, 潘雪央, 等. 梭鱼仔苗的盐度适应性研究[J]. 浙江海洋学院学报(自然科学版), 2006, 25(4): 407-409, 424. DOI:10.3969/j.issn.1008-830X.2006.04.010 |
| [8] |
李明德. 中国梭鱼42年来的研究概况[J]. 海洋通报, 1993, 12(6): 81-85. |
| [9] |
YOSHIMATSU T, FURUICHI M, KITAJIMA C. Optimum level of protein in purified experimental diets for redlip mullet (Liza haematocheila)[J]. Bulletin of the Japanese Society of Scientific Fisheries, 1992, 58(11): 2111-2117. DOI:10.2331/suisan.58.2111 |
| [10] |
张春暖, 王爱民, 刘文斌, 等. 饲料脂肪水平对梭鱼生长、营养物质消化及体组成的影响[J]. 江苏农业学报, 2012, 28(5): 1088-1095. |
| [11] |
AOAC. Official methods of analysis of AOAC International[M]. Arlington, VA: AOAC International, 1995.
|
| [12] |
黎军胜, 李建林, 吴婷婷. 奥尼罗非鱼淀粉酶、脂肪酶的分布与特性[J]. 中国水产科学, 2004, 11(5): 473-477. DOI:10.3321/j.issn:1005-8737.2004.05.015 |
| [13] |
REITMAN S, FRANKEL S. A Colorimetric method for the determination of serum glutamic oxalacetic and glutamic pyruvic transaminases[J]. American Journal of Clinical Pathology, 1957, 28(1): 56-63. DOI:10.1093/ajcp/28.1.56 |
| [14] |
TIFFANY T O, JANSEN J M, BURTIS C A, et al. Enzymatic kinetic rate and end-point analyses of substrate, by use of a GeMSAEC fast analyzer[J]. Clinical Chemistry, 1972, 18(8): 829-840. DOI:10.1093/clinchem/18.8.829 |
| [15] |
陈文祥, 张媚. 中华医学会检验学会血脂测定推存方法:血清总胆固醇测定参考[J]. 中华医学检验杂志, 1995, 18(2): 114-117. |
| [16] |
叶应妩, 王毓三, 申子瑜. 全国临床检验操作规程[M]. 3版.南京: 东南大学出版社, 2006: 479.
|
| [17] |
韩勃, 宋理平. 饲料淀粉水平对淡水黑鲷生长和消化酶活性的影响[J]. 上海海洋大学学报, 2010, 19(2): 207-213. |
| [18] |
蒋小珍, 张盛, 黄凯, 等. 饲料糖水平对斑点叉尾鮰生长和生理机能的影响[J]. 广东农业科学, 2014, 41(17): 111-118. DOI:10.3969/j.issn.1004-874X.2014.17.026 |
| [19] |
宋理平, 韩勃, 王爱英, 等. 碳水化合物水平对厚唇弱棘鯻生长和血液指标的影响[J]. 大连海洋大学学报, 2010, 25(4): 293-297. DOI:10.3969/j.issn.1000-9957.2010.04.003 |
| [20] |
蒋利和, 吴宏玉, 黄凯, 等. 饲料糖水平对吉富罗非鱼幼鱼生长和肝代谢功能的影响[J]. 水产学报, 2013, 37(2): 245-255. |
| [21] |
宋理平.宝石鲈营养需求的研究[D].硕士学位论文.济南: 山东师范大学, 2009: 67-69. http://cdmd.cnki.com.cn/Article/CDMD-10445-2009124768.htm
|
| [22] |
YANG W P, WANG A M, GAO F, et al. Dietary lipid concentrations influence growth and chemical and fatty acid compositions of juvenile redlip mullet, Liza haematocheila[J]. Aquaculture International, 2015, 23(4): 981-996. DOI:10.1007/s10499-014-9856-5 |
| [23] |
祝焱彬, 於叶兵, 杨文平, 等. 发酵豆粕替代鱼粉对梭鱼生长、血液生化指标和体成分的影响[J]. 盐城工学院学报(自然科学版), 31(4): 63-68. |
| [24] |
JAUNCEY K, ROSS B.A guide to tilapia feeds and feeding[M].Scotland: Institute of Aquaculture, University of Stirling, 1982: 29.
|
| [25] |
HOAGLUND C M, THOMAS V M, PETERSEN M K, et al. Effects of supplemental protein source and metabolizable energy intake on nutritional status in pregnant ewes[J]. Journal of Animal Science, 1992, 70(1): 273-280. |
| [26] |
ANDERSON J, JACKSON A J, MATTY A J, et al. Effects of dietary carbohydrate and fibre on the tilapia Oreochromis niloticus (Linn.)[J]. Aquaculture, 1984, 37(4): 303-314. DOI:10.1016/0044-8486(84)90296-5 |
| [27] |
SÁ R, GAVILÁN M, RIOSECO M J, et al. Dietary protein requirement of Patagonian blennie (Eleginops maclovinus, Cuvier 1830) juveniles[J]. Aquaculture, 2014, 428-429: 125-134. DOI:10.1016/j.aquaculture.2014.02.017 |
| [28] |
KIM S S, LEE K J. Dietary protein requirement of juvenile tiger puffer (Takifugu rubripes)[J]. Aquaculture, 2009, 287(1/2): 219-222. |
| [29] |
EL-SAYED A F M, SHIN-ICHI T. Protein and energy requirements of Nile tilapia, Oreochromis niloticus, fry[J]. Aquaculture, 1992, 103(1): 55-63. DOI:10.1016/0044-8486(92)90278-S |
| [30] |
FYNN-AIKINS K, HUNG S S O, LIU W, Li H. Growth, lipogenesis and liver composition of juvenile white sturgeon fed different levels of D-glucose[J]. Aquaculture, 1992, 105(1): 61-72. |
| [31] |
WANG Y, GUO J L, BUREAU D P, et al. Replacement of fish meal by rendered animal protein ingredients in feeds for cuneate drum (Nibea miichthioides)[J]. Aquaculture, 2006, 252(2/3/4): 476-483. |
| [32] |
ERFANULLAH, JAFRI A K. Protein-sparing effect of dietary carbohydrate in diets for fingerling Labeo rohita[J]. Aquaculture, 1995, 136(3/4): 331-339. |
| [33] |
MOHANTA K N, MOHANTY S N, JENA J, et al. Carbohydrate level in the diet of silver barb, Puntius gonionotus (Bleeker) fingerlings:effect on growth, nutrient utilization and whole body composition[J]. Aquaculture Research, 2010, 40(8): 927-937. |
| [34] |
SHIAU S Y, PENG C Y. Protein-sparing effect by carbohydrates in diets for tilapia, Oreochromis niloticus×O. aureus[J]. Aquaculture, 1993, 117(3/4): 327-334. |
| [35] |
蒋阳阳.不同蛋白质、脂肪和糖水平对团头鲂幼鱼生长性能、体组成和生理生化指标的影响[D].硕士学位论文.南京: 南京农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10307-1013286059.htm
|
| [36] |
NEMATIPOUR G R, BROWN M L, GATLIN Ⅲ D M. Effects of dietary carbohydrate:lipid ratio on growth and body composition of hybrid striped bass[J]. Journal of the World Aquaculture Society, 2010, 23(2): 128-132. |
| [37] |
SERRANO J A, NEMATIPOUR G R, GATLIN Ⅲ D M. Dietary protein requirement of the red drum (Sciaenops ocellatus) and relative use of dietary carbohydrate and lipid[J]. Aquaculture, 1992, 101(3/4): 283-291. |
| [38] |
胡毅, 陈云飞, 张德洪, 等. 不同碳水化合物和蛋白质水平膨化饲料对大规格草鱼生长、肠道消化酶及血清指标的影响[J]. 水产学报, 2018, 42(5): 777-786. |
| [39] |
周玉, 郭文场, 杨振国, 张凯. 鱼类血液学指标研究的进展[J]. 上海海洋大学学报, 2001(2): 163-165. DOI:10.3969/j.issn.1004-7271.2001.02.013 |




