中国奶业正面临严峻的挑战, 奶源过剩、原料奶价格低迷[1-2], 我国部分地区出现了卖奶难现象, "倒奶杀牛"时有发生[3-4]。牛乳酸化后可储存2~3 d, 这解决了大部分牛奶因奶价过低无法出售又无法储存的困难, 并且研究发现饲喂酸化乳不仅可以提高犊牛采食量、节省劳动力, 而且能够有效控制犊牛腹泻[5]。关于酸化乳的应用研究国内外已有一些相关报道。Daniels等[6]采用酸化乳饲喂犊牛后发现, 酸化乳可以降低腹泻率。Jaster等[7]的研究显示, 饲喂酸化乳的犊牛粪便评分较优。Woodford等[8]观察到犊牛饲喂酸化乳后粪便中干物质的量增加了, 但粪便形状在正常范围内。谭世新等[9]研究表明, 犊牛饲喂酸化乳较饲喂常乳腹泻率降低50%, 分析其原因可能是饲喂酸化乳降低了消化道内pH, 抑制了消化道内大肠杆菌的繁殖, 使消化道环境更适于乳酸菌生存。Yanar等[10]给犊牛饲喂添加甲酸的酸化代乳品(pH=4.8), 结果显示腹泻天数占总天数的比例显著降低。饲喂酸化乳对反刍动物粪便微生物多样性影响的研究较少, 因此, 本试验立足现代规模化奶牛场奶犊牛科学饲养生产实践, 开展探究饲喂酸化乳对犊牛粪便微生物多样性影响的研究, 以期为奶牛场应用酸化乳提供理论支撑。
1 材料与方法 1.1 试验设计本试验采用完全随机试验设计, 于黑龙江省安达市某大型规模化牧场选择体重在(40±5) kg的健康荷斯坦新生母犊牛10头, 随机分为2个处理(每个处理5头), 分别饲喂巴氏杀菌乳和酸化乳。试验期共90 d, 其中哺乳期60 d。在试验第50和90天, 每个处理采集5头犊牛的粪样, 采样结束后进行分组并测序。测序分组情况见表 1。
|
|
表 1 测序分组 Table 1 Grouping of sequencing |
犊牛出生后0.5 h内饲喂优质初乳4 L/头; 4日龄开始由独立的犊牛栏转入合群牛圈, 每个处理的5头犊牛在同一圈内。1~3日龄为人工通过奶瓶饲喂初乳; 4~60日龄使用奶罐饲喂对应的乳制品, 犊牛自行吮吸奶嘴, 保证24 h不断奶, 此阶段开始犊牛自由采食颗粒料, 提供充足清洁饮水。犊牛断奶后参照NRC(2001)[11]的营养需要量为犊牛提供由颗粒料、羊草和苜蓿组成的犊牛饲粮(表 2), 并保证充足清洁饮水。饲养期间保证2个处理的犊牛乳源相同, 其他饲养管理均相同。犊牛舍按照牛场日常生产管理要求进行清扫。
|
|
表 2 犊牛饲粮组成及营养水平(干物质基础) Table 2 Composition and nutrient levels of the diet for calves (DM basis) |
每日挤奶后取部分鲜奶经巴氏杀菌为巴氏杀菌乳, 另取部分鲜奶进行甲酸酸化处理后为酸化乳, 用于饲喂试验犊牛。巴氏杀菌的条件为:63~65℃下加热30 min。酸化乳的制作工艺为:将浓度为85%甲酸与水按照1.0:8.5的比例稀释, 将稀释液加入储存在全自动搅拌冷藏罐乳中以保证0~10℃环境, 搅拌均匀, 1 h后测定酸化乳pH, pH应处于4.0~4.5, 以4.2为最佳, 酸化时间要在10 h以上, 以达到最佳杀菌效果。制作酸化乳时注意当地水质pH。
1.4 样品采集与测定方法 1.4.1 腹泻率及粪便评分从饲喂乳制品开始至犊牛断奶, 每天观察犊牛粪便形态、颜色等。按表 3中粪便评分标准进行粪便评分, 3分(含)以上记为腹泻并计算腹泻率[13]:

|
|
|
表 3 粪便评分标准 Table 3 Scoring criteria of fecal |
分别于犊牛试验第50和90天晨饲前, 每个处理选取5头健康、体重相近的犊牛, 带无菌手套刮取犊牛直肠末端粪样约20 g, 装于无菌冻存管中, 液氮保存带回实验室后放于-80℃冰箱保存, 待提取粪便DNA, 并对16S rDNA扩增及测序。PCR扩增产物经Illumina Hiseq测序平台测序, 测序服务、数据库的构建及统计分析均由北京诺禾致源科技股份有限公司完成。
1.4.3 饲粮采集及分析测定方法用四分法收集新鲜饲粮样品1 kg, 用于测定饲粮中各种营养物质的含量。其中, 干物质(DM)、粗灰分(Ash)、粗脂肪(EE)和淀粉(starch)含量的测定参见AOAC(2000)[14]中方法, 粗蛋白质(CP)含量参照GB/T 6432-1994[15]中方法采用FOSS全自动凯氏定氮仪测定, 酸性洗涤纤维(ADF)和中性洗涤纤维(NDF)含量参考Van Soest等[16]的方法采用ANKOM A2000i(滤袋技术)全自动纤维仪测定, 钙(Ca)含量采用高锰酸钾法[17]测定, 磷(P)含量采用钒钼酸铵比色法[18]测定。
1.5 统计分析试验数据以"平均值±标准误"表示, 采用SAS V8统计软件对数据进行t检验, P < 0.05表示为差异显著, P < 0.01表示为差异极显著。
2 结果与分析 2.1 饲喂酸化乳对犊牛粪便评分和腹泻率的影响如表 4所示, 在4~10日龄阶段, 酸化乳处理的粪便评分较巴氏杀菌乳处理极显著降低(P < 0.01), 腹泻率较巴氏杀菌乳处理降低8.23个百分点, 差异显著(P < 0.05)。在11~30日龄阶段, 酸化乳处理的粪便评分较巴氏杀菌乳处理极显著降低(P < 0.01), 腹泻率较巴氏杀菌乳处理降低4.44个百分点, 差异显著(P < 0.05)。在31~60日龄阶段, 酸化乳处理的粪便评分较巴氏杀菌乳处理显著降低(P < 0.05), 腹泻率较巴氏杀菌乳处理降低4.44个百分点, 差异极显著(P < 0.01)。在4~60日龄阶段, 酸化乳处理的粪便评分较巴氏杀菌乳处理极显著降低(P < 0.01), 腹泻率较巴氏杀菌乳处理降低4.98个百分点, 差异极显著(P < 0.01)。
|
|
表 4 饲喂酸化乳对犊牛粪便评分和腹泻率的影响 Table 4 Effects of feeding acidified milk on fecal score and diarrhea rate of calves |
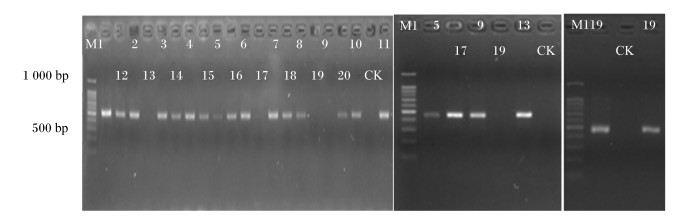
RFLP 16S rDNA PCR扩增检测图谱见图 1。由图可知, PCR扩增效果较好, 条带单一明亮, 可用于后续分析。
|
M1:Marker; 1~5:AB组的5个样本(AB1~5);6~10:AP组的5个样本(AP1~5);11~15:PB组的5个样本(PB1~5);16~20:PP组的5个样本(PP1~5);CK:空白。 M1:Marker; 1~5:five samples of AB group (AB1 to 5); 6~10:five samples of AP group (AP1 to 5); 11~15:five samples of PB group (PB1 to 5); 16~20:five samples of PP group (PP1 to 5); CK:blank control. 图 1 RFLP 16S rDNA PCR扩增检测图谱 Fig. 1 Detection map of RFLP 16S rDNA PCR amplification |
如表 5所示, 本试验共获得原始Tags序列1 526 477条, 除去低质量及嵌合体后, 最终用于后续分析的有效Tags序列为1 227 017条, 平均每个样本得到61 351条高质量序列, 其中Q20和Q30平均值分别为98%和95%。本次检测的样本序列数以及质量良好, 满足后续分析要求。
|
|
表 5 数据预处理统计及质控 Table 5 Data preprocessing statistics and quality control |
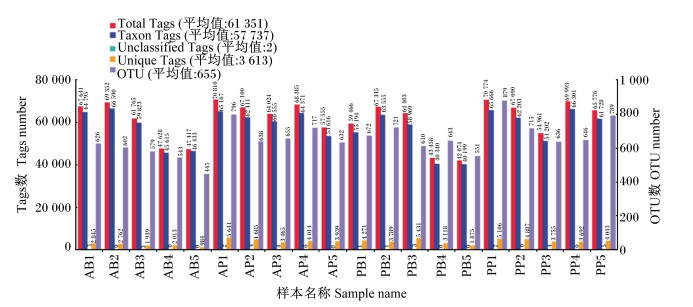
以97%的一致性将样本有效Tags聚类成为OTU, 并对OTU代表序列进行物种注释, 结果见图 2。由图可知, 平均各样本获得的Tags数为61 351条, 可用于构建OTU并且获得注释信息的Tags数为57 737条, 无法被聚类到OTU的Tags数为3 613条, 没有获得注释信息的Tags数为2条, 每个样本得到655个OTU。
|
Total Tags(红色)为每个样本用于OTU聚类等后续分析的有效数据; Taxon Tags(蓝色)为用于构建OTU并且获得注释信息的Tags数; Unclassified Tags(绿色)为没有获得注释信息的Tags数; Unique Tags(橙色)为无法聚类到OTU的序列; OTU(紫色)为每个样本得到的OTU数。 Total Tags (red) was the valid data for each sample for subsequent analysis such as OTU clustering; Taxon Tags (blue) was the number of Tags used to build the OTU and get the annotation information; Unclassified Tags (green) was the number of Tags that had not been annotated; Unique Tags (orange) were sequences that cannot be clustered to the OUT; OTU (purple) was the number of OUT per sample. 图 2 各样本的OTU聚类和注释情况统计 Fig. 2 OTU clustering and annotation statistics of each sample |
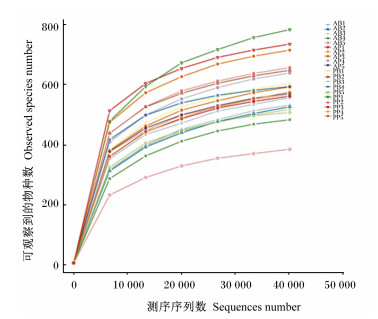
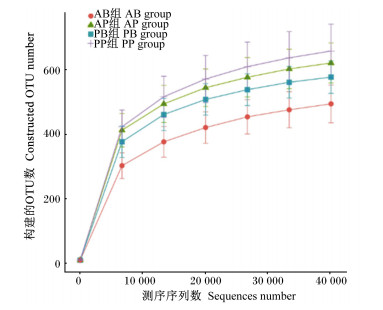
将抽取的测序数据量与对应的物种数来构建稀释曲线, 曲线趋向平坦时, 说明测序数据量渐进合理。由图 3和图 4可知, 单样本稀释曲线和组别稀释曲线均逐渐趋于平坦, 说明测序深度已基本满足试验需求。
|
图 3 单样本稀释曲线 Fig. 3 Single sample dilution curve |
|
图 4 组别稀释曲线 Fig. 4 Group dilution curve |
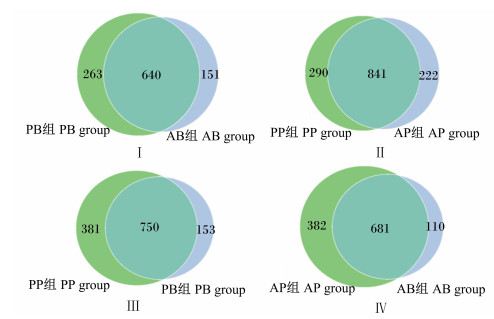
饲喂不同乳制品同一时间点的OTU Venn图见5-Ⅰ、图 5-Ⅱ。图 5-Ⅰ为饲喂巴氏杀菌乳和酸化乳犊牛在试验第50天时的粪便微生物OTU Venn图, 由图可知, 2组样本共有的OTU数为640个, PB组特有的OTU数为263个, AB组特有的OTU数为151个。图 5-Ⅱ为饲喂巴氏杀菌乳和酸化乳犊牛在试验第90天时的粪便微生物OTU Venn图, 由图可知, 2组样本共有的OTU数为841个, PP组特有的OTU数为290个, AP组特有的OTU数为222个。
|
图中每个圈代表一个组, 重叠部分代表组间共有的OTU数, 没有重叠部分代表每组特有的OTU数。 In the figure, each circle represented a group, the overlapping part represented the common OTU number between groups, and the non-overlapping part represented the unique OTU number of each group. 图 5 犊牛粪便微生物基于OTU的Venn图 Fig. 5 Calves fecal microbes based on OTU Venn diagram |
饲喂同种乳制品不同时间点的OTU Venn图见图 5-Ⅲ、图 5-Ⅳ。图 5-Ⅲ为饲喂巴氏杀菌乳犊牛在第50和90天的粪便微生物OTU Venn图, 由图可知, 2组样本共有的OTU数为750个, PP组特有的OTU数为381个, PB组特有的OTU数为153个。图 5-Ⅳ为饲喂酸化乳犊牛在第50和90天的粪便微生物OTU Venn图, 由图可知, 2组样本共有的OTU数为681个, AP组特有的OTU数为382个, AB组特有的OTU数为110个。
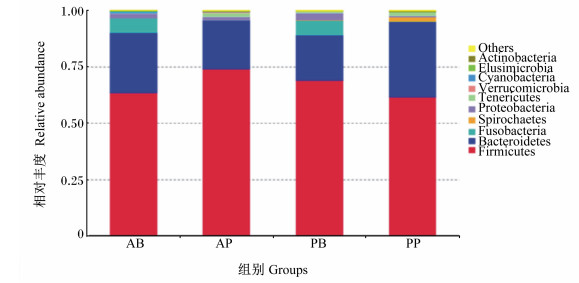
2.2.2.4 犊牛粪便微生物物种丰度分析图 6为4组样本在门水平上的物种相对丰度比较, 4组样本中部分优势菌群的相对丰度如表 6所示。4组样本中丰度最高的细菌为厚壁菌门(Firmicutes), 其次是拟杆菌门(Bacteroidetes)和梭杆菌门(Fusobacteria)。对饲喂巴氏杀菌乳的2个不同时期的组别PB组和PP组进行比较可以看出, Firmicutes和Fusobacteria的相对丰度随着犊牛月龄的增长呈逐渐下降趋势, 而Bacteroidetes的相对丰度则呈增加趋势。对饲喂酸化乳的2个不同时期的组别AB组和AP组进行比较可以看出, Bacteroidetes和Fusobacteria的相对丰度随着犊牛月龄的增长呈逐渐下降趋势, 而Firmicutes的相对丰度则呈增加趋势。对未断奶前饲喂不同乳制品的2个组别AB组和PB组进行比较可以看出, 饲喂酸化乳的AB组较饲喂巴氏杀菌乳的PB组Bacteroidetes的相对丰度高, Firmicutes和Fusobacteria的相对丰度则较低。对断奶后饲喂不同乳制品的2个组别AP组和PP组进行比较可以看出, 饲喂酸化乳的AP组较饲喂巴氏杀菌乳的PP组Firmicutes的相对丰度高, Fusobacteria的相对丰度相当, Bacteroidetes的相对丰度则较低。
|
|
表 6 犊牛粪便微生物中部分优势菌群的相对丰度 Table 6 Relative abundances of part dominant microfloras in fecal microbes of calves |
|
Firmicutes:厚壁菌门; Bacteroidetes:拟杆菌门; Fusobacteria:梭杆菌门; Spirochaetes:螺旋体门; Proteobacteria:变形菌门; Tenericutes:软壁菌门; Verrucomicrobia:疣微菌门; Cyanobacteria:蓝藻门; Elusimicrobia:迷踪菌门; Actinobacteria:放线菌门; Others:其他。 图 6 门水平上的物种相对丰度柱形图 Fig. 6 Relative abundance columnar chart of species on phylum level |
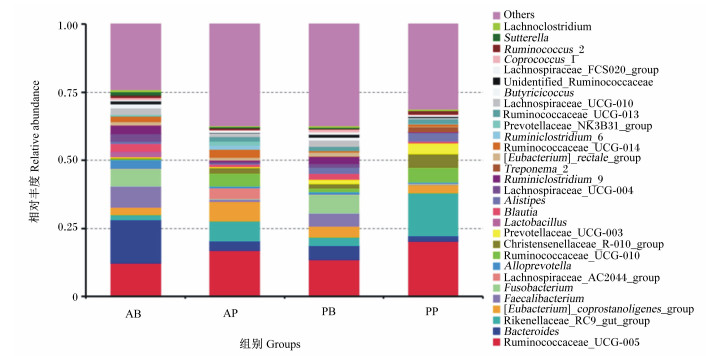
图 7为4组样本在属水平上的物种相对丰度比较。由图可知, PB组瘤胃球菌科UCG-005属(Ruminococcaceae_UCG-005)的相对丰度最高, 其次是梭杆菌属(Fusobacterium)和拟杆菌属(Bacteroides); AB组Bacteroides的相对丰度最高, 其次是Ruminococcaceae_UCG-005和栖粪杆菌属(Faecalibacterium); PP组Ruminococcaceae_UCG-005的相对丰度最高, 其次是理研菌科RC9肠道群(Rikenellaceae_RC9_gut_group)和瘤胃球菌科UCG-010属(Ruminococcaceae_UCG-010);AP组Ruminococcaceae_UCG-005的相对丰度最高, 其次是[Eubacterium]_coprostanoligenes_group和Rikenellaceae_RC9_gut_group。
|
Ruminococcaceae_UCG-005:瘤胃球菌科UCG-005属; Bacteroides:拟杆菌属; Rikenellaceae_RC9_gut_group:理研菌科RC9肠道群; Faecalibacterium:栖粪杆菌属; Fusobacterium:梭杆菌属; Lachnospiraceae_AC2044_group:毛螺旋菌科AC2044群; Alloprevotella:拟普雷沃菌属; Ruminococcaceae_UCG-010:瘤胃球菌科UCG-010属; Prerotellaceae_UCG-003:普雷沃氏菌科UCG-003属; Lactobacillus:乳酸杆菌属; Blautia:布劳特氏菌属; Alistipes:另枝菌属; Lachnospiraceae_UCG-004:毛螺旋菌科UCG-004属; Ruminiclostridium_9:瘤胃梭菌属9;Treponema_2:密螺旋体属2;Ruminococcaceae_UCG-014:瘤胃球菌科UCG-014属; Ruminiclostridium_6:瘤胃梭菌属6;Prerotellaceae_NK3B31_group:普雷沃氏菌科NK3B31群; Ruminococcaceae_UCG-013:瘤胃球菌科UCG-013属; Lachnospiraceae_UCG-010:毛螺旋菌科UCG-010属; Butyricicoccus:丁酸菌属; Unidentified_Ruminococcaceae:瘤胃球菌科未定义属; Lachnospiraceae_FCS020_group:毛螺旋菌科FCS020群; Coprococcus_1:粪球菌属1;Ruminococcus_2:瘤胃球菌属2;Sutterella:萨特氏菌属; Others:其他。图 8同The same as Fig. 8。 图 7 属水平上的物种相对丰度柱形图 Fig. 7 Relative abundance columnar chart of species on genus level |
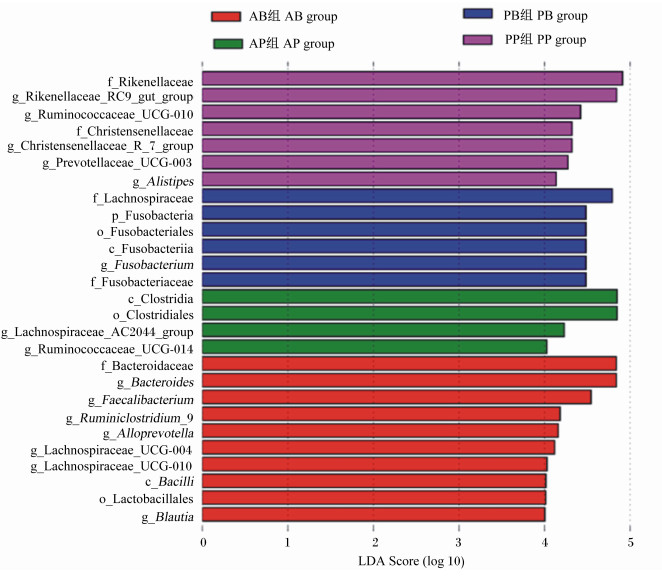
如图 8所示, 27个不同分类水平微生物的LDA Score大于4, PB组较其他组具有显著性差异的物种有毛螺旋菌科(Lachnospiraceae)、Fusobacteria、梭杆菌纲(Fusobacteria)、梭杆菌目(Fusobacteriales)、梭杆菌科(Fusobacteriaceae)、Fusobacteriam, 其中LDA Score最大即影响最大的为Lachnospiraceae。AB组较其他组具有显著性差异的物种有拟杆菌科(Bacteroidaceae)、Bacteroidetes、Faecalibacterium、瘤胃梭菌属_9(Ruminiclostridium_9)、拟普雷沃菌属(Alloprevotella)、毛螺旋菌科UCG-004属(Lachnospiraceae_UCG-004)、毛螺旋菌科UCG-010属(Lachnospiraceae_UCG-010)、芽孢杆菌纲(Bacill)、乳杆菌目(Lactobacillales)、布劳特氏菌属(Blautia), 其中影响最大的为Bacteroidaceae、Bacteroidetes。PP组较其他组具有显著性差异的物种有理研菌科(Rikenellaceae)、Rikenellaceae_RC9_gut_group、Ruminococcaceae_UCG-010、Christensenellaceae_R-7_group、普雷沃氏菌科UCG-003属(Prerotellaceae_UCG-003)、另枝菌属(Alistipes), 其中影响最大的为Rikenellaceae、Rikenellaceae_RC9_gut_group。AP组较其他组具有显著性差异的物种有梭菌纲(Clostridia)、梭菌目(Clostridiales)、毛螺旋菌科AC2044群(Lachnospiraceae_AC2044_group)、瘤胃球菌科UCG-014属(Ruminococcaceae_UCG-014), 其中影响最大的为Clostridia、Clostridiales。
|
图 8 LDA Score分布柱状图 Fig. 8 LDA Score distribution histogram |
犊牛腹泻会对犊牛的健康和生长产生非常不利的影响。犊牛腹泻一般分为营养性腹泻和传染性腹泻, 营养性腹泻一般由牛乳饲喂过量、牛乳成分改变、环境应激、低质或劣质代乳粉、奶温过低等原因造成, 传染性腹泻主要由细菌、病毒、寄生虫等引起。犊牛通常是因为饲养及各种应激等造成营养性腹泻引起肠道中菌群变化, 进而影响犊牛抵抗力, 患传染性腹泻[19]。肠道中乳酸杆菌等有益菌的生长和繁殖可抑制大肠杆菌等致病菌对肠壁的黏附和定植, 从而使消化道环境处于正常状态, 进而降低腹泻率[20]。韩静等[21]以犊牛为研究对象, 研究单栏定时定量饲喂牛乳和小群自由采食酸化乳2种不同饲养模式下犊牛的生长性能及腹泻情况, 结果显示, 小群自由采食酸化乳可显著降低犊牛腹泻率, 与本试验结果相似。本试验中, 在犊牛哺乳期内自由采食酸化乳较自由采食巴氏杀菌乳可降低犊牛腹泻率且可有效改善犊牛粪便评分肠道内pH处于6.0~8.0更适于大肠杆菌等有害菌的生长与繁殖[22], 饲喂酸化乳可能降低了犊牛肠道内的pH, 有可能是改善犊牛腹泻率的原因。
3.2 饲喂酸化乳对犊牛粪便微生物多样性的影响本试验的每个样本平均得到57 737条高质量的有效序列, 物种积累曲线显示随着样本量的增加, 物种数基本没有变化, 说明每个样本的测序深度足以反映样本群落所包含的微生物多样性和丰富度。本研究发现犊牛粪便微生物中主要的门是Firmicutes, 其次是Bacteroidetes, 在其他学者的研究中也发现在犊牛的肠道菌群中主要的门是Firmicutes和Bacteroidetes[23], 本试验结果与前人研究结果相符。此外, 研究显示Firmicutes和Bacteroidetes也作为优势菌门存在于大多数哺乳动物机体中[24-25]。
本研究的首要目标是探讨出不同处理乳制品是否影响犊牛粪便微生物多样性的变化, 因此本试验对不同时期犊牛粪便微生物多样性进行了分析, 结果显示, 通过Venn图和相对丰度柱状图发现, 第50和90天犊牛饲喂酸化乳和巴氏杀菌乳的粪便微生物结构不同, 第50天时2组样本共有的OTU数为640个, PB组特有的OTU数为263个, AB组特有的OTU数为151个, 饲喂酸化乳的AB组较饲喂巴氏杀菌乳的PB组的Bacteroides的相对丰度更高, AB组Bacteroides的相对丰度最高, PB组Ruminococcaceae_UCG-005的相对丰度最高。Bacteroidetes的丰度与肠道微生物的定植抗力(colonization resistance, CR)呈正相关[26-27], 感染初期能阻碍病原体的进入; 瘤胃球菌属(Ruminococcus)被认为是机体内原有的有益菌[28]。第90天时2组样本共有的OTU数为841个, PP组特有的OTU数为290个, AP组特有的OTU数为222个, 饲喂酸化乳的AP组较饲喂巴氏杀菌乳的PP组Firmicutes的相对丰度更高, PP组和AP组均为Ruminococcaceae_UCG-005的相对丰度最高。Firmicutes具有分解纤维的能力, 第90天时犊牛已断奶开始采食粗饲料, 故Firmicutes相对丰度较Bacteroidetes增加, 且饲喂酸化乳的犊牛Firmicutes的相对丰度较饲喂巴氏杀菌乳的犊牛更高, 说明饲喂酸化乳犊牛对纤维的消化能力更强。试验还探讨了酸化乳和巴氏杀菌乳在不同时期对犊牛粪便微生物多样性的影响。对于饲喂巴氏杀菌乳的犊牛粪便微生物, 2组样本共有的OTU数为750个, PP组特有的OTU数为381个, PB组特有的OTU数为153个, 在门水平上Firmicutes和Fusobacteria的相对丰度随着犊牛月龄的增长呈逐渐下降趋势, 而Bacteroidetes的相对丰度则呈增加趋势; 而对于饲喂酸化乳的犊牛粪便微生物, 2组样本共有的OTU数为681个, AP组特有的OTU数为382个, AB组特有的OTU数为110个, Bacteroidetes和Fusobacteria的相对丰度随着犊牛月龄的增长呈逐渐下降趋势, 而Firmicutes的相对丰度则呈增加趋势。上述结果说明饲喂巴氏杀菌乳和酸化乳的犊牛在断奶后的微生物丰度较哺乳期有所下降, 优势菌门均为Firmicutes、Bacteroidetes和Fusobacteria, 但菌群的变化趋势不同, 2组犊牛除哺乳期乳制品不同外其他饲养条件均相同, 所以造成这种差异很大可能是因为乳制品的不同。
LEfSe分析表示组与组之间具有统计学差异的生物标志物(biomarker)[29], 即组间差异显著的物种可用LDA Score表示。本试验中, 通过LEfSe分析绘制LDA Score分布柱状图, 当LDA Score大于设定值4时, PB组较其他组具有显著性差异的物种有Lachnospiraceae、Fusobacteria、Fusobacteria、Fusobacteriales、Fusobacteriaceae、Fusobacteriam。李昆[30]通过对江西部分地区部分健康仔猪与腹泻仔猪粪样菌群差异性比较发现, 腹泻哺乳仔猪粪样中Fusobacterium的比例更高, 而乳杆菌属(Lactobacillus)的比例更低, 表明Fusobacterium与哺乳仔猪腹泻有很大关系。本试验中饲喂巴氏杀菌乳的犊牛粪便微生物中Fusobacterium的相对丰度显著高于其他各组, 且此组犊牛粪便评分与腹泻率均高于饲喂酸化乳的犊牛, 证实Fusobacterium对犊牛腹泻有一定影响。AB组较其他组具有显著性差异的物种有Bacteroidaceae、Bacteroides、Faecalibacterium、Ruminiclostridium_9、Alloprevotella、Lachnospiraceae_UCG-004、Lachnospiraceae_UCG-010、Bacill、Lactobacillales、Blautia。Bäckhed等[31]研究表明, 拟杆菌对肠道内多糖的吸收与利用息息相关。毛螺旋菌对于降解果胶、纤维二糖和果糖等物质均有很好的效果, 还可产生果胶酯酶和果胶水解酶, 而水解酶既有内切酶活性又有外切酶活性。Lactobacillales包含乳酸杆菌, 乳酸杆菌对于动物肠道上皮的屏障保护、免疫激活、微生态平衡和代谢均有调节作用[32]。PP组较其他组具有显著性差异的物种有Rikenellaceae、Rikenellaceae_RC9_gut_group、Ruminococcaceae_UCG-010、Christensenellaceae_R-7_group、Prerotellaceae_UCG-003、Alistipes。有研究指出, Rikenellaceae是有益菌, 具有肠道保护性功能[33]。AP组较其他组具有显著性差异的物种有Clostridia、Clostridiales、Lachnospiraceae_AC2044_group、Ruminococcaceae_UCG-014。Lachnospiraceae_AC2044_group作为毛螺旋菌科中重要一员, 对动物糖代谢尤其是多糖降解方面具有重大作用。Ruminococcaceae_UCG-014为革兰氏阳性厌氧菌, 存在于牛和绵羊的瘤胃等处, 对发酵纤维二糖和纤维素起到重要作用, 由此表明AP组较其他组在多糖的利用上更具有优势。
4 结论饲喂酸化乳对哺乳期犊牛肠道菌群平衡产生了一定的调节作用, 并可降低腹泻率。与饲喂巴氏杀菌乳的犊牛相比, 饲喂酸化乳的犊牛在断奶后可能在纤维及多糖等利用上更具有优势。
| [1] |
郭利亚, 王加启, 李发第. 2015年我国奶业发展的挑战与机遇[J]. 中国畜牧杂志, 2015, 51(8): 24-27, 31. DOI:10.3969/j.issn.0258-7033.2015.08.005 |
| [2] |
谭桂宁, 杨忠, 曹亮, 等. 浅析我国奶业生产现状与发展对策[J]. 中国畜牧杂志, 2016, 52(8): 62-65. DOI:10.3969/j.issn.0258-7033.2016.08.012 |
| [3] |
巩少倩. 今冬奶业有点"冷"——进口奶价格下跌, 铸就中国奶农之殇[J]. 今日畜牧兽医:奶牛, 2014(10): 20-23. |
| [4] |
张元.基于奶农利益的黑龙江省原料乳价格影响因素分析[D].硕士学位论文.哈尔滨: 东北农业大学, 2014.
|
| [5] |
彭丽娟, 李阳东, 荀军. 犊牛的饲喂方法及饲养[J]. 养殖技术顾问, 2014(6): 1-2. |
| [6] |
DANIELS L B, HALL J R, HORNSBY O R, et al. Feeding naturally fermented, cultured, and direct acidified colostrum to dairy calves[J]. Journal of Dairy Science, 1977, 60(6): 992-996. DOI:10.3168/jds.S0022-0302(77)83976-3 |
| [7] |
JASTER E H, MCCOY G C, TOMKINS T, et al. Feeding acidified or sweet milk replacer to dairy calves[J]. Journal of Dairy Science, 1990, 73(12): 3563-3566. DOI:10.3168/jds.S0022-0302(90)79056-X |
| [8] |
WOODFORD S T, WHETSTONE H D, MURPHY M R, et al. Abomasal pH, nutrient digestibility, and growth of Holstein bull calves fed acidified milk replacer[J]. Journal of Dairy Science, 1987, 70(4): 888-891. DOI:10.3168/jds.S0022-0302(87)80088-7 |
| [9] |
谭世新, 翟卫爽, 俞新雷, 等. 饲喂酸化奶对犊牛生长发育的影响[J]. 中国奶牛, 2015(3/4): 13-16. |
| [10] |
YANAR M, GULER O, BAYRAM B, et al. Effects of feeding acidified milk replacer on the growth, health and behavioural characteristics of Holstein Friesian calves[J]. Turkish Journal of Veterinary and Animal Sciences, 2006, 30(2): 235-241. |
| [11] |
NRC.Nutrient requirements of dairy cattle[S].7th ed.Washington, D.C.: National Academy Press, 2001.
|
| [12] |
冯仰廉, 周建民, 张晓明, 等. 我国奶牛饲料产奶净能值测算方法的研究[J]. 中国畜牧杂志, 1987(1): 12-14. |
| [13] |
张蓉.能量水平及来源对早期断奶犊牛消化代谢的影响研究[D].硕士学位论文.北京: 中国农业科学院, 2008.
|
| [14] |
AOAC.Official methods of analysis of AOAC International[S].17th ed.Arlington: Association of Official Analytical Chemists, 2000.
|
| [15] |
国家技术监督局.GB/T 6432-1994饲粮中粗蛋白测定方法[S].北京: 中国标准出版社, 1994.
|
| [16] |
VAN SOEST P J, SNIFFEN C J, MERTENS D R, et al.A net protein system for cattle: the rumen submodel fornitrogen[C]//OWENS F N.Protein requirements for cattle: proceedings of an international symposium.Stillwater: Oklahoma State University, 1981: 265.
|
| [17] |
中华人民共和国国家质量监督检验检疫总局.GB/T 6436—2002饲料中钙的测定[S].北京: 中国标准出版社, 2007.
|
| [18] |
中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会.GB/T 6437—2002饲料中总磷的测定[S].北京: 中国标准出版社, 2002.
|
| [19] |
丑有财.复方女贞子和益生菌对犊牛生长性能和免疫功能的影响[D].硕士学位论文.哈尔滨: 东北农业大学, 2012.
|
| [20] |
王喜明, 许丽, 袁玲, 等. 低聚木糖对犊牛生长性能和血液生化指标的影响[J]. 东北农业大学学报, 2008, 39(7): 61-65. DOI:10.3969/j.issn.1005-9369.2008.07.015 |
| [21] |
韩静, 孟庆江, 刘景喜, 等. 饲喂酸化奶对犊牛采食量、腹泻率、血清生化及免疫指标的影响[J]. 中国饲料, 2016(18): 20-23. |
| [22] |
张宏福, 杨富林, 杨琳, 等. 断奶仔猪消化道酸度及其调控研究进展[J]. 中国畜牧杂志, 2002, 38(3): 51-52. DOI:10.3969/j.issn.0258-7033.2002.03.027 |
| [23] |
高凤.奶牛肠道微生物群落结构与多样性研究[D].硕士学位论文.邯郸: 河北工程大学, 2017.
|
| [24] |
ZHAO L P. The gut microbiota and obesity:from correlation to causality[J]. Nature Reviews Microbiology, 2013, 11(9): 639-647. DOI:10.1038/nrmicro3089 |
| [25] |
VAN DER WAAIJ D, BERGHUIS-DE VRIES J M, LEKKERKERK-VAN DER WEES J E C. Colonization resistance of the digestive tract in conventional and antibiotic-treated mice[J]. The Journal of Hygiene, 1971, 69(3): 405-411. DOI:10.1017/S0022172400021653 |
| [26] |
吴仲文, 李兰娟, 马伟杭. 肠道微生物定植抗力的新指标—B/E值[J]. 浙江预防医学, 2000, 12(7): 4-5. DOI:10.3969/j.issn.1007-0931.2000.07.002 |
| [27] |
WU W R, LV L X, SHI D, et al. Protective effect of Akkermansia muciniphila against immune-mediated liver injury in a mouse model[J]. Frontiers in Microbiology, 2017, 8: 1804. DOI:10.3389/fmicb.2017.01804 |
| [28] |
周祥.日粮不同NDF水平对杂交水牛瘤胃细菌群落结构与瘤胃主要功能细菌的影响[D].硕士学位论文.武汉: 华中农业大学, 2015.
|
| [29] |
DURSO L M, HARHAY G P, SMITH T P L, et al. Animal-to-animal variation in fecal microbial diversity among beef cattle[J]. Applied and Environmental Microbiology, 2010, 76(14): 4858-4862. DOI:10.1128/AEM.00207-10 |
| [30] |
李昆.江西部分地区哺乳仔猪含β2毒素基因的A型产气荚膜梭菌分子流行病学调查及拮抗CpA的乳酸杆菌筛选[D].硕士学位论文.南昌: 江西农业大学, 2016.
|
| [31] |
BÄCKHED F, DING H, WANG T, et al. The gut microbiota as an environmental factor that regulates fat storage[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(44): 15718-15723. DOI:10.1073/pnas.0407076101 |
| [32] |
曹力, 武晓红. 乳酸杆菌的肠道调节作用及其在动物生产中应用的研究进展[J]. 中国畜牧兽医, 2014, 41(11): 267-274. |
| [33] |
COX L M, YAMANISHI S, SOHN J, et al. Altering the intestinal microbiota during a critical developmental window has lasting metabolic consequences[J]. Cell, 2014, 158(4): 705-721. DOI:10.1016/j.cell.2014.05.052 |




