2. 中国农业科学院北京畜牧兽医研究所, 北京 100193
2. Beijing Institute of Animal Science and Veterinary Medicine, Chinese Academy of Agricultural Sciences, Beijing 100193, China
奶牛的产奶量与品种、胎次、泌乳天数、饲养管理、生理状态及环境温湿度等密切相关[1-3]。据报道,奶牛的泌乳水平与行为学之间存在显著相关性,特别是高产组奶牛的饮水时间和饮水次数显著高于低产组,而游走步数极显著低于低产组[4]。本团队前期研究发现,相同饲养条件下,干物质总采食量之间差异不显著,而产奶量却存在显著性差异。通过对高、低产组奶牛瘤胃发酵指标和菌群结构分析发现,高产组奶牛瘤胃液中丙酸和总挥发性脂肪酸含量显著高于低产组,且各组奶牛的瘤胃菌群结构及多样性均存在显著差异[5]。应用基于气相色谱串联飞行器/质谱(GC-TOF/MS)代谢组学方法分析,研究结果表明,奶牛的瘤胃液中存在54种显著差异的营养代谢物质,涉及的代谢通路主要富集于蛋白质的消化和吸收、腺苷三磷酸结合盒转运蛋白及不饱和脂肪酸的合成等信号通路[6]。由于产奶量受众多因素的调节,如遗传、营养、环境和管理等,这为研究奶牛泌乳周期自身调节机制带来了很大的困难。因此,深入了解不同泌乳水平奶牛自身泌乳调控机制、产奶量的变化规律及其影响因素的相关性,可以合理地调控奶牛泌乳量,进而达到改善乳品质的目的。
随着全球气候变暖的不断加剧,夏季气温升高,使得热应激对奶牛生产性能及繁殖性能的不利影响越来越受到广泛关注。当热应激发生时,机体作为一个有机整体,其调控反应机制非常复杂。据报道,当处于热应激状态时,奶牛通过大脑皮质协同交感-肾上腺髓质轴和垂体-肾上腺素皮质轴、垂体-甲状腺轴、垂体-性腺轴动员机体所有器官和组织,以降低应激刺激反应[7],主要表现为采食量减少、散热机制加快、泌乳量减少。目前,常用温湿指数(temperature-humidity index,THI)作为热应激判断标准之一[8]。THI不仅可以反映环境的温度和相对湿度对动物机体热量交换产生的影响,还可以判断动物处于热应激的程度。在夏季当THI高于68时,奶牛即处于热应激状态,而THI达到76之后,奶牛将处于严重热应激状态[9],而当THI高于72之后,数值每升高1,产奶量则下降0.2 kg[10]。然而,不同泌乳水平奶牛对热应激反应的比较研究较少。因此,在自然热应激条件下,通过对不同泌乳水平奶牛产奶量数据与热应激指数的相关性分析,可以为热应激状态下改善奶牛乳腺机能、降低热应激引起奶牛生产性能下降、提高奶牛健康高效生产提供新的研究思路。
目前,关于热应激的研究大多集中于饲喂功能性饲料添加剂、环境因素改变等减缓应激作用及其机制的研究,而对于自然热应激条件下,群组奶牛的产奶量与THI相关性的变化规律研究较少。因此,本研究旨在通过分析自然热应激条件下,高、中、低产奶牛的产奶量、乳成分与THI的相关性及回归分析,建立可控的奶牛热应激模型应用于生产实践研究,为缓解热应激提供理论依据。
1 材料与方法 1.1 试验设计选用胎次相近、体重为(610.00±22.13) kg、泌乳天数为(157±1.27) d、产奶量为(33.39±4.61) kg/d的泌乳中期健康荷斯坦奶牛60头,根据产奶量的不同,分为高产组[(42.47±3.73) kg/d]、中产组[(34.10±3.20) kg/d]及低产组[(28.28±4.19) kg/d],每组20头。试验于2019-06-20—2019-09-30在北京市延庆某奶牛养殖场进行,记录当日奶牛产奶量、天气情况(温度、湿度等)。当72 < THI < 79时,为轻度热应激,而当79 < THI < 89时,为中度热应激,当THI达到90以后,则为重度热应激[10]。2019-06-23—2019-07-22、2019-07-23—2019-07-29和2019-07-30—2019-09-09的THI均值都在72以上,即为热应激前期、热应激中期和热应激后期。2019-09-10—2019-09-24的THI的平均值为67.56,此段时间奶牛处于非热应激期。
1.2 饲养管理与试验饲粮按牛场正常饲养条件进行,每天饲喂3次,自由采食,自由饮水。应用阿菲金管道式挤奶系统,每天挤奶3次,分别在09:00、15:00和21:00;牛群为散栏式饲养方式。奶牛饲粮参照NRC(2001)配制,饲粮组成及营养水平见表 1。参照GB/T 6432—1994测定粗蛋白质含量,参照GB/T 6433—2006测定粗脂肪含量,参照GB/T 6434—2006测定酸性洗涤纤维和中性洗涤纤维含量,参照GB/T 6435—2002测定钙含量,参照GB/T 6436—2002测定磷含量。
|
|
表 1 饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the diet (DM basis) |
试验期间,于每周的周一、周三、周五分别进行乳样采集,将早、中、晚3次采集的奶样按照4 : 3 : 3比例混合后,4 ℃保存,使用MilkoScan FT120乳成分分析仪进行乳成分测定。利用阿菲金在线乳成分分析仪每天记录试验牛的产奶量。
4%乳脂校正奶(4% FCM)产量依据如下公式进行计算[11]:
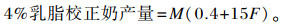
|
式中:M为产奶量;F为乳脂率。
THI的测定由干湿球温度计(河北武强滏阳仪表厂)完成。确保干湿球温度计位置适宜(牛舍中部,距离地面1.5 m处),每天3次记录(09:00、14:00和19:00)干球温度和湿球温度,计算平均值,并根据如下公式[12]计算THI:
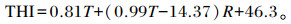
|
式中:T为温度(℃);R为相对湿度(%)。
1.4 数据统计与分析数据先用Excel 2007进行统计整理,采用Origin 9.0分析软件进行单因素方差分析、Duncan氏法多重比较分析、Pearson相关性分析与多元线性回归分析。P≤0.05表示差异显著,P < 0.01表示差异极显著,结果以平均值±标准差表示。
|
|
表 2 试验期内牛舍干球温度与THI的变化 Table 2 Changes of dry-bulb temperature and THI of cow barn during trial stage |
由表 2可知,2019-06-23—2019-09-09期间,THI的平均值为74.61±2.95,而奶牛的适宜THI为68以下,此段时间奶牛处于热应激期[10];2019-09-10—2019-09-24的THI的平均值为67.56±1.91,此段时间奶牛处于非热应激期。
2.2 不同泌乳水平奶牛产奶量和乳成分比较由表 3可知,高产组产奶量与低产组相比,高出50.18%(P < 0.01);4%乳脂校正奶产量在高、中、低产组间存在极显著差异(P < 0.01)。高产组乳脂率显著高于中产组(P < 0.05),高产组乳脂率/乳蛋白率极显著高于中产组(P < 0.01),而与低产组相比,差异不显著(P>0.05)。高产组乳蛋白率极显著高于中、低产组(P < 0.01)。各组间乳糖率差异不显著(P>0.05)。
|
|
表 3 不同泌乳水平奶牛的产奶量和乳成分比较 Table 3 Comparison of milk yield and milk composition of dairy cows with different levels of milk yield |
由表 4可知,在热应激期间,除乳糖率之外,产奶量及其他乳成分各组间均存在极显著差异(P < 0.01)。与热应激前期相比,热应激后期的高、中产组产奶量分别下降了6.46%和5.89%(P < 0.01),低产组产奶量无显著变化(P>0.05),然而,低产组产奶量在热应激中期显著下降(P=0.05)。在热应激中期,高、中产组乳脂率极显著低于热应激前期(P < 0.01),乳蛋白率无显著变化(P>0.05);在热应激后期,与热应激前期相比,各组乳蛋白率极显著降低(P < 0.01),中、低产组的乳脂率/乳蛋白率极显著升高(P < 0.01),低产组乳脂率极显著升高(P < 0.01)。
|
|
表 4 THI对奶产量和乳成分的影响 Table 4 Effects of THI on milk yield and milk composition |
由表 5可知,产奶量与泌乳天数、乳脂率和乳脂率/乳蛋白率呈显著负相关(P < 0.05),与THI、乳蛋白率和乳糖率呈显著正相关(P < 0.05)。
|
|
表 5 奶牛的产奶量、乳成分、THI的相关性 Table 5 Correlation of milk yield with milk composition and THI of dairy cows |
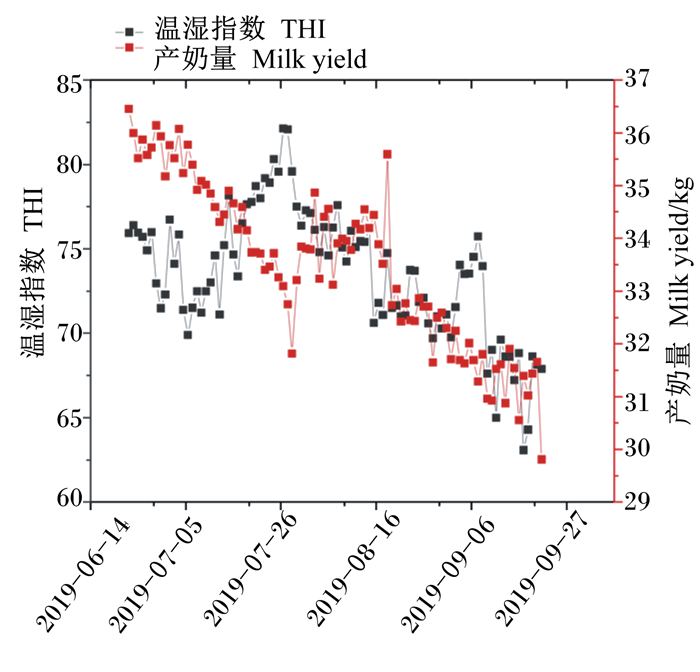
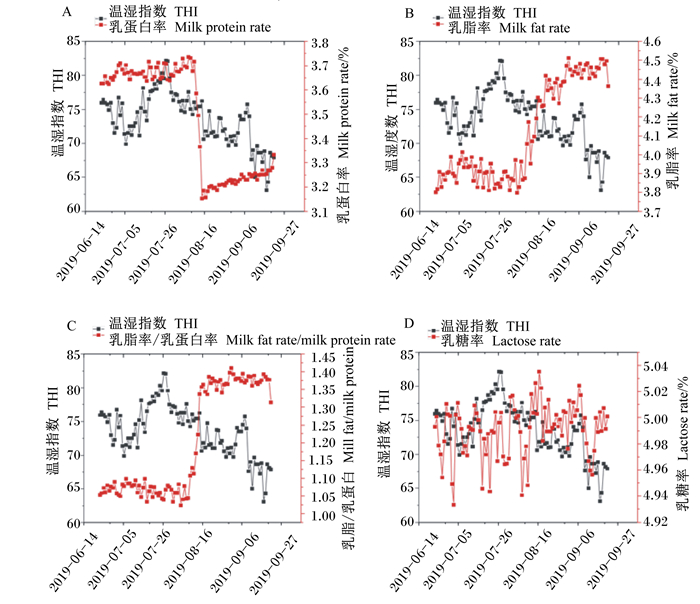
由图 1可知,随着时间的变化,THI与产奶量呈现一定的相关性。在热应激前期与热应激中期(2019-06-23—2019-07-29),随着THI增加,产奶量显著线性降低(r=-0.650,P < 0.05)(表 5)。随着时间的变化,THI与乳成分中乳蛋白率(图 2-A)、乳脂率(图 2-B)、乳脂率/乳蛋白率(图 2-C)和乳糖率(图 2-D)也具有一定的相关性。在热应激期间,THI与乳脂率存在显著的负相关关系(r=-0.288,P < 0.01)(表 5),THI与乳蛋白率的相关系数为r=0.458(P < 0.01)(表 5)。
|
图 1 THI与奶牛产奶量的变化曲线 Fig. 1 Changing curve of THI and milk yield |
|
图 2 THI与乳成分中乳蛋白率(A)、乳脂率(B)、乳脂率/乳蛋白率(C)和乳糖率(D)的变化曲线 Fig. 2 Changing curve of THI and milk protein rate (A), milk fat rate (B), milk fat rate/milk protein rate (C) and lactose rate (D) |
由表 6可知,产奶量与THI、乳成分之间差异极显著(F=44.63,P < 0.01)。产奶量与THI、乳成分之间的回归方程为:y=75.89-0.13x1-8.87x2-3.34x3+3.09x4, (x1为THI;x2为乳脂率;x3为乳蛋白率;x4为乳糖率);根据标准化偏回归系数的绝对值的大小,可以判断自变量对应变量的影响程度,x2、x3和x4的值大于x1,说明乳脂率、乳蛋白率和乳糖率对产奶量的影响高于热应激指数。乳成分受产奶量(体积)的影响,且自变量之间存在共线性。从标准化回归系数的符合中可知,x4前面为正号,说明乳糖率与产奶量呈正比,而x1、x2、x3符号为负号,说明THI、乳脂率和乳蛋白率与产奶量呈反比。
|
|
表 6 产奶量与THI、乳成分之间的方差分析 Table 6 Analysis of variance between milk yield and THI and milk composition |
通过对不同泌乳水平奶牛产奶量及乳成分与THI相关性分析,本研究发现,热应激期间产奶量显著下降,特别是高产组奶牛的产奶量呈极显著下降;不同泌乳水平奶牛的产奶量与热应激指数呈显著负相关关系。因此,有效阐明热应激与不同泌乳水平奶牛产奶量及乳成分的相关性趋势变化,建立奶牛热应激模型应用于生产实践,为有效减缓热应激对奶牛的危害提供理论依据。
本研究发现,高产组奶牛的产奶量在热应激期呈极显著下降;中、低产组奶牛的产奶量在热应激前期和后期变化不显著。据报道,当热应激发生时,奶牛的采食量下降,机体营养代谢消耗增加,导致机体代谢水平紊乱,因而奶牛的营养摄入量不足,使奶牛处于能量负平衡状态,导致免疫力下降,显著降低了奶牛的生产性能与繁殖性能[13-14]。此外,奶牛的产奶量还受到乳腺的发育及导管形成等因素的影响。由于本研究中缺乏每头牛的采食量数据,因此无法应用采食量变化导致的产奶量下降的原因进行阐述。由此,可推测高产组奶牛泌乳性能对于热应激的反应与机体代谢水平调节密切相关。特别是当热应激发生时,影响体内代谢酶的活性,产生较多的自由基,引起机体抗氧化能力的改变,而细胞和线粒体氧化损伤最终导致奶牛生产障碍[15]。然而,对于不同泌乳水平奶牛处于热应激期间体内酶水平的变化规律,有待进一步的研究。
本研究发现,热应激期间高、中产组的乳脂率显著下降,乳脂率与THI呈极显著负相关关系。据报道,在热应激期间,为了保持机体能量平衡,动物采食精饲料比较多,导致瘤胃内乙酸及丙酸的含量发生显著变化,而乙酸是乳脂合成的前体物,因此导致了热应激期乳脂率下降[16-17];本团队前期研究结果发现,与高产组相比,低产组奶牛的乙酸含量具有升高的趋势[5];由此推断,在热应激前期与中期,低产组奶牛的乳脂率无显著变化与热应激发生前瘤胃内的乙酸含量较高有着密切关系。此外,研究发现奶牛处于热应激状态时,血液中的葡萄糖含量显著升高[18],伴随胰岛素分泌量增加,诱导与糖异生相关的氨基酸含量升高[19],进而利用非酯化脂肪酸作为供能物质和乳合成的前体物质,致使机体处于能量负平衡状态,影响机体泌乳功能及乳成分的变化。综上,前期文献的研究结果表明,热应激期间奶牛机体内的相关代谢激素水平变化对产奶量及乳成分变化具有重要调节作用。而不同泌乳水平奶牛的产奶量与机体能量负平衡指标的相关关系如何,有待进一步的验证。因此,在今后的研究中,通过检测相关激素含量的变化,分析热应激期间的变化规律及其与不同泌乳水平奶牛产奶量变化的相关关系,是十分必要的。
随着热应激的发生发展,乳蛋白率不断下降。与前期研究报道相一致,奶牛乳腺处于热应激时期,乳汁营养价值显著降低,主要是由于乳腺上皮细胞合成乳蛋白相关基因的表达显著降低,乳中总酪蛋白含量减少,且尿素含量增加所致[20-21]。动物机体采食量的不足导致蛋白质摄入量降低,加速体内蛋白质的降解,引起乳蛋白率的降低[16-17]。此外,热应激发生时,血清中脂联素含量和腺苷酸活化蛋白激酶(AMPK)活性显著增加,而AMPK是细胞中重要的能量感受器,对细胞调节的代谢反应具有重要影响。那么,当机体处于能量负平衡状态时,AMPK使得合成乳蛋白的哺乳动物雷帕霉素靶蛋白(mTOR)信号通路受到抑制,影响细胞基因转录和生物合成代谢紊乱,最终影响奶牛乳腺泌乳性能及乳蛋白合成[22-23]。同时,热应激状态下奶牛的内分泌系统对乳汁合成及调控也起到了关键的作用。在高温环境下,下丘脑-垂体-肾上腺激素发挥重要的作用,不仅导致血液中葡萄糖含量增加[24-25],还可刺激肾上腺素糖皮质激素(主要为皮质醇激素)含量显著升高,进而影响中枢神经系统,表现为呼吸加快、兴奋、血压升高等现象,从而有效抵御热应激,维持机体内环境的稳定[26]。本团队前期研究结果表明,高产组奶牛的饮水次数显著高于低产组,特别是当温度升高时,饮水量急剧增多,采食量相应减少[4],即蛋白质的摄入量不足,导致产奶量下降,乳蛋白率下降。
通过回归分析结果可知,产奶量与THI、乳成分之间的回归分析可以判断自变量中的乳脂率对应变量乳产量的影响程度最大;且从标准化回归系数说明乳糖率与产奶量呈正比,而THI、乳脂率和乳蛋白率与产奶量呈反比。相关的研究指出,奶牛的产奶量与乳成分的变化与机体激素含量变化密切相关,因此,本研究的后续工作重点是关注奶牛体内相关激素水平的变化。据报道,热应激刺激下,机体的甲状腺素合成减少,肝脏组织氨基酸的分解与代谢紊乱,影响机体的β氧化与糖异生[26]。此外,热应激对性腺轴相关的雌二醇、孕激素等合成具有抑制作用,对乳腺组织的结构发育产生影响[27];同时,还可通过影响催乳素与其受体的结合,激活酪氨酸激酶2(JAK2),催化信号转导和转录活化蛋白5(STST5)的磷酸化,进而调控乳蛋白相关基因的表达[28]。热应激还可通过下丘脑-垂体-生长激素轴对泌乳能力的调节产生影响。因此,从内分泌角度分析各激素轴的变化十分必要,为探究热应激对泌乳奶牛产奶量合成调控影响和乳品质下降的机制,及进一步揭示奶牛热应激的发生机理和控制奶牛热应激的发生提供理论依据。
综上所述,本研究通过对不同泌乳水平奶牛在热应激发生时的产奶量及乳成分与THI相关关系分析及其变化规律的探讨,了解不同泌乳水平奶牛自身泌乳调控机制、产奶量的变化规律及其影响因素的相关性,为进一步解释在热应激条件下产奶量下降的原因提供了理论基础。本研究的后续工作将继续关注奶牛体内代谢酶活性、氧化应激、细胞凋亡及相关激素水平的变化,从饲粮消化吸收与乳腺的生理功能的角度分析,以期为缓解奶牛热应激和提高乳品质提供参考。
4 结论当热应激发生时,不同泌乳水平奶牛产奶量与THI呈显著负相关关系,乳蛋白率和乳脂率显著下降;与中、低产组相比,高产组奶牛产奶量及乳成分对热应激更敏感。
| [1] |
BAUMAN D E, HARVATINE K J, LOCK A L. Nutrigenomics, rumen-derived bioactive fatty acids, and the regulation of milk fat synthesis[J]. Annual Review of Nutrition, 2011, 31(1): 299-319. DOI:10.1146/annurev.nutr.012809.104648 |
| [2] |
KREHBIEL R C. Invited review:applied nutrition of ruminants:fermentation and digestive physiology[J]. The Professional Animal Scientist, 2014, 30(2): 129-139. DOI:10.15232/S1080-7446(15)30100-5 |
| [3] |
ZARRIN M, WELLNITZ O, VAN DORLAND H A, et al. Induced hyperketonemia affects the mammary immune response during lipopolysaccharide challenge in dairy cows[J]. Journal of Dairy Science, 2014, 97(1): 330-339. DOI:10.3168/jds.2013-7222 |
| [4] |
吴富鑫, 童津津, 张华, 等. 不同泌乳量奶牛行为学差异及其与泌乳性能的相关性[J]. 动物营养学报, 2019, 31(7): 3156-3163. DOI:10.3969/j.issn.1006-267x.2019.07.026 |
| [5] |
TONG J J, ZHANG H, YANG D L, et al. Illumina sequencing analysis of the ruminal microbiota in high-yield and low-yield lactating dairy cows[J]. PLoS One, 2018, 13(11): e198225. |
| [6] |
ZHANG H, TONG J J, ZHANG Y H, et al. Metabolomics reveals potential biomarkers in the rumen fluid of dairy cows with different levels of milk production[J]. Asian-Australasian Journal of Animal Sciences, 2020, 33(1): 79-90. DOI:10.5713/ajas.19.0214 |
| [7] |
颜瑞萍. 畜禽应激反应过程[J]. 中国畜禽种业, 2017, 13(9): 64. DOI:10.3969/j.issn.1673-4556.2017.09.045 |
| [8] |
DIKMEN S, HANSEN P J. Is the temperature-humidity index the best indicator of heat stress in lactating dairy cows in a subtropical environment?[J]. Journal of Dairy Science, 2009, 92(1): 109-116. DOI:10.3168/jds.2008-1370 |
| [9] |
李义, 方洛云, 熊本海, 等. 植物黄酮在缓解奶牛热应激上的应用前景[J]. 动物营养学报, 2019, 31(8): 3490-3495. |
| [10] |
RAVAGNOLO O, MISZTAL I. Genetic component of heat stress in dairy cattle, parameter estimation[J]. Journal of Dairy Science, 2000, 83(9): 2126-2130. DOI:10.3168/jds.S0022-0302(00)75095-8 |
| [11] |
侯昆, 童津津, 楚康康, 等. 竹叶黄酮与青蒿提取物对患隐性乳房炎奶牛产奶性能、乳中体细胞数及血清免疫和抗氧化相关指标的影响[J]. 动物营养学报, 2019, 31(9): 4286-4295. |
| [12] |
PAN L, BU D P, WANG J Q, et al. Effects of Radix Bupleuri extract supplementation on lactation performance and rumen fermentation in heat-stressed lactating Holstein cows[J]. Animal Feed Science and Technology, 2014, 187: 1-8. DOI:10.1016/j.anifeedsci.2013.09.008 |
| [13] |
HU H, BAI X, SHAH A A, et al. Dietary supplementation with glutamine and γ-aminobutyric acid improves growth performance and serum parameters in 22-to 35-day-old broilers exposed to hot environment[J]. Journal of Animal Physiology and Animal Nutrition, 2016, 100(2): 361-370. DOI:10.1111/jpn.12346 |
| [14] |
王哲奇, 徐元庆, 石璐璐, 等. 热应激对反刍动物采食和瘤胃功能的影响[J]. 动物营养学报, 2019, 31(8): 3448-3455. |
| [15] |
THANAN R, OIKAWA S, HIRAKU Y, et al. Oxidative stress and its significant roles in neurodegenerative diseases and cancer[J]. International Journal of Molecular Sciences, 2014, 16(1): 193-217. DOI:10.3390/ijms16010193 |
| [16] |
李征, 梅成, 郭智成. 热应激对荷斯坦奶牛生产性能和乳脂脂肪酸组成的影响[J]. 中国乳品工业, 2009, 37(9): 17-19. DOI:10.3969/j.issn.1001-2230.2009.09.005 |
| [17] |
程建波, 王伟宇, 郑楠, 等. 自然生产条件下热应激周期变化揭示泌乳中期奶牛出现"热应激乳蛋白降低征"[J]. 中国畜牧兽医, 2014, 41(10): 73-84. |
| [18] |
GUO J, GAO S T, QUAN S Y, et al. Blood amino acids profile responding to heat stress in dairy cows[J]. Asian-Australasian Journal of Animal Sciences, 2017, 31(1): 47-53. |
| [19] |
MIN L, ZHAO S G, TIAN H, et al. Metabolic responses and "omics" technologies for elucidating the effects of heat stress in dairy cows[J]. International Journal of Biometeorology, 2017, 61(6): 1149-1158. DOI:10.1007/s00484-016-1283-z |
| [20] |
COWLEY F C, BARBER D G, HOULIHAN A V, et al. Immediate and residual effects of heat stress and restricted intake on milk protein and casein composition and energy metabolism[J]. Journal of Dairy Science, 2015, 98(4): 2356-2368. DOI:10.3168/jds.2014-8442 |
| [21] |
HU H, ZHANG Y D, ZHENG N, et al. The effect of heat stress on gene expression and synthesis of heat-shock and milk proteins in bovine mammary epithelial cells[J]. Animal Science Journal, 2016, 87(1): 84-91. |
| [22] |
GWINN D M, SHACKELFORD D B, EGAN D F, et al. AMPK phosphorylation of raptor mediates a metabolic checkpoint[J]. Molecular Cell, 2008, 30(2): 214-226. |
| [23] |
ARAMBURU J, ORTELLS M C, TEJEDOR S, et al. Transcriptional regulation of the stress response by mTOR[J]. Science Signaling, 2014, 7(332): e2. DOI:10.1126/scisignal.2005326 |
| [24] |
张凡建, 徐聪, 翁晓刚, 等. 不同程度热应激对泌乳中期奶牛产奶量和乳成分的影响[J]. 中国兽医学报, 2014, 34(10): 1686-1688. |
| [25] |
TITTO C G A, NEGR |
| [26] |
李林, 艾阳, 谢正露, 等. 热应激状态下泌乳奶牛通过激活GHIGF-Ⅰ轴增强糖异生变化[J]. 中国农业科学, 2016, 46(15): 3046-3053. DOI:10.3864/j.issn.0578-1752.2016.15.018 |
| [27] |
QU M Z, WEI S J, CHEN Z Q, et al. Differences of hormones involved in adipose metabolism and lactation between high and low producing Holstein cows during heat stress[J]. Animal Nutrition, 2015, 1(4): 339-343. |
| [28] |
SALAZAR M, LERMA-ORTIZ A, HOOKS G M, et al. Progestin-mediated activation of MAPK and AKT in nuclear progesterone receptor negative breast epithelial cells:the role of membrane progesterone receptors[J]. Gene, 2016, 591(1): 6-13. |




