2. 广东省畜禽育种与营养研究重点实验室, 广州 510640;
3. 农业部华南动物营养与饲料重点实验室, 广州 510640;
4. 加拿大农业与农业食品部莱斯布里奇研究中心, 莱斯布里奇 T1J4B1;
5. 广州飞禧特生物科技有限公司, 广州 510640
2. Guangdong Key Laboratory of Animal Breeding and Nutrition, Guangzhou 510640, China;
3. Key Laboratory of Animal Nutrition and Feed Science(South China) of Ministry of Agriculture, Guangzhou 510640, China;
4. Agriculture and Agri-Food Canada, Lethbridge Research and Development Centre, Lethbridge AB T1J4B1, Canada;
5. Guangzhou Fishtech Biotechnology Co., Ltd., Guangzhou 510640, China
在当下“健康养殖”“饲料禁抗”“药物添加剂退出”三座大山的压迫下,抗生素替代品的开发方兴未艾,“替抗”已成为养殖业寻求的必然出路。植物提取物的营养调控对增强动物机体健康及其“替抗”作用是动物营养学研究的热点之一。在众多的植物提取物之中,单宁是一类特殊的多酚类植物次级代谢产物。人类对单宁的认识由来已久,古人使用它生产皮革,直至1795年Seguin才首次将这种能转化生皮的“植物提取物”描述为“植物多酚”。随着科技的发展,单宁已在食品、医药、化妆品、造纸、污水处理等方面得到广泛应用。长期以来,缩合单宁被视为饲料“抗营养因子”,因其具有苦涩味,使动物采食量降低,且不易被消化道吸收,容易与蛋白质、糖、消化酶、金属离子形成复杂的复合物,抑制营养物质的消化吸收,使动物生产性能下降,因而限制了缩合单宁在饲料和养殖业中的应用[1]。然而,近年来的研究发现,低剂量缩合单宁不仅不影响饲料适口性和动物生产性能,还能增强机体抗氧化能力和免疫力,提高动物健康水平[2-4]。小鼠急性毒性试验表明,缩合单宁小鼠经口半致死剂量(LD50)为13.192 g/kg,毒理学分级为实际无毒物质[5]。
天然植物提取物缩合单宁是由黄烷-3-醇单体组成的多酚类聚合物,分子质量在1 000~20 000 u。缩合单宁广泛存在于自然界,如水果、豆科牧草、灌木、谷物、草本植物的细胞壁或叶、花和种子的液泡之内,具有显著的抗氧化、免疫刺激、抗菌、抗炎、抗寄生虫等生物活性。与化学合成的抗氧化剂相比,缩合单宁具有无污染、无残留、安全高效等诸多优点,在抵御氧化应激对机体的危害、增强机体抗氧化能力、改善肠道健康等方面表现出巨大的研究价值和开发潜力,是理想的抗生素替代品。
本文介绍了缩合单宁的化学结构和生物活性,总结了近年来缩合单宁在畜牧和水产养殖业中的应用研究进展,以期为深化缩合单宁的生物功能研究,开发缩合单宁作为一种新型饲料添加剂并加以推广应用提供理论依据。
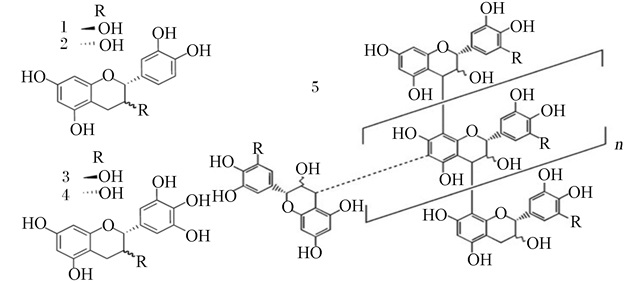
1 缩合单宁的化学结构缩合单宁是由儿茶素、表儿茶素、没食子儿茶素和表没食子儿茶素按照一定比例聚合而成的低聚物或高聚物(图 1)。缩合单宁分子质量大、结构复杂,很难在消化道环境中降解[6],其化学性质和生物活性根据其植物来源、单体组成、聚合度和分子间相互作用的不同而存在较大差异[7]。
|
1:儿茶素(+)-catechin;2:表儿茶素(-)-epicatechin;3:没食子儿茶素(+)-gallocatechin;4:表没食子儿茶素(-)-epigallocatechin;5:缩合单宁基本单元the basic unit of condensed tannins。 图 1 缩合单宁的化学结构 Fig. 1 Chemical structures of condensed tannins |
植物缩合单宁的提取普遍参照Terrill等[8]描述的浸提法,该方法能够得到纯度较高(90%以上)的缩合单宁,具体操作为:选用甲醇或70%丙酮等极性溶剂提取,加入乙醚溶剂使溶液分层,弃掉有机相,保留水相溶液,反复提取后对水相溶液进行蒸发浓缩,然后进行冷冻干燥,所得白色粉末状物质即为缩合单宁的粗提物。将缩合单宁的粗提物溶于80%乙醇溶液中,用滤纸过滤杂质,将滤液加入Sephadex LH-20交联葡聚糖柱(Sephadex LH-2使用前后均需浸泡在80%乙醇水溶液中)中,搅拌后真空抽滤,反复加入80%乙醇溶液,直至真空抽滤所得溶液为无色,弃去滤液,然后添加50%丙酮溶液洗脱柱子,反复冲洗直至滤液变为无色为止,所得滤液经旋转蒸发仪(40 ℃,120 r/min)除去丙酮,经氮气吹扫仪吹干,置于-20 ℃保存,然后进行冷冻干燥,冻干样品即为纯化的缩合单宁(需在-20 ℃避光保存)。
除了浸提法之外,缩合单宁的提纯还包括超声波提取[9]、微波提取[10]、超临界流体萃取[11]、酶转化提取[12]等方法,但由于植物中缩合单宁含量低以及现有纯化技术成本高的原因,使缩合单宁的工业化生产面临挑战,需要各方共同努力以扩大缩合单宁生产和应用范围。在缩合单宁的提纯过程中,要根据不同提取物和产品的使用目的来选择合适的提取方法,已达到经济、环保、提取率高、活性良好的目的。
3 缩合单宁的生物活性 3.1 抗氧化动物的抗氧化应激能力直接决定了机体的抗病力,缩合单宁具有清除自由基的功能,这对于提高动物健康具有重要意义[13]。缩合单宁通过向自由基提供电子,从而产生更加稳定的且危害更小的自由基结构物质,以达到清除超氧化物自由基、羟基自由基及过氧化氢和一氧化氮的目的[14]。缩合单宁较高的分子质量和芳香环的高度羟基化特点,使其比低分子质量多酚或非酚类抗氧化剂具有更强的抗氧化能力[15]。虽然体内和体外研究均表明缩合单宁具有较强的抗氧化活性[3, 16],但其抗氧化机理尚不完全清楚。Zhang等[17]报道,缩合单宁抑制脂肪氧化的机理与传统抗氧化剂[如丁基羟基茴香醚(BHA)、二丁基羟基甲苯(BHT)和特丁基对苯二酚(TBHQ)]相似,即通过抑制环氧酶活性达到抗氧化效果。Karama c ′等[18]研究表明,缩合单宁在氧化还原过程中贡献氢原子或电子,如能够与Fe2+螯合进而干扰芬顿反应,阻断氧化过程而发挥抗氧化作用。
提高动物机体抗氧化能力的根本措施是提高酶促体系的功能[19],而Kelch样环氧氯丙烷相关蛋白1(Keap1)-核转录因子E2相关因子2(Nrf2)/抗氧化反应元件(ARE)信号通路是调节机体内多种抗氧化酶表达的关键通路。近年来研究发现,缩合单宁可通过激活细胞Keap1-Nrf2/ARE抗氧化信号通路,上调下游Ⅱ相解毒酶和抗氧化酶基因表达水平,提高动物的抗氧化应激能力[20]。赵娇[21]研究表明,葡萄籽缩合单宁可通过提高Keap1的mRNA表达量,减轻活性氧自由基对仔猪肝脏的氧化损伤程度。Monagas等[22]报道,缩合单宁不能直接被肠道吸收利用,而是被肠道细菌降解或转化。肠道细菌是多酚类物质发挥生物活性的关键因素[23]。乳酸菌被定义为“抗氧化细菌”,因其具有清除活性氧、抵抗超氧阴离子自由基和过氧化氢的作用[24]。研究表明,黄烷-3-醇单体可促进乳酸菌和拟杆菌增殖,从而改善肠道健康[25]。因此,缩合单宁的抗氧化作用也可能是通过与肠道抗氧化细菌的相互作用实现的。有关缩合单宁干预肠道菌群发挥抗氧化作用的机理有待进一步深入研究。
3.2 抗炎抗炎活性是缩合单宁的重要生物功能之一[26]。由于炎症过程的复杂性及可能存在的干扰,缩合单宁抗炎的作用机制尚未明确。大多数关于缩合单宁抗炎活性的研究针对的是其抗氧化活性及其对核因子-κB(NF-κB)的干扰,后者可促进许多炎症细胞因子的转录,如白细胞介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)或核因子-κB受体活化因子配体(RANKL)。体外研究表明,葡萄籽缩合单宁通过调节细胞因子的表达来降低轻度炎症疾病,如肥胖[27],还能有效缓解关节炎、肠炎、脑脊髓炎、动脉粥样硬化、皮炎等炎症相关疾病[28]。然而,动物体内有关缩合单宁抗炎活性的研究和报道很少,仍需要进一步明确缩合单宁的抗炎作用机制。缩合单宁的抗炎活性可能与其调节巨噬细胞的免疫应答有关,因为缩合单宁抑制了细胞炎症反应过程中促炎症因子一氧化氮的生成[29]。缩合单宁的抗炎活性还可能与其抑制丝裂原活化蛋白激酶(MAPK)和NF-κB炎症信号通路的活化[30]及降低细胞通透性[31]有关,通过减少炎性细胞因子如白细胞介素-6(IL-6)和IL-8的释放,达到抗炎目的。值得注意的是,Park等[29]研究表明,单体和二聚体的缩合单宁可抑制干扰素γ诱导的一氧化氮(NO)产生、TNF-α分泌以及NF-κB依赖性基因的表达水平,而三聚体原花青素C-2可增强这些参数。此外,在未刺激的原始巨噬细胞中,原花青素C-2增加了TNF-α的分泌,且呈浓度和时间依赖效应,这表明了缩合单宁的抗炎活性受其化学结构和聚合度的直接影响。
3.3 抗菌缩合单宁被证明具有显著的抑菌活性[32]。缩合单宁对乳酸菌、金黄色葡萄球菌、大肠杆菌、沙门氏菌、肺炎链球菌等细菌具有抑制或杀灭作用[33],对单细胞酵母菌、丝状真菌、霉菌等真菌具有显著的抑制效果[34],对假单胞菌、志贺氏杆菌、幽门螺杆菌、炭疽杆菌等病原菌的生长同样具有抑制作用[4, 35]。缩合单宁的抑菌机理主要归纳为以下5个方面:1)抑制胞外酶活性;2)通过抑制氧化磷酸化或电子传递过程直接作用于微生物代谢;3)与过渡金属络合抑制金属酶的合成;4)竞争性剥夺微生物生长所需底物;5)破坏细胞膜完整性和通透性而抑制微生物生长。相关研究表明,微生物细胞膜是缩合单宁发挥抑制作用的主要部位,缩合单宁使细胞聚集并破坏其结构[36],这可能是缩合单宁抑菌的主要原因。缩合单宁的抑菌活性具有微生物特异性,如其对革兰氏阳性菌的抑制效果强于革兰氏阴性菌[37]。Peng等[38]报道,冻干、晒干和青贮方法制备的紫色达利菊缩合单宁的化学结构不同,其对大肠杆菌25922的抑制作用存在显著差异,其中冻干紫色达利菊缩合单宁的抑菌效果最强。Peng等[38]还发现,紫色达利菊缩合单宁对大肠杆菌不同菌株的作用效果不同,其对大肠杆菌25922有抑制效果,但不影响大肠杆菌35281的生长。缩合单宁对微生物作用效果的差异归因于缩合单宁含量和化学结构的多样性,如植物来源、分子聚合度、立体化学结构、羟基化类型和链长的变化,将导致缩合单宁抑菌效果的差异。Mueller-Harvey[39]报道,羟基数目和单宁氧化后过氧化氢的释放是影响单宁抗菌效果的2个重要因素。缩合单宁的三羟基B环结构(如没食子儿茶素)比二羟基B环结构(如儿茶素)的抑菌效果更佳,表儿茶素没食子酸和表没食子儿茶素没食子酸对肉毒杆菌(Clostridium botulinum)的毒性大于表儿茶素和表没食子儿茶素[4]。研究表明,长期使用单一纯化的抑菌剂将导致微生物的耐药性增加,常见方法是通过改变微生物自身细胞膜的通透性或选择能够分解抑菌剂的菌群成员,缩合单宁结构的复杂性使其能够通过多种机制协同作用抑制或杀灭微生物,从而表现出比一般化学抑菌剂或单宁的纯化单体更加优越的抑菌效果。
3.4 抗寄生虫缩合单宁对寄生虫的抑制作用呈剂量依赖效应,且发生在其生命周期的各个阶段[40]。在实际生产中,放牧者利用饲喂富含单宁的牧草来减少牛、羊体内的寄生虫,以达到替代抗寄生虫药物的目的[41]。研究表明,植物来源的缩合单宁(如红豆草、百脉根、白坚木、冠状岩黄蓍、菊苣、绿茶)对毛圆线虫、肺线虫、消化道线虫、捻转血矛线虫等寄生虫的卵发育具有明显的抑制作用[42-44]。缩合单宁可减少反刍动物瘤胃原虫数量,抑制肠道寄生虫生长[3, 45]。缩合单宁对寄生虫的抑制作用机理存在2种假说,即代谢阻断假说和营养免疫假说。代谢阻断假说认为缩合单宁能够破坏寄生虫的代谢过程,例如:通过结合线虫角质层所含的脯氨酸和羟脯氨酸而损害线虫的正常生理过程[46],或通过抑制线虫蛋白酶的分泌从而影响线虫的新陈代谢[47],或直接结合在原虫细胞的表面并对原虫产生毒性[48]。营养免疫假说认为,缩合单宁能够结合蛋白质并顺利通过瘤胃,从而提高机体对营养物质的吸收,增强动物的免疫力和对寄生虫的抵抗力[49]。值得关注的是,与抗菌作用效果类似,缩合单宁的抗寄生虫作用效果也因缩合单宁的化学结构和组成、寄生虫的种类和生长阶段以及宿主种类的不同而大不相同[50]。Molan等[42]研究发现,原翠雀定和原花青素在缩合单宁中的比例会影响缩合单宁抗寄生虫的效果,原翠雀定比原花青素对不同阶段寄生虫的抑制效果更明显。
3.5 抗病毒缩合单宁可增加动物或人对猪流行性腹泻病毒(PEDV)、牛腺相关病毒(AAV)、诺如病毒(NoVs)、丙型肝炎病毒(HCV)、流感病毒、单纯疱疹病毒(HSV)、人类免疫缺陷病毒(HIV)等病毒感染的抵抗力[4]。缩合单宁的抗病毒活性与自身化学组成和分子结构以及病毒的种类有关。例如,二聚体缩合单宁比其他分子结构的缩合单宁具有更强的抗HSV、抗HIV和清除自由基的能力,而缩合单宁B环上的邻三羟基基团在发挥抗HSV和清除自由基过程中起重要作用[14]。Ueda等[51]报道,柿子缩合单宁显著降低了12种被测病毒的感染性,而绿茶、金合欢和五倍子缩合单宁只对部分病毒有效,蛋白质聚集可能是柿子缩合单宁抗病毒的基本机制。目前,普遍认为缩合单宁抗病毒的作用机理如下:1)抑制病毒对细胞的吸附;2)抑制病毒对细胞核的渗透;3)抑制病毒的逆转录酶。缩合单宁通过以上途径,最终阻碍了病毒的脱壳,以达到解毒功效。
3.6 调节营养物质代谢除了抗氧化、抗炎、抗菌、抗寄生虫、抗病毒之外,缩合单宁还表现出降血糖、降脂、抗应激、调节肌肉脂肪酸分布等生物活性。
Huang等[52]和Peng等[3]报道,紫色达利菊缩合单宁能够显著降低绵羊血清中葡萄糖的含量。缩合单宁可能通过抑制糖代谢相关酶活性[53],刺激胰岛β细胞分泌胰岛素[54],抑制葡萄糖转运载体mRNA表达[55],刺激肠道L细胞分泌胰高血糖素样肽-1(GLP-1)[56],改变肠道微生物的种类和数量而影响细菌对肠道细胞的黏附[57]等途径降低血糖含量。
葡萄籽缩合单宁可通过调节miRNA降低脂肪酸合成酶基因表达,减少脂肪在肝脏中的积累[58]。柿子缩合单宁通过上调肝脏细胞色素P450 7A1(CYP7A1)基因表达,促进粪便中胆汁酸的排泄,达到降低血脂的目的[59]。
缩合单宁可增强动物机体的抗应激能力。卢俊姣[60]研究表明,葡萄籽缩合单宁可缓解饲料中镉金属对罗非鱼的毒性作用,减少鱼体肝脏和肠道的损伤。Fedeli等[61]发现,缩合单宁可以减少自由基对鳟鱼红细胞的攻击,阻碍细胞DNA氧化损伤。
Girard等[62]研究表明,红豆草缩合单宁能够调控肌肉中游离脂肪酸组成,增加n-3等有益脂肪酸含量,同时减少羊肉中甲基吲哚含量。饲粮中添加栗子缩合单宁可提高羊奶中α-亚麻酸含量,改善奶品质[63]。Chamorro等[64]研究表明,饲粮中添加5%~10%的葡萄渣缩合单宁可提高肉鸡大腿肌肉中多不饱和脂肪酸的含量。Yan等[65]报道,添加0.3%葡萄渣缩合单宁改变了仔猪皮下脂肪和肌肉中的脂肪酸组成。
4 缩合单宁在动物生产中的应用研究进展 4.1 单胃动物在猪和家禽饲粮中,缩合单宁因影响饲料适口性而普遍被视为“抗营养因子”,通常采用微生物降解、热处理、碱处理等方式破坏饲料原料中单宁的化学结构,缓解或消除其抗营养作用[66]。缩合单宁对动物的营养和健康表现为“双刃剑”,这与其含量和化学结构密切相关。近年来发现,低含量的缩合单宁对改善动物生产性能、抗菌、调节肠道菌群具有显著效果[2],从而显现了缩合单宁饲料化开发利用的巨大潜力。Chamorro等[64]报道,高达10%的葡萄渣提取物(缩合单宁)不仅不影响1~21日龄肉鸡的生长性能,还能提高机体的抗氧化能力。另有研究表明,10%的葡萄渣缩合单宁提取物不仅不影响仔猪的生长性能,还能增加肌肉红色[67]。Brus等[68]报道,饲粮中添加0.19%的栗树缩合单宁可显著提高82~127日龄仔猪的生长性能,还可增加肠道乳酸菌数量,抑制致病性大肠杆菌生长。植物缩合单宁还能降低肉鸡感染球虫病的死亡率,提高染病肉鸡增重率和抗氧化能力[69-70]。从缩合单宁本身具有的苦涩味和促生长作用分析,其对单胃动物的作用效果最终取决于其对饲料适口性的负面影响及其促进动物健康(调节肠道菌群、抗氧化、免疫刺激等)的平衡关系,同时受动物种类、生理状态、饲粮组成、缩合单宁含量和化学结构的影响。从动物种类来看,猪对饲粮中缩合单宁的耐受力比家禽强,可能是因为猪的腮腺肥大以及与唾液中分泌的富含脯氨酸的蛋白质结合中和了缩合单宁的毒性作用有关[71]。
4.2 反刍动物缩合单宁对反刍动物的应用价值高于单胃动物,因为缩合单宁具有与蛋白质结合过瘤胃的特性,且能够抑制瘤胃蛋白质降解菌的生长,从而调控瘤胃内氮代谢。Mc Mahon等[48]研究表明,低含量的缩合单宁可以降低瘤胃可溶性氮和氨态氮的含量,提高蛋白质的利用率且不影响动物采食量和碳水化合物的消化率,这对于反刍动物意义重大,因为蛋白质是一种昂贵的饲料资源。缩合单宁对反刍动物氮代谢的调控作用通常表现为生长或生产性能的提高,归因于缩合单宁增加了瘤胃发酵过程中菌体蛋白的合成量,提高了血液和小肠中必需氨基酸的含量,使得较少的氮被分解。Marten等[72]发现,在放牧条件下,采食红豆草比采食苜蓿草的小母牛体重增加了19%。Wang等[73-74]研究表明,饲喂缩合单宁含量为34 g/kg的百脉根提高了母羊的增重率、胴体质量、羊毛产量以及泌乳中后期的产奶量,同时增加了羊奶中乳糖和乳蛋白的含量。反刍动物对缩合单宁的耐受力通常高于单胃动物,尽管一些牧草富含缩合单宁,但其适口性与不含单宁的豆科牧草相当,甚至比豆科牧草更好[75]。Peng等[3]报道,缩合单宁含量为64.1 g/kg的紫色达利菊干草不影响绵羊的适口性,且比苜蓿干草具有更高的营养物质表观消化率,同时紫色达利菊缩合单宁不影响绵羊的生产性能,且能提高血清抗氧化能力,降低瘤胃原虫数量。此外,含有缩合单宁牧草的营养价值和安全性往往高于不含缩合单宁的牧草。Peng等[34]研究表明,紫色达利菊缩合单宁减少了牧草青贮及有氧暴露过程中蛋白质的降解,尤其是抑制了腐败微生物和产毒真菌的生长,并降低了脱氧雪腐镰刀菌烯醇和赭曲霉毒素的含量,增加了青贮过程中细菌菌群的多样性以及有氧暴露过程中细菌和真菌菌群的多样性,从而提高了牧草青贮发酵品质和有氧暴露的稳定性。缩合单宁还被报道具有抑制瘤胃甲烷排放和胀气的功效,这对于保护生态环境和放牧下的安全生产至关重要[41]。Sottie等[76]报道,肉牛的胀气发病率随着红豆草缩合单宁含量的增加而降低,推测缩合单宁通过抑制瘤胃中产生黏性物质的细菌生长,减少了蛋白质泡沫的形成和瘤胃产气量,从而抑制胀气。缩合单宁减少甲烷排放的作用归因于其对瘤胃产甲烷细菌和原虫的抑制[77]。
4.3 水产动物与单胃动物相似,缩合单宁对水产动物的作用效果存在不确定性,这种不确定性是由缩合单宁的含量和化学结构、动物种类和生理状态、饲料等综合因素决定的。Becker等[78]报道,白坚木缩合单宁含量超过2%则会影响饲料适口性,不利于草食性和杂食性鱼类的生长。饲料中缩合单宁添加量超过10 g/kg则抑制肉食性欧洲鲈鱼的生长[79]。除了适口性的问题,缩合单宁降低鱼类生长性能还可能归因于其对消化酶活性的抑制作用[80],或者与内源蛋白质或饲料中蛋白质、微量元素等组分形成络合物[81],降低饲料消化率。卢俊姣[60]报道,800 mg/kg缩合单宁可促进罗非鱼生长,缓解氧化损伤。尽管缩合单宁对水产动物生产性能影响的研究结论不一致,但学术界一致认同缩合单宁能够提高鱼类的抗氧化能力和免疫力[61, 82],缩合单宁还能提高尼罗罗非鱼肌肉脂质的抗氧化能力[83]。近年来,我国水产养殖产量稳步上涨,水产品为我国乃至世界提供了优质蛋白质,对渔业发展起支撑作用。缩合单宁是理想的抗生素替代品,可有效改善水产动物肠道微生态环境,抑制病原菌并提高机体抗氧化能力,有益于水产动物健康和水产品安全。目前,缩合单宁在水产动物上的研究较少,研究对象品种单一,研究机理不够深入,缩合单宁的生物活性有待进一步挖掘,其在水产动物上的应用效果究竟与单胃动物和反刍动物有何差异,这一系列问题仍然需要更多更深入的探讨。
5 小结与展望植物提取物缩合单宁具有抗氧化、抗炎、抗菌、抗寄生虫、抗病毒、调节营养物质代谢等生物功能,是理想的抗生素替代品。缩合单宁发挥生物活性的作用机制可能归因于其对机体抗氧化和免疫信号通路的调控,这与缩合单宁的含量和化学结构密切相关。不同植物来源和分子结构的变化,导致缩合单宁对动物生产性能的作用效果存在不确定性,启示我们接下来需要对缩合单宁的构-效关系进行深入探索,以明确具体化学结构的作用机理。在动物生产中,应当避免长期使用单一化学结构的缩合单宁,以降低免疫疲劳和细菌耐药性,同时优化缩合单宁的提纯方法,降低工业生产成本,以实现缩合单宁在饲料工业和动物生产中的应用。
| [1] |
REDONDO L M, CHACANA P A, DOMINGUEZ J E, et al. Perspectives in the use of tannins as alternative to antimicrobial growth promoter factors in poultry[J]. Frontiers in Microbiology, 2014, 5: 118. |
| [2] |
STARČEVIĆ K, KRSTULOVIĆ L, BROZIĆ D, et al. Production performance, meat composition and oxidative susceptibility in broiler chicken fed with different phenolic compounds[J]. Journal of the Science of Food and Agriculture, 2015, 95(6): 1172-1178. |
| [3] |
PENG K, SHIRLEY D C, XU Z J, et al. Effect of purple prairie clover (Dalea purpurea Vent.) hay and its condensed tannins on growth performance, wool growth, nutrient digestibility, blood metabolites and ruminal fermentation in lambs fed total mixed rations[J]. Animal Feed Science and Technology, 2016, 222: 100-110. |
| [4] |
HUANG Q Q, LIU X L, ZHAO G Q, et al. Potential and challenges of tannins as an alternative to in-feed antibiotics for farm animal production[J]. Animal Nutrition, 2018, 4(2): 137-150. |
| [5] |
秦绪军, 海春旭, 何伟, 等. 单宁急性毒性及其对小鼠丙二醛和抗氧化酶的影响[J]. 卫生毒理学杂志, 2004, 18(2): 80-82. |
| [6] |
MCSWEENEY C S, PALMER B, MCNEILL D M, et al. Microbial interactions with tannins:nutritional consequences for ruminants[J]. Animal Feed Science and Technology, 2001, 91(1/2): 83-93. |
| [7] |
MCMAHON L R, MCALLISTER T A, BERG B P, et al. A review of the effects of forage condensed tannins on ruminal fermentation and bloat in grazing cattle[J]. Canadian Journal of Plant Science, 2000, 80(3): 469-485. |
| [8] |
TERRILL T H, ROWAN A M, DOUGLAS G B, et al. Determination of extractable and bound condensed tannin concentrations in forage plants, protein concentrate meals and cereal grains[J]. Journal of the Science of Food and Agriculture, 1992, 58(3): 321-329. |
| [9] |
张建, 李保坤, 毛晓英. 超声波提取葡萄梗中单宁的研究[J]. 安徽农业科学, 2008, 36(23): 9828-9830. |
| [10] |
段文贵, 耿哲, 覃柳妹. 黑荆树皮中缩合单宁的提取[J]. 广西大学学报, 2007, 32(2): 138-142. |
| [11] |
王红, 陈秀秀, 刘军海. 单宁的提取纯化技术研究进展[J]. 辽宁化工, 2011, 40(8): 864-866. |
| [12] |
前彩虹, 吴谋成. 植物单宁制备方法研究进展[J]. 现代农业科学, 2009, 16(3): 54-56. |
| [13] |
RICCI A, OLEJAR K J, PARPINELLO G P, et al. Antioxidant activity of commercial food grade tannins exemplified in a wine model[J]. Food Additives & Contaminants:Part A, 2016, 33(12): 1761-1774. |
| [14] |
KOLECKAR V, KUBIKOVA K, REHAKOVA Z, et al. Condensed and hydrolysable tannins as antioxidants influencing the health[J]. Mini-Reviews in Medicinal Chemistry, 2008, 8(5): 436-447. |
| [15] |
HAGERMAN A E, RIEDL K M, JONES G A, et al. High molecular weight plant polyphenolics (tannins) as biological antioxidants[J]. Journal of Agricultural and Food Chemistry, 1998, 46(5): 1887-1892. |
| [16] |
BARREIRA J C M, FERREIRA I C F R, OLIVEIRA M B P P, et al. Antioxidant activities of the extracts from chestnut flower, leaf, skins and fruit[J]. Food Chemistry, 2008, 107(3): 1106-1113. |
| [17] |
ZHANG Y J, DEWITT D L, MURUGESAN S, et al. Novel lipid-peroxidation-and cyclooxygenase-inhibitory tannins from Picrorhiza kurroa seeds[J]. Chemistry and Biodiversity, 2004, 1(3): 426-441. |
| [18] |
KARAMAĆ M, KOSINSKA A, AMAROWICZ R. Chelating of Fe (Ⅱ), Zn (Ⅱ) and Cu (Ⅱ) by tannin fractions separated from hazelnuts, walnuts and almonds[J]. Bromatologii i Chemii Toksykologicznej, 2006, 39: 257-260. |
| [19] |
林谦, 邱磊, 云龙, 等. 核因子E2相关因子2调控机体抗氧化途径特性及其与畜禽的健康和肉品质的关系[J]. 动物营养学报, 2014, 26(6): 1421-1429. |
| [20] |
陈雁.Nrf2信号通路在葡萄籽原花青素降低铅诱导的大鼠肾脏氧化应激中的作用[D].硕士学位论文.哈尔滨: 东北农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10224-1016106268.htm
|
| [21] |
赵娇.葡萄籽原花青素缓解氧化应激仔猪肝脏损伤及可能机制研究[D].硕士学位论文.雅安: 四川农业大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10626-1014102258.htm
|
| [22] |
MONAGAS M, URPI-SARDA M, SÁNCHEZ-PATÁN F, et al. Insights into the metabolism and microbial biotransformation of dietary flavan-3-ols and the bioactivity of their metabolites[J]. Food & Function, 2010, 1(3): 233-253. |
| [23] |
卞恒娟.利用伪无菌小鼠研究肠道菌群在茶多酚减肥中的作用[D].硕士学位论文.广州: 华南农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10564-1016923354.htm
|
| [24] |
WANG A N, YI X W, YU H F, et al. Free radical scavenging activity of Lactobacillus fermentum in vitro and its antioxidative effect on growing-finishing pigs[J]. Journal of Applied Microbiology, 2009, 107(4): 1140-1148. |
| [25] |
CARDONA F, ANDRÉS-LACUEVA C, TULIPANI S, et al. Benefits of polyphenols on gut microbiota and implications in human health[J]. The Journal of Nutritional Biochemistry, 2013, 24(8): 1415-1422. |
| [26] |
PARK M, CHO H, JUNG H, et al. Antioxidant and anti-inflammatory activities of tannin fraction of the extract from black raspberry seeds compared to grape seeds[J]. Journal of Food Biochemistry, 2014, 38(3): 259-270. |
| [27] |
CHACÓN M R, CEPERUELO-MALLAFRÉ V, MAYMÓ-MASIP E, et al. Grape-seed procyanidins modulate inflammation on human differentiated adipocytes in vitro[J]. Cytokine, 2009, 47(2): 137-142. |
| [28] |
贺宇佳, 刘明, 伍树松. 植物多酚对氧化应激与炎症信号通路的调控机制[J]. 动物营养学报, 2019, 31(4): 1554-1563. |
| [29] |
PARK Y C, RIMBACH G, SALIOU C, et al. Activity of monomeric, dimeric, and trimeric flavonoids on NO production, TNF-α secretion and NF-κB-dependent gene expression in RAW 264.7 macrophages[J]. FEBS Letters, 2000, 465(2/3): 93-97. |
| [30] |
WU S S, YANO S, CHEN J H, et al. Polyphenols from Lonicera caerulea L.berry inhibit LPS-induced inflammation through dual modulation of inflammatory and antioxidant mediators[J]. Journal of Agricultural and Food Chemistry, 2017, 65(25): 5133-5141. |
| [31] |
VAN BUITEN C B, LAMBERT J D, ELIAS R J. Green tea polyphenols mitigate gliadin-mediated inflammation and permeability in vitro[J]. Molecular Nutrition & Food Research, 2018, 62(12): e1700879. |
| [32] |
MCALLISTER T A, WANG Y X, DIARRA M S, et al. Challenges of a one-health approach to the development of alternatives to antibiotics[J]. Animal Frontiers, 2018, 8(2): 10-20. |
| [33] |
彭凯.贮藏方式对饲用紫色达利菊缩合单宁的化学结构及生物活性的影响研究[D].博士学位论文.北京: 中国农业大学, 2017. https://xueshu.baidu.com/usercenter/paper/show?paperid=ada623302b0d0c2c2c91e2e858759ac3&site=xueshu_se&hitarticle=1
|
| [34] |
PENG K, JIN L, NIU Y D, et al. Condensed tannins affect bacterial and fungal microbiomes and mycotoxin production during ensiling and upon aerobic exposure[J]. Applied and Environmental Microbiology, 2018, 84(5): e02274-17. |
| [35] |
WANG Y, JIN L, OMINSKI K H, et al. Screening of condensed tannins from Canadian prairie forages for anti-Escherichia coli O157:H7 with an emphasis on purple prairie clover (Dalea purpurea Vent)[J]. Journal of Food Protection, 2013, 76(4): 560-567. |
| [36] |
LIU X L, HAO Y Q, JIN L, et al. Anti-Escherichia coli O157:H7 properties of purple prairie clover and sainfoin condensed tannins[J]. Molecules, 2013, 18(2): 2183-2199. |
| [37] |
SMITH A H, MACKIE R I. Effect of condensed tannins on bacterial diversity and metabolic activity in the rat gastrointestinal tract[J]. Applied and Environmental Microbiology, 2004, 70(2): 1104-1115. |
| [38] |
PENG K, HUANG Q Q, XU Z J, et al. Characterization of condensed tannins from purple prairie clover (Dalea purpurea Vent.) conserved as either freeze-dried forage, sun-cured hay or silage[J]. Molecules, 2018, 23(3): 586. |
| [39] |
MUELLER-HARVEY I. Unravelling the conundrum of tannins in animal nutrition and health[J]. Journal of the Science of Food and Agriculture, 2006, 86(13): 2010-2037. |
| [40] |
MOLAN A L, WAGHORN G C, MCNABB W C. Effect of condensed tannins on egg hatching and larval development of Trichostrongylus colubriformis in vitro[J]. Veterinary Record, 2002, 150(3): 65-69. |
| [41] |
WANG Y X, MCALLISTER T A, ACHARYA S. Condensed tannins in sainfoin:composition, concentration, and effects on nutritive and feeding value of sainfoin forage[J]. Crop Science, 2015, 55(1): 13-22. |
| [42] |
MOLAN A L, MCNABB W C, HOSKIN S O, et al. Effect of condensed tannins extracted from four forages on the viability of the larvae of deer lungworms and gastrointestinal nematodes[J]. Veterinary Record, 2000, 147(2): 44-48. |
| [43] |
MOLAN A L, DUNCAN A J, BARRY T N, et al. Effects of condensed tannins and crude sesquiterpene lactones extracted from chicory on the motility of larvae of deer lungworm and gastrointestinal nematodes[J]. Parasitology International, 2003, 52(3): 209-218. |
| [44] |
MOLAN A L, SIVAKUMARAN S, SPENCER P A, et al. Green tea flavan-3-ols and oligomeric proanthocyanidins inhibit the motility of infective larvae of Teladorsagia circumcincta and Trichostrongylus colubriformis in vitro[J]. Research in Veterinary Science, 2004, 77(3): 239-243. |
| [45] |
TIBE O, SUTHERLAND I A, LESPERANCE L, et al. The effect of purified condensed tannins of forage plants from Botswana on the free-living stages of gastrointestinal nematode parasites of livestock[J]. Veterinary Parasitology, 2013, 197(1/2): 160-167. |
| [46] |
PAOLINI V, FRAYSSINES A, DE LA FARGE F, et al. Effects of condensed tannins on established populations and on incoming larvae of Trichostrongylus colubriformis and Teladorsagia circumcincta in goats[J]. Veterinary Research, 2003, 34(3): 331-339. |
| [47] |
ATHANASIADOU S, KYRIAZAKIS I, JACKSON F, et al. Direct anthelmintic effects of condensed tannins towards different gastrointestinal nematodes of sheep:in vitro and in vivo studies[J]. Veterinary Parasitology, 2001, 99(3): 205-219. |
| [48] |
MC MAHON L R, MAJAK W, MCALLISTER T A, et al. Effect of sainfoin on in vitro digestion of fresh alfalfa and bloat in steers[J]. Canadian Journal of Animal Science, 1999, 79(2): 203-212. |
| [49] |
WAGHORN G C, MCNABB W C. Consequences of plant phenolic compounds for productivity and health of ruminants[J]. Proceedings of the Nutrition Society, 2003, 62(2): 383-392. |
| [50] |
HOSTE H, MARTINEZ-ORTIZ-DE-MONTELLANO C, MANOLARAKI F, et al. Direct and indirect effects of bioactive tannin-rich tropical and temperate legumes against nematode infections[J]. Veterinary Parasitology, 2012, 186(1/2): 18-27. |
| [51] |
UEDA K, KAWABATA R, IRIE T, et al. Inactivation of pathogenic viruses by plant-derived tannins:strong effects of extracts from persimmon (Diospyros kaki) on a broad range of viruses[J]. PLoS One, 2013, 8(1): e55343. |
| [52] |
HUANG Q Q, JIN L, XU Z, et al. Effects of purple prairie clover (Dalea purpurea Vent.) on feed intake, nutrient digestibility and faecal shedding of Escherichia coli O157:H7 in lambs[J]. Animal Feed Science and Technology, 2015, 207: 51-61. |
| [53] |
GAO J J, XU P, WANG Y F, et al. Combined effects of green tea extracts, green tea polyphenols or epigallocatechin gallate with acarbose on inhibition against α-amylase and α-glucosidase in vitro[J]. Molecules, 2013, 18(9): 11614-11623. |
| [54] |
邢莎莎.香椿子总多酚降血糖作用及机制研究[D].硕士学位论文.宜昌: 三峡大学, 2011. http://d.wanfangdata.com.cn/thesis/D221912
|
| [55] |
ALZAID F, CHEUNG H M, PREEDY V R, et al. Regulation of glucose transporter expression in human intestinal Caco-2 cells following exposure to an anthocyanin-rich berry extract[J]. PLoS One, 2013, 8(11): e78932. |
| [56] |
YAMASHITA Y, OKABE M, NATSUME M, et al. Cinnamtannin A2, a tetrameric procyanidin, increases GLP-1 and insulin secretion in mice[J]. Bioscience, Biotechnology, and Biochemistry, 2013, 77(4): 888-891. |
| [57] |
BUSTOS I, GARCÍA-CAYUELA T, HERNÁNDEZ-LEDESMA B, et al. Effect of flavan-3-ols on the adhesion of potential probiotic Lactobacilli to intestinal cells[J]. Journal of Agricultural and Food Chemistry, 2012, 60(36): 9082-9088. |
| [58] |
BASELGA-ESCUDERO L, BLADÉ C, RIBAS-LATRE A, et al. Grape seed proanthocyanidins repress the hepatic lipid regulators miR-33 and miR-122 in rats[J]. Molecular Nutrition and Food Research, 2012, 56(11): 1636-1646. |
| [59] |
MATSUMOTO K, YOKOYAMA S I. Induction of uncoupling protein-1 and-3 in brown adipose tissue by kaki-tannin in type 2 diabetic NSY/Hos mice[J]. Food and Chemical Toxicology, 2012, 50(2): 184-190. |
| [60] |
卢俊姣.饲料中添加原花青素对吉富罗非鱼生长及氧化应激的影响[D].硕士学位论文.厦门: 集美大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10390-1016224951.htm
|
| [61] |
FEDELI D, BERRETTINI M, GABRYELAK T, et al. The effect of some tannins on trout erythrocytes exposed to oxidative stress[J]. Mutation Research, 2004, 563: 89-96. |
| [62] |
GIRARD M, DOHME-MEIER F, SILACCI P, et al. Forage legumes rich in condensed tannins may increase n-3 fatty acid levels and sensory quality of lamb meat[J]. Journal of the Science of Food and Agriculture, 2016, 96(6): 1923-1933. |
| [63] |
BUCCIONI A, SERRA A, MINIERI S, et al. Milk production, composition, and milk fatty acid profile from grazing sheep fed diets supplemented with chestnut tannin extract and extruded linseed[J]. Small Ruminant Research, 2015, 130: 200-207. |
| [64] |
CHAMORRO S, VIVEROS A, REBOLÉ A, et al. Influence of dietary enzyme addition on polyphenol utilization and meat lipid oxidation of chicks fed grape pomace[J]. Food Research International, 2015, 73: 197-203. |
| [65] |
YAN L, KIM I H. Effect of dietary grape pomace fermented by Saccharomyces boulardii on the growth performance, nutrient digestibility and meat quality in finishing pigs[J]. Asian-Australasian Journal of Animal Sciences, 2011, 24(12): 1763-1770. |
| [66] |
杨露, 谭会泽, 刘松柏, 等. 单宁的抗营养作用及其在畜禽营养中的研究进展[J]. 粮食与饲料工业, 2019(6): 53-56. |
| [67] |
BERTOL T M, LUDKE J V, DE CAMPOS R M L, et al. Inclusion of grape pomace in the diet of pigs on pork quality and oxidative stability of omega-3 enriched fat[J]. Ciencia Rural, 2017, 47(4): e20150358. |
| [68] |
BRUS M, DOLINŠEK J, CENCIČ A, et al. Effect of chestnut (Castanea sativa Mill.) wood tannins and organic acids on growth performance and faecal microbiota of pigs from 23 to 127 days of age[J]. Bulgarian Journal of Agricultural Science, 2013, 19(4): 841-847. |
| [69] |
WANG M L, SUO X, GU J H, et al. Influence of grape seed proanthocyanidin extract in broiler chickens:effect on chicken coccidiosis and antioxidant status[J]. Poultry Science, 2008, 87(11): 2273-2280. |
| [70] |
CEJAS E, PINTO S, PROSDOCIMO F, et al. Evaluation of quebracho red wood (Schinopsis lorentzii) polyphenolic vegetable extract for the reduction of coccidiosis in broiler chicks[J]. International Journal of Poultry Science, 2011, 10(5): 344-349. |
| [71] |
CAPPAI M G, WOLF P, PINNA W, et al. Pigs use endogenous proline to cope with acorn (Quercus pubescens Willd.) combined diets high in hydrolysable tannins[J]. Livestock Science, 2013, 155(2/3): 316-322. |
| [72] |
MARTEN G C, EHLE F R, RISTAU E A. Performance and photosensitization of cattle related to forage quality of four legumes[J]. Crop Science, 1987, 27(1): 138-145. |
| [73] |
WANG Y, DOUGLAS G B, WAGHORN G C, et al. Effect of condensed tannins in Lotus corniculatus upon lactation performance in ewes[J]. Journal of Agricultural Science, 1996, 126(3): 353-362. |
| [74] |
WANG Y, DOUGLAS G B, WAGHORN G C, et al. Effect of condensed tannins upon the performance of lambs grazing Lotus corniculatus and lucerne (Medicago sativa)[J]. Journal of Agricultural Science, 1996, 126(1): 87-98. |
| [75] |
KHALILVANDI-BEHROOZYAR H, DEHGHAN-BANADAKY M, REZAYAZDI K. Palatability, in situ and in vitro nutritive value of dried sainfoin (Onobrychis viciifolia)[J]. Journal of Agricultural Science, 2010, 148(6): 723-732. |
| [76] |
SOTTIE E T, ACHARYA S N, MCALLISTER T A, et al. Alfalfa pasture bloat can be eliminated by intermixing with newly-developed sainfoin population[J]. Agronomy Journal, 2014, 106(4): 1470-1478. |
| [77] |
TAN H Y, SIEO C C, ABDULLAH N, et al. Effects of condensed tannins from Leucaena on methane production, rumen fermentation and populations of methanogens and protozoa in vitro[J]. Animal Feed Science and Technology, 2011, 169(3/4): 185-193. |
| [78] |
BECKER K, MAKKAR H P S. Effects of dietary tannic acid and quebracho tannin on growth performance and metabolic rates of common carp (Cyprinus carpio L.)[J]. Aquaculture, 1999, 175(3/4): 327-335. |
| [79] |
OMNES M H, GOASDUFF J L, LE DELLIOU H, et al. Effects of dietary tannin on growth, feed utilization and digestibility, and carcass composition in juvenile European seabass (Dicentrarchus labrax L.)[J]. Aquaculture Reports, 2017, 6: 21-27. |
| [80] |
MANDAL S, GHOSH K. Inhibitory effect of Pistia tannin on digestive enzymes of Indian major carps:an in vitro study[J]. Fish Physiology and Biochemistry, 2010, 36(4): 1171-1180. |
| [81] |
CHUNG K T, WEI C I, JOHNSON M G. Are tannins a double-edged sword in biology and health?[J]. Trends in Food Science & Technology, 1998, 9(4): 168-175. |
| [82] |
MAGRONE T, FONTANA S, LAFORGIA F, et al. Administration of a polyphenol-enriched feed to farmed sea bass (Dicentrarchus labrax L.) modulates intestinal and spleen immune responses[J]. Oxidative Medicine and Cellular Longevity, 2016, 2016: 2827567. |
| [83] |
THITICHAYAPHONG N, RUKKWAMSUK T. Dietary supplementation of condensed tannin decreased lipid peroxidation in muscle of Nile tilapias (Oreochromis niloticus)[J]. Thai Journal of Veterinary Medicine, 2016, 46(4): 649-654. |




