从20世纪70年代开始人们对动物脂肪组织进行研究,脂肪组织作为动物机体的重要组成部分,它的功能不仅可以用于能量的储备和代谢,还可以分泌多种脂肪细胞因子参与调控机体的生理功能。脂质代谢包括脂质的合成、分解以及类脂的代谢。当动物摄入能量过多时,机体的合成代谢大于分解代谢,脂肪会以甘油三酯的形式按照一定的顺序依次沉积在皮下、尾部、内脏周围(包括腹腔和肾周)以及肌间和肌内。对动物脂质代谢的调节可以减少动物体内脂肪的过度积累,同时还会影响肉的嫩度、色泽、风味等。脂质代谢机理的深入研究对进一步调控动物脂质代谢,同时对提高动物生长性能、改善肉品质具有重大的意义。
植物多酚是目前被广泛应用于调控脂质代谢的物质,其应用在食品中的途径主要有2种:一是作为饲料添加剂,适度添加用以改善肉中脂肪酸组成以及肉品质;二是作为天然抗氧化剂,用于食品包装中延长畜产品的保质期。植物多酚存在于植物的根、叶、皮、果实中,是一类具有生物活性的强还原物质。目前从植物中已经分离鉴定出8 000余种酚类化合物[1],大量研究表明,植物多酚具有降血糖血脂[2]、抑菌[3]、抗氧化[4]等功能。植物多酚在动物中的应用主要是通过调节脂质的合成和分解,减少脂质中的氧化应激反应来发挥其生物活性作用[5]。本文主要综述了植物多酚在动物体内脂质代谢过程中的调控机制及其应用。
1 植物多酚对脂质代谢的影响植物多酚作为饲料添加剂可以调节动物脂质代谢,进一步改善动物的生长性能、肉品质。植物多酚调节脂质代谢主要是通过调节肠道微生物多样性、激活能量转换器腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)、促进线粒体的生物合成、减少氧化应激反应等途径。
1.1 对肠道微生物多样性的影响动物肠道微生物菌群是一个复杂的微生物生态系统,参与体内脂质、葡萄糖代谢调节和免疫调节,在维持体内平衡中起着至关重要的作用[6]。机体微生物生态系统的组成在个体中不仅存在很大差异,而且容易受到饮食因素和各种疾病条件驱动的影响[7]。当在哺乳动物饮食中添加多酚时,其中总摄入量的5%~10%(其中主要包括具有单体和二聚体结构的多酚)可以直接在小肠中吸收,这些不太复杂的多酚化合物通过肠上皮细胞进入肝细胞中,经过氧化、还原和水解以及一系列复杂的生物转化后,产生水溶性共轭代谢物(甲基、葡萄糖醛酸和硫酸盐衍生物),这些代谢物被释放至体循环中进一步分布至其他器官[8]。而剩余的90%~95%多酚在经过小肠中未被吸收,而是在肠酶催化下反应,或被结肠微生物分解,进行一系列反应[9]。在结肠中,它们可以被微生物群分解代谢为一类具有生物活性功能的酚酸,一方面,酚酸作为一种抗微生物物质,可以以一种理想的方式调节结肠微生物群的组成,促进有益细菌的生长,同时抑制致病菌的生长[10];另一方面,酚酸可以与胆汁酸结合,可以部分阻断胆汁盐的重吸收,间接降低血浆和肝脏中的胆固醇含量[11]。膳食多酚通过影响动物肠道微生物的丰富度和多样性,改变微生物代谢途径,影响机体脂质代谢。在反刍动物中,瘤胃微生物群的组成也受植物多酚的调节,但目前相关研究较少[12]。
Queipo-Ortuno等[13]让试验人员定期摄入红葡萄酒,发现其中的多酚类物质可以使血清中甘油三酯、总胆固醇和高密度脂蛋白胆固醇含量显著下降,这些显著的改变主要归因于多酚促进肠道内拟杆菌的生长。Wang等[14]给高脂饮食小鼠饲喂绿茶中提取的多酚物质,发现其可以促进双歧杆菌的生长,抑制沙门氏菌的生长,通过改变肠道微生物组成和多样性,增加了高脂饮食小鼠的葡萄糖耐量,抑制了小鼠血脂升高和体重增加。Collins等[15]连续16周将富含多酚的葡萄粉添加到高脂饮食雄鼠的饲料中,发现与未在饲料中添加葡萄粉的高脂饮食小鼠相比,食用葡萄粉的雄鼠具有较低的体脂百分比,白色脂肪组织重量减轻,同时肝脏中激素敏感性脂肪酶和甘油三酯脂肪酶的mRNA表达水平升高,并且证实这些改变与肠道细菌群落结构变化有关。综上所述,植物多酚确实可以改变肠道微生物的组成、微生物基因表达和代谢途径,降低胆汁酸的重吸收,肠道胆汁酸水平的降低会减少脂质的吸收,有助于改善宿主健康[16],但是这样的改变具有一定的时限性[17]。Guo等[18]将人体粪便悬浮液接种给无酶无菌小鼠,饲喂绿茶多酚3周后发现肠道微生物种群达到最大值,并且厚壁菌门数量增加,拟杆菌门数量降低(厚壁菌门/拟杆菌门的比例可反映身体肥胖或生态失调),当3周后不再饲喂绿茶多酚时,拟杆菌门数量还在持续降低,这表明绿茶多酚可以调节肠道微生物组成,并且这种影响是持久的过程,这与前人的研究结果[16-18]相左,需要进一步研究。
1.2 对AMPK蛋白磷酸化水平的影响AMPK作为细胞代谢的关键调节因子,可以调节体内新陈代谢,由α、β和γ亚基组成[19]。其中AMPK的催化亚基α1亚型在祖细胞和脂肪组织中显著表达[20]。
近年来的研究发现,植物多酚激活AMPK使其磷酸化调节脂质代谢的主要形式是:1)植物多酚能够使AMPK磷酸化水平升高,进一步通过上调下游信号因子从而促进分解代谢并抑制肝脏和其他组织的生物合成[6]。2)植物多酚在AMPKα1的介导下可以激活棕色、类棕色脂肪,调节机体能量代谢,减少脂肪沉积[21]。
研究表明,植物多酚可以增加肠道内产生短链脂肪酸(SCFA)的细菌数量,从而增加SCFA的产生。SCFA被吸收到血液中,一方面,SCFA通过促进AMPK磷酸化并抑制过氧化物酶体增殖物激活受体γ(PPARγ)进入肝脏,增强机体的能量代谢[22];另一方面,SCFA激活AMPK可以抑制乙酰辅酶A羧化酶(ACC)活性,减少脂肪酸合成,并防止脂肪积累[23]。同时激活的AMPK还可以通过直接抑制β-羟-β-甲戊二酸单酰辅酶A(HMG-CoA)的活性来调节肝脏中胆固醇的合成途径[24],改善机体健康。棕色脂肪组织是一种消耗能量产生热量的脂肪组织,棕色脂肪细胞中有大量的线粒体和小脂滴,通过其特异性蛋白解偶联蛋白1(UCP1)的解偶联作用,可以大量消耗能量产生热量[25]。因此,近年来人们希望能够通过激活棕色脂肪改善机体脂质代谢紊乱,研究表明当机体受到寒冷刺激或交感神经兴奋时部分白色脂肪会开始表达特异性蛋白UCP1,转变为类棕色脂肪,发挥解偶联作用[26]。
Rocha等[27]给小鼠饲喂绿茶提取物后激活了脂肪组织中的AMPK,增加葡萄糖运载体4(GLUT4)的mRNA表达,降低血浆和肝脏中脂质含量,还可以刺激相同组织中的脂肪酸氧化,与之有相同作用的还有白藜芦醇,同样可以使能量代谢的主要调节因子AMPK的磷酸化和活化,AMPK上调脂肪酸氧化并通过GLUT4易位增加葡萄糖的摄取[28]。Andrade等[29]给小鼠饮食中添加白藜芦醇2个月后发现小鼠血浆中总胆固醇和葡萄糖含量降低,棕色脂肪组织中棕色脂肪细胞UCP1表达量增加,使得线粒体消耗脂肪酸进行氧化磷酸化产热。Zou等[30]给小鼠饲喂补充了5%覆盆子的高脂饮食10周,发现覆盆子中的植物多酚通过激活腺苷酸活化蛋白激酶α1(AMPKα1)可以促进肥胖小鼠棕色脂肪组织的发育,增加机体产热,从而改善了野生型小鼠的胰岛素敏感性并降低了脂肪量。由以上研究可知,多酚类物质可以通过对AMPK和棕色脂肪的调节进而实现对脂质代谢的影响(图 1)。
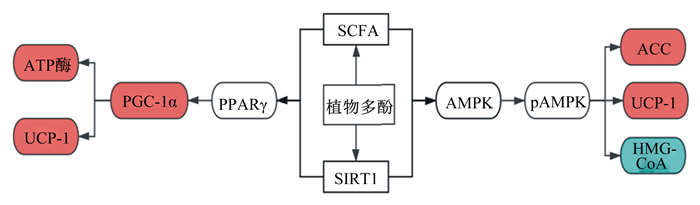
|
图中红色部分表示上调表达基因,蓝色部分表示下调表达基因,箭头表示直接调控作用。In the figure, the red parts indicate up-regulated genes, the blue parts indicate down-regulated genes, and the arrows indicate direct regulation. SCFA:短链脂肪酸short-chain fatty acid;SIRT1:沉默信息调节因子1 silent information regulator 1;PPARγ:过氧化物酶体增殖物激活受体γ peroxisome proliferator-activated receptor γ; PGC-1α:过氧化物酶体增殖物激活受体γ共激活因子-1α peroxisome proliferator-activated receptor gamma coactivated-1α; ATP酶:三磷酸腺苷酶ATP enzyme;UCP1:解偶联蛋白1 uncoupling protein 1;AMPK:腺苷酸活化蛋白激酶adenosine monophosphate activated protein kinase;pAMPK:磷酸化的AMPK phosphorylated AMPK;HMG-CoA:β-羟-β-甲戊二酸单酰辅酶β-hydroxy-β-meglutarate monoacyl coenzyme;ACC:乙酰辅酶A羧化酶acetyl-CoA carboxylase。 图 1 植物多酚通过氧化物酶体增殖物激活受体、腺苷酸活化蛋白激酶和沉默信息调节因子1信号通路调控动物脂质代谢功能 Fig. 1 Plant polyphenols regulate lipid metabolism in animals by PPAR, AMPK and SIRT1 signaling pathways |
线粒体是机体能量代谢的主要细胞器,动物骨骼肌的氧化能力主要依赖于线粒体,线粒体的生物发生主要指线粒体数量的增加及质量的提高。脂质代谢异常大多是因为脂肪的异位堆积引起的[31],越来越多的证据显示线粒体生物发生和相关的脂肪酸氧化增强可以直接改善全身葡萄糖代谢,对细胞健康以及调节机体脂质代谢起着至关重要的作用[32]。线粒体生物发生受到过氧化物酶体增殖物激活受体γ共激活因子-1α(PGC-1α)、核因子NF-E1相关因子(NRF1)和沉默信息调节因子1(SIRT1)等基因的调控[33]。其中PGC-1α作为PPARγ转录协同激活因子具有调控能量代谢相关的多种功能,如调节棕色脂肪组织产热、线粒体生物发生以及肌纤维类型的转换[34]。NRF1是由核基因编码的能调控线粒体呼吸链表达的转录因子,与线粒体功能和生物发生基因的表达有关,可以诱导线粒体转录因子A表达调节线粒体DNA(mtDNA)拷贝数和转录活性[35]。SIRT1与AMPK细胞能量传感器紧密相互作用,可以整体改善线粒体质量[36]。
Sun等[37]研究发现,脂质代谢紊乱后骨骼肌中肌肉线粒体会发生功能障碍,包括不平衡的氧化还原状态、线粒体数量减少和电子传递链复合物减少。随后,他们在脂质代谢异常的小鼠饲料中添加白藜芦醇,探究植物多酚在脂质中的调节作用,发现其显著改善了小鼠全身葡萄糖和脂质体内平衡、降低了肝脏内脂质含量,同时增加了PPARγ和PGC-1α表达量及下游转录因子ATP酶的活性。这表明白藜芦醇对脂质代谢的调节可能是由于肌肉中线粒体的生物合成增加引起的[38]。同时白藜芦醇还是SIRT1的有效激活剂,Abe等[39]使用白藜芦醇补充的培养基培养牛胚胎细胞发现,牛胚胎细胞中SIRT1被激活,导致AMPK活化并通过β-氧化增加胚胎中的脂质消耗,从而降低脂质含量,同时SIRT1激活后的线粒体的质量整体提升。还有研究表明,白藜芦醇通过上调SIRT1的表达,可以增加PPARγ共激活因子PGC-1α的表达,PGC-1α是组织特异性代谢功能的重要调节因子,参与调节产热、肝糖异生、线粒体生物合成和能量消耗,从而有助于抑制脂质积累[40]。
还有研究表明,植物多酚激活AMPKα1后介导棕色脂肪及类棕色脂肪组织产热,增加了细胞中的线粒体密度,致使线粒体生物合成增加;脂肪细胞中PGC-1α的表达激活了UCP1活性,增加了线粒体生物发生,可以通过增强棕色脂肪组织产热和脂肪组织氧化代谢来减轻高脂肪饮食诱导的肥胖[41]。Lee等[42]在高脂饮食小鼠饲料中添加2%表没食子儿茶素没食子酸酯(EGCG),试验组小鼠棕色脂肪组织产热增加,棕色脂肪细胞中AMPK被激活,线粒体生物合成相关基因的mRNA表达水平增加。这表明EGCG可能通过增加棕色脂肪组织产热和增加线粒体生物发生调节机体能量代谢(图 1)。
1.4 对氧化应激的影响氧化应激是指动物体内氧化与抗氧化作用失衡,活性氧(ROS)或不饱和脂肪酸过度累积,导致细胞中脂质、DNA和蛋白质等成分发生过氧化现象,进而导致组织损伤,致使畜产品品质降低[43]。机体内抗氧化系统能够通过减少氧化剂的形成或清除ROS来预防氧化应激。植物多酚对氧化应激的影响机制:一方面,植物多酚特殊的化学结构使其具很强的金属离子螯合能力,从而降低了金属离子对氧化反应的催化作用,减少过氧化物的生成[44];另一方面,植物多酚可以激活机体红系衍生的核因子2相关因子(Nrf2)途径,Nrf2是启动抗氧化反应原件的转录因子,可促进抗氧化蛋白和Ⅱ解毒酶的表达,而其介导的抗氧化反应途径是抵抗氧化应激的细胞毒性作用的主要细胞防御途径[45]。在正常条件下,红系衍生的核因子2相关因子-1(Nrf2-Keap1)复合物在细胞质中处于静息状态;在氧化应激下或在内源性毒素存在下,多酚可以修饰Keap1的硫醇基团使得Nrf2从Nrf2-Keap1复合物中释放出来,在机体中可以结合抗氧化反应元件(ARE)[46],提高与抗氧化反应相关的基因表达,同时显著提高机体一系列抗氧化酶活性,保护脂肪细胞免受氧化损伤,减少由脂质过氧化物引起的氧化应激反应(图 2)[47]。
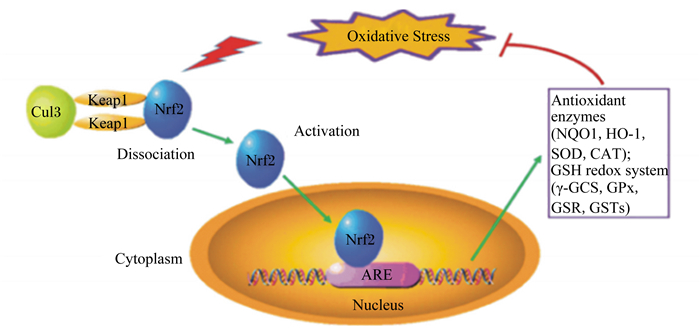
|
Oxidative Stress:氧化应激;Cul3: Cullin-Ring E3泛素连接酶Cullin-Ring-based E3-ligases;Keap1:Kelch样环氧氯丙烷相关蛋白-1 Kelch-like epichlorohydrin associated protein-1;Nrf2:红系衍生的核因子2相关因子red series derived nuclear factor 2 correlation factor;Dissociation:解离;Activation:激活;Cytoplasm:细胞质;ARE:抗氧化反应元件antioxidant response element;Nucleus:细胞核;Antioxidant enzymes:抗氧化酶;NQO1:醌氧化还原酶1 quinone oxidoreductase 1;HO-1:血红素氧合酶-1 heme oxygenase-1;SOD:超氧化物歧化酶superoxide dismutase;CAT:过氧化氢酶catalase;GSH redox system:谷胱甘肽氧化还原系统;GSH:还原型谷胱甘肽reduced glutathione;γ-GCS:γ-糖皮质激素γ-glucocorticoid;GPx:谷胱甘肽过氧化物酶glutathion peroxidase;GSR:谷胱甘肽还原酶glutathione reductase;GSTs:谷胱甘肽转硫酶glutathione S-transferase。 图 2 植物多酚激活机体Nrf2途径减少氧化应激反应 Fig. 2 Plant polyphenols reduce oxidative stress by activating body's Nrf2 pathway[53] |
Denis等[48]利用Caco-2/15细胞(表达成熟人肠细胞的几种形态和功能特征的单层细胞)研究蔓越莓中多酚类化合物的作用,发现蔓越莓中的多酚类物质可以改善GLUT基因表达和胰岛素敏感性, 减少线粒体功能障碍和肠道中的氧化应激反应。除此之外,人们还发现,蔓越莓中的黄酮醇和原花青素能够提高DNA修复酶的表达量,它可以消除由氧化应激引起的DNA损伤[49]。Yen等[50]使用槲皮素和白藜芦醇处理3T3-L1脂肪细胞,发现其可以减少由肿瘤坏死因子-α引起的氧化应激反应,抑制了白细胞介素-6、脂联素和ROS的产生。Qi等[51]研究茶多酚对在黑暗和过氧化氢(H2O2)诱导下氧化应激反应的改善作用,结果表明茶多酚通过介导Keap1/Nrf2转录途径和调节下游酶的表达平衡细胞氧化还原状态,显著逆转黑暗和H2O2诱导的细胞活力和线粒体功能障碍。在不断的研究中,人们还发现在细胞或动物模型中添加不同剂量的植物多酚, 对Nrf2信号通路调控效果也不尽相同,低剂量时多酚类化合物能够激活Nrf2信号通路,当剂量超过阈值时Nrf2信号通路则被抑制[52]。
2 植物多酚在畜禽生产中的应用近年来植物多酚经常被添加到各种动物饲粮中,用以调控脂质代谢紊乱,减少炎症和氧化应激反应,增加饲粮转化率,进而提高动物生长性能,改善畜禽产品品质。
2.1 禽类目前已有很多研究结果表明,将植物多酚适量添加到禽类的饲粮中,可以增加饲料转化率,改善鸡肉品质并且增加其营养价值[54]。Zhang等[55]使用白藜芦醇作为补充剂添加到饲粮中喂养42 d后发现,试验组肉鸡的饲料转化率提高,体重增加,同时肌肉中肌糖原含量和抗氧化酶活性显著提高,丙二醛含量降低,表明白藜芦醇补充剂可以通过减少肌肉无氧糖酵解代谢和提高肌肉抗氧化能力来预防由于运输应激导致的肉鸡肉品质下降。Juskiewicz等[56]在火鸡饲粮中添加水果渣,发现尽管不同水果渣含有的多酚种类和数量都不相同,但是都在一定程度上提高了火鸡的生长性能和鸡肉营养价值。其中草莓渣中多酚含量最高,抗氧化能力最强,可以降低鸡肉中硫代巴比妥酸活性物质(TBARS)的含量,提高鸡肉中脂质抗氧化能力。此外,Chen等[57]还发现在蛋鸡饲粮中添加800 mg/kg桉树叶,其中的多酚物质不仅增加了血清中过氧化氢酶、谷胱甘肽过氧化物酶等抗氧化酶的活性,增加了机体的抗氧化能力,而且通过增加蛋壳厚度和降低蛋黄中的丙二醛和胆固醇含量改善了鸡蛋品质。
植物多酚可以与其他抗氧化剂复合添加,对提高肉的抗氧化能力有协同作用。很多研究表明,植物多酚混合菌粉添加到饲粮中可以改善肉鸡的肠道菌群结构、生长性能和营养价值。Zou等[58]向肉鸡饲粮中添加新型短乳杆菌M8和茶多酚,发现肌肉中赖氨酸、亮氨酸、谷氨酸、精氨酸和天冬氨酸的含量显著高于对照组,改善了肉质并促进了肠道中有益细菌生长,增加了乳酸杆菌和拟杆菌的定植。Li等[59]在饲粮中复合添加茶多酚乳酸菌,研究发现机体血清中胆固醇和低密度脂蛋白胆固醇含量降低,胰脂肪酶活性、胃泌素含量和胃蛋白酶活性增加,表明其改善了脂质代谢和消化酶活性,并且这种改变可能与核转录因子-κB(NF-κB)信号有关。
2.2 猪我国是猪肉的消费大国,随着人们对饮食健康的重视,人们对肉品质的要求也越来越高。在之前的研究中我们发现植物多酚可改善小鼠的糖脂代谢水平[60]、抗氧化能力[61]、减少炎症反应[62],植物多酚影响脂质代谢紧密关联的机制也逐渐清晰。为了有效提高猪生长性能、繁殖性能、免疫机能和肉品质,人们将植物多酚作为添加剂添加到饲粮中,并做了很多相关研究。Burgess等[63]发现白藜芦醇或富含白藜芦醇的葡萄提取物可降低猪肉中脂肪沉积,改善脂肪分布和葡萄糖代谢,提高猪肉的瘦肉率。之前有研究表明,绿茶中提取的多酚可有效增加以液体形式保存的哺乳动物精子的运动性和活力,Kitaji等[64]使用0.01%的茶多酚在孵育公猪精子后发现其具有更高程度的解冻后活力和顶体完整性。不仅如此,在母猪饲粮中添加适量茶多酚还可以提高胚胎存活率, 提高母猪血清中孕酮含量,有利于胚胎发育[65]。Jang等[66]发现猪食用可可粉对肠道健康有促进作用, 提高乳酸杆菌和双歧杆菌丰度。肠道微生物通过调节肠屏障功能,减少细菌组分向循环中的易位并刺激宿主免疫系统, 减少了促炎性和氧化性刺激物的易位。Rossi等[67]在猪屠宰前38 d在饲粮中添加毛蕊花苷和维生素E混合物,发现饲喂后改善了背最长肌的氧化稳定性和颜色。徐瑞等[68]在育肥猪的饲粮中添加2%的茶叶渣进行饲养试验,通过测定生长指标及肉质指标发现育肥猪的生长性能提高,猪肉的色泽和保水性能均有改善,不仅能提高了饲料转换率,还降低了饲料生产中的成本。以上的研究结果都揭示了多酚在提高猪肉品质参数方面的潜力,还需要进一步研究饲粮中添加多酚发挥作用的具体机制及其在猪肉及其衍生产品中的有效性。
2.3 反刍动物植物多酚的应用在单胃动物上已有大量的研究,而在反刍动物中关于植物多酚对其影响的研究主要还停留在减少动物代谢过程中产生甲烷的作用上[69],关于多酚类物质在瘤胃中的生物利用程度及其对瘤胃细菌数量、发酵和吸收的影响及机制的相关研究还较少。随着消费者对饮食与健康了解的深入,目前有很多关于反刍动物的饮食中加入不饱和脂肪从而改变反刍动物肉中脂肪酸组成、提高营养价值的研究,但是这种做法可能对反刍动物肉品的氧化稳定性和理化性质产生负面影响[46]。植物多酚作为一种具有强还原活性的物质被越来越多地应用于对反刍动物生长性能和屠宰后肉品质的研究中,用来降低其屠宰后肌肉氧化损伤风险,并且对肉品质、风味、色泽等都会产生一定的影响[70]。MuÍÑo等[71]在山羊饲粮中添加植物多酚后研究其生理特征和屠宰后肉质变化,发现其增加了肌红蛋白、脂质和肌原纤维蛋白的氧化稳定性,改善了肉品质。Morán等[72]发现补充鼠尾草酸和补充维生素E对羊的作用相似,在屠宰后肉的保藏过程中减少了脂质的过氧化,改善了育肥羔羊肉的感官品质。Inserra等[73]发现饲粮中补充柑橘果肉可以显著减少羊肉脂质的氧化,在保存期间肉的颜色参数也未发生明显变化,证明其可以改善羊肉色泽;但是Samman等[74]研究发现,植物多酚会干扰机体对铁离子的吸收,从而对肉的颜色产生不良影响。关于植物多酚对反刍动物肉色的影响,目前还存在着一些争议。反刍动物的瘤胃微生物会将多不饱和脂肪酸氢化并产生一些不良的代谢产物积累到肌肉或者乳汁中,从而影响其营养价值[75],Jafari等[76]将瘤胃微生物分离,并使用不同溶剂探究瘤胃加氢和产甲烷的作用,发现植物多酚可以调节瘤胃的发酵作用,降低脂肪酸的氢化速度。Cappucci等[77]给母羊饲喂富含多酚的橄榄油提取物发现羊奶中的多不饱和脂肪酸含量增加,并且推测可能的原因是多酚类物质对瘤胃微生物氢化过程产生干扰。
3 小结近年来研究人员尝试将很多具有生物活性的物质作为饲料添加剂饲喂给动物,植物多酚是目前研究的热点。植物多酚可以通过影响动物肠道微生物组成、激活能量感受器AMPK、增加线粒体生物合成和减少脂质的氧化应激反应来调节机体脂质代谢,从而达到提高动物生长性能、改善肉品质的目的。目前,对植物多酚的研究应用都集中在抗氧化生物活性作用上,关于植物多酚如何影响动物体内的脂质代谢的研究还相对较少,具体机制仍不够明确。虽然在动物饲粮中添加植物多酚对动物的生长性能和畜产品品质均有改善作用,但植物多酚在动物体内的相对利用程度较低,因此继续探究植物多酚在动物体内发挥生物活性的具体机制,同时筛选可以高产多酚的植物,探究植物多酚在机体内的最适添加量,提高植物多酚在机体的生物利用度,将为提高畜产品品质提供新的途径。
| [1] |
LIPIŃSKI K, MAZUR M, ANTOSZKIEWICZ Z, et al. Polyphenols in monogastric nutrition:a review[J]. Annals of Animal Science, 2017, 17(1): 41-58. |
| [2] |
SCALBERT A, MANACH C, MORAND C, et al. Dietary polyphenols and the prevention of diseases[J]. Critical Reviews in Food Science and Nutrition, 2005, 45(4): 287-306. |
| [3] |
蔡孟轩, 周雅涵, 张鸿雁, 等. 橄榄假丝酵母控制苹果果实青霉病的效果及机制[J]. 食品科学, 2018, 39(5): 265-271. |
| [4] |
王芙蓉, 王晓妍, 刘巨海, 等. 茶多酚对长期饮酒所致心肌胰岛素抵抗的影响及机制研究[J]. 山东中医杂志, 2020, 39(4): 390-394. |
| [5] |
代燕丽, 邹宇晓, 刘凡, 等. 植物多酚干预脂质代谢紊乱作用机制研究进展[J]. 中国中药杂志, 2015, 40(21): 4136-4141. |
| [6] |
CARDONA F, ANDRÉS-LACUEVA C, TULIPANI S, et al. Benefits of polyphenols on gut microbiota and implications in human health[J]. The Journal of Nutritional Biochemistry, 2013, 24(8): 1415-1422. |
| [7] |
FRAGA C G, CROFT K D, KENNEDY D O, et al. The effects of polyphenols and other bioactives on human health[J]. Food & Function, 2019, 10(2): 514-528. |
| [8] |
MARÍN L, MIGUÉLEZ E M, VILLAR C J, et al. Bioavailability of dietary polyphenols and gut microbiota metabolism:antimicrobial properties[J]. Biomed Research International, 2015, 2015: 905215. |
| [9] |
GIOVINAZZO G, GRIECO F. Functional properties of grape and wine polyphenols[J]. Plant Foods for Human Nutrition, 2015, 70(4): 454-462. |
| [10] |
AXLING U, OLSSON C, XU J, et al. Green tea powder and Lactobacillus plantarum affect gut microbiota, lipid metabolism and inflammation in high-fat fed C57BL/6J mice[J]. Nutrition & Metabolism, 2012, 9: 105. |
| [11] |
迟晓君, 朱靖博, 李梅松, 等. 丹酚酸B调节胆固醇代谢的研究[J]. 安徽农业科学, 2011, 39(08): 4742+4746. |
| [12] |
GOHLKE A, INGELMANN C J, NVRNBERG G, et al. Influence of 4-week intraduodenal supplementation of quercetin on performance, glucose metabolism, and mRNA abundance of genes related to glucose metabolism and antioxidative status in dairy cows[J]. Journal of Dairy Science, 2013, 96(11): 6986-7000. |
| [13] |
QUEIPO-ORTUNO M I, BOTO-ORDÓÑEZ M, MURRI M, et al. Influence of red wine polyphenols and ethanol on the gut microbiota ecology and biochemical biomarkers[J]. The American Journal of Clinical Nutrition, 2012, 95(6): 1323-1334. |
| [14] |
WANG L, ZENG B H, LIU Z W, et al. Green tea polyphenols modulate colonic microbiota diversity and lipid metabolism in high-fat diet treated HFA mice[J]. Journal of Food Science, 2018, 83(3): 864-873. |
| [15] |
COLLINS B, HOFFMAN J, MARTINEZ K, et al. A polyphenol-rich fraction obtained from table grapes decreases adiposity, insulin resistance and markers of inflammation and impacts gut microbiota in high-fat-fed mice[J]. The Journal of Nutritional Biochemistry, 2016, 31: 153-165. |
| [16] |
HUANG J B, FENG S M, LIU A N, et al. Green tea polyphenol EGCG alleviates metabolic abnormality and fatty liver by decreasing bile acid and lipid absorption in mice[J]. Molecular Nutrition & Food Research, 2018, 62(4). DOI:10.1002/mnfr.201700696 |
| [17] |
TUOHY K M, CONTERNO L, GASPEROTTI M, et al. Up-regulating the human intestinal microbiome using whole plant foods, polyphenols, and/or fiber[J]. Journal of Agricultural and Food Chemistry, 2012, 60(36): 8776-8782. |
| [18] |
GUO X J, CHENG M, ZHANG X, et al. Green tea polyphenols reduce obesity in high-fat diet-induced mice by modulating intestinal microbiota composition[J]. International Journal of Food Science & Technology, 2017, 52(8): 1723-1730. |
| [19] |
HARDIE D G, ROSS F A, HAWLEY S A. AMPK:a nutrient and energy sensor that maintains energy homeostasis[J]. Nature Reviews Molecular Cell Biology, 2012, 13(4): 251-262. |
| [20] |
DONG J, ZHANG X, ZHANG L, et al. Quercetin reduces obesity-associated ATM infiltration and inflammation in mice:a mechanism including AMPKα1/SIRT[J]. Journal of Lipid Research, 2014, 55(3): 363-374. |
| [21] |
WANG S, LIANG X, YANG Q, et al. Resveratrol induces brown-like adipocyte formation in white fat through activation of AMP-activated protein kinase (AMPK) α1[J]. International Journal of Obesity, 2015, 39(6): 967-976. |
| [22] |
ROTHENBERG D O, ZHOU C B, ZHANG L Y. A review on the weight-loss effects of oxidized tea polyphenols[J]. Molecules, 2018, 23(5): 1176. |
| [23] |
HUANG J B, ZHANG Y, ZHOU Y B, et al. Green tea polyphenols alleviate obesity in broiler chickens through the regulation of lipid-metabolism-related genes and transcription factor expression[J]. Journal of Agricultural and Food Chemistry, 2013, 61(36): 8565-8572. |
| [24] |
YE X L, HUANG W W, CHEN Z, et al. Synergetic effect and structure-activity relationship of 3-hydroxy-3-methylglutaryl coenzyme a reductase inhibitors from crataegus pinnatifida bge[J]. Journal of Agricultural and Food Chemistry, 2010, 58(5): 3132-3138. |
| [25] |
杨靖. 棕色脂肪产热机制的研究进展[J]. 广东化工, 2018, 45(9): 111-113, 137. |
| [26] |
何际洲, 高博闻, 程辰. 脂肪组织的分类及研究进展[J]. 组织工程与重建外科杂志, 2017, 13(4): 224-227. |
| [27] |
ROCHA A, BOLIN A P, CARDOSO C A L, et al. Green tea extract activates AMPK and ameliorates white adipose tissue metabolic dysfunction induced by obesity[J]. European Journal of Nutrition, 2015, 55(7): 2231-2244. |
| [28] |
ZANG M W, XU S Q, MAITLAND K A, et al. Polyphenols stimulate AMP-activated protein kinase, lower lipids, and inhibit accelerated atherosclerosis in diabetic LDL receptor-deficient mice[J]. Diabetes, 2006, 55(8): 2180-2191. |
| [29] |
ANDRADE J MO, FRADE A C M, GUIMARÃES J B, et al. Resveratrol increases brown adipose tissue thermogenesis markers by increasing SIRT1 and energy expenditure and decreasing fat accumulation in adipose tissue of mice fed a standard diet[J]. European Journal of Nutrition, 2014, 53(7): 1503-1510. |
| [30] |
ZOU T D, WANG B, YANG Q Y, et al. Raspberry promotes brown and beige adipocyte development in mice fed high-fat diet through activation of AMP-activated protein kinase (AMPK) α[J]. The Journal of Nutritional Biochemistry, 2018, 55: 157-164. |
| [31] |
DESPRÉS J P, LEMIEUX I, BERGERON J, et al. Abdominal obesity and the metabolic syndrome:contribution to global cardiometabolic risk[J]. Arteriosclerosis, Thrombosis, and Vascular Biolog, 2008, 28(6): 1039-1049. |
| [32] |
CIVITARESE A E, UKROPCOVA B, CARLING S, et al. Role of adiponectin in human skeletal muscle bioenergetics[J]. Cell Metabolism, 2006, 4(1): 75-87. |
| [33] |
VIRBASIUS J V, SCARPULLA R C. Activation of the human mitochondrial transcription factor a gene by nuclear respiratory factors:a potential regulatory link between nuclear and mitochondrial gene expression in organelle biogenesis[J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(4): 1309-1313. |
| [34] |
孙爽, 牛佳鹏, 高燕燕. 冷刺激对棕色脂肪组织活化调控机制的研究进展[J]. 山东医药, 2017, 57(21): 110-112. |
| [35] |
BARTH C, KENNEDY L A, FISHER P R.Mitochondrial gene expression and dysfunction in model protozoa[M]//BULLERWELL C.Organelle genetics.Berlin, Heidelberg: Springer, 2012.
|
| [36] |
SATO D, ITAMI N, TASAKI H, et al. Relationship between mitochondrial DNA copy number and SIRT1 expression in porcine oocytes[J]. PLoS One, 2014, 9(4): e94488. |
| [37] |
SUN J Y, HUANG T, QI Z T, et al. Early mitochondrial adaptations in skeletal muscle to obesity and obesity resistance differentially regulated by high-fat diet[J]. Experimental and Clinical Endocrinology & Diabetes, 2017, 125(8): 538-546. |
| [38] |
SUN J Y, ZHANG C, KIM M J, et al. Early potential effects of resveratrol supplementation on skeletal muscle adaptation involved in exercise-induced weight loss in obese mice[J]. BMB Reports, 2018, 51(4): 200-205. |
| [39] |
ABE T, KAWAHARA-MIKI R, HARA T, et al. Modification of mitochondrial function, cytoplasmic lipid content and cryosensitivity of bovine embryos by resveratrol[J]. Journal of Reproduction and Development, 2017, 63(5): 455-461. |
| [40] |
MEYDANI M, HASAN S T. Dietary polyphenols and obesity[J]. Nutrients, 2010, 2(7): 737-751. |
| [41] |
LEE M S, LEE S, DOO M, et al. Green Tea (-)-epigallotocatechin-3-gallate induces PGC-1α gene expression in HepG2 cells and 3T3-L1 adipocytes[J]. Preventive Nutrition and Food Science, 2016, 21(1): 62-67. |
| [42] |
LEE M S, SHIN Y, JUNG S, et al. Effects of epigallocatechin-3-gallate on thermogenesis and mitochondrial biogenesis in brown adipose tissues of diet-induced obese mice[J]. Food & Nutrition Research, 2017, 61(1): 1325307. |
| [43] |
周佳. 茶多酚在动物生产中的应用及研究进展[J]. 广东饲料, 2019, 28(3): 27-29. |
| [44] |
张婷, 陈宇光, 罗佳捷. 茶多酚在动物生产中的研究进展[J]. 饲料博览, 2013(3): 16-19. |
| [45] |
HALLIWELL B. Biochemistry of oxidative stress[J]. Biochemical Society Transactions, 2007, 35(5): 1147-1150. |
| [46] |
GESSNER D K, RINGSEIS R, EDER K. Potential of plant polyphenols to combat oxidative stress and inflammatory processes in farm animals[J]. Journal of Animal Physiology and Animal Nutrition, 2016, 101(4): 605-628. |
| [47] |
ZOU B, XIAO G S, XU Y J, et al. Persimmon vinegar polyphenols protect against hydrogen peroxide-induced cellular oxidative stress via Nrf2 signalling pathway[J]. Food Chemistry, 2018, 255: 23-30. |
| [48] |
DENIS M C, DESJARDINS Y, FURTOS A, et al. Prevention of oxidative stress, inflammation and mitochondrial dysfunction in the intestine by different cranberry phenolic fractions[J]. Clinical Science, 2015, 128(3): 197-212. |
| [49] |
MCKAY D L, BLUMBERG J B. Cranberries (Vaccinium macrocarpon) and cardiovascular disease risk factors[J]. Nutrition Reviews, 2007, 65(11): 490-502. |
| [50] |
YEN G C, CHEN Y C, CHANG W T, et al. Effects of polyphenolic compounds on tumor necrosis factor-α (TNF-α)-induced changes of adipokines and oxidative stress in 3T3-L1 adipocytes[J]. Journal of Agricultural and Food Chemistry, 2011, 59(2): 546-551. |
| [51] |
QI G Y, MI Y S, FAN R, et al. Tea polyphenols ameliorate hydrogen peroxide-and constant darkness-triggered oxidative stress via modulating the Keap1/Nrf2 transcriptional signaling pathway in HepG2 cells and mice liver[J]. RSC Advances, 2017, 7(51): 32198-32208. |
| [52] |
赖灯妮, 覃思, 赵玲艳, 等. 果蔬中多酚类化合物双向调控Nrf2/Keap1信号通路的研究进展[J]. 食品科学, 2018, 39(5): 311-320. |
| [53] |
李慧, 杨林. Nrf2抗氧化的分子调控机制[J]. 生物信息学, 2018, 16(1): 1-6. |
| [54] |
BRENES A, VIVEROS A, CHAMORRO S, et al. Use of polyphenol-rich grape by-products in monogastric nutrition.A review[J]. Animal Feed Science and Technology, 2016, 211: 1-17. |
| [55] |
ZHANG C, WANG L, ZHAO X H, et al. Dietary resveratrol supplementation prevents transport-stress-impaired meat quality of broilers through maintaining muscle energy metabolism and antioxidant status[J]. Poultry Science, 2017, 96(7): 2219-2225. |
| [56] |
JUSKIEWICZ J, JANKOWSKI J, ZIELINSKI H, et al. The fatty acid profile and oxidative stability of meat from turkeys fed diets enriched with n-3 polyunsaturated fatty acids and dried fruit pomaces as a source of polyphenols[J]. PLoS One, 2017, 12(1): e0170074. |
| [57] |
CHEN Y, CHEN H, LI W, et al. Polyphenols in Eucalyptus leaves improved the egg and meat qualities and protected against ethanol-induced oxidative damage in laying hens[J]. Journal of Animal Physiology and Animal Nutrition, 2017, 102(1): 214-223. |
| [58] |
ZOU X Z, XIAO R, LI H L, et al. Effect of a novel strain of Lactobacillus brevis M8 and tea polyphenol diets on performance, meat quality and intestinal microbiota in broilers[J]. Italian Journal of Animal Science, 2018, 17(2): 396-407. |
| [59] |
LI H L, LI Z J, WEI Z S, et al. Long-term effects of oral tea polyphenols and Lactobacillus brevis M8 on biochemical parameters, digestive enzymes, and cytokines expression in broilers[J]. Journal of Zhejiang University-SCIENCE B, 2015, 16(12): 1019-1026. |
| [60] |
雷昕, 李楠洋, 汤雨凌, 等. 超微茶粉对生长猪生长性能、胴体品质及脂肪代谢的影响[J]. 畜牧与兽医, 2017, 49(11): 24-29. |
| [61] |
吴姝, 蒋步云, 宋泽和, 等. 植物多酚对黄羽肉鸡抗氧化性能、肠道形态及肉品质的影响[J]. 动物营养学报, 2018, 30(12): 5118-5126. |
| [62] |
GESSNER D K, FIESEL A, MOST E, et al. Supplementation of a grape seed and grape marc meal extract decreases activities of the oxidative stress-responsive transcription factors NF-κB and Nrf2 in the duodenal mucosa of pigs[J]. Acta Veterinaria Scandinavica, 2013, 55(1): 18. |
| [63] |
BURGESS T A, ROBICH M P, CHU L M, et al. Improving glucose metabolism with resveratrol in a swine model of metabolic syndrome through alteration of signaling pathways in the liver and skeletal muscle[J]. Archives of Surgery, 2011, 146(5): 556-64. |
| [64] |
KITAJI H, OOKUTSU S, SATO M, et al. Preincubation with green tea polyphenol extract is beneficial for attenuating sperm injury caused by freezing-thawing in swine[J]. Animal Science Journal, 2015, 86(11): 922-928. |
| [65] |
李捷. 茶多酚作为饲料添加剂在猪生产中的应用[J]. 中国饲料, 2019(14): 17-20. |
| [66] |
JANG S, SUN J H, CHEN P, et al. Flavanol-enriched cocoa powder alters the intestinal microbiota, tissue and fluid metabolite profiles, and intestinal gene expression in pigs[J]. The Journal of Nutrition, 2016, 146(4): 673-680. |
| [67] |
ROSSI R, RATTI S, PASTORELLI G, et al. The effect of dietary vitamin E and verbascoside on meat quality and oxidative stability of longissimus dorsi muscle in medium-heavy pigs[J]. Food Research International, 2014, 65: 88-94. |
| [68] |
徐瑞, 王改琴, 邬本成, 等. 茶叶渣对育肥猪生产性能及猪肉品质的影响[J]. 黑龙江畜牧兽医, 2017(10): 73-75, 286. |
| [69] |
ZAKARIA A A, YONG-MENG G, ALI-RAJION M, et al. The influence of plant polyphenols from oil palm (Elaeis guineensis Jacq.) leaf extract on fermentation characteristics, biohydrogenation of C18 PUFA, and microbial populations in rumen of goats:in vitro study[J]. Acta Agriculturae Scandinavica, Section A-Animal Science, 2017, 67(1/2): 76-84. |
| [70] |
ADEYEMI K D, SHITTU R M, SABOW A B, et al. Influence of diet and Postmortem ageing on oxidative stability of lipids, myoglobin and myofibrillar proteins and quality attributes of Gluteus medius muscle in goats[J]. PLoS One, 2016, 11(5): e0154603. |
| [71] |
MUÍÑO I, APELEO E, FUENTE J, et al. Effect of dietary supplementation with red wine extract or vitamin E, in combination with linseed and fish oil, on lamb meat quality[J]. Meat Science, 2014, 98(2): 116-123. |
| [72] |
MORÁN L, ANDRÉS S, BODAS R, et al. Meat texture and antioxidant status are improved when carnosic acid is included in the diet of fattening lambs[J]. Meat Science, 2012, 91(4): 430-434. |
| [73] |
INSERRA L, PRIOLO A, BIONDI L, et al. Dietary citrus pulp reduces lipid oxidation in lamb meat[J]. Meat Science, 2014, 96(4): 1489-1493. |
| [74] |
SAMMAN S, SANDSTRÖM B, TOFT M B, et al. Green tea or rosemary extract added to foods reduces nonheme-iron absorption[J]. The American Journal of Clinical Nutrition, 2001, 73(3): 607-612. |
| [75] |
王雪, 闫素梅. 多不饱和脂肪酸对动物脂类代谢的调节作用与机制[J]. 动物营养学报, 2019, 31(6): 2471-2478. |
| [76] |
JAFARI S, MENG G Y, ALI RAJION M, et al. Manipulation of rumen microbial fermentation by polyphenol rich solvent fractions from papaya leaf to reduce green-house gas methane and biohydrogenation of C18 PUFA[J]. Journal of Agricultural and Food Chemistry, 2016, 64(22): 4522-4530. |
| [77] |
CAPPUCCI A, ALVES S P, BESSA R J B, et al. Effect of increasing amounts of olive crude phenolic concentrate in the diet of dairy ewes on rumen liquor and milk fatty acid composition[J]. Journal of Dairy Science, 2018, 101(6): 4992-5005. |




