2. 国家水禽产业技术体系营养与饲料功能研究室, 青岛 266109
2. National Waterfowl Industry Technical System Nutrition and Feed Function Laboratory, Qingdao 266109, China
溃疡性结肠炎(ulcerative colitis,UC)属于炎症性肠病(inflammatory bowel disease,IBD),是一种原因不明的慢性自身免疫性肠炎[1],病情易反复,患者会出现腹痛、血性腹泻、全身感染等并发症,严重时甚至死亡。这种病极大地影响了患者的生活品质[2]。新的流行病学研究发现,西方国家有200多万人患此病,近年来中国的发病率有明显增高趋势[3]。现如今抗生素的使用越发广泛,引起的抗药性成为其不可避免的弊端。研究发现,抗菌肽可成为抗生素的有效替代品。天蚕素抗菌肽(cecropin antibacterial peptide,CAP)具有广谱抗菌性,能够改善动物肠道结构,促进免疫器官发育,提高免疫器官指数,提高抗病力,控制炎性反应,改善动物肠道菌群,减少应激[4];鹅油甘油二酯(goose oil diglyceride,GDG)具有抑菌性,较易乳化,利于吸收,可用作经肠吸收营养剂,用于加强吸收功能不全及手术后患者的营养[5]。研究表明,家蝇天蚕素能够有效改善小鼠肠道菌群失衡,减轻鼠伤寒沙门氏菌感染引起的结肠屏障功能损害[6]。何思莲等[7]研究得出,甘油二酯具有一定的抑菌作用,能有效延长大肠杆菌、牛奶酸败菌的生长适应期。洪学斌[8]研究发现,樟树籽甘油二酯能够作为食品级乳化剂,在儿童、老年人食品配方中使用,可以强化预防呼吸道、消化道感染。CAP具有抑菌性,GDG也具有体内外抑菌效果,而CAP和GDG对溃疡性结肠炎修复作用是否具有协同作用目前还未见报道。采用GDG作为CAP载体,可避免CAP冷冻或融化损伤,保持CAP活性,不会造成浪费,同时二者在体内可协同抑菌。因此,本研究以溃疡性结肠炎小鼠为动物模型,以GDG、CAP为主要干预试验材料,通过与对照组和模型组的对比,观察不同水平的GDG和CAP合用对小鼠溃疡性结肠炎的修复作用,确定二者适宜水平,为有效预防和治疗溃疡性结肠炎提供技术支撑。
1 材料与方法 1.1 材料与试剂GDG为本实验室自制,含量≥90%,保存于4 ℃冰箱,灌胃前在45 ℃水浴中溶化为液态;CAP购自华北制药股份有限公司,含量≥93%,灌胃前将GDG和CAP在45 ℃下充分搅拌混合均匀。
6周龄雄性昆明小鼠购自中国青岛大任富城有限公司;葡聚糖硫酸钠(DSS)购自合肥博美生物科技有限公司;肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-4(IL-4)、白细胞介素-6(IL-6)和白细胞介素-17(IL-17)酶联免疫吸附测定(ELISA)试剂盒购自南京建成生物工程研究所;小鼠专用基础饲粮购自德州诺唯实生物技术有限公司。
1.2 试验设备低温高速离心机(美国Sigma公司)、IMARK全自动酶标仪(美国Bio-Rad公司)、石蜡切片机(德国Leica公司)、BX20型荧光显微镜摄像机(日本OLYMPUS公司)、超低温冰箱(日本三洋公司)、DH-6000A型电热恒温培养箱(天津泰斯特仪器有限公司)、XS-204电子分析天平(瑞士梅特勒-托利多集团)、微型移液器(德国EPPENDORF公司)。
1.3 试验设计与方法试验分2个阶段进行。
1) 造模阶段:第1~2周,将184只小鼠随机分为8个组,分别为对照组(Ⅰ组)、模型组(Ⅱ组)和修复组(Ⅲ~Ⅷ组),对照组与模型组每组4个重复,每个重复8只;修复组每组4个重复,每个重复5只小鼠。第1周适应性喂养,第2周对照组小鼠自由饮用蒸馏水,模型组和修复组小鼠均自由饮用5% DSS水溶液诱导小鼠肠道炎症,连续1周。造模结束后,对照组和模型组各抽取12只小鼠,禁食24 h后眼球采血,取血清和结肠,检测结肠长度、体重变化和血清炎症因子含量,并观察肠道组织形态,验证造模是否成功。
2) 修复阶段:第2周开始正式试验,GDG添加水平分别为50、75、100 μL/只,CAP添加水平分别为3.75、5.00 mL/kg BW。造模阶段后的对照组、模型组和修复组每组4个重复,每个重复5只小鼠。对照组和模型组均灌喂生理盐水,修复组按设计灌喂不同水平的GDG和CAP,试验设计见表 1。基础饲粮组成及营养水平见表 2。
|
|
表 1 试验设计 Table 1 Experimental design |
|
|
表 2 基础饲粮组成及营养水平(风干基础) Table 2 Composition and nutrient levels of the basal diet (air-dry basis) |
本试验按照《实验动物福利伦理审查指南》(GB/T 35892—2018)实施。试验小鼠饲养于特定病原体(SPF)级动物房,室内温度控制在(20±2) ℃,相对湿度为50%~60%,室内通风良好,光照12 h(08:00—20:00)。小鼠5只1笼饲养。试验期间小鼠自由摄食、饮水。每日记录,观察小鼠质量、血便、稀便的情况,以及死亡数目。试验期为4周,每周测1次体重,给药方式为灌胃[9],第3周每天上午进行每只小鼠灌胃给药。
1.5 样品采集和指标测定试验第4周后对小鼠进行眼球采血,每重复采样3只。血样用3 500 r/min离心10 min,分离上清获得血清样品,-80 ℃超低温冰箱贮存。采血后通过颈椎脱臼法将小鼠处死,收集结肠、盲肠等置于-80 ℃超低温冰箱,用于相关指标观察检测。
一般状况观察:试验期间常规观察小鼠的精神状态、摄食量、毛色、大小便等,分别于试验开始及结束时以重复为单位称量小鼠体重,计算造模后体重和修复后体重。
疾病活动度观察:对小鼠进行疾病活动指数(disease activity index,DAI)评分,观察记录小鼠体重变化、大便隐血/便血、大便性状情况。
DAI=(体重下降百分比评分+大便隐血/便血评分+大便性状评分)/3[10]。
结肠长度:用刻度尺测量小鼠的结肠长度。
血清生化指标:采用ELISA方法检测小鼠血清中TNF-α、IL-1β、IL-17、IL-6和IL-4含量,按照ELISA试剂盒说明书进行操作,用酶标仪测定450 nm处的吸光度。
结肠肠道组织观测:切下距肛门1 cm的5 mm长的结肠样品,固定在10%中性福尔马林中用于制作石蜡切片。将样品取出,用流水冲洗12 h、乙醇脱水、二甲苯透明、浸蜡、包埋,然后用切片机切片,3~4 μm厚,连续切片,苏木精-伊红(HE)染色后用中性树胶固定于玻片上,在光镜下观察组织形态学变化,并记录绒毛高度和隐窝深度,计算绒毛高度/隐窝深度[11]。
1.6 数据统计分析试验数据用SPSS 17.0软件GLM程序分析主效应和互作效应,再利用ANOVA程序和LSD法对数据进行差异显著性分析,造模阶段的对照组和模型组之间差异采用Student-t检验分析。对于不满足正态分布或方差齐性的数据采用Welch检验和Brown-Forsythe检验[12]。数据用平均值和均值标准误(SEM)表示,P>0.05为差异不显著,P < 0.05为差异显著。
2 结果与分析 2.1 溃疡性结肠炎小鼠模型的建立Ⅰ组小鼠精神状态良好,饮食正常,毛发光泽;Ⅱ组小鼠精神萎蔫,饮食减少,毛发干枯无光泽。饮用DSS水溶液1周后,Ⅱ组小鼠普遍出现排血便的现象。DSS诱导小鼠溃疡性结肠炎模型的建立结果见表 3,由表可知,Ⅰ组与Ⅱ组小鼠初始体重无显著差异(P>0.05);饮用DSS水溶液1周后,与Ⅰ组相比,Ⅱ组小鼠造模后体重显著降低(P < 0.05),造模后DAI评分显著增加(P < 0.05),结肠长度显著降低(P < 0.05),血清炎症因子IL-6、TNF-α含量显著升高(P < 0.05)。由此表明,溃疡性结肠炎小鼠模型建立成功。
|
|
表 3 DSS诱导小鼠溃疡性结肠炎模型的建立结果 Table 3 Results of model establishment by DSS-induced ulcerative colitis of mice (n=12) |
由表 4可知,各组小鼠初始体重无显著差异(P>0.05);Ⅱ~Ⅷ组小鼠造模后体重显著低于Ⅰ组(P < 0.05);经7 d修复干预后,Ⅲ~Ⅷ组小鼠修复后体重显著高于Ⅱ组(P < 0.05),Ⅲ、Ⅳ、Ⅴ、Ⅶ、Ⅷ组小鼠修复后体重显著低于Ⅰ组(P < 0.05),Ⅵ组小鼠修复后体重与Ⅰ组无显著差异(P>0.05)。
|
|
表 4 GDG与CAP合用对溃疡性结肠炎小鼠体重变化的影响 Table 4 Effects of GDG combined with CAP on body weight changes of ulcerative colitis mice (n=4) |
由表 5可知,与Ⅰ组相比,Ⅱ组的造模后DAI评分显著增加(P < 0.05);Ⅲ~Ⅷ组的造模后DAI评分与Ⅰ组相比显著增加(P < 0.05),与Ⅱ组无显著差异(P>0.05)。Ⅱ组的修复后DAI评分显著高于Ⅰ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ、Ⅷ组(P < 0.05);Ⅲ、Ⅳ、Ⅵ和Ⅶ组的修复后DAI评分与Ⅰ组无差异显著(P>0.05),Ⅴ、Ⅷ组的修复后DAI评分显著高于Ⅰ组(P < 0.05)。
|
|
表 5 GDG与CAP合用对溃疡性结肠炎小鼠DAI评分的影响 Table 5 Effects of GDG combined with CAP on DAI score of ulcerative colitis mice (n=12) |
综上结果表明,GDG与CAP合用能够有效修复小鼠体重,并使DAI评分升高,但二者交互作用不显著(P>0.05)。
2.3 GDG与CAP合用对溃疡性结肠炎小鼠结肠长度的影响由表 6可知,与Ⅰ组相比,Ⅱ组的小鼠结肠长度显著降低(P < 0.05);Ⅲ~Ⅷ组的小鼠结肠长度显著高于Ⅱ组(P < 0.05);Ⅲ、Ⅴ、Ⅵ、Ⅶ、Ⅷ组的小鼠结肠长度与Ⅰ组相比无显著差异(P>0.05);GDG和CAP协同对小鼠结肠长度有显著交互作用(P < 0.05)。
|
|
表 6 GDG与CAP合用对溃疡性结肠炎小鼠结肠长度的影响 Table 6 Effects of GDG combined with CAP on colonic length of ulcerative colitis mice (n=12) |
结果表明,GDG与CAP合用能够修复溃疡性结肠炎小鼠结肠的损伤。
2.4 GDG与CAP合用对溃疡性结肠炎小鼠肠道组织形态的影响由图 1可看出,Ⅰ组小鼠结肠组织各层结构清晰,黏膜层肠腺丰富且排列规则,黏膜下层以及肌层未见明显异常,无溃疡、出血等损伤表现,隐窝结构完整;Ⅱ组小鼠结肠组织局部溃疡,肠黏膜损伤,黏膜和黏膜下层较多炎性细胞浸润,隐窝结构多被破坏,绒毛高度缩短;Ⅲ、Ⅳ、Ⅵ组小鼠结肠组织结构较为清晰,较少出现溃疡现象,隐窝结构较完整,无炎症细胞浸润现象。Ⅴ、Ⅶ、Ⅷ组小鼠结肠组织可见少许溃疡现象,隐窝结构相对完整。
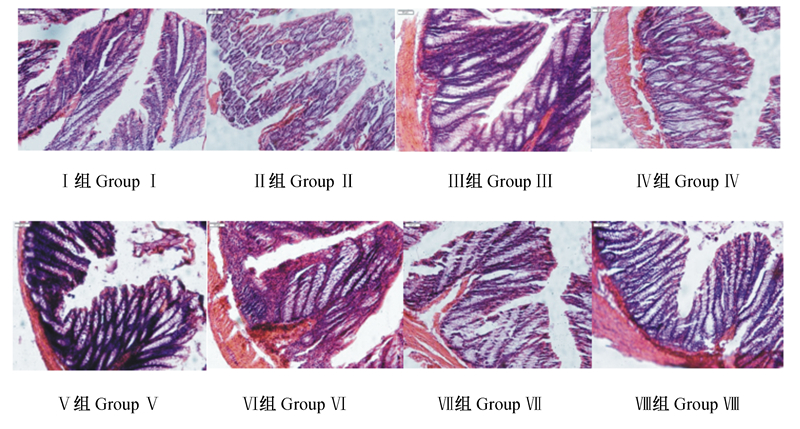
|
图 1 小鼠结肠组织形态 Fig. 1 Morphology of mouse colon tissue (200×) |
由表 7可知,与Ⅰ组相比,Ⅱ组小鼠结肠绒毛高度显著降低(P < 0.05);Ⅲ~Ⅷ组小鼠结肠绒毛高度显著高于Ⅱ组(P < 0.05),与Ⅰ组无显著差异(P>0.05);GDG与CAP合用对小鼠结肠绒毛高度有显著交互作用(P < 0.05)。
|
|
表 7 GDG与CAP合用对溃疡性结肠炎小鼠结肠绒毛高度、隐窝深度的影响 Table 7 Effects of GDG combined with CAP on colonic villus length and crypt depth of ulcerative colitis mice (n=12) |
与Ⅰ组相比,Ⅱ组小鼠结肠隐窝深度显著增加(P < 0.05);Ⅲ~Ⅷ组小鼠结肠隐窝深度显著低于Ⅱ组(P < 0.05),Ⅲ‐Ⅷ组小鼠结肠隐窝深度与Ⅰ组无显著差异(P>0.05);GDG与CAP合用对小鼠结肠隐窝深度有显著交互作用(P < 0.05)。
与Ⅰ组相比,Ⅱ组小鼠结肠绒毛高度/隐窝深度显著降低(P < 0.05);Ⅲ~Ⅷ组小鼠结肠绒毛高度/隐窝深度显著高于Ⅱ组(P < 0.05),与Ⅰ组无显著差异(P>0.05);GDG与CAP合用对小鼠绒毛高度/隐窝深度有显著交互作用(P < 0.05)。
2.6 GDG与CAP合用对溃疡性结肠炎小鼠血清炎症因子含量的影响由表 8可知,与Ⅱ组相比,Ⅰ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ、Ⅷ组血清IL-4含量显著升高(P < 0.05);Ⅶ、Ⅷ组血清IL-4含量显著高于Ⅰ组(P < 0.05),且显著高于Ⅲ、Ⅳ、Ⅴ、Ⅵ组(P < 0.05);Ⅲ、Ⅳ、Ⅴ、Ⅵ组血清IL-4含量与Ⅰ组无显著差异(P < 0.05),Ⅲ、Ⅳ、Ⅴ、Ⅵ组之间也无显著差异(P < 0.05);GDG与CAP合用对血清IL-4含量有显著交互作用(P < 0.05)。
|
|
表 8 GDG与CAP合用对溃疡性结肠炎小鼠血清炎症因子含量的影响 Table 8 Effects of GDG combined with CAP on serum inflammatory cytokine contents of ulcerative colitis mice (n=12) |
与Ⅱ组相比,Ⅰ、Ⅲ、Ⅴ、Ⅵ、Ⅶ组血清IL-6含量显著降低(P < 0.05),Ⅳ、Ⅷ组无显著差异(P>0.05);与Ⅰ组相比,Ⅲ、Ⅴ、Ⅵ、Ⅶ组血清IL-6含量无显著差异(P>0.05);Ⅲ、Ⅴ、Ⅵ、Ⅶ组之间血清IL-6含量无显著差异(P>0.05);GDG与CAP合用对血清IL-6含量有显著交互作用(P < 0.05)。
Ⅰ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ组血清IL-17含量显著低于Ⅱ组(P < 0.05),Ⅷ组与Ⅱ组无显著差异(P>0.05);Ⅲ、Ⅳ、Ⅴ、Ⅵ组血清IL-17含量与Ⅰ组无显著差异(P>0.05),Ⅶ组显著高于Ⅰ组(P < 0.05);GDG与CAP合用对血清IL-17含量有显著交互作用(P < 0.05)。
Ⅱ组血清IL-1β含量显著高于Ⅰ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ、Ⅷ组(P < 0.05);Ⅲ‐Ⅷ组血清IL-1β含量显著高于Ⅰ组(P < 0.05);Ⅳ、Ⅴ、Ⅷ组之间血清IL-1β含量无显著差异(P>0.05);GDG与CAP合用对血清IL-1β含量有显著交互作用(P < 0.05)。
Ⅰ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ组血清TNF-α含量显著低于Ⅱ组(P < 0.05),Ⅷ组血清TNF-α含量与Ⅱ组无显著差异(P>0.05);Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ组血清TNF-α含量与Ⅰ组无显著差异(P>0.05);GDG与CAP合用对血清TNF-α含量有显著交互作用(P < 0.05)。
3 讨论 3.1 GDG与CAP合用对溃疡性结肠炎小鼠体重、DAI评分的影响一般认为,DSS诱导溃疡性结肠炎的机制是通过抑制肠道上皮细胞增生损坏肠道黏膜屏障,导致肠道菌群失调,免疫功能紊乱,从而诱导溃疡性结肠炎发生[13]。溃疡性结肠炎病变特征通常为肠黏膜的慢性炎症和溃疡性改变,临床症状主要包括有腹泻、便血和体重减轻[14]。Zhai等[2]研究表明,CAP能够减轻结肠炎造成的体重减少、DAI评分升高现象。Murase等[15]研究表明,给予甘油二酯饮食后,小鼠体重及内脏脂肪重较给予甘油三酯组明显降低。石海杰等[3]研究发现,小鼠患溃疡性结肠炎后体重下降,DAI评分升高。本试验发现,GDG与CAP合用能够缓解溃疡性结肠炎小鼠体重下降,使DAI评分升高,修复干预后期小鼠的便血、腹泻现象逐渐好转甚至消失。这表明GDG与CAP合用对溃疡性结肠炎有一定的修复作用,其中75 μL/只 GDG+5.00 mL/kg BW CAP对小鼠体重和DAI评分的效果较好。
3.2 GDG与CAP合用对溃疡性结肠炎小鼠肠道组织形态的影响肠道不仅具有消化吸收功能,还是机体最大的“天然免疫器”。肠黏膜自身的结构和功能,以及内部大量的有益微生物,构成了强大的肠道黏膜屏障系统。小肠黏膜发育不良或受损将严重影响机体正常的生长发育和免疫功能。最新研究表明,溃疡性结肠炎的病理表现为明显充血、水肿、广泛溃疡发生,黏膜上皮细胞损伤脱落,组织内出现以中性粒细胞为主的大量炎性细胞浸润[16]。徐霞[17]研究发现,溃疡性结肠炎小鼠肠黏膜可见糜烂及溃疡形成,病变部位主要局限在黏膜层及黏膜下层,病变部位中有大量的中性粒细胞及淋巴细胞浸润。本试验研究发现,模型组小鼠肠道黏膜内已被大量炎性细胞浸润,对照组结肠组织清晰,无水肿、溃疡现象,修复组结肠损伤明显减轻,炎性细胞浸润较少,黏膜糜烂现象减轻或消失。这表明GDG与CAP合用能够缓解结肠组织损伤,减轻黏膜损伤和溃疡现象,Ⅲ、Ⅳ、Ⅵ组肠道组织的修复效果较好。
3.3 GDG与CAP合用对溃疡性结肠炎小鼠绒毛高度、隐窝深度及绒毛高度/隐窝深度的影响炎症性肠病的组织形态学特征是炎性细胞的黏膜浸润扩散,黏膜肌层增生和绒毛状表面不规则[18],小肠绒毛的长度与小肠上皮细胞的数量呈正相关,而且绒毛高度的变化直接影响绒毛的表面积。小肠绒毛高度越高,吸收和消化营养物质能力增强,有利于排除有害菌群的定植。肠隐窝即肠腺,隐窝深度变浅表明肠上皮细胞成熟率上升,吸收功能增强[19]。小肠绒毛高度/隐窝深度越大表明小肠内膜的面积越大,消化吸收功能越强。本试验发现,GDG与CAP合用能够提高溃疡性结肠炎小鼠的绒毛高度并降低隐窝深度,增大绒毛高度/隐窝深度。这表明GDG与CAP合用能够修复小鼠肠道炎症,保护绒毛完整和隐窝结构完整,其中75 μL/只 GDG+5.00 mL/kg BW CAP对小鼠的绒毛高度、隐窝深度和绒毛高度/隐窝深度的效果最佳。
3.4 GDG与CAP合用对溃疡性结肠炎小鼠血清炎症因子含量的影响巨噬细胞及相关趋化因子在DSS诱发的溃疡性结肠炎中起重要作用。肠道上皮细胞损伤后,细胞释放出炎性细胞因子和趋化因子,从而激活了巨噬细胞,即巨噬细胞的清除炎症功能被激活。另外,巨噬细胞释放出包括IL-1β、IL-6和TNF-α在内的大量炎性细胞因子,对肠上皮细胞产生第2次攻击[20]。沈雁等[21]研究表明,治疗溃疡性结肠炎小鼠的肠炎可能与盐酸小柴碱抑制结肠组织中TNF-α和IL-1β表达、提高IL-10表达有关。徐霞[17]研究表明,溃疡性结肠炎小鼠血清中IL-4含量降低。本试验研究发现,GDG与CAP合用不同程度地降低了血清IL-6、IL-1β、TNF-α、IL-17含量,提高了血清IL-4含量,其中75 μL/只 GDG+5.00 mL/kg BW CAP对降低促炎因子含量、提高抗炎因子含量的作用效果最佳。这说明GDG和CAP合用能有效治疗DSS诱导的溃疡性结肠炎,可能与有选择地抑制促炎因子IL-6、IL-1β、TNF-α、IL-17含量,提高抗炎因子IL-4含量有关。
由于酸性环境和酶的干扰作用,许多药物用于消化道炎症治疗效果不够理想,尤其是消化道后段炎症的修复治疗更难取得理想效果。抗菌肽的等电点大于7,表现出较强的阳离子特征,对较大的离子强度和较高或较低的pH均具有较强的抗性,抗菌活性高,抗菌谱广。因此,抗菌肽是目前抗生素较好的替代产品。然而,由于该产品价格高、用量低,在复杂的消化道酸性环境中活性有时也会产生一定影响,导致对肠道后段炎症修复作用效果减弱。为此,探索一种具有pH稳定、协同增效的新型乳化剂具有重要意义。本研究发现,利用鹅油制备的GDG具有抗菌和乳化特性,在消化道中稳定、抗酸、不吸收,是与抗菌肽配伍用于肠道炎症修复治疗的理想制剂,在代替抗生素医学领域中具有广阔市场前景。
4 结论GDG和CAP合用能够促进小鼠溃疡性结肠炎的修复,减轻肠黏膜的损伤;小鼠按75 μL/只 GDG+5.00 mL/kg BW CAP灌胃对溃疡性结肠炎损伤的修复效果最佳。
| [1] |
顾鉴秋, 邵梦茹, 陈家艺, 等. 肠炎清口服液改善小鼠溃疡性结肠炎肠道黏膜通透性的作用机制[J]. 中国实验方剂学杂志, 2014, 20(23): 133-137. |
| [2] |
ZHAI Z Y, ZHANG F, CAO R H, et al. Cecropin a alleviates inflammation through modulating the gut microbiota of C57BL/6 mice with DSS-induced IBD[J]. Frontiers in Microbiology, 2019, 10: 1595. DOI:10.3389/fmicb.2019.01595 |
| [3] |
石海杰, 文萍. 葛根提取物对溃疡性结肠炎大鼠肠黏膜损伤影响及机制[J]. 中国公共卫生, 2019, 35(8): 1038-1042. |
| [4] |
陈琛, 吴三桥, 薄新文, 等. 天蚕素抗菌肽的性质、功能及应用研究进展[J]. 西北农林科技大学学报(自然科学版), 2014, 42(7): 197-204. |
| [5] |
蔡丽丽, 朱立蕃, 刘润哲. 甘二酯的应用与制备研究进展[J]. 粮食与食品工业, 2012, 19(1): 24-29. |
| [6] |
ZHANG L, GUI S Q, LIANG Z B, et al. Musca domestica cecropin (Mdc) Alleviates salmonella typhimurium-induced colonic mucosal barrier impairment:associating with inflammatory and oxidative stress response, tight junction as well as intestinal flora[J]. Frontiers in microbiology, 2019, 10: 522. DOI:10.3389/fmicb.2019.00522 |
| [7] |
何思莲, 韦庆益, 宁正祥, 等. 1-硬脂酸-3-富马酸单甲酯-甘油二酯的合成与抑菌活性研究[J]. 食品工业科技, 2013, 34(17): 282-284. |
| [8] |
洪学斌.樟树籽油甘油酯分离纯化及抑菌活性[D].硕士学位论文.南昌: 南昌大学, 2015.
|
| [9] |
XIAO Y, DONG J L, YIN Z T, et al. Procyanidin B2 protects against D-galactose-induced mimetic aging in mice:metabolites and microbiome analysis[J]. Food and Chemical Toxicology, 2018, 119: 141-149. DOI:10.1016/j.fct.2018.05.017 |
| [10] |
赵红伟, 张建, 和丽丽, 等. 银杏叶提取物对肠炎小鼠免疫机制的调节作用[J]. 河北医科大学学报, 2017, 38(9): 1076-1079. |
| [11] |
DIELEMAN L A, PALMEN M J, AKOL H, et al. Chronic experimental colitis induced by dextran sulphate sodium (DSS) is characterized by Th1 and Th2 cytokines[J]. Clinical & Experimental Immunology, 1998, 114(3): 385-391. |
| [12] |
巴突尔·艾克木, 买买提·依斯热依力, 吾布力卡斯木·吾拉木, 等. NADPH氧化酶Nox-4在DSS诱导的小鼠肠炎中的表达及作用[J]. 医学研究杂志, 2018, 47(10): 135-140. |
| [13] |
CHEN Y, YANG B, ROSS R P, et al. Orally administered CLA ameliorates DSS-induced colitis in mice via intestinal barrier improvement, oxidative stress reduction, and inflammatory cytokine and gut Microbiota modulation[J]. Journal of Agricultural and food Chemistry, 2019, 67(48): 13282-13298. DOI:10.1021/acs.jafc.9b05744 |
| [14] |
贺庆芝, 罗晓清, 马芙蓉, 等. 鼠衣原体改善DSS诱导的小鼠溃疡性结肠炎的作用研究[J]. 微生物学报, 2020, 60(4): 695-702. |
| [15] |
MURASE T, MIZUNO T, OMACHI T, et al. Dietary diacylglycerol suppresses high fat and high sucrose diet-induced body fat accumulation in C57BL/6J mice[J]. Journal of Lipid Research, 2001, 42(3): 372-378. |
| [16] |
LI Y, PAN H O, LIU J X, et al. L-arabinose inhibits colitis by modulating gut microbiota in mice[J]. Journal of Agricultural and Food Chemistry, 2019, 67(48): 13299-13306. DOI:10.1021/acs.jafc.9b05829 |
| [17] |
徐霞.三皮汤对实验性小鼠溃疡性结肠炎的作用及IL-4、IL-6表达的变化[D].硕士学位论文.长沙: 中南大学, 2014.
|
| [18] |
ERBEN U, LODDENKEMPER C, SPIECKERMANN S, et al. Histomorphology of intestinal inflammation in inflammatory bowel diseases (IBD) mouse models and its relevance for IBD in men[J]. International Journal of Clinical and Experimental Medicine, 2016, 9(2): 408-442. |
| [19] |
李婵艺.蜜炙黄芪多糖的制备及对DSS诱导结肠炎小鼠的影响[D].硕士学位论文.湛江: 广东药科大学, 2019.
|
| [20] |
CHAO L, ZHENG P Y, XIA L, et al. Calycosin attenuates dextran sulfate sodium (DSS)-induced experimental colitis[J]. Iranian Journal of Basic Medical Sciences, 2017, 20(9): 1056-1062. |
| [21] |
沈雁, 钟继红, 徐磊, 等. 盐酸小檗碱对溃疡性结肠炎小鼠结肠组织TNF-α、IL-1β和IL-10表达的影响[J]. 中国现代应用药学, 2017, 34(8): 1094-1098. |




