2. 东北农业大学动物科学技术学院, 哈尔滨 150030
2. College of Animal Science and Technology, Northeast Agricultural University, Harbin 150030, China
使用抗生素会导致病原微生物产生耐药性、肠道菌群失衡和影响人的健康等问题,世界各国分别在不同时期限制或禁止抗生素在动物饲粮中的应用。我国也将在2020年7月1日起,禁止使用所有促生长抗生素作为饲料添加剂。因此,寻找抗生素的替代品成为目前迫在眉睫的问题[1-2]。植物精油是通过采用水蒸气蒸馏法从植物材料中提取的具有芳香气味、挥发性较强的油状液体[3-4]。植物精油的化学成分非常复杂,从化学角度分类主要包括萜、醇、酚、醛、酮、酯类和含氮含硫类化合物等。酚类化合物结构特点是含有苯环,如百里香酚、香芹酚等含酚类的植物精油,该类物质具有增强动物机体免疫功能的作用,且在杀菌方面应用广泛,此外,还具有镇痛、麻醉等药理作用;醛类物质的典型特点是散发浓香气,如肉桂醛等,其在一定范围内具备防治疾病的药理作用[5]。目前使用较为广泛的植物精油有百里香酚、香芹酚、肉桂醛等[6]。植物精油具有抑菌、抗氧化、调节机体免疫力等作用[7-8],可提高动物机体免疫应答水平、提高采食量、改善生长性能,此外,植物精油能够为肠道健康提供良好的环境,能够调节肠道菌群,且可促进消化酶分泌与肠绒毛生长[9]。周洋等[10]报道指出,植物精油的芳香性可提高饲粮的适口性。Mohiti-Asli等[11]研究发现,肉仔鸡饲粮中添加牛至油可显著提高肉仔鸡生产效率及免疫球蛋白滴度。Walter等[12]研究表明,育肥猪饲粮中添加痢草精油可提高血清抗体水平,提高抗病力。Zou等[13]研究表明,在猪饲粮中添加牛至油可提高空肠绒毛高度,改善肠道屏障的完整性。虽然关于不同植物精油对不同动物饲喂效果的研究报道众多,但作用结果不一,仍需进一步深入研究。因此,本研究以肉仔鸡为试验动物,比较不同来源的植物精油对其生长性能、免疫功能及肠道发育的影响,旨在为实际生产提供科学依据。
1 材料与方法 1.1 试验材料植物精油A(EO1组)有效成分为百里香酚,有效含量为1.7%;植物精油B(EO2组)有效成分为香芹酚与肉桂醛,有效含量分别为5%、3%;植物精油C(EO3组)有效成分为肉桂醛与百里香酚,有效含量均为10%;植物精油D(EO4组)有效成分为百里香酚与香芹酚,有效含量均为25%。
1.2 试验动物与试验设计选取1日龄、体重相近健康的爱拔益加肉仔鸡504羽(公母混合),随机分为6组(每组7个重复,每个重复12羽),分别为对照组(CK组),饲喂基础饲粮;抗生素组(AG组),在基础饲粮中添加抗生素(恩拉霉素),添加量为5 mg/kg;植物精油组(EO1组、EO2组、EO3组、EO4组),在基础饲粮中添加4种植物精油,添加量以推荐剂量为准,分别为150、100、100和200 mg/kg。试验期42 d。整个试验期内,肉仔鸡自由采食和饮水。基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets (air-dry basis) |
本试验在东北农业大学阿城试验基地进行,在进鸡雏前将鸡笼、水槽、料槽等洗刷干净后放入鸡舍内并将育雏鸡笼、鸡舍进行细致清洁打扫,选用福尔马林与高锰酸钾混合液以2 : 1的剂量混合进行消毒,消毒完毕后,要确保鸡舍没有刺鼻气味,要打开鸡舍门窗通风至少3 d,再将鸡雏送进鸡舍准备育雏。
本试验参照育种公司Aviagen营养推荐标准,采用3阶段饲粮饲喂。在此期间内,保证肉仔鸡自由饮水采食,每日要定时清理打扫水槽、料槽及鸡雏粪便并随时观察鸡雏采食饮水和健康状态,注意肉仔鸡是否有腹泻等疾病及异常现象,正常程序进行免疫。
1.4 测定指标与方法 1.4.1 生长性能的测定试验开始对鸡只分组时,对其进行称重并以重复为单位进行记录,于肉仔鸡42日龄以重复为单位对试验鸡只进行称重并计算各阶段采食量,主要包括体重(BW)、平均日采食量(ADFI)、平均日增重(ADG)、料重比(F/G)。由于植物精油对14日龄肉仔鸡作用不明显,因此未对其结果进行表述。
1.4.2 免疫器官指数的测定肉仔鸡42日龄时,每重复选取1只接近该重复平均体重的肉仔鸡对其称重后屠宰,取胸腺、法氏囊、脾脏称重,计算免疫器官指数。
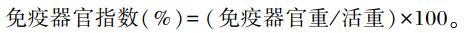
|
肉仔鸡42日龄时,每重复选取1只接近该重复平均体重的肉仔鸡,采取颈静脉采血方式,采取血液10 mL于离心管中,并分离血清,分装于试管中,置-20 ℃保存待测。采用酶联免疫吸附试验(ELISA)法测定血清中免疫球蛋白M(IgM)、免疫球蛋白G(IgG)、免疫球蛋白A(IgA)含量,试剂盒购自南京建成生物工程研究所,测定仪器为TECAN GENIOS多功能酶标仪。
1.4.4 肠道形态的测定肉仔鸡42日龄时,屠宰后取1 cm左右的十二指肠、空肠、回肠肠段,用生理盐水缓缓的冲洗肠段内容物,保存于福尔马林溶液中进行固定,采用石蜡对固定好的样品进行包埋,包埋后进行取样染色,取样原则为:各组各列每隔10片取1片,且在每列中取2张,采用苏木精-伊红(HE)染色法进行染色并进行拍摄取片,采用Motic Images Advanced 3.2病理图像分析系统对绒毛长度和隐窝深度进行测量,每张切片测5个平行样并计算平均值。
1.5 数据处理试验数据采用SPSS 20.0进行单因素方差分析,利用Duncan氏法进行多重比较,利用Means过程计算平均值及标准误。结果以平均值±标准误的方式表示,显著水平为P < 0.05。
2 结果与分析 2.1 植物精油对肉仔鸡生长性能的影响由表 2可知,1~42日龄阶段,与CK组相比,AG组平均日采食量显著升高(P < 0.05),EO组有升高趋势,但差异不显著(P>0.05);AG组、EO3组和EO4组平均日增重与体重显著升高(P < 0.05),且EO1组和EO2组较AG组显著降低(P < 0.05),而EO3组和EO4组与AG组相比,差异不显著(P>0.05);各组间料重比差异不显著(P>0.05)。
|
|
表 2 植物精油对1~42日龄肉仔鸡生长性能的影响 Table 2 Effects of plant essential oil on growth performance of broilers at 1 to 42 days of age |
由表 3可知,各组间脾脏指数、法氏囊指数、胸腺指数均差异不显著(P>0.05)。
|
|
表 3 植物精油对42日龄肉仔鸡免疫器官指数的影响 Table 3 Effects of plant essential oil on immune organ indexes of broilers at 42 days of age |
由表 4可知,与CK组相比,AG组与EO4组血清IgA含量均有升高趋势,但差异不显著(P>0.05),与AG组相比,EO3组与EO4组血清中IgA含量差异不显著(P>0.05),EO1组与EO2组显著降低(P < 0.05)。与CK组相比,AG组血清中IgG含量显著升高(P < 0.05),EO2组、EO3组、EO4组有升高趋势,但差异不显著(P>0.05)。与CK组相比,AG组、EO3组、EO4组血清IgM含量均显著升高(P < 0.05),EO1组与EO2组差异不显著(P>0.05),但EO3组、EO4组与AG组差异不显著(P>0.05)。
|
|
表 4 植物精油对42日龄肉仔鸡血清免疫球蛋白含量的影响 Table 4 Effects of plant essential oil on contents of serum immunoglobulin in serum of broilers at 42 days of age |
由表 5可知,与CK组相比,各组间十二指肠绒毛高度差异不显著(P>0.05);AG组隐窝深度显著降低(P < 0.05),EO1组、EO2组、EO3组、EO4组差异不显著(P>0.05);AG组绒毛高度与隐窝深度比值显著升高(P < 0.05),其他组间差异不显著(P>0.05),EO1组与EO4组显著低于AG组(P < 0.05)。与CK组相比,EO3组空肠绒毛高度显著升高(P < 0.05),其他组差异不显著(P>0.05),与AG组相比,EO3组显著升高(P < 0.05);AG组、EO1组、EO2组、EO4组隐窝深度均显著降低(P < 0.05),EO3组差异不显著(P>0.05);AG组空肠绒毛高度与隐窝深度比值显著升高(P < 0.05)。与CK组相比,AG组回肠绒毛高度显著升高(P < 0.05),其他各组差异不显著(P>0.05);各组隐窝深度差异不显著(P>0.05);AG组绒毛高度与隐窝深度比值显著升高(P < 0.05),其他组差异不显著(P>0.05)。
|
|
表 5 植物精油对42日龄肉仔鸡肠道形态的影响 Table 5 Effects of plant essential oil on intestinal morphology of broilers at 42 days of age |
研究表明,植物精油对动物生长有促进作用,可提高平均日增重与饲料转化率[14],Li等[15]研究表明,仔猪饲粮中添加百里香酚可提高仔猪采食量。Zheng等[16]研究表明,香芹酚与肉桂醛等混合物可提高肉仔鸡平均日增重。Weber等[17]研究表明,肉仔鸡饲粮中添加百里香酚与胡椒碱混合物可显著改善肉仔鸡的生长性能。Botsoglou等[18]在肉鸡饲粮中添加止痢草(主要成分为百里香酚与香芹酚)可提高肉鸡采食量与体重。王兰等[19]研究表明,肉鸡饲粮中添加植物精油对肉鸡生长性能无显著影响,但可提高部分养分消化率。本试验研究结果表明,添加植物精油对肉仔鸡体重有一定提高作用,与CK组比较,EO3组与EO4组达到显著水平,且与AG组相比,增重差异不显著。AG组与EO组对肉仔鸡各阶段采食量有促进作用,且AG组较各EO组差异不显著。在本试验条件下,AG组与EO组对肉鸡生长性能均有所改善,这与前人研究结果相一致。分析原因可能是植物精油具有刺激食欲、促进动物采食及胃肠道蠕动等作用。Jang等[20]研究发现,肉鸡饲粮中添加植物精油可显著提高胰蛋白酶、α-淀粉酶和肠麦芽酶活性。此外,Jamroz等[21]报道指出,饲粮中添加植物精油可刺激肉鸡腺胃表皮细胞分泌更多的中性黏多糖和少量唾液蛋白,有助于食糜的消化吸收,提高饲料转化率。
3.2 植物精油对肉仔鸡免疫器官指数的影响胸腺、脾脏及法氏囊是参与家禽体液免疫与细胞免疫的重要器官,法氏囊是家禽特有的免疫器官,其主要功能是参与体液免疫,同时胸腺参与细胞免疫,而脾脏则是家禽最大外周免疫器官。免疫器官重量与其自身细胞增殖速度及免疫机能强弱密切相关[22]。早在20世纪,学者就以胸腺、脾脏及法氏囊重量作为评估动物机体免疫功能的指标[23]。抗生素对免疫器官指数影响的报道较多,Dafwang等[24]报道指出,肉鸡饲粮中添加一定量抗生素可促进法氏囊发育,增加法氏囊重量。朱晓磊等[25]研究表明,百里香酚可提高麻花鸡胸腺指数,但对脾脏指数有负面效应。姜维等[26]研究表明,随着肉仔鸡饲粮中薰衣草精油添加量的提高,胸腺指数与抗生素组趋于一致。本试验结果表明,AG组及EO组胸腺、脾脏及法氏囊指数均有所提高,且EO4组胸腺指数高于AG组。这与朱晓磊等[25]研究结果不完全一致,但与姜维等[26]研究结果相似,可能由于植物精油的成分不同及鸡品种不同导致试验结果有所差异。植物精油在肉仔鸡免疫器官发育的促进作用效果,值得深入研究。
3.3 植物精油对肉仔鸡血清免疫球蛋白含量的影响动物淋巴细胞经抗原诱导可生成具有免疫活性的蛋白质,主要以IgM、IgG、IgA 3种形式存在,其抗体活性及化学结构与抗体相似[27]。血清中免疫球蛋白的含量可衡量动物免疫水平的高低[28]。Li等[15]研究发现,仔猪饲粮中添加植物精油可提高其血清IgG与IgA含量。本试验结果表明,EO3组与EO4组血清中IgM含量显著提高,且与AG组无显著差异,说明植物精油在提高肉仔鸡血清中IgM含量上起到积极作用,但姜维等[26]研究表明,肉仔鸡饲粮中添加薰衣草精油对肉仔鸡血清IgA含量无显著影响,这与本试验结果存在出入,可能是由于植物精油种类不同对不同类型的免疫球蛋白含量影响不同。
3.4 植物精油对肉仔鸡肠道形态的影响肠道绒毛高度、隐窝深度及其二者比值是反映肠道结构完整性的重要指标[29]。肠道不仅是动物的主要消化器官,当内源性与外源性细菌、病毒入侵时,起到很好的防护作用,当机体肠道受损,动物生长性能下降[30]。Castillo等[31]报道,肉桂醛可防止细胞氧化,促进肠道绒毛生长。刘洋等[32]研究发现,肉仔鸡饲粮中添加肉桂醛可显著提高肠道绒毛高度,促进肠道发育。Zhang等[33]研究表明,饲粮中添加胡椒提取的精油,可提高空肠绒毛高度,降低隐窝深度,增大绒毛表面积。本试验结果表明,与CK组比较,肉仔鸡饲粮中添加植物精油B、C、D均有降低十二指肠和空肠隐窝深度、提高空肠绒毛高度与隐窝深度比值的趋势,且植物精油C显著提高了空肠绒毛高度,还有改善十二指肠绒毛高度和回肠绒毛高度与隐窝深度比值的趋势。这说明肉仔鸡饲粮中添加植物精油可能对肠道发育有一定改善作用。本试验中,EO3组效果较其他植物精油组效果好,分析原因,一方面,可能与其较高含量的肉桂醛有关,肉桂醛可刺激肠道分泌丁酸,从而降低肠道损伤[34];另一方面,Pei等[35]研究表明,含有肉桂醛的精油抑菌作用较不含有肉桂醛的精油强,且肉桂醛与百里香酚组合具有协同作用,且作用效果强于肉桂醛与香芹酚组合。此外,张显东[36]报道指出,香芹酚是油状液体,在加工储存过程中容易挥发氧化导致失活,而百里香酚常温下以晶体形式存在,相对稳定。这可能也是EO3组效果较好的原因。
4 结论按不同来源的植物精油推荐剂量饲喂肉仔鸡后发现,植物精油均对肉仔鸡生长性能和免疫功能具有一定的促进作用,其中EO3组,即在本试验中添加100 mg/kg植物精油C(肉桂醛与百里香酚有效含量为10%)效果最佳,接近抗生素饲喂效果,说明其具有作为抗生素替代物的潜力。
| [1] |
MEMARIANI Z, SHARIFZADEH M, BOZORGI M, et al. Protective effect of essential oil of pistacia atlantica desf.On peptic ulcer:role of α-pinene[J]. Journal of Traditional Chinese Medicine, 2017, 37(1): 57-63. DOI:10.1016/S0254-6272(17)30027-4 |
| [2] |
DRAUGHON F A. Use of botanicals as biopreservatives in foods[J]. Food Technology, 2004, 58(2): 20-28. |
| [3] |
LIVEIRA G L, CARDOSO S K, JÚNIOR C R O l, et al. Chemical study and larvicidal activity against Aedes aegypti of essential oil of Piper aduncum L.(Piperaceae)[J]. .Anais da Academia Brasileira de Ciências, 2013, 85(4): 1227-1234. DOI:10.1590/0001-3765201391011 |
| [4] |
BOUCHEKRIT M, LAOUER H, HAJJI M, et al. Essential oils from Elaeoselinum asclepium:chemical composition, antimicrobial and antioxidant properties[J]. Asian Pacific Journal of Tropical Biomedicine, 2016, 6(10): 851-857. DOI:10.1016/j.apjtb.2016.07.014 |
| [5] |
张克英. 植物精油在家禽营养中的应用进展[J]. 饲料与畜牧(新饲料), 2006(12): 41-44. |
| [6] |
DI VAIO C, GRAZIANI G, GASPARI A, et al. Essential oils content and antioxidant properties of peel ethanol extract in 18 lemon cultivars[J]. Scientia Horticulturae, 2010, 126(1): 50-55. DOI:10.1016/j.scienta.2010.06.010 |
| [7] |
BENBELAÏD F, KHADIR A, BENDAHOU M, et al. Composition and antimicrobial activity of Cistus munbyi essential oil:an endemic plant from Algeria[J]. Journal of Forestry Research, 2017, 28(6): 1129-1134. DOI:10.1007/s11676-017-0387-6 |
| [8] |
MONZOTE L, SCULL R, COS P, et al. Essential oil from Piper aduncum:chemical analysis, antimicrobial assessment, and literature review[J]. Medicines, 2017, 4(3): 49. DOI:10.3390/medicines4030049 |
| [9] |
MARCINČÁK S, CABADAJ R, POPELKA P, et al. Antioxidative effect of oregano supplemented to broilers on oxidative stability of poultry meat[J]. Slovenian Veterinary Research, 2008, 45(2): 61-66. |
| [10] |
周洋, 彭艳, 周小秋. 植物精油对动物生长和免疫力的影响及其作用机制[J]. 动物营养学报, 2018, 30(1): 37-43. DOI:10.3969/j.issn.1006-267x.2018.01.006 |
| [11] |
MOHITI-ASLI M, GHANAATPARAST-RASHTI M. Comparison of the effect of two phytogenic compounds on growth performance and immune response of broilers[J]. Journal of Applied Animal Research, 2017, 45(1): 603-608. DOI:10.1080/09712119.2016.1243119 |
| [12] |
WALTER B M, BILKEI G. Immunostimulatory effect of dietary oregano etheric oils on lymphocytes from growth-retarded, low-weight growing-finishing pigs and productivity[J]. Tijdschrift Voor Diergeneeskunde, 2004, 129(6): 178-181. |
| [13] |
ZOU Y, XIANG Q H, WANG J, et al. Oregano essential oil improves intestinal morphology and expression of tight junction proteins associated with modulation of selected intestinal bacteria and immune status in a pig model[J]. BioMed Research International, 2016, 2016: 5436738. |
| [14] |
MUELLER K, BLUM N M, KLUGE H, et al. Influence of broccoli extract and various essential oils on performance and expression of xenobiotic- and antioxidant enzymes in broiler chickens[J]. British Journal of Nutrition, 2012, 108(4): 588-602. DOI:10.1017/S0007114511005873 |
| [15] |
LI S Y, RU Y J, LIU M, et al. The effect of essential oils on performance, immunity and gut microbial population in weaner pigs[J]. Livestock Science, 2012, 145(1/2/3): 119-123. |
| [16] |
ZHENG Z L, TAN J Y W, LIU H Y, et al. Evaluation of oregano essential oil (Origanum heracleoticum L.) on growth, antioxidant effect and resistance against aeromonas hydrophila in channel catfish (Ictalurus punctatus)[J]. Aquaculture, 2009, 292(3/4): 214-218. |
| [17] |
WEBER G M, MICHALCZUK M, HUYGHEBAERT G, et al. Effects of a blend of essential oil compounds and benzoic acid on performance of broiler chickens as revealed by a meta-analysis of 4 growth trials in various locations[J]. Poultry Science, 2012, 91(11): 2820-2828. DOI:10.3382/ps.2012-02243 |
| [18] |
BOTSOGLOU N A, FLOROU-PANERI P, CHRISTAKI E, et al. Effect of dietary oregano essential oil on performance of chickens and on iron-induced lipid oxidation of breast, thigh and abdominal fat tissues[J]. British Poultry Science, 2002, 43(2): 223-230. DOI:10.1080/00071660120121436 |
| [19] |
王兰, 陈代文, 余冰, 等. 植物精油对肉鸡生长性能、抗氧化能力和免疫机能的影响[J]. 动物营养学报, 2019, 31(2): 348-355. |
| [20] |
JANG I S, KO Y H, KANG S Y, et al. Effect of a Commercial essential oil on growth performance, digestive enzyme activity and intestinal microflora population in broiler chickens[J]. Animal Feed Science and Technology, 2007, 134(3/4): 304-315. |
| [21] |
JAMROZ D, WERTELECKI T, HOUSZKA M, et al. Influence of diet type on the inclusion of plant origin active substances on morphological and histochemical characteristics of the stomach and jejunum walls in chicken[J]. Journal of Animal Physiology and Animal Nutrition, 2006, 90(5/6): 255-268. |
| [22] |
HASSAN H M A, MOHAMED M A, YOUSSEF A W, et al. Effect of using organic acids to substitute antibiotic growth promoters on performance and intestinal microflora of broilers[J]. Asian-Australasian Journal of Animal Sciences, 2010, 23(10): 1348-1353. DOI:10.5713/ajas.2010.10085 |
| [23] |
王开云, 曾检华, 魏金刚, 等. 生长抑素基因疫苗对肉用鸡血浆生化指标和免疫器官指数的影响[J]. 江西农业大学学报, 2010(1): 134-140. |
| [24] |
DAFWANG I I, COOK M E, SUNDE M L, et al. Bursal, intestinal, and spleen weights and antibody response of chicks fed subtherapeutic levels of dietary antibiotics[J]. Poultry Science, 1985, 64(4): 634-639. DOI:10.3382/ps.0640634 |
| [25] |
朱晓磊, 祁凤华, 黄金涛, 等. 百里香精油对麻花鸡生长性能及免疫器官指数的影响[J]. 石河子大学学报(自然科学版), 2013, 31(1): 43-47. DOI:10.3969/j.issn.1007-7383.2013.01.010 |
| [26] |
姜维, 张丁文, 李虎, 等. 薰衣草精油饲喂肉仔鸡对免疫器官指数和血清、空肠组织中iga含量的影响[J]. 新疆农业科学, 2014, 51(2): 340-347. |
| [27] |
GIANNENAS I, TRIANTAFILLOU E, STAVRAKAKIS S, et al. Assessment of dietary supplementation with carvacrol or thymol containing feed additives on performance, intestinal microbiota and antioxidant status of rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 2012, 350-353: 26-32. DOI:10.1016/j.aquaculture.2012.04.027 |
| [28] |
MAGNADÓTTIR B. Innate immunity of fish (overview)[J]. Fish & Shellfish Immunology, 2006, 20(2): 137-151. |
| [29] |
CHAMORRO S, ROMERO C, BRENES A, et al. Impact of a sustained consumption of grape extract on digestion, gut microbial metabolism and intestinal barrier in broiler chickens[J]. Food & Function, 2019, 10(3): 1444-1454. |
| [30] |
FRANCIOSINI M P, CASAGRANDE-PROIETTI P, FORTE C, et al. Effects of oregano (Origanum vulgare L.) and rosemary (Rosmarinus Officinalis L.) aqueous extracts on broiler performance, immune function and intestinal microbial population[J]. Journal of Applied Animal Research, 2016, 44(1): 474-479. DOI:10.1080/09712119.2015.1091322 |
| [31] |
CASTILLO M, MARTÍN-ORÚE S M, ROCA M, et al. The response of gastrointestinal microbiota to avilamycin, butyrate, and plant extracts in early-weaned pigs[J]. Journal of Animal Science, 2006, 84(10): 2725-2734. DOI:10.2527/jas.2004-556 |
| [32] |
刘洋, 臧素敏, 李同洲, 等. 肉桂醛对肉鸡肠道菌群、肠道结构及营养物质消化率的影响[J]. 中国畜牧杂志, 2013, 49(13): 65-68. DOI:10.3969/j.issn.0258-7033.2013.13.017 |
| [33] |
ZHANG K Y, YAN F, KEEN C A, et al. Evaluation of microencapsulated essential oils and organic acids in diets for broiler chickens[J]. International Journal of Poultry Science, 2005, 4(9): 612-619. DOI:10.3923/ijps.2005.612.619 |
| [34] |
TIIHONEN K, KETTUNEN H, BENTO M H L, et al. The effect of feeding essential oils on broiler performance and gut microbiota[J]. British Poultry Science, 2010, 51(3): 381-392. DOI:10.1080/00071668.2010.496446 |
| [35] |
PEI R S, ZHOU F, JI B P, et al. Evaluation of combined antibacterial effects of eugenol, cinnamaldehyde, thymol, and carvacrol against E. coli with an Improved Method[J]. Journal of Food Science, 2009, 74(7): M379-M383. DOI:10.1111/j.1750-3841.2009.01287.x |
| [36] |
张显东. 香芹酚和百里香酚的作用机理及其在单胃动物中的应用研究进展[J]. 中国畜牧杂志, 2017, 53(11): 25-30. |




