2. 山东农业大学动物科技学院, 泰安 271018
2. College of Animal Science and Technology, Shandong Agricultural University, Tai'an 271018, China
犊牛腹泻是犊牛最常见的疾病之一,给牛产业带来了巨大的损失。近几年来,随着我国奶牛养殖业规模扩大,犊牛腹泻发病率也呈上升趋势。犊牛腹泻可造成57%断奶犊牛死亡[1],严重影响犊牛生长发育和生产性能的发挥,影响养牛业的良性发展。目前临床上常用土霉素、头孢哌酮、庆大霉素、氟派酸等进行治疗,但易产生耐药性及畜产品药物残留超标,引起公共卫生和食品安全问题。
近年来,微生态制剂已被作为一种有效的抗生素替代品来饲喂动物,来改善肠道菌群进而对宿主动物产生有益影响,尤其是预防腹泻。腹泻是肠道菌群紊乱的表现。肠道微生物在反刍动物营养物质消化代谢中发挥着重要作用,它们与宿主共生,在物质代谢、生物屏障和宿主防御等方面有重要作用,尤其对宿主免疫功能也具有关键的调控作用[2],良好的肠道微生态区系可明显提高能量利用率、改善奶牛健康水平。Lee等[3]研究表明,联合饲喂植物乳杆菌和枯草芽孢杆菌能够降低犊牛腹泻持续时间、调节肠道菌群平衡和预防小牛腹泻。An等[4]研究发现,乳酸菌能调节犊牛胃肠道菌群平衡,显著增加犊牛体重,减少粪便中致病菌数量,改善犊牛健康,降低腹泻。Kawakami等[5]研究发现,饲喂含酵母菌和乳酸菌的代乳粉能显著增加饲料转化率、日增重,减少粪便评分,抑制黑白花奶牛腹泻并促进生长。微生态制剂对肠道菌群的影响已成为国际上研究热点[6]。新生犊牛消化系统微生物基本处于空白状态,这个阶段添加微生态制剂会从起点帮助消化系统建立优势微生态区系。低聚果糖(FOS)又名寡果糖,它具备改善肠道功能、预防和治疗便秘和腹泻发生等显著功效。王平等[7]研究发现,低聚果糖可调节肠道菌群;赵思琪等[8]研究指出,低聚果糖能提高小鼠肠道微生物菌群多样性及丰富度,在一定程度上改善肠道微环境;杨大亮等[9]研究发现,益生菌制剂联合低聚果糖治疗可提高腹泻患儿肠道内双歧杆菌和乳酸菌数量,降低小儿抗生素相关性腹泻治愈时间,可加强益生菌的治疗效果。前人的研究主要专注于益生菌对犊牛腹泻的影响,而本研究将复合微生态制剂联合低聚果糖饲喂犊牛,监测其对犊牛生长性能和腹泻率的影响,并利用高通量测序技术研究其对肠道微生态区系的影响,为促进微生态制剂在哺乳期犊牛中的应用提供理论支撑。
1 材料与方法 1.1 试验材料低聚果糖,纯度≥95%;植物乳杆菌,活菌数≥1×109 CFU/g;枯草芽孢杆菌,活菌数≥2×1010 CFU/g。
1.2 试验设计选取健康荷斯坦母犊牛21头,按照日龄[(5.0±1.2) d]、体重[(40.5±0.9) kg]、胎次[(1.9±0.8)胎]相近原则,随机分成3组,每组7头,ZK组每日每头添加植物乳酸杆菌(1×109 CFU)和枯草芽孢杆菌(2×1010 CFU)各5 g;ZKT组每日每头添加植物乳酸杆菌(1×109 CFU)、枯草芽孢杆菌(2×1010 CFU)和低聚果糖各5 g(上述2组在常规饲喂后1 h分2次将相应的制剂溶解在温水中用奶瓶灌入);C组为空白对照组,常规饲喂。预试期7 d,正试期50 d,于10日龄开始正式试验,60日龄结束。
1.3 试验饲粮与饲养管理试验犊牛饲喂于犊牛岛,每日于05:00、13:00、19:30饲喂恒温酸化奶,共3次,饲喂量随日龄变化,7~14日龄2.6 L/次,15~30日龄3.2 L/次,31~45日龄3.8 L/次,46~60日龄2.0 L/次。犊牛自由饮水,自由采食精料补充料,其组成及营养水平见表 1。试验期腹泻犊牛给予补液治疗,禁用任何抗生素。
|
|
表 1 饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the diet (DM basis) |
每天记录各组耗料量(精料补充料质量),计算平均日采食量。试验牛于预饲7 d后测定空腹体重作为初始体重,正式试验50 d后测定终末体重,计算每头牛平均日增重。
1.5 腹泻动物的记录每日观察试验犊牛粪便状况并进行评分,粪便形状正常,掉在地面后外形微有变化,成形但不坚硬,记为1分;外形松软成堆,但难以保持,记为2分;薄饼或软膏状,易扩散,记为3分;呈水状,固液分离,记为4分[10]。3分及以上记为腹泻,统计完成后计算腹泻率[11],计算公式如下:

|
正式试验50 d后,使用直肠采样器采集粪便,每组随机选取4头牛,采集后迅速置入密封袋,冰块封住迅速转入-80 ℃冰箱保存,以备送检。
1.7 样本送检将样品送至北京诺禾致源生物信息科技有限公司,采用Illumina Miseq平台进行16S扩增子测序,分析犊牛肠道微生态区系变化。
1.8 统计分析用Excel 2010整理试验数据,然后用SAS 9.1.3统计软件的one-way ANOVA过程进行单因子方差分析,差异显著用Duncan氏法进行多重比较检验,P < 0.05作为差异显著的标准。试验结果用“平均值±标准误”表示。
2 结果与分析 2.1 复合微生态制剂联合低聚果糖对哺乳期犊牛生长性能及腹泻率的影响由表 2、表 3可知,与C组相比,ZK组和ZKT组生长性能无显著变化(P>0.05);而这2组粪便评分和腹泻率均显著低于C组(P < 0.05)。
|
|
表 2 复合微生态制剂联合低聚果糖对哺乳期犊牛生长性能的影响 Table 2 Effects of compound microecological preparation combined with FOS on growth performance of lactation calves |
|
|
表 3 复合微生态制剂联合低聚果糖对哺乳期犊牛粪便评分和腹泻率的影响 Table 3 Effects of compound microecological preparation combined with FOS on fecal score and diarrhea rate of lactation calves |
根据聚类分析得到操作分类单元(OTU),将其分析发现3组之间共有472个OTU,ZKT组与ZK组之间共有538个,占74%;ZKT组与C组之间共有492个,占67.68%;ZK组与C组之间共有518个,占71.25%,说明添加2种制剂能改变肠道菌群OTU组成(图 1)。

|
CFB:C 组样品 samples in C group;ZKFB:ZK 组样品 samples in ZK group;ZKTFB:ZKT 组样品 samples in ZKT group。下图同 The same as below。 图 1 维恩图 Fig. 1 Venn graph |
Alpha多样性用于分析样本内微生物群落多样性,通过单样本多样性分析,可反映样本内微生物群落丰富度和多样性。本研究主要在OTU稀释曲线、等级聚类曲线图和蜜蜂群图 3个层面进行展示。稀释曲线随着测试深度不断增加逐渐上升,并趋于平缓,说明本研究测序深度较为合理(图 2-A)。等级聚类曲线可直观反映样本中物种的丰富度和均匀度。在水平方向上,物种丰富度由曲线宽度来反映,物种丰富度越高,曲线在横轴上跨度越大;在垂直方向上,曲线的平滑程度,反映了样本中物种的均匀程度,曲线越平缓,物种分布越均匀(图 2-B)。
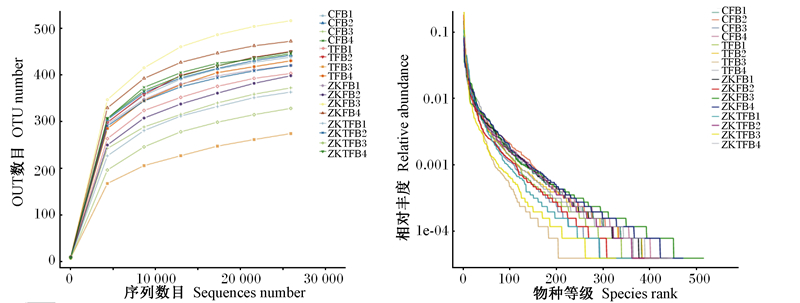
|
图 2 OTU稀释曲线图(A)和等级聚类曲线图(B) Fig. 2 OTU dilution curve (A) and hierarchical clustering curve (B) |
图 3展示的是所有样本不同组间的物种总数的散点分布,即丰富度。通过Wilcoxon秩和检验,测得的物种数在ZK-ZKT、C-ZKT、C-ZK 2组间P值分别为0.170 4、0.394 6、0.565 8, 差异不显著(P>0.05)(图 3-A)。Shannon指数组间差异蜜蜂群图反映的是不同样本间物种多样性和均一性的差别。Shannon指数在ZK-ZKT、C-ZKT、C-ZK 2组间P值分别为0.139 3、0.293 8、0.624 5,差异不显著(P>0.05)(图 3-B)。通过Alpha组间差异分析,可初步判断各组间样本微生物群落结构组成的相似性。
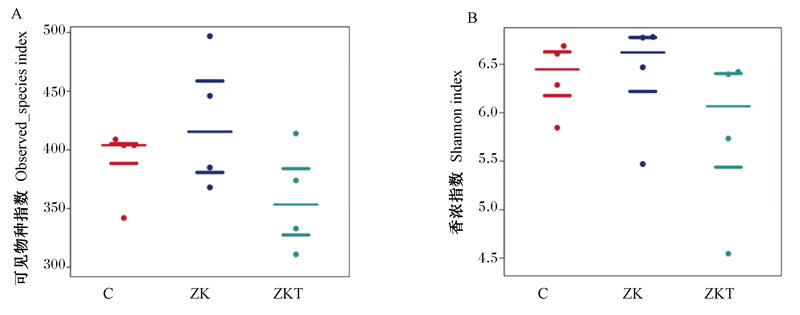
|
图 3 可见物种指数组间差异蜜蜂群图(A)和Shannon指数组间差异蜜蜂群图(B) Fig. 3 Beeswarm graph of differences between observed_species index groups (A) and differences between Shannon index groups (B) |
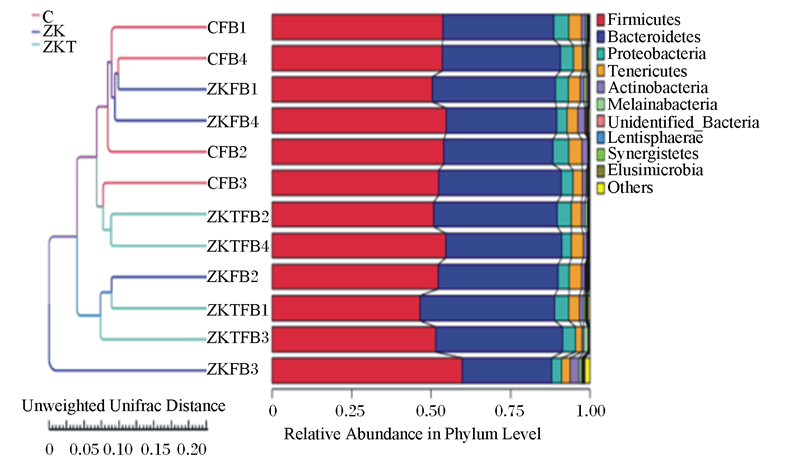
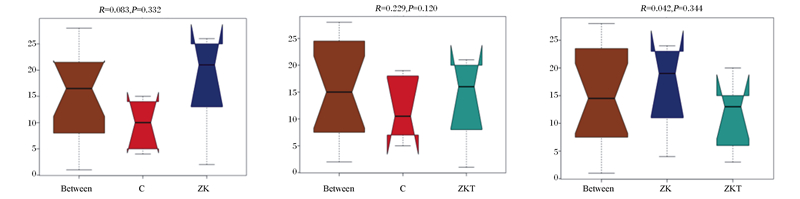
Beta多样性分析是用来比较样品在组间物种多样性方面存在的差异大小。样本距离越接近,表示物种组成结构越相似,因此群落结构相似度高的样本倾向于聚集在一起,群落差异很大的样本则会远远分开。基于Unweighted Unifrac距离主成分分析(PCoA),PC2贡献率为21.45%,PC1贡献率为24.75%。由图 4看出,C组聚类最好,ZKT组次之,ZK组较为分散,说明组间物种多样性差异较大。以Weighted Unifrac距离矩阵做非加权组平均法(UPGMA)分析,并将聚类结果与各样本在门水平上的物种相对丰度整合展示,C组聚类最好,ZKT组次之,ZK组较为分散(图 5)。这说明微生态制剂的添加影响了肠道菌群的多样性。Anosim分析表明本试验组间各组差异显著(R=0.083, R=0.229, R=0.042),说明分组有意义(图 6)。
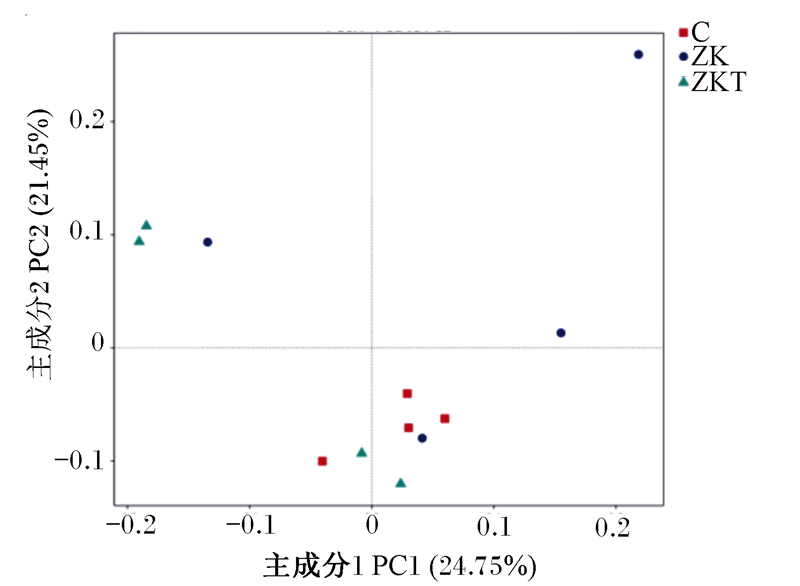
|
图 4 基于Unweighted Unifrac距离PCoA Fig. 4 PCoA based on Unweighted Unifrac |
|
Unweighted Unifrac Distance:非加权距离; Relative Abundance in Phylum Level:门水平相对丰度; Firmicutes:厚壁菌门; Bacteroidetes:拟杆菌门; Proteobacteria:变形菌门; Tenericutes:无壁菌门; Actinobacteria:放线菌门; Melainabacteria:黑水仙菌菌门; Unidentified_Bacteria:未定义细菌; Lentisphaerae Elusimicrobia:迷踪菌门; Others:其他。 图 5 基于Unweighted Unifrac的UPGMA聚类树 Fig. 5 UPGMA cluster tree based on Unweighted Unifrac |
|
Between:组间;R:R 值; P:P 值。Between: groups; R: R-value; P: P-value. R 值介于(-1, 1)之间,R 值大于0,说明组间差异显著。R 值小于0,说明组内差异大于组间差异,统计分析的可信度用P 值表示,P < 0.05表示统计具有显著性。R-value is between (-1, 1), and R-value is greater than 0, indicating significant differences between groups. R-value is less than 0, indicating that the difference within the group is greater than the difference between the groups. The reliability of statistical analysis is represented by P-value, and P < 0.05 means that the statistics are significant. 图 6 Anosim组间差异分析 Fig. 6 Difference analysis between Anosim groups |
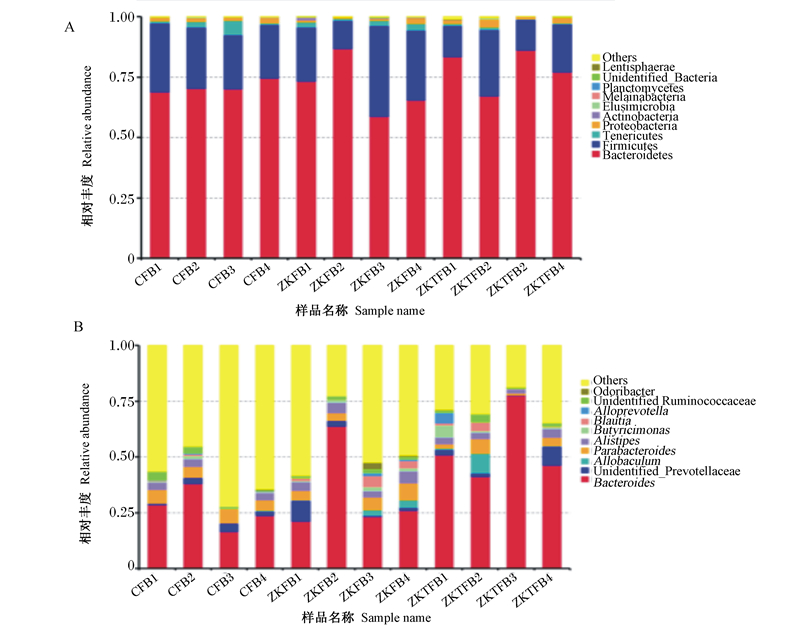
本研究共获得2个界,13个门,19个纲,32个目,52个科,110个属,75个种。在门水平上,优势菌门主要包括拟杆菌门、厚壁菌门、无壁菌门,排名前10位的菌门相对丰度各组之间差异不显著(P>0.05)(图 7-A);在属水平上,优势菌属主要包括拟杆菌属、未鉴定普雷沃氏菌科、别样棒菌属等,其中ZKT组拟杆菌属相对丰度显著高于C组和ZK组(P < 0.05),其他各菌属相对丰度差异不显著(P>0.05)(图 7-B)。
|
Bacteroidetes:拟杆菌门;Firmicutes:厚壁菌门;Tenericutes:无壁菌门;Proteobacteria:变形菌门;Actinobacteria:放线菌门;Elusimicrobia:迷踪菌门;Melainabacteria:黑水仙菌菌门;Planctomycetes:浮霉菌门;Lentisphaerae:黏胶球形菌门;Others:其他;Bacteroides:拟杆菌属;Unidentified_Prevotellaceae:未鉴定普雷沃氏菌科;Allobaculum:别样棒菌属;Parabacteroides:狄氏副拟杆菌属;Alistipes:另枝菌属;Butyricimonas:丁酸弧菌属;Blautia:布劳特氏菌属;Alloprevotella:拟普雷沃菌属;Unidentified Ruminococcaceae:未鉴定瘤胃菌科;Odoribacter:紫单胞菌科。 图 7 不同组的门水平(A)和属水平(B)微生物结构 Fig. 7 Microbial structure of phylum level (A) and genus level (B) in different groups |
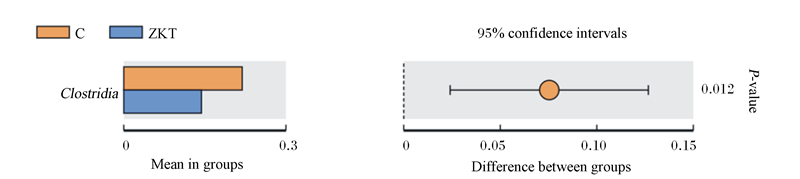
通过组间t-检验寻找各分类水平下组间差异物种,结果显示,C组梭状芽孢杆菌相对丰度为21.9%,ZKT组中的相对丰度为14.4%,差异显著(P=0.012)(图 8)。这说明ZKT组复合微生态制剂联合低聚果糖的添加显著降低了肠道内梭状芽孢杆菌相对丰度(P < 0.05)。
|
Clostridia:梭状芽孢杆菌;Mean in groups:组间均值;Difference between groups:组间差异;confidence intervals:置信区间;P-value:P值。左图为组间差异物种丰度展示,右图为组间差异置信度展示。The left figure shows the species abundance of differences between groups, and the right figure shows the confidence of differences between groups. 图 8 t-检验组间物种差异分析图 Fig. 8 t-test analysis chart of species differences between groups |
植物乳酸杆菌为兼性厌氧菌,可分解乳糖产生大量细菌素、乳酸、苯乳酸等物质,有效抑制沙门氏菌和金黄色葡萄球菌等致病菌,从而为犊牛健康生长提供有力保障[12]。枯草芽孢杆菌为需氧菌,可迅速消耗环境中游离氧,造成肠道低氧,促进有益厌氧菌如植物乳酸杆菌生长,并产生乳酸等有机酸类,进而降低肠道pH,间接抑制其他致病菌生长;它在代谢过程中可产生短杆菌肽、枯草菌素等活性物质,这些物质对致病菌也有明显抑制作用。低聚果糖能明显改善肠道内菌群结构,是肠道内乳酸菌活化增殖因子[13-14],可促进肠道乳酸菌增殖,是乳酸菌在肠道中定植的必要条件[15]。有试验研究低聚糖进入人体后,不被吸收而直达大肠,选择性地供给肠道中有益菌,如双歧杆菌和乳杆菌[16-17]。本研究将低聚果糖、植物乳杆菌和枯草芽孢杆菌组合与植物乳杆菌、枯草芽孢杆菌组合相比较,探讨添加低聚果糖与否在提高犊牛生长性能、降低腹泻率、改变肠道微生态区系的作用有无差别。试验结果表明,ZK组和ZKT组在提高生长性能上与C组差异不显著;这与之前的研究给断奶前后犊牛添加益生元可以一定程度上改善犊牛的生长性能但作用很小结果[18-19]相一致。而在降低腹泻率上ZK组和ZKT组与C组差异显著,ZKT组效果要好于ZK组。目前大量研究证明,给新生犊牛补充乳酸杆菌有助于降低腹泻率[20],枯草芽孢杆菌和低聚果糖的添加可促进植物乳酸菌的增殖,乳酸菌则可以防止致病菌对氨基酸的脱羧作用,从而减少肠内容物氨和毒性胺的合成,进而改善肠道环境。在植物乳酸杆菌、枯草芽孢杆菌和低聚果糖三者之间的共同作用下,犊牛的腹泻率显著降低,低聚果糖的贡献功不可没。
3.2 复合微生态制剂联合低聚果糖对犊牛瘤肠道微生态区系的影响肠道微生物是一个复杂的微生态系统,许多细菌在体内充当“特殊器官”,在物质代谢、免疫调节、生物屏障和宿主防御等方面发挥着重要作用。本研究中,犊牛后肠道中优势菌门主要包括拟杆菌门、厚壁菌门。Shanks等[21]采集健康肉牛粪便进行宏基因组测序,发现饲喂条件不同的牛肠道优势菌门都属于厚壁菌门和拟杆菌门;研究发现,动物胃肠道中优势菌门是拟杆菌门和厚壁菌门[22-23]。本研究结果与前人研究结果相一致,可见后肠系统的细菌数量与瘤胃相似,几种瘤胃菌群的优势菌群也出现在正常的反刍动物大肠菌群中。
在属水平上,占据主导地位的菌属为拟杆菌属、未鉴定普雷沃氏菌科、别样棒菌属等,其中ZKT组拟杆菌属相对丰度显著高于C组和ZK组。Moens等[24]研究表明,一些肠道内存在的其他微生物,如拟杆菌、大肠杆菌也可以利用低聚糖,而且肠道内不同菌群间还存在“交叉喂养”现象。本研究中,在属水平上,ZKT组拟杆菌属相对丰度显著高于C组和ZK组,说明低聚糖的添加促进了拟杆菌属的增殖,这一结果与Moens等[24]结论相吻合。
3.3 差异物种分析益生菌进入体内形成优势后与病原微生物之间存在着定植位点竞争、营养素竞争、生存和繁殖空间竞争、氧的竞争等,以抑制病原微生物增殖,维持动物消化道微生态平衡。本研究通过t-检验发现C组肠道内梭状芽孢杆菌相对丰度显著高于ZKT组,说明植物乳杆菌枯草、芽孢杆菌和低聚果糖的添加显著改善了肠道菌群结构,抑制了梭状芽孢杆菌的增殖,进而可起到预防犊牛腹泻的作用。
产气荚膜梭菌属于梭状芽孢杆菌属,是引起犊牛腹泻除大肠杆菌、沙门氏菌以外的主要病原菌。正常情况下与动物肠道菌群保持相对平衡,当饲养管理或外界环境突变,如断奶、气候突变、转群、惊吓等,产气荚膜梭菌会大量增殖,产生外毒素,从而引起致病。该病目前在各大牛场发病率有增高趋势。根据所分泌致死性毒素类型可将其分为A、B、C、D、E共5种血清型,菌株血清型不同引起机体产生临床症状不同[25]。其中,B型产气荚膜梭菌导致的牛产气荚膜梭菌病,主要症状为坏死性肠毒血症和坏死性肠炎等,对规模化牛场养殖危害较大,需给予足够重视。该病是引起犊牛卧地不起、精神不振、食欲废绝、腹部肿胀、抽搐,甚至死亡的一种急性病。病程较短,一般为1 d,致死率为100%[26]。
目前,抗生素疗法已经被广泛用于犊牛腹泻的治疗,然而抗生素的耐药性、抗生素进入环境以及动物产品中的化学残留物等安全性问题已经备受关注[27]。犊牛在出生后断奶前尽早摄入益生菌有利于优势菌群的建立,体现明显的占位效应,对消化道菌群的定植有积极的影响。微生态制剂用于犊牛可有效的预防腹泻,值得大力推广应用。
4 结论① 本研究通过给哺乳期犊牛添加植物乳酸杆菌和枯草芽孢杆菌以及植物乳酸杆菌、枯草芽孢胞杆菌和低聚果糖2种制剂发现, 该2种制剂对犊牛生长性能影响不显著,但可以显著减少腹泻的发生。
② ZK组制剂对犊牛肠道微生态区系影响不显著,但ZKT组制剂可显著改变犊牛肠道微生物区系,使其拟杆菌属相对丰度显著增加。
③ ZK组制剂可显著减少犊牛肠道梭状芽孢杆菌的相对丰度,减少犊牛腹泻的发生。
| [1] |
THOMSEN P T, DAHL-PEDERSEN K, JENSEN H E. Necropsy as a means to gain additional information about causes of dairy cow deaths[J]. Journal of Dairy Science, 2012, 95(10): 5798-5803. DOI:10.3168/jds.2012-5625 |
| [2] |
BÄCKHED F, LEY R E, SONNENBURG J L, et al. Host-bacterial mutualism in the human intestine[J]. Science, 2005, 307(5717): 1915-1920. DOI:10.1126/science.1104816 |
| [3] |
LEE Y E, KANG I J, YU E A, et al. Effect of feeding the combination with Lactobacillus plantarum and Bacillus subtilis on fecal microflora and diarrhea incidence of Korean native calves[J]. Korean Journal of Veterinary Service, 2012, 35(4): 343-346. DOI:10.7853/kjvs.2012.35.4.343 |
| [4] |
AN H M, LEE D K, CHA M K, et al. Effects of Lactic Acid Bacteria(LAB) supplement on the growth rate and elimination of enteropathgenic bacteria in calves[J]. Biotechnogy & Biotechno-Logical Equipment, 2011, 25(4): 2597-2603. |
| [5] |
KAWAKAMI S I, YAMADA T, NAKANISHI N, et al. Feeding of lactic acid bacteria and yeast affects fecal flora of Holstein calves[J]. Journal of Animal and Veterinary Advances, 2011, 10(3): 269-271. DOI:10.3923/javaa.2011.269.271 |
| [6] |
张家超, 郭壮, 孙志宏, 等. 益生菌对肠道菌群的影响——以Lactobacillus casei Zhang研究为例[J]. 中国食品学报, 2011, 11(9): 58-68. DOI:10.3969/j.issn.1009-7848.2011.09.007 |
| [7] |
王平, 夏川, 罗焕, 等. 低聚果糖对慢性应激小鼠抑郁样行为及肠道菌群的影响[J]. 中国微生态学杂志, 2018, 30(11): 1241-1246, 1251. |
| [8] |
赵思琪, 秦翠丽, 王辉, 等. 高通量测序研究三种非消化性寡糖及其组合对小鼠肠道菌群的影响[J]. 营养学报, 2019, 41(6): 576-579, 586. |
| [9] |
杨大亮, 罗丹, 王蓉. 微生态制剂联合低聚果糖治疗对抗生素诱发腹泻患儿肠道菌群的影响[J]. 西部医学, 2017, 29(10): 1389-1392, 1396. DOI:10.3969/j.issn.1672-3511.2017.10.013 |
| [10] |
张蓉.能量水平及来源对早期断奶犊牛消化代谢的影响研究[D].硕士学位论文.北京: 中国农业科学院, 2008.
|
| [11] |
LARSON L L, OWEN F G, ALBRIGHT J L, et al. Guidelines toward more uniformity in measuring and reporting calf experimental data[J]. Journal of Dairy Science, 1977, 60(6): 989-991. DOI:10.3168/jds.S0022-0302(77)83975-1 |
| [12] |
TIMMERMAN H M, MULDER L, EVERTS H, et al. Health and growth of veal calves fed milk replacers with or without probiotics[J]. Journal of Dairy Science, 2005, 88(6): 2154-2165. DOI:10.3168/jds.S0022-0302(05)72891-5 |
| [13] |
陈臣.植物乳杆菌ST-Ⅲ全基因组序列分析及其对低聚果糖代谢通路的解析[D].博士毕业论文.无锡: 江南大学, 2014.
|
| [14] |
陈臣, 周方方, 任婧, 等. 乳酸菌利用低聚果糖代谢机理的研究进展[J]. 食品与发酵工业, 2013, 39(10): 156-160. |
| [15] |
陈臣, 卢艳青, 于海燕, 等. 乳酸菌代谢低聚糖机理的研究进展[J]. 中国食品学报, 2019, 19(6): 274-283. |
| [16] |
SAULNIER D M A, MOLENAAR D, DE VOS W M, et al. Identification of prebiotic fructooligosaccharide metabolism in Lactobacillus plantarum WCFS1 through microarrays[J]. Applied and Environmental Microbiology, 2007, 73(6): 1753-1765. |
| [17] |
李玉, 路福平, 王正祥. 功能性低聚糖合成中糖基转移酶研究进展[J]. 食品科学, 2013, 34(9): 358-363. |
| [18] |
UYENO Y, SHIGEMORI S, SHIMOSATO T. Effect of probiotics on cattle health and productivity[J]. Microbes and Environments, 2015, 30(2): 126-132. DOI:10.1264/jsme2.ME14176 |
| [19] |
KIDO K, TEJIMA S, NAGAYAMA H, et al. Effects of supplementation with cellooligosaccharides on growth performance of weaned calves on pasture[J]. Animal Science Journal, 2016, 87(5): 661-665. DOI:10.1111/asj.12469 |
| [20] |
梁彦彦, 兰道亮, 林宝山, 等. 动物肠道乳酸菌的分离鉴定技术研究进展[J]. 动物医学进展, 2015, 36(10): 90-94. DOI:10.3969/j.issn.1007-5038.2015.10.020 |
| [21] |
SHANKS O C, KELTY A, ARCHIBEQUE S, et al. Community structures of fecal bacteria in cattle from different animal feeding operations[J]. Applied and Environmental Microbiology, 2011, 77(9): 2992-3001. |
| [22] |
QIN J J, LI R Q, RAES J, et al. A human gut microbial gene catalogue established by metagenomic sequencing[J]. Nature, 2010, 464(7285): 59-65. DOI:10.1038/nature08821 |
| [23] |
SINGH K M, AHIR V B, TRIPATHI A K, et al. Metagenomic analysis of Surti buffalo (Bubalus bubalis) rumen:a preliminary study[J]. Molecular Biology Reports, 2012, 39(4): 4841-4848. DOI:10.1007/s11033-011-1278-0 |
| [24] |
MOENS F, VERCE M, DE VUYST L. Lactate-and acetate-based cross-feeding interactions between selected strains of lactobacilli, bifidobacteria and colon bacteria in the presence of inulin-type fructans[J]. International Journal of Food Microbiology, 2017, 241: 225-236. DOI:10.1016/j.ijfoodmicro.2016.10.019 |
| [25] |
韩广伟, 李兆才, 宫晓炜, 等. 产气荚膜梭菌α毒素和ε毒素的共表达及其免疫原性的研究[J]. 中国兽医科学, 2014, 44(6): 630-635. |
| [26] |
尹辉, 赵达, 陈为宏, 等. 牛产气荚膜梭菌α-ε毒素基因的融合表达及其纯化[J]. 中国生物制品学杂志, 2015, 28(3): 261-265. |
| [27] |
MARTINEZ-VAZ B M, FINK R C, DIEZ-GONZALEZ F, et al. Enteric pathogen-plant interactions:molecular connections leading to colonization and growth and implications for food safety[J]. Microbes and Environments, 2014, 29(2): 123-135. |




