羔羊瘤胃的发育直接影响成年绵羊的采食和消化吸收能力,良好的瘤胃发育可以提高绵羊饲料利用率,进而提高生长性能。羔羊出生后尽早采食颗粒饲料,刺激胃肠道尤其是瘤胃的发育,能够促进瘤胃微生物区系的建立,完善消化吸收功能[1]。前人研究发现,反刍动物瘤胃微生物主要包括厌氧性的细菌、真菌、古菌和原虫四大类,这些微生物依靠饲粮中所提供的可消化糖和淀粉作为能量,并吸收饲粮中的蛋白质前体物、限制性氨基酸以及必需微量元素和维生素进行生长和繁殖,同时分解饲粮中的纤维素、非蛋白含氮物生成挥发性脂肪酸(VFA)、各种气体以及细菌的菌体蛋白质[2],供机体利用。羔羊瘤胃内最早出现的微生物为细菌,出生1 d后,瘤胃中即可发现兼性厌氧细菌存在,出生2 d后瘤胃中便可检测到严格厌氧菌,出生10 d左右即可达到与成年动物相似的纤维分解菌水平,纤维分解菌的定植可为反刍动物利用纤维物质提供基本条件[3-4]。羔羊提早进行固体颗粒饲粮的采食,可以促进瘤胃生长发育,但由于断奶及含植物蛋白质饲粮等应激对瘤胃的生长发育又有一定阻碍作用[5-6]。因此,适宜的断奶时间既有利于瘤胃生长发育和微生物区系的建立,又可以降低饲料来源不同对营养物质摄入的影响,提高绵羊的生长性能。反刍动物摄入固体饲粮可以增加发酵底物的供应量,提高瘤胃微生物降解速度,增加瘤胃内VFA含量[7]。断奶前后,反刍动物瘤胃内生理生化反应加速,瘤胃形态生理发生一系列变化,如瘤胃乳头的发育以及微生物的定植,进而在断奶后形成较为完整的瘤胃形态与功能。初生羔羊复胃中皱胃比重最大,约占总重的56%;随着采食固体饲粮量的增加,瘤胃开始迅速发育,在7~21日龄时瘤胃相对质量增长速度最快,占复胃总重由20%增长到43%,容积由15%增加到46%[8], 56日龄时占复胃总重的比例高达60%,占复胃容积为78%,已接近成年羊瘤胃的相对质量及容积[9]。有研究表明,瘤胃微生物区系的建立早于瘤胃组织结构及代谢的发育。反刍动物断奶期间引入固体饲粮能够提高瘤胃发酵能力,有利于瘤胃以及肠道微生物菌群向成熟的瘤胃状态转变。
早期瘤胃微生物区系的建立是羔羊瘤胃结构和功能发育的重要影响因素;饲粮对羔羊瘤胃的影响尤为重要。断奶前后,羔羊饲粮由母乳转变为固体饲粮,发酵底物的增多有利于微生物增殖,进而加快饲粮在瘤胃中的发酵速度,同时大量的外源微生物也会植入到瘤胃中,使瘤胃内的微生物区系的结构和功能日渐丰富[10-11]。本研究通过测定分析不同断奶时间羔羊瘤胃微生物(细菌)群落结构及功能的多样性,从微生物角度分析不同断奶时间对羔羊瘤胃发育的影响,为青海省海东地区主要绵羊品种(小尾寒羊)羔羊提供适宜的断奶时间,为提高羔羊生长发育、降低饲养成本提供数据支持和理论依据。
1 材料与方法 1.1 试验设计选择体重[(3.17±4.52) kg]、体况、胎次相近的青海省海东地区小尾寒羊双胎羔羊90只,采用单因素试验设计,随机分为3组,每组30只;分别于30、40、50日龄断奶,断奶后采用能量和蛋白质水平相同的饲粮饲养至90日龄,饲粮组成及营养水平见表 1。
|
|
表 1 饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the diet (DM basis) |
所有试验动物从出生后7日龄开始饲喂开食料,饲粮营养水平同上(精饲料)。断奶羔羊每天每只初始饲喂量见表 2,所有羔羊每日饲喂量相同,每5 d按比例增加饲喂量(精饲料:青贮玉米:燕麦干草=7 : 2 : 1,干物质计算),其中精料每次每只羔羊增加15.13 g。每天饲喂2次(08:00和17:00),自由饮水。羔羊进圈舍之前对圈舍进行彻底消毒,此后,每天对羔羊圈舍进行清扫处理。对各组试验羔羊进行常规的免疫注射及内外寄生虫防治。
|
|
表 2 羔羊饲粮饲喂量(干物质基础) Table 2 Feeding level of lamb diet (DM basis) |
羔羊初生、90日龄时称重,并计算平均日采食量(ADFI)。
90日龄饲养试验结束后,每组随机选择6只羔羊颈静脉放血屠宰后,采集瘤胃内容物于50 mL离心管中,3 500 r/min离心15 min,取上层液体混匀后通过4层纱布过滤,将滤液分为2份,一份装于5 mL冻存管中,用液氮带回实验室置于-80 ℃冰箱冷冻保存,用于后期瘤胃细菌多样性的测定; 另一份取5 mL装在加有2 mL 25%偏磷酸的10 mL螺口离心管中,-20 ℃保存,用于测定瘤胃液VFA含量。
1.4 瘤胃液VFA含量测定参照Liang等[12]的方法,利用气相色谱仪(Thermo Scientific,美国)测定瘤胃液VFA含量。测定条件:色谱分析柱为DB-FFAP毛细管色谱柱(30 m×0.32 mm×0.25 μm,美国),进样口和检测器温度均为240 ℃,温度设置为以25 ℃/min的速率将温度从50 ℃升高到190 ℃保留2 min,再以10 ℃/min的升温速率升高到200 ℃保留5 min,最后以10 ℃ /min的升温速率升高到220 ℃保留5 min,进样量为1 μL,空气流率为350 mL/min,氢气流率为35 mL/min,载气(氮气)流率为20 mL/min,分流比为50 : 1。
1.5 瘤胃微生物(细菌)多样性测定16S rDNA基因的测序由百迈克生物公司完成。每组选择6只试验动物,通过Illumina HiSeq 2500平台进行微生物多样性检测,分析瘤胃微生物(细菌)多样性、属水平丰度及瘤胃细菌主要功能分析。以提取的DNA为模板,利用位于V3~V4高变区两侧的引物进行了PCR扩增,通用引物序列为338F:5’-ACTCCTACGGGAGGCAGCA-3’和806R:5’-GGACTACHVGGGTWTCTAAT-3’。PCR扩增程序为:98 ℃持续2 min后进行30个循环,依次为98 ℃ 30 s、50 ℃ 30 s、72 ℃ 1 min,最后在72 ℃下延长7 min。
1.6 数据分析通过Excel 2013对数据进行初步整理,应用SAS 9.0软件进行单因素方差分析(one-way ANOVA),P < 0.05为差异显著。
2 结果 2.1 断奶时间对羔羊体重的影响由表 3可知,羔羊断奶重各组间差异不显著(P>0.05)。40日龄断奶组90日龄体重显著高于其他2组(P < 0.05),30日龄断奶组显著高于50日龄断奶组(P < 0.05)。40日龄断奶组平均日增重显著高于其他2组(P < 0.05),30日龄断奶组和50日龄断奶组之间差异不显著(P>0.05)。
|
|
表 3 断奶时间对羔羊体重的影响 Table 3 Effects of weaning time on weight of lambs |
由表 4可知,40日龄断奶组总挥发性脂肪酸(TVFA)、乙酸含量及乙酸/丙酸显著高于其他2组(P<0.05),丙酸含量显著低于其他2组(P<0.05),丁酸和异丁酸含量随着断奶时间的延长逐渐降低(P<0.05)。
|
|
表 4 断奶时间对羔羊90日龄瘤胃液 VFA 组成的影响 Table 4 Effects of weaning time on VFA composition of rumen fluid of lambs at 90 days of age |
基于97%的物种相似性,共从15个样本中获得959 387条Clean tags被分配到915个操作分类单元(OTUs),其中有783个为3组共有OTUs(图 1)。覆盖率大于0.99表明本试验测序深度能够准确反映羔羊瘤胃微生物组成;α多样性显示,40日龄断奶组羔羊瘤胃细菌OTUs数高于其他2组,表明羔羊40日龄断奶瘤胃微生物(细菌)的丰富性和多样性优于其他断奶时间。
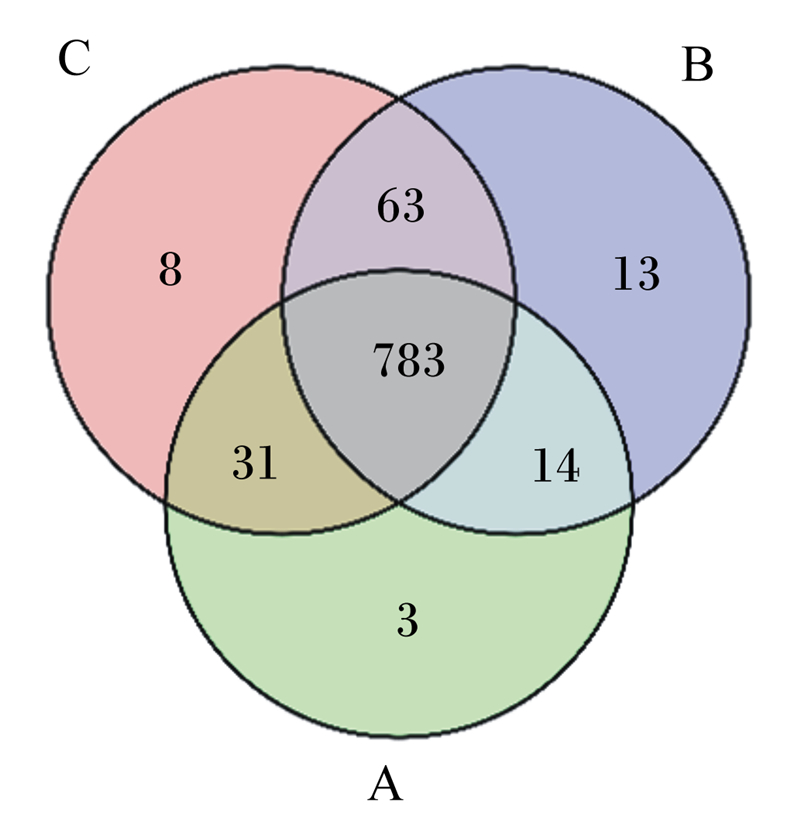
|
A:30日龄断奶组30 days of age weaning group;B:40日龄断奶组40 days of age weaning group; C:50日龄断奶组50 days of age weaning group。下图同the same as below。 图 1 不同断奶时间羔羊瘤胃液细菌Venn图 Fig. 1 Venn graph of rumen fluid bacteria of lambs at different weaning time |
基于UniFrac加权主坐标分析表明,3个断奶时间组聚类于不同的坐标位置,说明不同断奶时间对于瘤胃微生物(细菌)的菌落的发育有一定影响,其中30日龄断奶组和40日龄断奶组距离相隔较近,50日龄断奶组与另外2组相隔较远,表明羔羊断奶时间越晚,瘤胃微生物(细菌)的菌落多样性差异越大。

|
图 2 UniFrac加权主坐标分析图 Fig. 2 UniFrac weighted principal coordinate analysis graph |
试验共鉴定出瘤胃细菌13门和153属。图 3显示了属水平相对丰度前10位的细菌。其中克里斯滕森氏菌科R-7群(Christensenellaceae R-7 group)、瘤胃菌科NK4A214群(Ruminococcaceae_NK4A214_group)、普雷沃氏菌属1 (Prevotella 1)、理研菌科RC9 gut群(Rikenellaceae RC9 gut group)、丁酸弧菌属2(Butyrivibrio 2)、瘤胃球菌属2(Ruminococcus 2)、毛螺菌科NK3A20群(Lachnospiraceae_NK3A20_group)、毛螺菌科XPB1014群(Lachnospiraceae_XPB1014_group)、奎因氏菌属(Quinella)的相对丰度均大于1%, Christensenellaceae R-7 group、Ruminococcaceae_NK4A214_group和Prevotella 1为本试验优势菌属;40日龄断奶组羔羊瘤胃细菌多样性高于其他2组;属水平相对丰度前10位菌群中,40日龄断奶组Butyrivibrio 2、Ruminococcaceae_NK4A214_group、Ruminococcus 2和Lachnospiraceae_NK3A20_group、Lachnospiraceae_XPB1014_group相对丰度显著高于其他2组(P < 0.05),40日龄断奶组Prevotella 1和Rikenellaceae RC9 gut group相对丰度显著低于其他2组(P < 0.05), 物种丰度显著性分析结果见表 5。
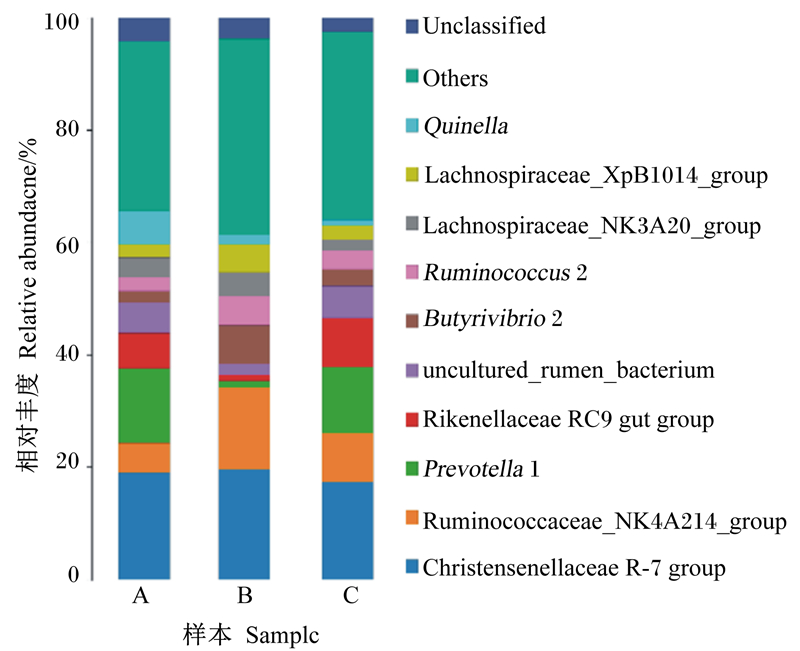
|
Unclassified:未被分类;Others:其他;Quinella:奎因氏菌属;Lachnospiraceae_XpB1014_group:毛螺菌科XPB1014群;Lachnospiraceae_NK3A20_group:毛螺菌科NK3A20群;Ruminococcus 2:瘤胃球菌属2;Butyrivibrio 2:丁酸弧菌属2;uncultured_rumen_bacterium:未培养瘤胃细菌;Rikenellaceae RC9 gut group:理研菌科RC9 gut群;Prevotella 1:普雷沃氏菌属1;Ruminococcaceae_NK4A214_group:瘤胃菌科NK4A214群;Christensenellaceae R-7 group:克里斯滕森氏菌科R-7群。 图 3 属水平物种分布柱状图 Fig. 3 Histogram of species distribution at genus level |
|
|
表 5 属水平细菌相对丰度 Table 5 Bacterial relative abundance at genus level |
蛋白质相邻类(COG)功能注释分类图(图 4)表明,在不同断奶时间羔羊瘤胃生长发育和微生物定植方面细菌功能主要集中在氨基酸代谢(复制、重组和修复)、核糖体结构与生物发生(翻译)、细胞壁/膜/包膜生物发生、信号转导(转录)、能量产生和转换。其中,碳水化合物和氨基酸运输与代谢比例最高。
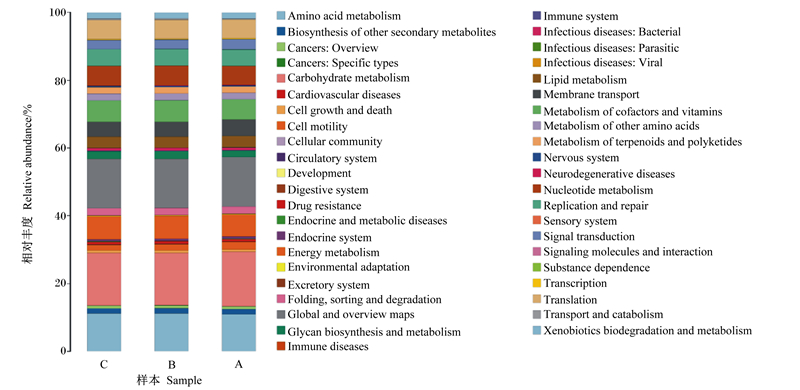
|
Amino acid metabolism:氨基酸代谢;Biosynthesis of other secondary metabolites:其他次生代谢产物的生物合成;Cancers: Overview:癌症:概述;Cancers: Specific types:癌症:特定类型;Carbohydrate metabolism:碳水化合物代谢;Cardiovascular diseases:心血管疾病;Cell growth and death:细胞生长与死亡;Cell motility:细胞运动;Cellular community:细胞群落;Circulatory system:循环系统;Development:发展;Digestive system:消化系统;Drug resistance:耐药性;Endocrine and metabolic diseases:内分泌代谢疾病;Endocrine system:内分泌系统;Energy metabolism:能量代谢;Environmental adaptation:环境适应;Excretory system:排泄系统;Folding, sorting and degradation:折叠、分类和降解;Global and overview maps:全球和概览地图;Glycan biosynthesis and metabolism:聚糖生物合成与代谢;Immune diseases:免疫性疾病;Immune system:免疫系统;Infectious diseases: Bacterial:传染病:细菌性;Infectious diseases: Parasitic:传染病:寄生虫病;Infectious diseases: Viral:传染病:病毒性;Lipid metabolism:脂质代谢;Membrane transport:膜传输;Metabolism of cofactors and vitamins:辅酶和维生素的代谢;Metabolism of other amino acids:其他氨基酸代谢;Metabolism of terpenoids and polyketides:萜类化合物和聚酮类化合物的代谢; Nervous system:神经系统; Neurodegenerative diseases;神经变性疾病; Nucleotide metabolism:核苷酸代谢; Replication and repair:复制和修复; Sensory system:感觉系统; Signal transduction:信号转导; Signaling molecules and interaction:信号分子与相互作用; Substance dependence:物质依赖性; Transcription:转录; Translation:翻译; Transport and catabolism:运输和分解代谢; Xenobiotics biodegradation and metabolism:外源生物降解与代谢。 图 4 COG功能注释分布图 Fig. 4 Distribution graph of COG function annotation |
羔羊早期断奶技术是现代化养羊业中采用的重要技术手段。初生羔羊瘤胃发育尚未完善,瘤胃内处于无菌且无胚芽状态,随着母乳的采食,瘤胃内微生物开始定植,但微生物区系不健全,消化功能也相对较弱[13]。随着羔羊日龄增长,消化器官会发育趋于完善,40日龄以后,随着羔羊食管沟的闭合,瘤胃等消化器官逐步发育成熟,羔羊能够完全靠采食固体饲粮满足自身对营养物质的需求。进入断奶后育肥阶段,消化系统的良好发育对羔羊机体的健康快速生长起着至关重要的作用[14]。本研究在羔羊30、40、50日龄断奶,羔羊40日龄断奶组平均日增重显著高于50日龄断奶组,说明长期采食母乳不能满足羔羊进一步的生长发育;而过早断奶羔羊瘤胃发育不完全,对固体饲粮适应性差造成30日龄断奶组羔羊平均日增重显著低于40日龄断奶组。
羔羊瘤胃的发育情况与瘤胃发酵有直接关系,瘤胃内营养物质可以通过厌氧发酵生成VFA(包括乙酸、丙酸、丁酸、戊酸等)和微生物菌体蛋白,为反刍动物正常的生命活动供应能量和蛋白质[15]。40日龄断奶组羔羊瘤胃TVFA、乙酸含量和乙酸/丙酸显著高于其他2组,丙酸含量显著低于其他2组,丁酸和异丁酸含量随着断奶时间的延长逐渐降低。羔羊瘤胃液VFA由瘤胃上皮发酵代谢产生,是厌氧消化过程的重要中间产物,能够为瘤胃上皮乳头发育和吸收功能的完善提供必要的化学刺激,其中,丁酸对瘤胃发育的促进作用最为显著。在瘤胃中纤维分解菌能降解纤维素产生乙酸,淀粉分解菌能促进丙酸的生成和累积,厚壁菌能够高效地水解淀粉和蛋白质[16]。本研究对瘤胃菌群的分析,发现40日龄断奶组瘤胃微生物(细菌)种类和丰度也高于30、50日龄断奶羔羊。断奶后羔羊采食植物性饲料可以刺激瘤胃生长发育,促进瘤胃微生物的定植,增强瘤胃微生物对植物性饲料的消化能力,进而提高绵羊对饲料的转化率和利用率。因此在青海寒冷的冬季40日龄断奶羔羊的瘤胃发育较30日龄时趋于完善,50日龄断奶羔羊接触固体饲粮相对较晚,瘤胃发育的较为迟缓。曹少奇[17]对哈萨克羔羊早期断奶研究表明,在38日龄时断奶,应激较小,断奶效果较好,与本研究结果接近。
大多数瘤胃细菌如蛋白质分解菌、纤维素分解菌和其他种类细菌在4~10日龄羔羊的瘤胃微生物区系中即定植[18],幼龄反刍动物瘤胃的发育好坏将直接影响到成年后的消化吸收能力及生长发育性能。柴建民[19]通过对出生后10、20、30日龄断奶处理与60日龄断奶处理的羔羊相比较发现,早期断奶羔羊瘤胃内微生物的Shannon指数和Simpson指数与对照组差异显著,表明早期断奶有利于羔羊瘤胃内微生物区系的定植,促进羔羊瘤胃的生长发育和对营养物质的消化吸收能力。有研究发现,对早期断奶羔羊进行代乳料的饲喂,发现瘤胃重量增加的同时增加了瘤胃乳头密度和乳头长度,但超早期断奶会影响小肠绒毛的发育,降低消化吸收能力[17]。本研究中Christensenellaceae R-7 group、Ruminococcaceae_NK4A214_group和Prevotella 1为优势菌属。Prevotella 1能高效水解淀粉和蛋白质[20];有研究者利用纯培养的方法分离出Prevotella,其能够占到瘤胃细菌的60%,是拥有高活性的半纤维分解菌[21-22];Prevotella属于拟杆菌门,拟杆菌门是瘤胃微生物组成中非纤维性碳水化合物(NFC)的主要降解菌,能够根据饲粮组成变化调整自身对环境的适应性,从而更好地利用饲粮中的营养物质[23-24]。厚壁菌门包含大量分解纤维的菌属如Ruminococcus、Butyrivibrio以及Christensenellaceae,可以分解植物性饲料中的纤维素供机体利用。研究表明,拟杆菌门和厚壁菌门常共生于瘤胃细菌区系中,具有促进植物类纤维类多糖的发酵,碳水化合物、脂肪、蛋白质和氨基酸等营养物质的调控吸收,瘤胃微生物平衡,营养物质的吸收利用以及宿主自身的健康的作用[25]。羔羊断奶后随着饲粮的摄入及外界环境中的微生物进入瘤胃,也为瘤胃发酵提供了更多的发酵条件,促使瘤胃微生物的数量逐渐上升。
瘤胃内微生物的组成变化影响瘤胃的发育,纤维分解菌降解纤维素产生乙酸,淀粉分解菌能促进丙酸的生成和累积,厚壁菌能够高效地水解淀粉和蛋白质,菌群间相互协调。本研究结果表明,Butyrivibrio 2、Ruminococcaceae_NK4A214_group、Ruminococcus 2和Lachnospiraceae_NK3A20_group、Lachnospiraceae_XPB1014_group相对丰度在40日龄断奶组高于其他2组,Butyrivibrio 2能调节半纤维素降解酶的分泌,它是瘤胃中重要的多糖降解菌,也是重要的丁酸盐产生者,可以促进胃上皮细胞增殖;Ruminococcaceae可以产生短链脂肪酸,对宿主健康有多重作用,且与反刍动物纤维素等多糖的消化代谢息息相关[26];瘤胃球菌可产生碳水化合物活性酶,降解饲粮中的碳水化合物;Lachnospiraceae可发酵碳水化合物为短链脂肪酸,大多数Ruminococcus是抗性多糖(淀粉和纤维素)的降解菌,可构成一系列降解酶系统,使宿主消化植物细胞壁[27]。羔羊瘤胃中的微生物可利用饲粮生产VFA、氨态氮及微生物蛋白质等,还可以和宿主产生互作,影响宿主的健康及生长性能。瘤胃微生物区系的建立是幼龄反刍动物瘤胃结构和功能发育的核心要素,反刍动物瘤胃微生物区系是在进食固体饲粮之前就建立起来的,而固体饲粮的采食反过来又强化了瘤胃微生物区系。40日龄断奶羔羊瘤胃微生物发育优于30日龄断奶组,并及时接触固体饲粮加强了瘤胃微生物区系的建立,有利于羔羊对饲粮营养物质的吸收。
羔羊早期断奶可以缩短母羊繁殖周期,提高母羊利用率。青海省海东地区绵羊的饲养管理模式仍以传统方式为主,羔羊的断奶时间一般为2~3月龄,不利于现代化、集约化饲养模式的建立。前期研究发现,青海省海东地区小尾寒羊母羊泌乳高峰期出现在产后第30~35天,因此,本研究通过研究不同时间断奶羔羊生长发育、瘤胃发酵参数及瘤胃微生物(细菌)群落和功能,40日龄断奶有利于青海省海东地区小尾寒羊羔羊的生长发育,在实际生产中可以作为理想断奶时间进行应用。
4 结论① 羔羊在40日龄断奶,平均日增重及瘤胃VFA含量显著高于其他2组。
② 羔羊瘤胃内细菌在属水平上,Christensenellaceae、Ruminococcaceae_NK4A214_group和Prevotella 1为优势菌属;40日龄断奶组羔羊瘤胃细菌多样性高于其他2组,以纤维消化为特征的细菌为主。
③ COG功能注释发现,羔羊瘤胃细菌功能主要集中在碳水化合物和氨基酸的转运及代谢。
| [1] |
任春燕.不同NDF水平的开食料对犊牛生长、屠宰性能、抗氧化、免疫及胃肠道发育的影响[D].博士学位论文.兰州: 甘肃农业大学, 2018.
|
| [2] |
解彪.不同NDF水平饲粮对羔羊生长性能和瘤胃发育的影响[D].硕士学位论文.晋中: 山西农业大学, 2018.
|
| [3] |
符运勤.地衣芽孢杆菌及其复合菌对后备牛生长性能和瘤胃内环境的影响[D].硕士学位论文.北京: 中国农业科学院, 2012.
|
| [4] |
郭峰.断母乳日龄及营养水平对肉犊牛生长性能与瘤胃发酵的影响[D].硕士学位论文.乌鲁木齐: 新疆农业大学, 2015
|
| [5] |
陈昊, 刘婷, 吴建平, 等. 牛至精油对新生犊牛生长发育和血液免疫的影响[J]. 草业科学, 2017, 34(10): 2141-2148. |
| [6] |
罗惦, 柴林荣, 常生华, 等. 我国青藏高原地区牦牛草地放牧系统管理及优化[J]. 草业科学, 2017, 34(4): 881-891. |
| [7] |
肖怡.三种益生菌对肉羊甲烷排放、物质代谢和瘤胃发酵的影响[D].硕士学位论文.阿拉尔: 塔里木大学, 2016.
|
| [8] |
郭江鹏, 张元兴, 李发弟, 等. 0~56日龄舍饲肉用羔羊胃肠道发育特点研究[J]. 畜牧兽医学报, 2011, 42(4): 513-520. |
| [9] |
祁敏丽, 刁其玉, 张乃锋. 羔羊瘤胃发育及其影响因素研究进展[J]. 中国畜牧杂志, 2015, 51(9): 77-81. |
| [10] |
王剑.干草添加时期对哺乳期犊牛生长性能和瘤胃发育的影响[D].硕士学位论文.泰安: 山东农业大学, 2015.
|
| [11] |
马万浩, 张宁, 李飞, 等. 断奶日龄对湖羊羔羊瘤胃内微生物多样性的影响[J]. 动物营养学报, 2018, 30(8): 3055-3062. |
| [12] |
LIANG Y S, LI G Z, LI X Y, et al. Growth performance, rumen fermentation, bacteria composition, and gene expressions involved in intracellular pH regulation of rumen epithelium in finishing Hu lambs differing in residual feed intake phenotype[J]. Journal of Animal Science, 2017, 95(4): 1727-1738. |
| [13] |
朱文涛.15~150日龄羔羊日粮消化率和瘤胃消化功能变化的研究[D].博士学位论文.乌鲁木齐: 新疆农业大学, 2005.
|
| [14] |
王志有, 侯生珍, 赵小龙. 早期断奶日龄对藏羔羊生长发育的影响[J]. 黑龙江畜牧兽医, 2015(22): 66-68. |
| [15] |
RUSSELL J B, RYCHLIK J L. Factors that alter rumen microbial ecology[J]. Science, 2001, 292(5519): 1119-1122. |
| [16] |
靳文尧.瘤胃微生物厌氧消化农业固体有机废物技术与应用研究[D].博士学位论文.大连: 大连理工大学, 2018.
|
| [17] |
曹少奇.早期断奶对哈萨克羔羊生长性能及胃肠道发育的影响[D].硕士学位论文.石河子: 石河子大学, 2016.
|
| [18] |
LI M J, ZHOU M, ADAMOWICZ E, et al. Characterization of bovine ruminal epithelial bacterial communities using 16S rRNA sequencing, PCR-DGGE, and qRT-PCR analysis[J]. Veterinary Microbiology, 2012, 155(1): 72-80. |
| [19] |
柴建民.断母乳日龄对羔羊生长性能与胃肠道发育的影响[D].硕士学位论文.北京: 中国农业科学院, 2015.
|
| [20] |
KAMRA D N. Rumen microbial ecosystem[J]. Current Science, 2005, 89(1): 124-135. |
| [21] |
WOOD J, SCOTT K P, AVGUSTIN G, et al. Estimation of the relative abundance of different Bacteroides and Prevotella ribotypes in gut samples by restriction enzyme profiling of PCR-amplified 16S rRNA gene sequences[J]. Applied and Environmental Microbiology, 1998, 64(10): 3683-3689. |
| [22] |
MATSUI H, OGATA K, TAJIMA K, et al. Phenotypic characterization of polysaccharidases produced by four Prevotella type strains[J]. Current Microbiology, 2000, 41(1): 45-49. |
| [23] |
HOOPER L V, WONG M H, THELIN A, et al. Molecular analysis of commensal host-microbial relationships in the intestine[J]. Science, 2001, 291(5505): 881-884. |
| [24] |
BÄCKHED F, LEY R, SONNENBURG J, et al. The human intestinal microbiota and its relationship to energy balance[J]. Food & Nutrition, 2006, 50(Suppl.2): 121-123. |
| [25] |
BACKHED F, DING H, WANG T, et al. The gut microbiota as an environmental factor that regulates fat storage[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(44): 15718-15723. |
| [26] |
高凤.奶牛肠道微生物群落结构与多样性研究[D].硕士学位论文.邯郸: 河北工程大学, 2017.
|
| [27] |
张莉.日粮纤维对仔猪肠道屏障功能的影响及调控机制的研究[D].博士学位论文.北京: 中国农业科学院, 2018.
|




