饲粮中碳水化合物是反刍动物的主要能量来源,大部分在瘤胃内被微生物代谢利用产生有机酸而氧化提供ATP,小部分在瘤胃后消化道分解代谢提供能量,在维持动物生长发育、机体代谢和生产性能等方面发挥重要作用。动物体内的75%~85%的能量来源于饲粮中的碳水化合物,饲粮中碳水化合物结构是否合理对动物生长和健康有很大影响,譬如反刍动物生产中出现的瘤胃健康问题和能量负平衡问题均与碳水化合物代谢有关。我国传统的反刍动物以“低投入-低产出节粮型”生产模式为主,而西方发达国家以“高投入-高产出”的生产模式为主。近年来,随着我国畜牧业逐步向“集约、高效”发展,奶牛、肉牛和肉羊生产盲目追求高产,为了提高生产效率大量饲喂以谷物淀粉为主的全混合日粮(TMR)和颗粒饲料,从而改变了原有的饲粮中碳水化合物结构的平衡,导致以亚急性瘤胃酸中毒(SARA)为主的代谢性疾病的发病率提高,也导致动物消化道和机体健康受损。这种饲养模式不仅消耗掉大量谷物粮食,而且对动物本身的消化道健康和环境带来负面影响,已成为我国反刍动物生产中的突出问题之一。本文结合本团队及国内外研究进展,围绕反刍动物饲粮中碳水化合物结构与能量高效利用和消化道健康的关系,采用系统整体营养调控措施提高饲料利用效率和改善健康方面进行综述,为反刍动物营养调控决策提供参考。
1 反刍动物饲粮结构与能量供给的特点反刍动物由于在长期的进化中形成独特的消化系统,其前胃(包括瘤胃和网胃)栖居有大量的微生物,能够消化和利用大量的富含纤维素和半纤维素的植物来源的碳水化合物。反刍动物的消化生理是以微生物消化为主要特点,其体内能量的前体物是由瘤胃微生物发酵所产生的挥发性脂肪酸(FVA)为主,而单胃动物(猪和家禽体)能量的前体物是以葡萄糖为主。碳水化合物中纤维性碳水化合物(FC)的作用是维持瘤胃健康和为机体提供能量;而非纤维性碳水化合物(NFC)的作用是为瘤胃微生物提供能量和为机体提供能量,其次是提供葡萄糖。碳水化合物转化为乙酸、丙酸和丁酸能量利用效率分别为62%、109%和78%,可见瘤胃丙酸发酵是机体和微生物能量利用效率最高的发酵方式[1-2]。符合反刍动物消化生理特点的饲粮结构要以纤维性碳水化合物为主,非纤维性碳水化合物为辅,这样才能保证反刍动物的消化道健康。饲粮中纤维物质在反刍动物营养生理中发挥重要作用,同时对维持正常瘤胃功能和保持动物消化道健康有着不可替代的作用。正是反刍动物能够大量利用粗饲料的特点,反刍动物可以将人类不能直接利用的低质粗饲料转化为畜产品而为人类服务,这也是世界各国大力发展反刍动物,作为节粮型畜牧业发展的优势所在。在反刍动物生产中也需要根据其基本的消化生理特点合理配制饲粮,才能保证反刍动物生产的健康发展。
2 饲粮中碳水化合物结构对能量利用效率和消化道健康的影响 2.1 饲粮中瘤胃可降解淀粉(RDS)评价根据饲粮的碳水化合物在反刍动物体内转化为能量的速度,可将其分为快速能量物质和慢速能量物质。非纤维性碳水化合物属于快速能量物质。其中,RDS是决定反刍动物消化道健康与养分利用的关键饲粮因子[3]。正常情况下,瘤胃内碳水化合物代谢的主要产物为乙酸(55%~70%)、丙酸(16%~25%)、丁酸(8%~10%)和少量支链脂肪酸,其比例随饲粮精粗比而变化。正常情况下,瘤胃内有机酸的产生和利用保持平衡,中和酸度主要通过唾液分泌、瘤胃上皮吸收有机酸、瘤胃液外流稀释和代谢途径来完成。如果动物采食大量富含谷物淀粉的快速能量物质则会引起SARA。瘤胃对酸度变化的缓冲能力受内源因素和饲粮因素的影响,内源缓冲能力主要由动物的唾液分泌量决定;饲粮缓冲能力主要由饲粮中的中性洗涤纤维(NDF)水平和饲粮阴阳离子差决定。国内外学者在饲粮精粗料比例对瘤胃微生物代谢的影响以及SARA的发生方面进行了大量研究。近年来,在反刍动物饲粮结构,特别是碳水化合物类型对SARA发生的影响方面也进行了研究。研究普遍认为保持瘤胃微生物区系的稳定是维持瘤胃酸度平衡和健康的关键所在。非纤维性碳水化合物中的不同组分(蔗糖、果胶、淀粉和抗性淀粉)对瘤胃发酵的影响存在差异, 与淀粉相比, 可溶性糖(如蔗糖)发酵产生的丁酸较多, 果胶发酵产生乙酸较多。另外,据报道不同类型的碳水化合物饲粮其在瘤胃中的发酵速度不同,如可溶性糖、淀粉、半纤维素及纤维素被降解的时间分别为12~25 min、1.2~5.0 h、8~25 h、24~96 h,即使是同类型饲粮因其淀粉结构(支链淀粉和直链淀粉)不同而其代谢的时间与方式也不尽一致,如小麦淀粉和马铃薯淀粉的瘤胃降解速率分别为每小时34%和5%;软粒小麦比硬粒小麦在瘤胃内发酵产生的乳酸少[4]。饲粮中碳水化合物在瘤胃中的降解速度和代谢产物可改变瘤胃微生物区系,也可以影响瘤胃微生物对有机酸代谢的途径。通过饲粮加工可改变饲粮中淀粉的瘤胃降解率, 从而改变进入小肠淀粉的量。过瘤胃淀粉在胰腺α-淀粉酶的作用下生成葡萄糖, 是反刍动物代谢葡萄糖中外源葡萄糖的最主要来源。提高饲粮中淀粉的过瘤胃率和过瘤胃淀粉的消化率,可提高淀粉的能量利用效率。当淀粉的小肠消化率低于70%时,在保证瘤胃健康的前提下,提高RDS的量可提高淀粉能量利用效率。然而,小肠淀粉的利用率会受到小肠中胰淀粉酶的分泌量限制。淀粉在小肠水解过程中生成的葡萄糖比在瘤胃中生产有机酸的供能效率高约42%[5-6],因此,在生产应用中可适当提高过瘤胃淀粉量来提高淀粉的能量利用率,但过多的过瘤胃淀粉会降低淀粉的小肠消化率, 未消化的淀粉随粪便排出体外又会造成能量损失, 降低动物生产性能[7]。综合淀粉在瘤胃、小肠和大肠降解特点及其对反刍动物的能量供应差异,姚军虎等[3]提出饲粮淀粉能量利用效率(SEF)公式:SEF(%)=0.7 RDS+1.0 SIDS+0.4 LIDS,式中RDS、SID和SLIDS分别为瘤胃、小肠和大肠降解淀粉量占动物总淀粉摄入量的百分比(%)。假设淀粉在小肠内完全消化吸收的能量效率为1,已知淀粉在瘤胃内降解利用的能量利用效率为小肠的0.7倍,淀粉在大肠内降解利用的能量利用效率为小肠的0.4倍。胰腺α-淀粉酶分泌不足是限制过瘤胃淀粉在小肠消化率的最关键因素。于志鹏[8]研究发现, 一些功能性氨基酸如亮氨酸和苯丙氨酸均能促进α-淀粉酶分泌,有助于提高淀粉在小肠的利用率。大肠对全肠道淀粉消化率的贡献比瘤胃和小肠低,淀粉在大肠发酵的能量利用效率仅为小肠的40%,是能量利用效率最低的淀粉消化位点[6],要避免大量淀粉进入大肠发酵。但大肠对动物生产和健康具有同样重要的影响。大肠贡献反刍动物消化道吸收总挥发性脂肪酸的8%~17%,提供5%~10%代谢能[9]。因此,在生产实践中, 除考虑饲粮淀粉含量外, 还需要综合考虑胃肠道不同位点(瘤胃和小肠)淀粉的降解率与能量利用效率。
2.2 饲粮中有效纤维的评价饲粮中纤维物质包括所有非淀粉多糖(NSP)和果胶,属于慢速能量物质。纤维的物理和化学特性与其在动物体内消化活动以及消化酶的作用关系密切,NDF含量在很大程度上影响瘤胃正常功能发挥与健康,饲粮的物理与化学特性在很大程度上影响动物对饲粮的咀嚼、反刍时间、流通、饲料利用率和瘤胃酸碱平衡,与消化道健康和SARA的发生有密切关。Mertens[10]提出物理有效纤维(peNDF)的评价指标,将饲粮中纤维长短与动物咀嚼能力和反刍次数相联系,将宾州筛(PSPS)应用于饲料粒度的测定。peNDF水平过低或饲料颗粒太小也是引起SARA的重要因素。奶牛饲粮中充足的peNDF是维持其瘤胃健康和牛奶中乳脂率恒定所必需的。当饲粮淀粉含量大于28%(干物质基础)、精粗比例大于55%、饲粮纤维含量过低,如NDF小于25%和来源于粗饲料的NDF小于19%时,均可引发SARA。Wang等[11]采用以长、中、短不同长度的羊草为基础的不同peNDF水平的饲粮饲喂后备奶牛,获得8~10月龄后备奶牛最佳生长发育和瘤胃健康的饲粮peNDF>8.0为18%。Yang等[12]测定了奶牛饲粮中不同peNDF水平对咀嚼时间、瘤胃酸度、NDF消化率、产乳量和乳脂率的影响,发现增加饲粮peNDF水平可延长动物咀嚼时间,但不能保证提高瘤胃液pH。尽管peNDF评价指标系统在反刍动物饲粮纤维有效性评价技术方面有很大的进步,但也存在一些局限性,主要是测定饲料粒度的筛的标准化、计算以干物质还是以饲喂时风干状态为基础、NDF是否均匀分布及其受饲料中水分含量的影响等;该系统没有考虑影响反刍时间的粗饲料脆性和消化率;一些学者已经提出和采用饲粮中非粗饲料来源纤维(NFFS)作为饲粮有效纤维的评价指标;潮湿和干燥状态下的粗饲料对反刍活动和唾液分泌量的影响存在较大差异,但采用peNDF指标却没有区分度。因此,NRC(2001)中未将peNDF指标列入饲粮碳水化合物指标。最近,一些学者[13-14]提出校正物理有效纤维(paNDF)指标,采用PSPS测定饲料粒度,并用瘤胃可降解NDF(dNDF)、瘤胃可降解淀粉(dStarch)、粗饲料源NDF(fNDF)和粒度脆性指标建立用于预测年干物质采食量、反刍时间和瘤胃酸度的模型。Mertens[15]也提出潜在可消化中洗纤维(pdNDF)和不可消化中洗纤维(iNDF)的指标,即纤维消化率=pdNDF×[kd/(kd+kp)]。今后建立一种在国际上统一的反刍动物饲粮有效纤维评价方法势在必行。
2.3 饲粮碳水化合物结构对瘤胃微生物菌群及其代谢的影响 2.3.1 瘤胃微生物区系的变化高谷物精料饲粮会诱发反刍动物瘤胃微生物区系发生显著变化,通常表现为在门水平上引起瘤胃中优势菌群发生变化,使厚壁菌门数量增加,拟杆菌门、变形菌门和放线菌门数量减少。饲喂高精料饲粮的奶牛瘤胃液中牛链球菌和乳酸杆菌数量分别提高3.62%和4.65%,溶纤维丁酸弧菌和埃氏巨型球菌的数量分别降低1.14%和4.90%[16]。在高精料饲粮条件下,奶牛易发生SARA,同时发现由于高精料型碳水化合物结构饲粮可致使瘤胃液pH降低,进而导致瘤胃菌群结构失衡;瘤胃上皮乳头出现肿大、角质层脱落等异常状态[17]。
2.3.2 高精料饲粮激活瘤胃微生物的乳酸代谢通路高精料饲粮会引起瘤胃内微生物紊乱,特别是乳酸产生菌与乳酸利用菌之间的菌群失衡而导致瘤胃内乳酸积累,这是诱发SARA的直接原因[17]。瘤胃中乳酸产生菌主要包括溶纤维丁酸弧菌、牛链球菌、乳酸杆菌等;乳酸利用菌主要包括反刍兽新月单胞菌、埃氏巨形球菌等,二者之间的平衡状态决定了瘤胃中乳酸的积累程度。当反刍动物摄入大量可溶性碳水化合物后,几乎所有瘤胃微生物均加速生长。牛链球菌在诱发SARA中至关重要,该菌在不同的pH条件下所代谢的产物不同,当pH低于6.0时,则激活该菌的乳酸脱氢酶(LDH)活性,同时抑制其丙酮酸甲酸裂解酶(PFL)的活性,激活乳酸代谢通路后将以乳酸为代谢终产物[18];当pH高于6.0时,牛链球菌快速繁殖的代谢产物是乳酸,而缓慢生长则以产乙酸、甲酸和乙醇为主;如果在反刍动物生产中长期饲喂以谷物为主的高精料饲粮,牛链球菌可将淀粉和可溶性糖快速地分解为乳酸的比例增加,那么瘤胃乳酸浓度维持一定水平,瘤胃液pH长时间(3 h/d)维持在5.0~5.5, 将诱发SARA。大部分乳酸可被乳酸利用菌代谢转化为丙酸和乙酸,然而,当瘤胃液pH低于5.0时乳酸利用菌受到抑制,就会造成乳酸积累[19]。在集约化养殖条件下,以淀粉为主的高精料饲粮的饲养方式会引起反刍动物瘤胃中牛链球菌快速增殖和发酵产生大量乳酸,造成乳酸积累,加速SARA进程[20-21]。Asanuma等[22]研究发现,牛链球菌糖酵解产酸主要倾向乳酸和甲酸。瘤胃中超过70%的乳酸能被埃氏巨型球菌分解利用,埃氏巨型球菌酵解乳酸产物主要为丙酸、丁酸及少量的乙酸、戊酸等。瘤胃中乳酸的分解代谢主要有3条通路:琥珀酸途径、丙烯酸途径、乙酸和丁酸途径(图 1)。
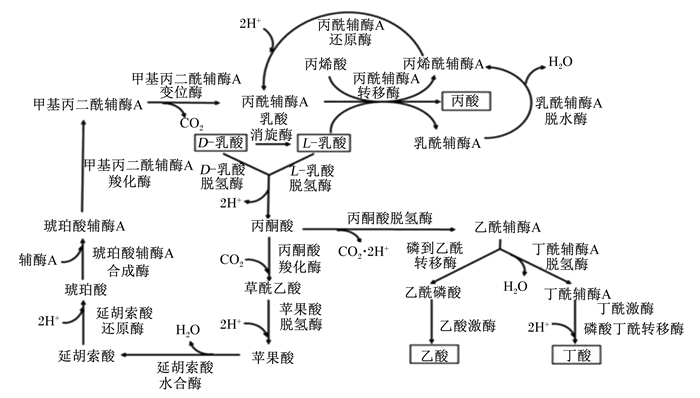
|
图 1 瘤胃中乳酸的代谢途径 Fig. 1 Metabolic pathways of lactic acid in rumen[23] |
埃氏巨型球菌利用乳酸可产生丙酸,主要通过丙烯酸途径和琥珀酸途径[24]。在不同饲粮条件下的乳酸利用途径存在差异,瘤胃中pH是决定乳酸代谢途径的关键。常规饲粮条件下,瘤胃中乳酸主要经琥珀酸途径或者由乙酸和丁酸途径进行代谢,乳酸经由对应的LDH转化为丙酮酸,进入三羧循环后生成丙酸;丙酮酸也可能生成乙酸和丁酸。而在高精料饲粮条件下,乳酸主要经过丙烯酸途径,生成乳酰辅酶A,随后脱水生成丙烯酰辅酶A,最终丙烯酰辅酶通过加氢作用被还原为丙酸。
高谷物精料型碳水化合物结构的饲粮会引起瘤胃内pH降低。本团队Chen等[25]的研究发现底物浓度相同,pH分别在5.5(发生SARA)和6.5(正常生理状态)条件下,牛链球菌的增殖速率有所差异,且其产酸模式受pH的调控。瘤胃酸度对牛链球菌糖酵解产酸起到调控作用,主要是因为酵解产酸过程中相关酶的活性随pH的变化被不同程度地抑制或激活。除对酶的活性影响外,pH还可从转录水平调控LDH合成。Asanuma等[26]研究发现培养基pH会影响LDH的转录水平。但其信号通路或者感应机制介导途径仍有待进一步研究。由于乳酸代谢产生ATP的效率明显低于其他有机酸, 这样会降低谷物能量的利用效率。
2.4 高淀粉饲粮诱发瘤胃异常代谢产物形成高谷物饲粮诱发SARA后,瘤胃代谢紊乱,使瘤胃中G-菌死亡崩解而产生大量异常代谢产物[包括细菌内毒素(LPS)、组胺、酪胺、色胺、乙醇胺、亚硝基二甲胺和D-乳酸等][27]。这些异常代谢产物会引起消化道炎症反应而影响消化道上皮结构的完整性;当奶牛发生SARA时,瘤胃中低pH和高渗透压可能导致瘤胃复层扁平上皮的结构受损,降低细胞颗粒层间的紧密连接[28],因此,在饲喂高精料诱发SARA时,瘤胃上皮和肠上皮屏障功能受损,消化道中产生的LPS可能同时通过瘤胃壁和肠壁而转移至循环系统,导致LPS渗透性增强,使得大量革兰氏阴性菌死亡崩解释放的LPS被吸收入血,形成内毒素血症[29-31]。
组胺是一种结构简单的化学信号分子和自体活性物质,其与组胺受体(HR)结合可改变细胞的生物活性,发挥广泛的生理或病理作用[32]。在酸性条件下,组胺由组氨酸脱羧酶作用于组氨酸而产生。当奶牛采食高精料饲粮时,导致瘤胃内不同种类细菌促使组氨酸脱羧,组胺浓度升高[33]。组胺可以通过瘤胃壁和肠壁转运至血液。生理状体下,进入机体的微量组胺可通过肝脏的甲基化或氧化作用迅速转化为非活性物质从尿液排出体外[34]。当SARA发生时,血液中组胺浓度升高会造成胃肠道紧密连接蛋白和内嵌蛋白表达下调以及上皮细胞凋亡速率提高[35],黏膜和上皮细胞损伤,屏障功能下降,导致组胺和LPS转运增加,进而加重SARA。乙醇胺是由瘤胃中革兰氏阴性菌大量死亡和瘤胃上皮细胞更新产生,可通过为肠道中致病菌供给碳源和氮源促进其在肠道定植,进而发挥致病作用。
2.5 高淀粉饲粮诱发动物发生炎症反应及免疫反应高精料型碳水化合物结构饲粮诱发消化道内产生大量的LPS,通过瘤胃或小肠吸收而进入血液循环系统运送至其他组织和器官,从而引起炎性反应和免疫反应,也可能沉积在乳、肉畜产品中而影响畜产品的品质,增加畜产品的安全风险。血液中的LPS可激活核因子-κB(NF-κB)通路而引起炎症反应[36]。同时,LPS也可诱导细胞因子的表达而激活免疫系统。奶牛发生SARA后,外周血中白细胞数在24 h时内增加11×103个/μL,中性粒细胞比例提高35%,淋巴细胞比例降低33%[37]。有研究也表明,高精料(63%)饲粮相对于低精料(41%)饲粮,能诱发奶牛血中白细胞、中性粒细胞和CD14细胞数量显著升高[38]。另有报道,SARA会导致奶牛外周血中急性期蛋白(血清珠蛋白、内毒素结合蛋白等)含量上升[39]。
组胺可以作为一种炎症信号,促进细胞表达和释放炎症因子。Aschenbach等[40]研究发现,外周血中组胺含量将会随着瘤胃内产生的组胺增加而增加;另有研究表明,奶牛瘤胃内高浓度的组胺可以激活瘤胃上皮细胞的NF-κB信号通路,引起奶牛瘤胃上皮细胞的炎症损伤[41]。组胺是通过与组胺受体(H1R、H2R、H3R和H4R)结合而产生的。组胺与H1R结合,主要诱导或增强炎症反应;与H2R结合,主要抑制或减弱炎症反应[42]。组胺对机体免疫系统也有广泛的调节作用,并调节先天和获得性免疫。组胺通过其受体主动参与抗原递呈细胞(树突状细胞,DC)各分化阶段的功能和活化,与H1R和H3R结合诱导未成熟DC的钙内流、肌动蛋白聚合,提高DC的趋化活性,增强其细胞递呈抗原、合成促炎性细胞因子及激活辅助性T细胞(Thl)的能力。相反,H2R抑制其抗原递呈能力,抑制单核细胞合成肿瘤坏死因子-α(TNF-α)、白细胞介素-12(IL-12)及白细胞介素-18(IL-18)等促炎性细胞因子,促进白细胞介素-10(IL-10)等抗炎性细胞因子的合成,并诱导合成IL-10的T细胞(或Th2细胞)增殖[43]。成熟DC的这些反应丧失,但组胺仍可以通过H2R剂量依赖性增加成熟DC内环磷酸腺苷(cAMP)水平并刺激IL-10分泌,同时抑制DC的IL-12合成[44]。
3 采用系统整体营养调控技术措施提高饲粮中碳水化合物利用效率和消化道健康的研究进展 3.1 饲粮结构和组成平衡调控生命在于平衡,营养平衡是动物健康的基础。中国最早的典籍之一《黄帝内经》中记载有“五谷为养,五果为助,五畜为益,五菜为充,气味合而服之,以补精益气”。这里强调的是食物的综合平衡。动物机体内营养平衡是保证动物获得较好的饲粮利用效率、理想的生产性能和良好的健康状况的重要技术指标。从系统动物营养学多层次营养平衡理论[45]的角度出发,从饲粮层次、消化道层次和代谢层次(肝脏和外周组织)3个水平考虑调控反刍动物对饲粮碳水化合物的高效利用。在饲粮层次上,徐明[6]提出采用饲粮中碳水化合物平衡指数, 即物理有效纤维与饲粮中瘤胃可降解淀粉比值(peNDF/RDS)来调控饲粮中碳水化合物结构的平衡,研究确定泌乳牛和泌乳山羊的适宜peNDF/RDS为1.0~1.1,育肥牛peNDF/RDS为0.25。Sun等[46]将饲粮中物理有效纤维与代谢葡萄糖比值(peNDF/MG)应用于8~10月龄后备奶牛的生长发育评定,确定最佳比值为1.46。在消化道层次上,在维持瘤胃微生物高效发酵的前提下,通过调控淀粉的降解和消化部位以及粗饲料的能量利用来提高碳水化合物的利用效率。在代谢层次上,通过调控C2+C4能和C3+C6能占摄入代谢能的比例,为机体有效地提供葡萄糖(MG),并进一步提高碳水化合物利用效率;另外,动物体内的渗透压平衡、酸碱平衡、氧化平衡和免疫平衡是重要的生理基础,与体内碳水化合物的代谢、吸收、利用密切相关,在实施营养调控技术中必须加以重视。
充足的纤维供给是反刍动物唾液分泌、反刍、瘤胃缓冲和瘤胃壁健康所必需的。在生产实际中依据动物的生产目标,通过调控碳水化合物组成来制定合理平衡的饲粮结构和预期采食量,包括RDS、中性洗涤纤维(NDF、peNDF)、有机酸等组分的合理结构。以奶牛为例,NRC(2001)颁布的标准中推荐泌乳奶牛饲粮中碳水化合物结构平衡的推荐量,详见表 1。即在NRC(2001)奶牛饲养标准中提出:采用饲粮中非纤维性碳水化合物与中性洗涤纤维比例(NFC/NDF)作为评价奶牛饲粮中碳水化合物平衡的标准,并提出奶牛饲粮中75%的NDF应来源于粗饲料,饲粮中NFC含量最高不超出44%,这样保证饲粮中peNDF的充足含量。在奶牛和肉牛的饲养实践中,以美国为先导的世界上许多国家在奶牛饲粮配制方法上推广使用科学的TMR,以保证饲粮中的peNDF含量,饲粮中淀粉含量在22%以下,最大限度地预防SARA的发生。
|
|
表 1 泌乳奶牛饲粮中碳水化合物结构(NFC/NDF)平衡的推荐量(NRC,2001) Table 1 References of carbohydrate structure (NFC/NDF) in diets of lactating dairy cows (NRC, 2001) |
Plaizier等[47]在其综述中提出饲粮中peNDF低于12.5%时就会发生SARA。Zebeli等[48]用45个试验的Meta分析结果中指出:奶牛饲粮peNDF与RDS的比值达到1.45时可维持瘤胃液pH在6.2以上,以保证奶牛消化道的健康。淀粉在消化道不同部位消化的供能效率不同,谷物饲料原料理化特性和加工处理方法对消化部位有很大影响,要调控淀粉在消化道的最佳位点,适当提高饲粮中淀粉的过瘤胃率可提高淀粉的能量利用效率。
3.2 谷物能量饲料原料预处理技术为充分发挥高产反刍动物生产性能,生产中常大量饲喂谷物饲料,以高淀粉增加饲粮能量水平。由于不同来源谷物的淀粉含量和瘤胃降解率有较大差异,常用谷物的有效降解率顺序为燕麦>小麦>大麦>玉米>高粱。对谷物进行预处理可以在一定程度上提高谷物的消化率和能量利用率,也可预防和缓解SARA,目前对谷物的预处理技术主要有:物理处理(如制粒、膨化、烘焙、爆破、蒸汽压片、包衣等)、化学处理(如酸碱法、氨化、化学修饰等)和生物学处理(如微生物、酶处理等)。多数物理处理谷物可提高谷物淀粉的瘤胃降解率和消化率,但烘焙加工后,淀粉与蛋白质结合形成复合结构,可降低淀粉的瘤胃降解率。部分物理加工方式可能会加快谷物在瘤胃内的发酵,诱发SARA。Shen等[49]运用有机酸处理谷物在调控瘤胃发酵、缓解瘤胃酸中毒方面显示出正效应。最近有研究表明,有机酸不仅可以用作饲料添加剂,还可直接作用于反刍动物的谷物精料,通过增加精料中的瘤胃抗性淀粉的含量来改善瘤胃发酵,提高瘤胃液pH等,从而在缓解SARA方面发挥重要的作用。这里值得注意的是谷物粉碎程度和粒度对淀粉利用和消化道健康会产生很大影响,特别是在生产应用谷物时不宜粉碎太细,甚至在低精料饲粮条件下可整粒饲喂玉米。对谷物原料进行预处理,不仅可以提高过瘤胃淀粉的量,也可提高淀粉能量的利用效率,而且有助于保证瘤胃健康,从而改善反刍动物健康状况和生产性能。但是在生产应用时仍需进一步进行成本与效益的综合评估。
3.3 缓解SARA的营养调控技术 3.3.1 采用硫胺素(VB1)调控硫胺素是参与体内碳水化合物代谢的一种重要的水溶性维生素。在正常生理条件下可由瘤胃微生物自身合成充足的硫胺素,并不需要从饲粮中额外补充。但Miller等[50]研究发现,逐渐提高饲粮中NFC/NDF,硫胺素的生物合成量将降低,这就提示在反刍动物发生SARA时可能存在硫胺素的缺乏。在国际上,王洪荣教授团队首次研究发现硫胺素可通过调控瘤胃内微生物对碳水化合物代谢而缓解瘤胃酸中毒[51-52]。硫胺素是体内碳水化合物代谢产物丙酮酸进入三羧循环或乳酸代谢中重要的辅助因子,它作为丙酮酸脱氢酶以及α-酮戊二酸脱氢酶的重要辅酶,当体内硫胺素缺乏时,饲粮的碳水化合物代谢中间产物无法继续代谢。饲粮能量水平较高时其需要量迅速增加,主要是因为此时期瘤胃微生物迅速生长繁殖,特别是一些丙酸产生菌需要大量的硫胺素来完成能量代谢活动,但仍不能满足其需要量的急剧变化,因而造成硫胺素的缺乏。此外,高精料条件下瘤胃微生物区系遭到改变,硫胺素的生物合成能力受到限制[51]。扬州大学团队潘晓花等[53]报道:当高精料饲粮诱发奶牛发生SARA时,其瘤胃微生物区系发生显著变化,添加硫胺素有效降低乳酸产生菌(牛链球菌)的数量,增加乳酸利用菌(埃氏巨型球菌)的数量。Pan等[54]的研究表明,高精料可能引起瘤胃上皮硫胺素转运能力的降低,从而抑制硫胺素的吸收,这些因素都进一步加剧了SARA发生时瘤胃内硫胺素的缺乏。采用Illumina测序的手段分析对比高精料饲粮条件下添加硫胺素与未添加组的奶山羊瘤胃微生物区系的变化,发现补充硫胺素可以显著增加纤维分解菌在瘤胃中的分布并促进乳酸利用菌的生长,从而提高瘤胃液pH和乙酸的含量,并使得瘤胃内的微生物分布趋于正常水平。Zhang等[55]的研究发现,高精料饲粮中添加硫胺素可以缓解上皮角质层的脱落,加强细胞间的连接,提高上皮细胞层的厚度,维持上皮组织形态结构。研究表明,添加一定量的硫胺素可通过抑制牛链球菌和乳酸杆菌等乳酸产生菌的生长,促进埃氏巨型球菌的生长而调节瘤胃菌群结构的平衡,同时可以缓解上皮损伤,维持上皮生理结构的完整性而缓解SARA。采用宏基因组学分析饲喂含有硫胺素的饲粮的动物瘤胃内真菌分布时发现,硫胺素可以显著改善高精料饲粮条件下引起的真菌丰度的降低,提高反刍动物对纤维的分解消化能力[56]。
3.3.2 添加酵母培养物(YC)和酵母菌制剂调控YC是一种微生物发酵产物,它通过调节瘤胃微生物区系的稳定来达到调控SARA的效果。任胜男等[57]研究表明:在高NFC底物条件下模拟SARA,添加YC能够通过降低发酵液中乳酸含量达到调控瘤胃发酵液pH的效果,促进瘤胃微生物对氨氮的利用和瘤胃微生物的生长,具有缓解SARA的潜力。YC可以通过减少乳酸的产生、增加瘤胃微生物对乳酸的利用量而稳定瘤胃pH。但也有研究表明,YC对瘤胃pH没有显著影响,但能够降低瘤胃内的乳酸含量[58]。
3.3.3 直接饲喂微生物和添加抗菌制剂调控Weimer等[59]报道,通过瘤胃灌注低营养富集埃氏球菌(M. elsdenii)菌液可以改善瘤胃发酵,缓解高淀粉饲粮诱导的SARA。日本和韩国等学者研究体外筛选试构建了耐酸工程菌、抑制瘤胃中牛链球菌的菌剂或菌素等方法。这些方法处于研究之中,这些技术和产品有希望在将来应用于生产实践中。
4 小结碳水化合物是动物最基本的能量载体物质之一。反刍动物在碳水化合物代谢与其他高等动物最大的区别在于其直接将碳水化合物在瘤胃内分解为有机酸后氧化供能,并通过唾液缓冲及瘤胃吸收等方式来维持瘤胃偏碱性的内环境平衡。近年来,随着我国集约化养殖程度地不断提高和对高生产效率的盲目追求,生产中出现违背反刍动物的营养生理特性而过量使用谷物饲料的趋势,进而诱发动物出现消化道健康问题。反刍动物利用碳水化合物的机制复杂,涉及瘤胃微生物代谢、消化吸收、肝脏代谢转化及外周组织营养分配等诸多环节,目前相关的基础数据缺乏,更深层次的碳水化合物利用机制仍处于探索中。采用系统营养调控策略来解决这一问题仍在继续探究。在生产上仍需重视碳水化合物对动物健康的影响,最大限度地减少谷物淀粉的用量和降低其对动物健康的负面影响,探索符合我国饲料资源特点和生产实际的高效节粮型反刍动物健康养殖模式和应用技术是今后需要重点关注的问题。
| [1] |
李宗军.瘤胃丙酸发酵的增强策略及其对碳水化合物代谢的动态影响[D].博士学位论文.杨凌: 西北农林科技大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10712-1018973551.htm
|
| [2] |
HRISTOV A N, OH J, FIRKINS J L, et al. Special topics-mitigation of methane and nitrous oxide emissions from animal operations:Ⅰ.A review of enteric methane mitigation options[J]. Journal of Animal Science, 2013, 91(11): 5045-5069. DOI:10.2527/jas.2013-6583 |
| [3] |
姚军虎, 申静. 瘤胃可降解淀粉:决定反刍动物消化道健康与养分利用的关键日粮因子[J]. 饲料工业, 2020(8): 1-7. |
| [4] |
MONTEILS V, JURJANZ S, COLIN-SCHOELLEN, et al. Kinetics of ruminal degradation of wheat and potato starches in total mixed rations[J]. Journal of Animal Science, 2002, 80(1): 235-241. |
| [5] |
HARMON D L, MCLEOD K R. Glucose uptake and regulation by intestinal tissues:implications and whole-body energetics[J]. Journal of Animal Science, 2001, 79(Suppl.E): E59-E72. |
| [6] |
徐明.反刍动物瘤胃健康和碳水化合物能量利用效率的营养调控[D].博士学位论文.杨凌: 西北农林科技大学, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10712-2008037102.htm
|
| [7] |
GRESSLEY T F, HALL M B, ARMENTANO L E. Ruminant nutrition symposium:productivity, digestion, and health responses to hindgut acidosis in ruminants[J]. Journal of Animal Science, 2011, 89(4): 1120-1130. DOI:10.2527/jas.2010-3460 |
| [8] |
于志鹏.苯丙氨酸和亮氨酸对山羊胰腺发育和外分泌功能的调控研究[D].博士学位论文.杨凌: 西北农林科技大学, 2013. http://qikan.cqvip.com/Qikan/Article/Detail?id=39401896
|
| [9] |
VARÁDYOVÁ Z, ZELEÑÁK I, SIROKA P. In vitro study of the rumen and hindgut fermentation of fibrous materials (meadow hay, beech sawdust, wheat straw) in sheep[J]. Animal Feed Science and Technology, 2000, 83(2): 127-138. DOI:10.1016/S0377-8401(99)00121-2 |
| [10] |
MERTENS D R. Creating a system for meeting the fiber requirements of dairy cows[J]. Journal of Dairy Science, 1997, 80(7): 1463-1481. DOI:10.3168/jds.S0022-0302(97)76075-2 |
| [11] |
WANG H R, CHEN Q, CHEN L M, et al. Effects of dietary physically effective neutral detergent fiber content on the feeding behavior, digestibility, and growth of 8- to 10-month-old Holstein replacement heifers[J]. Journal of Dairy Science, 2017, 100(2): 1161-1169. DOI:10.3168/jds.2016-10924 |
| [12] |
YANG W Z, BEAUCHEMIN K A. Physically effective fiber:method of determination and effects on chewing, ruminal acidosis, and digestion by dairy cows[J]. Journal of Dairy Science, 2006, 89(7): 2618-2633. DOI:10.3168/jds.S0022-0302(06)72339-6 |
| [13] |
WHITE R R, HALL M B, FIRKIN J L, et al. Physically adjusted neutral detergent fiber system for lactating dairy cow rations.Ⅰ:deriving equations that identify factors that influence effectiveness of fiber[J]. Journal of Dairy Science, 2017, 100(12): 9551-9568. DOI:10.3168/jds.2017-12765 |
| [14] |
WHITE R R, HALL M B, FIRKIN J L, et al. Physically adjusted neutral detergent fiber system for lactating dairy cow rations.Ⅱ:development of feeding recommendations[J]. Journal of Dairy Science, 2017, 100(12): 9569-9584. DOI:10.3168/jds.2017-12766 |
| [15] |
MERTENS D R.Importance of the detergent system of feed analyses for improving animal nutrition[C]//Proceedings-Cornell Nutrition Conference for Feed Manufacturers.[s.l.]: [s.n.], 1993: 25-36.
|
| [16] |
WANG H R, PAN X H, WANG C, et al. Effects of different dietary concentrate to forage ratio and thiamine supplementation on the rumen fermentation and ruminal bacterial community in dairy cows[J]. Animal Production Science, 2015, 55(2): 189-193. DOI:10.1071/AN14523 |
| [17] |
刘烨彤, 刘大程, 卢德勋, 等. 慢性瘤胃酸中毒状态下奶山羊瘤胃细菌内几种相关细菌数量变化的研究[J]. 中国畜牧兽医, 2009, 36(3): 123-126. |
| [18] |
RUSSELL J R, HINO T. Regulation of lactate production in Streptococcus bovis:a spiraling effect that contributes to rumen acidosis[J]. Journal of Dairy Science, 1985, 68(7): 1712-1721. DOI:10.3168/jds.S0022-0302(85)81017-1 |
| [19] |
RUSSELL J B, ALLEN M S.Physiological basis for interactions among rumen bacteria: Streptococcus bovis and Megasphaera elsdenii as a model[M]//KLUG M J, REDDY C A.Current perspectives in microbial ecology.Washington, D.C.: American Society for Microbiology, 1984: 239-247.
|
| [20] |
MAROUNE M, BARTOS S. Interactions between rumen amylolytic and lactate-utilizing bacteria in growth on starch[J]. Journal of Applied Bacteriology, 1987, 63(3): 233-238. DOI:10.1111/j.1365-2672.1987.tb04941.x |
| [21] |
王洪荣. 反刍动物瘤胃酸中毒机制解析及其营养调控措施[J]. 动物营养学报, 2014, 26(10): 3140-3148. |
| [22] |
ASANUMA N, YOSHIZAWA K, HINO T. Properties and role of glyceraldehyde-3-phosphate dehydrogenase in the control of fermentation pattern and growth in a ruminal bacterium, Streptococcus bovis[J]. Current Microbiology, 2009, 58(4): 283-287. DOI:10.1007/s00284-008-9326-2 |
| [23] |
夏光亮, 赵芳芳, 王洪荣. 反刍动物瘤胃内乳酸代谢与瘤胃酸中毒调控的研究进展[J]. 动物营养学报, 2019, 31(4): 1511-1517. |
| [24] |
PRABHU R, ALTMAN E, EITEMAN M A. Lactate and acrylate metabolism by Megasphaera elsdenii under batch and steady-state conditions[J]. Applied and Environmental Microbiology, 2012, 78(24): 8564-8570. DOI:10.1128/AEM.02443-12 |
| [25] |
CHEN L M, LIU S M, WANG H R, et al. Relative significances of pH and substrate starch level to roles of Streptococcus bovis S1 in rumen acidosis[J]. AMB Express, 2016, 6: 80. DOI:10.1186/s13568-016-0248-2 |
| [26] |
ASANUMA N, HINO T. Fructose bisphosphate aldolase activity and glycolytic intermediate concentrations in relation to lactate production in Streptococcus bovis[J]. Anaerobe, 2002, 8(1): 1-8. DOI:10.1006/anae.2001.0398 |
| [27] |
PLAIZIER J C, KHAFIPOUR E, LI S, et al. Subacute ruminal acidosis (SARA), endotoxins and health consequences[J]. Animal Feed Science and Technology, 2012, 172(1/2): 9-21. |
| [28] |
STEELE M A, CROOM J, KAHLER M, et al. Bovine rumen epithelium undergoes rapid structural adaptations during grain-induced subacute ruminal acidosis[J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2011, 300(6): R1515-R1523. DOI:10.1152/ajpregu.00120.2010 |
| [29] |
CHIN A C, FLYNN A N, FEDWICK J P, et al. The role of caspase-3 in lipopolysaccharide-mediated disruption of intestinal epithelial tight junctions[J]. Canadian Journal of Physiology and Pharmacology, 2006, 84(10): 1043-1050. DOI:10.1139/y06-056 |
| [30] |
EMMANUEL D G V, MADSEN K L, CHURCHILL T A, et al. Acidosis and lipopolysaccharide from Escherichia coli B:055 cause hyperpermeability of rumen and colon tissues[J]. Journal of Dairy Science, 2007, 90(12): 5552-5557. DOI:10.3168/jds.2007-0257 |
| [31] |
ALLEN M S. Effects of diet on short-term regulation of feed intake by lactating dairy cattle[J]. Journal of Dairy Science, 2000, 83(7): 1598-1624. DOI:10.3168/jds.S0022-0302(00)75030-2 |
| [32] |
SIMONS F E R, SIMONS K J. Histamine and H1-antihistamines:celebrating a century of progress[J]. Journal of Allergy and Clinical Immunology, 2011, 128(6): 1139-1150. DOI:10.1016/j.jaci.2011.09.005 |
| [33] |
CANI P D, DELZENNE N M. The role of the gut microbiota in energy metabolism and metabolic disease[J]. Current Pharmaceutical Design, 2009, 15(13): 1546-1558. DOI:10.2174/138161209788168164 |
| [34] |
胡红莲.奶山羊亚急性瘤胃酸中毒营养生理机制的研究[D].博士学位论文.呼和浩特: 内蒙古农业大学, 2008. http://d.wanfangdata.com.cn/Thesis_Y1307735.aspx
|
| [35] |
MENNIGEN R, NOLTE K, RIJCKEN E, et al. Probiotic mixture VSL#3 protects the epithelial barrier by maintaining tight junction protein expression and preventing apoptosis in a murine model of colitis[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2009, 296(5): G1140-G1149. DOI:10.1152/ajpgi.90534.2008 |
| [36] |
GUHA M, MACKMAN N. LPS induction of gene expression in human monocytes[J]. Cellular Signalling, 2001, 13(2): 85-94. DOI:10.1016/S0898-6568(00)00149-2 |
| [37] |
SWEET M J, HUME D A. Endotoxin signal transduction in macrophages[J]. Journal of Leukocyte Biology, 1996, 60(1): 8-26. DOI:10.1002/jlb.60.1.8 |
| [38] |
吴永霞.不同日粮模式对奶山羊和奶牛血中内毒素含量及免疫活化状态的影响[D].硕士学位论文.重庆: 西南大学, 2012. http://d.wanfangdata.com.cn/Thesis/Y2087068
|
| [39] |
陆天水, 陈杰, 汤艾菲, 等. 利用瘤胃缓冲剂调控奶牛血浆组胺内毒素水平与提高产奶性能的研究[J]. 中国奶牛, 1992(6): 45-47. |
| [40] |
ASCHENBACH J R, GÄBEL G. Effect and absorption of histamine in sheep rumen:significance of acidotic epithelial damage[J]. Journal of Animal Science, 2000, 78(2): 464-470. DOI:10.2527/2000.782464x |
| [41] |
王婷婷.亚急性瘤胃酸中毒病牛瘤胃组胺对瘤胃上皮细胞炎性通路的影响[D].硕士学位论文.长春: 吉林大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10183-1015600722.htm
|
| [42] |
EMERSON M R, ORENTAS D M, LYNCH S G, et al. Activation of histamine H2 receptors ameliorates experimental allergic encephalomyelitis[J]. NeuroReport, 2002, 13(11): 1407-1410. DOI:10.1097/00001756-200208070-00012 |
| [43] |
TAKAHASHI H K, IWAGAKI H, MORI S, et al. Histamine inhibits lipopolysaccharide-induced interleukin (IL)-18 production in human monocytes[J]. Clinical Immunology, 2004, 112(1): 30-34. DOI:10.1016/j.clim.2004.03.006 |
| [44] |
MAZZONI A, YOUNG H A, SPITZER J H, et al. Histamine regulates cytokine production in maturing dendritic cells, resulting in altered T cell polarization[J]. Journal of Clinical Investigation, 2001, 108(12): 1865-1873. DOI:10.1172/JCI200113930 |
| [45] |
卢德勋. 新版系统动物营养学导论[M]. 北京: 中国农业出版社, 2016.
|
| [46] |
SUN J, XU J H, SHEN Y Z, et al. Effects of different dietary ratio of physically effective neutral detergent fiber and metabolizable glucose on rumen fermentation, blood metabolites and growth performance of 8 to 10-month-old heifers[J]. Asian-Australasian Journal of Animal Sciences, 2018, 31(8): 1230-1237. DOI:10.5713/ajas.17.0885 |
| [47] |
PLAIZIER J C, KRAUSE D O, GOZHO G N, et al. Subacute ruminal acidosis in dairy cows:the physiological causes, incidence and consequences[J]. The Veterinary Journal, 2008, 176(1): 21-31. DOI:10.1016/j.tvjl.2007.12.016 |
| [48] |
ZEBELI Q, DIJKSTRA J, TAFAJ M, et al. Modeling the adequacy of dietary fiber in dairy cows based on the responses of ruminal pH and milk fat production to composition of the diet[J]. Journal of Dairy Science, 2008, 91(5): 2046-2066. DOI:10.3168/jds.2007-0572 |
| [49] |
SHEN Y Z, DING L Y, CHEN L M, et al. Feeding corn grain steeped in citric acid modulates rumen fermentation and inflammatory responses in dairy goats[J]. Animal, 2019, 13(2): 301-308. DOI:10.1017/S1751731118001064 |
| [50] |
MILLER B L, MEISKE J C, GOODRICH R D. Effects of grain source and concentrate level on B-vitamin production and absorption in steers[J]. Journal of Animal Science, 1986, 62(2): 473-483. DOI:10.2527/jas1986.622473x |
| [51] |
张红伟.硫胺素(VB1)对瘤胃内营养物质消化代谢的影响[D].硕士学位论文.扬州: 扬州大学, 2010. http://d.wanfangdata.com.cn/Thesis/Y1702109
|
| [52] |
王洪荣, 张红伟. 硫胺素和硫水平对山羊人工瘤胃代谢和微生物菌群的影响[J]. 中国农业科学, 2012, 45(8): 1595-1605. |
| [53] |
潘晓花, 王梦芝, 付聪, 等. 饲粮精粗比和添加硫胺素对奶牛体外瘤胃发酵参数及菌群结构的影响[J]. 动物营养学报, 2013, 25(1): 88-99. |
| [54] |
PAN X H, XUE F G, NAN X M, et al. Illumina sequencing approach to characterize thiamine metabolism related bacteria and the impacts of thiamine supplementation on ruminal microbiota in dairy cows fed high-grain diets[J]. Frontiers in Microbiology, 2017, 8: 1818. DOI:10.3389/fmicb.2017.01818 |
| [55] |
ZHANG H, PENG A L, ZHAO F F, et al. Thiamine ameliorates inflammation of the ruminal epithelium of Saanen goats suffering from subacute ruminal acidosis[J]. Journal of Dairy Science, 2020, 103(2): 1931-1943. DOI:10.3168/jds.2019-16944 |
| [56] |
XUE F G, NAN X M, SUN F Y, et al. Metagenome sequencing to analyze the impacts of thiamine supplementation on ruminal fungi in dairy cows fed high-concentrate diets[J]. AMB Express, 2018, 8: 159. DOI:10.1186/s13568-018-0680-6 |
| [57] |
任胜男, 金亚倩, 赵芳芳, 等. 酵母培养物对山羊亚急性瘤胃酸中毒体外发酵模型的调控作用[J]. 动物营养学报, 2020, 32(5): 2263-2272. |
| [58] |
DOREAU M, JOUANY J P. Effect of a Saccharomyces cerevisiae culture on nutrient digestion in lactating dairy cows[J]. Journal of Dairy Science, 1998, 81(12): 3214-3221. DOI:10.3168/jds.S0022-0302(98)75885-0 |
| [59] |
WEIMER P J, CABRAL L D S, CACITE F. Effects of ruminal dosing of Holstein cows with Megasphaera elsdenii on milk fat production, ruminal chemistry, and bacterial strain persistence[J]. Journal of Dairy Science, 2015, 98(11): 8078-8092. DOI:10.3168/jds.2015-9721 |



