糖类是自然界中广泛存在的一类有机化合物,在生活中也是不可或缺的一部分,蔗糖、淀粉和纤维素等都属于糖类。众所周知,循环系统中葡萄糖水平是调控动物采食的最直接因素。然而随着近年来研究的深入,发现糖类对采食的调控是一个复杂的过程。有研究表明,甜味可以诱导动物摄入更多的食物和营养[1],近年来日趋增多的肥胖症大部分原因是摄入过多的糖分,但是糖类包含多种糖,每种糖对动物采食行为的作用效果、作用途径都不尽相同。美国1970—1990年的20年间对高果糖玉米糖浆的食用量增长了1 000%,大量研究表明果糖摄入在动物模型和人类中均会引发过度体增重[2];小鼠分别摄入含有相同能量的高果糖玉米糖浆和蔗糖,结果显示果糖组小鼠体增重显著高于蔗糖组[3]。
动物的食欲产生主要是由外周、中枢神经系统及内分泌系统调节。动物肝脏、胃肠道及血液中的营养物质浓度和激素组成了调控食欲的外周信号。而中枢神经系统的调控主要分为2部分:机体稳态(如饥饿导致寻找食物,进而去采食以维持自身能量需要)和相关奖赏机制(享乐或者愉悦采食,乐于通过采食获得满足)的调控[4]。机体稳态系统调控采食主要依靠弓状核(arcuate nucleus,ARC)、室旁核(paraventricular nucleus,PVN)、臂旁核(parabrachial nucleus,PBN)等核团,其中弓状核能够整合感应多种激素和营养素信号,是机体调控采食的关键部位[5]。除了可以通过神经细胞直接发出神经信号外,弓状核分布有表达神经肽Y(neuropeptide-Y,NPY)和刺鼠相关蛋白(agouti-related peptide,AgRP)的促食欲神经元及促黑素皮质素(pro-opiomelanocortin,POMC)等抑食欲神经元[6]。采食奖赏指动物摄入可口食物时产生的奖赏效应,就算动物不是饥饿的状态,摄入美味食物时也会通过中枢和外周信号传入大脑奖赏系统,然后通过奖赏效应促进动物继续采食[7]。采食奖赏主要依赖于中脑多巴胺(dopamine,DA)奖赏系统,伏隔核(nucleus accumbens, NAC)和前额叶皮层(prefrontal cortex, PFC)受到来自腹侧被盖区(ventral tegmental area,VTA)的多巴胺神经元投射,对多巴胺浓度进行调控,从而调节畜禽的采食行为[8-9]。
畜禽采食量的高低直接影响到营养物质的摄入量及生产性能的发挥,是畜禽养殖中不可忽略的因素。生产中发现给仔猪灌喂5%的葡萄糖或浓糖水,可预防其先天性营养不良造成的低血糖病,降低仔猪的死亡率;饲粮中添加2%的白糖或0.01%的糖精可使7日龄仔猪立即进食,度过补料期;在哺乳母猪饲粮中添加60 mg/kg的糖精,可有效缓解哺乳期的厌食和减重问题[10]。另有研究表明,雏鸡饮水中添加0.2%的果糖低聚糖可提高雏鸡成活率,蛋鸡饲粮中补充蜂蜜可提高产蛋率,此外饮水中添加适量乳糖和甘露糖能够减少鸡肠道中沙门氏菌[11]。在小鼠中的研究表明,糖类除了为动物机体提供能量,还会对采食行为发挥调控作用。摄入低剂量葡萄糖时对AgRP神经元作用高于POMC神经元,而高剂量葡萄糖则更多激活POMC神经元从而抑制食欲[12];Colley等[13]的研究也证明果糖摄入使动物体内循环甘油三酯加倍,而添加葡萄糖则导致下丘脑中多种饱腹感相关肽分泌上调。为了能够对糖类在动物采食行为中的调控作用有更加系统的认识,从而为畜牧生产过程中糖的应用提供指导意义,本文从稳态系统和奖赏系统2个方面对单糖、双糖和多糖三大类糖对动物采食产生的影响进行综述。
1 糖类通过稳态系统调控动物采食 1.1 单糖对稳态系统的影响众所周知,葡萄糖是活细胞的能量来源和新陈代谢中间产物,在单糖中具有重要地位。最新研究表明,生产中饲粮添加50 mg/kg右旋葡萄糖可改善母猪断奶-发情间隔及哺乳母猪的体重损失,并推测这跟摄入葡萄糖后动物胰岛素(insulin)水平显著升高有关[14]。另有研究发现,生产中饮水添加葡萄糖氧化酶(一种能专一性的将葡萄糖氧化成葡萄糖酸的脱氢酶)可改善断奶仔猪和肉鸡的生长性能和胃肠道环境,提高饲料报酬[15-16]。果糖是一种特殊的甜味剂,在机体的代谢途径不同于葡萄糖和蔗糖等。果糖不会刺激胰岛素产生,所以摄入果糖相比于同等能量的其他糖类会引起较小的胰岛素波动[2]。Shapiro等[17]的研究表明,长期摄入果糖会在引起体重、体脂肪及血清瘦素、胰岛素、葡萄糖水平升高之前首先引起瘦素抵抗,从而加速高脂饮食引发的肥胖;此外,与葡萄糖相比,果糖在肝脏中优先代谢为脂质,更容易引发胰岛素抵抗、高甘油三酯、高血压等症状[18];近年来食用量陡增的果糖玉米糖浆被证明可以减少循环中胰岛素和瘦素水平,从而使动物采食量增多,体重增加[19];对果糖偏好小鼠添加葡萄糖的研究,发现果糖偏好小鼠相对于对照组的正常小鼠表现出更强的葡萄糖偏好,且添加葡萄糖后的果糖偏好小鼠伏隔核和外侧下丘脑中POMC神经元产生神经肽减少,对照组添加葡萄糖后却无此现象[20]。半乳糖是哺乳动物乳汁中乳糖的组成成分,多存在于奶类产品和甜菜中。本实验室前期试验发现,饮水添加或饲粮添加半乳糖对小鼠采食量均无显著差异;但是有研究发现仔猪饲粮添加α-半乳糖苷酶(一种外源性碳水化合物酶)可以显著提高营养物质的消化率、平均日增重和肠道消化酶活性,降低断奶仔猪腹泻率及改善肠道绒毛形态[21];在肉鸡饲粮中添加α-半乳糖苷酶能够显著降低肉鸡平均日采食量和料重比,显著提高粗蛋白质和粗纤维的表观消化率[22]。体外试验表明, α-半乳糖苷酶在pH 5.5的条件下可以降低水苏糖和棉子糖等抗营养因子的含量,提高果糖、葡萄糖和半乳糖的含量,但以上所述α-半乳糖苷酶对仔猪和肉鸡的影响是否由这3种糖的其中1种或几种引起尚不清楚。D-木糖是一种天然戊糖,研究表明木糖对餐后血液葡萄糖和胰岛素的激增有急性抑制作用[23];近期研究发现,D-木糖可改善高脂饮食诱导的肥胖小鼠的血脂谱并减少肝脏中的脂质累积,且调节脂肪细胞分化、脂肪生成以及脂肪组织、肝脏组织中脂肪酸氧化的基因表达[24]。
1.2 双糖对稳态系统的影响天然存在的双糖中,使用量最大的是蔗糖。早期的猪生产中已有研究表明生长育肥猪饲粮添加适量蔗糖不仅能够增强饲粮适口性和猪的采食量,而且对提高猪的平均日增重和饲料利用率均有效果[25]。最新的小鼠试验研究表明,相比于三氯蔗糖、阿斯巴甜等非能量甜味剂,饮食添加蔗糖会显著增加体增重[26];而另一关于食欲的研究也验证了此观点,Van Engelen等[27]测试了蔗糖、高果糖玉米糖浆、葡萄糖和三氯蔗糖(作为对照组)对9~14岁正常体重男孩食欲和摄食量的影响,结果发现蔗糖和高果糖玉米糖浆组均提高了能量摄入,且蔗糖组差异最显著;但是在小鼠上面的研究却发现蔗糖降低了小鼠的采食量,这可能是蔗糖自身含有较多能量,并且试验对象的不同造成的。另外,小鼠对于麦芽糖的浓度偏爱规律不同于蔗糖的随浓度递增然后递减,小鼠对于麦芽糖的摄入量在100 mmol/L时突然增多,而小于100 mmol/L时则摄入量与水没有差异[28];Tey等[29]在研究中使用非营养甜味剂(non nutritive sweetener,NNS)与蔗糖进行处理,也发现NNS组在随后的随意午餐摄入量显著高于蔗糖组,能量差异在进食中得到补偿,总的日能量摄入没有显著差异;并且摄入蔗糖后1 h内血液葡萄糖和胰岛素水平大幅上升,但在午餐后(3 h内),蔗糖组和NNS组血液葡萄糖和胰岛素水平无显著差异;此外,有研究发现,人类饮食添加蔗糖会引起肝脏因子成纤维细胞因子21(fibroblast growth factor 21,FGF21)分泌,可减少对蔗糖的摄入,并发现不喜甜食者FGF21水平较高,此研究表明肝脏也可能会分泌某些调控采食的物质[30]。乳果糖是由果糖和半乳糖人工合成的双糖,生产中有研究表明肉鸡饲粮添加5 g/kg乳果糖可显著改善其屠宰性能,并且可以增加肠道中丁酸含量[31],表明乳果糖或能影响肉鸡采食量。
1.3 多糖对稳态系统的影响肝素是一种存在于细胞外基质和循环血液中的糖胺聚糖,具有抗凝血作用并参与机体的免疫调节。研究发现,肝素对动物的采食和葡萄糖稳态具有调节作用,通过急性注射发现肝素可显著提高小鼠采食量,长期注射则体重增加,进一步试验发现肝素通过激活叉头框转录因子O亚族1(FoxO1),显著促进AgRP神经元中神经递质的表达和分泌,从而促进小鼠采食量,而抑制或封闭AgRP神经元均能阻断肝素的促采食作用,由此证明,肝素主要通过激活下丘脑AgRP神经元提高小鼠采食量[32]。海带多糖是一种β-葡聚糖,也具有调节免疫机能的作用。以肠道内分泌细胞系STC-1为研究模型发现,添加10 mg/mL的海带多糖能够显著促进胰高血糖素样肽-1(glucagon-like peptide-1, GLP-1)的分泌,小鼠急性灌服1 g/kg的海带多糖在1~3 h内显著促进肠道GLP-1的分泌,进而抑制小鼠的采食量并降低血液葡萄糖水平,长期灌服则可通过抑制动物体内白色脂肪组织的合成途径和缓解胰岛素抵抗而降低试验小鼠的肥胖速度[33];另有研究表明,海参多糖也可调节胰岛素、瘦素及GLP-1的分泌,并调节肠道菌群及其代谢物[34]。最近一项研究发现,低聚果糖可以通过提高血清和肠道中的短链脂肪酸含量来降低血清脂质水平,并且抑制高脂高糖饮食引起的炎症[35],也暗示其促进采食的作用。甜菊糖是优质的天然甜味剂,提取于甜叶菊的叶子,是天然低热量的甜味剂,研究发现小鼠对浓度为0.03%~0.30%的甜菊糖溶液摄入量增多,同时此浓度下对水的饮用量最低,但是对于采食量及相关行为变化没有进一步研究[28]。魔芋粉是一种可溶性纤维,主要成分是魔芋葡甘聚糖和淀粉,其中魔芋葡甘聚糖是由葡萄糖和甘露糖构成的高分子多糖。有研究表明,妊娠母猪饲粮添加2%魔芋粉可提高母猪采食后的饱感及其泌乳期的采食量,其可能依赖的机制为在消化道前段增加饲粮水合性,延缓胃排空,在消化道后段发酵产生短链脂肪酸,促进饱感产生,并且提高血液中丁酸浓度,改善母猪泌乳期胰岛素敏感性,从而提高采食量[36]。
1.4 不同糖类通过稳态系统调控动物采食的机制异同综上所述,3种糖类通过稳态系统对采食行为的调控作用均涉及以下几个具体途径:一是添加糖类的肠道发酵后产物或糖类自身能够调节循环胰岛素水平或敏感性,从而直接调控动物采食量;二是添加糖类通过刺激肠道激素的分泌(如GLP-1)或调节肠道菌群来调控采食;三是通过调控下丘脑采食相关神经元活性,激活促采食的AgRP神经元或抑制抑采食的POMC神经元来提高采食量。现有的对单糖和双糖的研究主要集中在果糖和蔗糖,由于果糖特殊的代谢途径,摄入果糖后不会升高胰岛素水平,而摄入蔗糖则会引起胰岛素水平急性升高,从而减少了除蔗糖以外的能量摄入。而相比于单糖和双糖,多糖结构复杂,种类繁多,进入机体后的分解产物也会不同程度地影响采食,如魔芋粉发酵后产生的短链脂肪酸,会增加饱感并减少采食量,所以多糖对采食的调控相对复杂,一般会同时涉及到几个途径。
2 糖类通过奖赏系统调控动物采食 2.1 单糖对采食奖赏系统的影响Colantuoni等[37]研究发现,间歇性过度饮用25%葡萄糖溶液的小鼠10 d后饮用糖水量达初始饮用量的2倍,并且形成每天刚接触到葡萄糖溶液的第1个小时会过度饮用的习惯,伏隔核多巴胺D-1受体及中脑多巴胺递质亲和力增加,背侧纹状体中多巴胺D-2受体亲和力降低,且扣带皮层、海马、蓝斑及伏隔壳中阿片类mμ-1受体亲和力也显著增加,推测小鼠喜爱糖水的原因主要是糖水影响中脑多巴胺分泌所致;另有研究提出摄入温度可能会影响葡萄糖的奖赏效应,结果发现0 ℃下葡萄糖对腹侧被盖区血氧水平耐受影响略强于22 ℃,但差异不显著[38]。有研究表明,果糖摄入是引起流行性肥胖和代谢综合征的关键因素,并且果糖会对大脑以及学习和记忆等认知能力造成损伤[39-40]。Franco-Pérez等[41]通过把电极植入果糖添加的小鼠,发现饲粮中添加果糖增加了大鼠睡眠觉醒周期中的清醒时间,长期饲喂果糖会导致下丘脑和脑干运动能力的增加以及食欲素A和多巴胺水平的增加,这都寓意着采食奖赏行为的增加。Sclafani等[42]通过小鼠饮水添加3种含能量糖类(蔗糖、果糖、葡萄糖)和1种非能量糖(糖精)的研究证明了动物对糖的奖赏效应取决于口腔后对葡萄糖感应而不是糖类的能量多少或有无。
2.2 双糖对采食奖赏系统的影响Smail-Crevier等[43]研究发现,间歇性获得糖水(12 h)和连续获得糖水对大鼠条件性位置偏爱(CPP)形成有不同影响,除间歇性获得蔗糖组外,对照组和连续获得蔗糖组均形成对15%蔗糖溶液介导的CPP,但是所有组小鼠都可形成吗啡介导CPP,证明间歇性获得蔗糖只是减弱了蔗糖对大鼠的奖赏效应,但是没有改变刺激-奖赏关联的能力;Kreisler等[44]的研究也证明了这个观点,使小鼠间歇性获得高蔗糖食物证明小鼠暴露于高蔗糖饮食时长不同(2、4、8 h)会影响其采食及相关行为,采食高蔗糖食物时间越短,小鼠越容易形成暴食样采食,采食效率高且体重增长快。由于对肥胖的突出“贡献”,高脂高糖常常同时出现。Tenk等[45]研究发现,动物对含有高脂高蔗糖食物的摄入量明显高于单独的高脂或高蔗糖,且几乎没有性别差异;另有研究发现,高脂高蔗糖饲喂小鼠可以影响大脑中与采食和奖赏相关区域的时钟基因的表达,对小鼠进行6周的高脂高糖饲喂会打乱伏隔核和外侧下丘脑中调节睡眠-觉醒周期的基因昼夜节律蛋白2(per2)mRNA昼夜表达的差异,短期饲喂小鼠只含有高蔗糖的溶液,发现伏隔核中per2 mRNA表达上调,而与采食相关肽的mRNA表达昼夜差异没有变化[46]。对小鼠每天饲喂2 h的10%蔗糖溶液持续21 d,发现正常体重小鼠胞外多巴胺分泌量增加到基线的122%,限饲后虽然体重降为原来的85%,但是再添加蔗糖发现小鼠多巴胺分泌量增加到基线的179%,表明动物暴食糖分后,减重再进行糖分暴食会释放更多的多巴胺[47],这有助于小鼠形成采食奖赏行为;小鼠间歇性摄入8%蔗糖及其单糖组分葡萄糖和果糖会增加其产生不同程度的糖采食并对可卡因介导CPP产生不同影响,其中葡萄糖产生低水平的暴食未形成可卡因介导CPP,果糖产生高强度的暴食行为并形成了可卡因介导CPP,结果支持混合糖(如蔗糖、高果糖玉米糖浆等)的单个成分不同的参与和改变大脑中奖赏通路的猜想[48]。
2.3 多糖对采食奖赏系统的影响人参多糖是从人参中提取的一种多糖,具有激活先天免疫、调节血糖平衡、提高抗氧化能力的作用。Wang等[49]通过研究表明,小鼠饮水中添加1.5 g/L的人参多糖可以提高小鼠平均日采食量及其对高脂的偏好。这种变化是通过影响中脑多巴胺奖赏系统来实现的,并且发现小鼠的焦虑样行为减少,推测人参多糖也可能通过下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)轴来改变小鼠进食行为。
2.4 不同糖类通过奖赏系统调控动物采食的途径异同奖赏系统主要依赖中脑多巴胺系统,现有研究表明糖类可以通过刺激奖赏相关脑区多巴胺的分泌引起愉悦采食,或者影响多巴胺受体亲和力间接调控采食。个体对味道的感知很大程度上影响其对食物的欲望,所以味觉在调控采食行为方面也扮演重要角色[50]。Hajnal等[51]研究发现, 对大鼠分别以0.03、0.10、0.30 mol/L的蔗糖假饲,蔗糖摄入量及伏隔核内多巴胺浓度也随之呈梯度增多,证明了伏隔核中多巴胺与蔗糖形成的味觉刺激间的浓度依赖性奖赏效应。果糖和蔗糖均对小鼠睡眠时间产生影响,综合2种糖均为甜度较高的糖,故推测其通过口腔或肠道甜味信号传到大脑相关区域,刺激多巴胺分泌继而影响睡眠时间。相比于单糖和双糖,多糖对采食奖赏调控目前研究内容较少,研究成果也仅阐明表型,具体机制尚待研究。
3 小结与展望糖类作为生物体中提供热量的主要物质,在调控动物采食行为方面也有重要作用,对其的研究具有重要意义。综上可以得出,糖类对动物采食的调控作用主要表现在以下几方面(图 1):一是刺激下丘脑食欲中枢稳态调控相关区域,分泌AgRP、POMC和NPY等调控动物采食;二是引起中脑边缘系统的奖赏效应,动物分泌了多巴胺从而促进愉悦采食;三是通过调控胃肠道及肝脏等外周分泌并改变肠道菌群来调控采食。每种糖由于其味道、结构、能量值甚至质地等的不同,对于采食调控的具体机制也不尽相同。目前研究主要集中在果糖和蔗糖等常见的糖对于稳态采食的调控机制,而关于它们通过奖赏系统某个区域调控动物采食的具体机制通路研究尚浅。多糖种类繁多,很多植物中或存在特定的多糖,如果能够通过研究筛选出能够提高采食量的植物多糖,可以替代添加剂,直接作为饲料原料,将大大节约养殖成本。目前关于一些复杂的多糖在畜禽养殖中的应用报道尚且较少,有关这些问题有必要在以后的研究中深入探讨,发挥出糖类在畜禽养殖甚至人类健康中的价值。
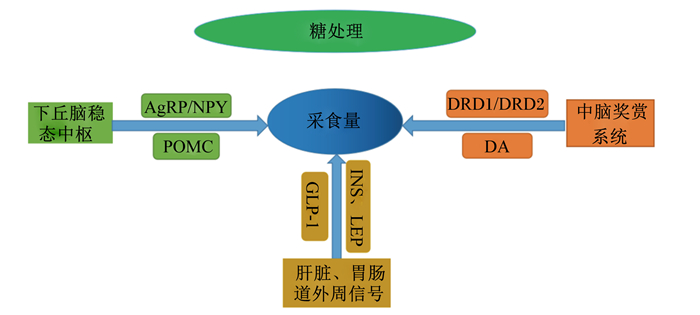
|
AgRP:刺鼠相关蛋白agouti-related peptide;NPY:神经肽Y neuropeptide-Y;POMC:促黑素皮质素pro-opiomelanocortin;DA:多巴胺dopamine;DRD1/DRD2:多巴胺受体D1/D2 dopamine receptor D1/D2;INS:胰岛素insulin;LEP:瘦素leptin;GLP-1:胰高血糖素样肽-1 glucagon-like peptide-1。 图 1 糖类调控动物采食途径 Fig. 1 Ways of sugars regulating animal feeding |
| [1] |
HAN P F, MOHEBBI M, SEO H S, et al. Sensitivity to sweetness correlates to elevated reward brain responses to sweet and high-fat food odors in young healthy volunteers[J]. Neuroimage, 2020, 208: 116413. DOI:10.1016/j.neuroimage.2019.116413 |
| [2] |
ELLIOTT S S, KEIM N L, STERN J S, et al. Fructose, weight gain, and the insulin resistance syndrome[J]. The American Journal of Clinical Nutrition, 2002, 76(5): 911-922. DOI:10.1093/ajcn/76.5.911 |
| [3] |
BOCARSLY M E, POWELL E S, AVENA N M, et al. High-fructose corn syrup causes characteristics of obesity in rats:increased body weight, body fat and triglyceride levels[J]. Pharmacology Biochemistry and Behavior, 2010, 97(1): 101-106. DOI:10.1016/j.pbb.2010.02.012 |
| [4] |
LIU J J, MUKHERLEE D, HARITAN D, et al. High on food:the interaction between the neural circuits for feeding and for reward[J]. Frontiers in Biology, 2015, 10(2): 165-176. |
| [5] |
SUZUKI K, SIMPSON K A, MINNION J S, et al. The role of gut hormones and the hypothalamus in appetite regulation[J]. Endocrine Journal, 2010, 57(5): 59-72. |
| [6] |
ESSNER R A, SMITH A G, JAMNIK A A, et al. AgRP neurons can increase food intake during conditions of appetite suppression and inhibit anorexigenic parabrachial neurons[J]. The Journal of Neuroscience, 2017, 37(36): 8678-8687. DOI:10.1523/JNEUROSCI.0798-17.2017 |
| [7] |
WISE R A. Role of brain dopamine in food reward and reinforcement[J]. Philosophical Transactions of the Royal Society B:Biological Sciences, 2006, 361(1471): 1149-1158. DOI:10.1098/rstb.2006.1854 |
| [8] |
李永祥, 王嘉雯, 江青艳, 等. 采食的奖赏性调节及其机制[J]. 中国畜牧杂志, 2018, 54(9): 10-15. |
| [9] |
BERTHOUD H R, MORRISON C. The brain, appetite, and obesity[J]. Annual Review of Psychology, 2008, 59: 55-92. DOI:10.1146/annurev.psych.59.103006.093551 |
| [10] |
李万华. 糖类添加剂在生猪生产中的应用[J]. 山东畜牧兽医, 2013, 34(6): 84. |
| [11] |
孙克年. 糖类添加剂在养鸡生产中应用[J]. 中国禽业导刊, 1998(1): 14. |
| [12] |
MA X S, ZUBCEVIC L, ASHCROFT F M. Glucose regulates the effects of leptin on hypothalamic POMC neurons[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(28): 9811-9816. DOI:10.1073/pnas.0800952105 |
| [13] |
COLLEY D, CASTONGUAY T W. Effects of sugar solutions on hypothalamic appetite regulation[J]. Physiology & Behavior, 2015, 139: 202-209. |
| [14] |
沈福良, 施全林, 王利文, 等. 高营养水平日粮添加葡萄糖对高温应激哺乳母猪繁殖性能和产仔性能的影响[J]. 中国饲料, 2020(4): 91-94. |
| [15] |
杨久仙, 张荣飞, 马秋刚, 等. 葡萄糖氧化酶对断奶仔猪生长性能及肠道健康的影响[J]. 中国畜牧兽医, 2011, 38(6): 18-21. |
| [16] |
于娟, 庄明, 杨景晁, 等. 饮水添加葡萄糖氧化酶对肉鸡生产性能的影响[J]. 家禽科学, 2019(4): 25-8. |
| [17] |
SHAPIRO A, MU W, RONCAL C, et al. Fructose-induced leptin resistance exacerbates weight gain in response to subsequent high-fat feeding[J]. American Journal of Physiology:Regulatory, Integrative and Comparative Physiology, 2008, 295(5): R1370-R1375. DOI:10.1152/ajpregu.00195.2008 |
| [18] |
LÊ K A, TAPPY L. Metabolic effects of fructose[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2006, 9(4): 469-475. DOI:10.1097/01.mco.0000232910.61612.4d |
| [19] |
TEFF K L, ELLIOTT S S, TSCHÖP M, et al. Dietary fructose reduces circulating insulin and leptin, attenuates postprandial suppression of ghrelin, and increases triglycerides in women[J]. The Journal of Clinical Endocrinology & Metabolism, 2004, 89(6): 2963-2972. |
| [20] |
JIAO G F, ZHANG G Z, WANG H Y, et al. Glucose intake alters expression of neuropeptides derived from proopiomelanocortin in the lateral hypothalamus and the nucleus accumbens in fructose preference rats[J]. Neural Plasticity, 2017, 2017: 1-7. |
| [21] |
马红艳, 姚毅, 赵辉. 日粮添加α-半乳糖苷酶对断奶仔猪生长性能、养分消化率、肠道形态和消化酶活力的影响[J]. 中国饲料, 2018(14): 66-70. |
| [22] |
高木珍, 王俊菊, 史艳艳, 等. α-半乳糖苷酶对肉鸡生产性能、表观消化率和肠道菌群的影响[J]. 天津农业科学, 2020, 26(2): 58-61. |
| [23] |
BAE Y J, BAK Y K, KIM B, et al. Coconut-derived D-xylose affects postprandial glucose and insulin responses in healthy individuals[J]. Nutrition Research and Practice, 2011, 5(6): 533-539. DOI:10.4162/nrp.2011.5.6.533 |
| [24] |
LIM E, LIM J Y, SHIN J H, et al. D-xylose suppresses adipogenesis and regulates lipid metabolism genes in high-fat diet-induced obese mice[J]. Nutrition Research, 2015, 35(7): 626-636. DOI:10.1016/j.nutres.2015.05.012 |
| [25] |
孟宪生. 日粮中添加蔗糖饲喂生长肥育猪的增重效果[J]. 当代畜牧, 2002(2): 41-42. |
| [26] |
HIGGINS K A, MATTES R D. A randomized controlled trial contrasting the effects of 4 low-calorie sweeteners and sucrose on body weight in adults with overweight or obesity[J]. The American Journal of Clinical Nutrition, 2019, 109(5): 1288-1301. DOI:10.1093/ajcn/nqy381 |
| [27] |
VAN ENGELEN M, KHODABANDEH S, AKHAVAN T, et al. Effect of sugars in solutions on subjective appetite and short-term food intake in 9- to 14-year-old normal weight boys[J]. European Journal of Clinical Nutrition, 2014, 68(7): 773-777. DOI:10.1038/ejcn.2014.33 |
| [28] |
YIN K J, XIE D Y, ZHAO L, et al. Effects of different sweeteners on behavior and neurotransmitters release in mice[J]. Journal of Food Science and Technology, 2020, 57(1): 113-121. |
| [29] |
TEY S L, SALLEH N B, HENRY J, et al. Effects of aspartame-, monk fruit-, stevia- and sucrose-sweetened beverages on postprandial glucose, insulin and energy intake[J]. International Journal of Obesity, 2017, 41(3): 450-457. DOI:10.1038/ijo.2016.225 |
| [30] |
SØBERG S, SANDHOLT C H, JESPERSEN N Z, et al. FGF21 is a sugar-induced hormone associated with sweet intake and preference in humans[J]. Cell Metabolism, 2017, 25(5): 1045-1053. DOI:10.1016/j.cmet.2017.04.009 |
| [31] |
吕路芳, 谢文惠, 姜宁, 等. 乳果糖生产方法及其在肉鸡生产中的应用[J]. 中国饲料, 2018(19): 15-19. |
| [32] |
ZHU C J, XU P W, HE Y L, et al. Heparin increases food intake through AgRP neurons[J]. Cell Reports, 2017, 20(10): 2455-2467. DOI:10.1016/j.celrep.2017.08.049 |
| [33] |
YANG L S, WANG L N, ZHU C J, et al. Laminarin counteracts diet-induced obesity associated with glucagon-like peptide-1 secretion[J]. Oncotarget, 2017, 8(59): 99470-99481. DOI:10.18632/oncotarget.19957 |
| [34] |
ZHAO F Q, LIU Q B, CAO J, et al. A sea cucumber (Holothuria leucospilota) polysaccharide improves the gut microbiome to alleviate the symptoms of type 2 diabetes mellitus in Goto-Kakizaki rats[J]. Food and Chemical Toxicology, 2020, 135: 110886. DOI:10.1016/j.fct.2019.110886 |
| [35] |
YU R Q, YIN Y X, CAO M K, et al.Fructo-oligosaccharides lower serum lipid levels and suppress high-fat/high-sugar diet-induced inflammation by elevating serum and gut levels of short-chain fatty acids[J/OL].The Journal of International Medical Research, 2019, doi: 10.1177/0300060519896714.
|
| [36] |
孙海清.母猪妊娠日粮中可溶性纤维调控泌乳期采食量的机制及改善母猪繁殖性能的作用[D].博士学位论文.武汉: 华中农业大学, 2013.
|
| [37] |
COLANTUONI C, SCHWENKER J, MCCARTHY J, et al. Excessive sugar intake alters binding to dopamine and mu-opioid receptors in the brain[J]. Neuroreport, 2001, 12(16): 3549-3552. DOI:10.1097/00001756-200111160-00035 |
| [38] |
VAN OPSTAL A M, VAN DEN BERG-HUYSMANS A A, HOEKSMA M, et al. The effect of consumption temperature on the homeostatic and hedonic responses to glucose ingestion in the hypothalamus and the reward system[J]. The American Journal of Clinical Nutrition, 2018, 107(1): 20-25. DOI:10.1093/ajcn/nqx023 |
| [39] |
CHONG C P, SHAHAR S, HARON H, et al. Habitual sugar intake and cognitive impairment among multi-ethnic Malaysian older adults[J]. Clinical Interventions in Aging, 2019(14): 1331-1342. |
| [40] |
ROSS A P, BARTNESS T J, MIELKE J G, et al. A high fructose diet impairs spatial memory in male rats[J]. Neurobiology of Learning and Memory, 2009, 92(3): 410-416. DOI:10.1016/j.nlm.2009.05.007 |
| [41] |
FRANCO-PÉREZ J, MANJARREZ-MARMOLEJO J, BALLESTEROS-ZEBADÚA P, et al. Chronic consumption of fructose induces behavioral alterations by increasing orexin and dopamine levels in the rat brain[J]. Nutrients, 2018, 10(11): 1722. DOI:10.3390/nu10111722 |
| [42] |
SCLAFANI A, ZUKERMAN S, ACKROFF K. Postoral glucose sensing, not caloric content, determines sugar reward in C57BL/6J mice[J]. Chemical Senses, 2015, 40(4): 245-258. DOI:10.1093/chemse/bjv002 |
| [43] |
SMAIL-CREVIER R L, MARACLE A C, WASH S I J, et al. Binge-like intake of sucrose reduces the rewarding value of sucrose in adult rats[J]. Physiology & Behavior, 2018, 194: 420-429. |
| [44] |
KREISLER A D, MATTOCK M, ZORRILLA E P. The duration of intermittent access to preferred sucrose-rich food affects binge-like intake, fat accumulation, and fasting glucose in male rats[J]. Appetite, 2018, 130: 59-69. DOI:10.1016/j.appet.2018.07.025 |
| [45] |
TENK C M, FELFELI T. Sucrose and fat content significantly affects palatable food consumption in adolescent male and female rats[J]. Appetite, 2017, 118: 49-59. DOI:10.1016/j.appet.2017.07.016 |
| [46] |
BLANCAS-VELAZQUEZ A S, UNMEHOPA U A, EGGELS L, et al. A free-choice high-fat high-sugar diet alters day-night Per2 gene expression in reward-related brain areas in rats[J]. Frontiers in Endocrinology, 2018, 9: 154. DOI:10.3389/fendo.2018.00154 |
| [47] |
AVENA N M, RADA R, HOEBEL B G. Underweight rats have enhanced dopamine release and blunted acetylcholine response in the nucleus accumbens while bingeing on sucrose[J]. Neuroscience, 2008, 156(4): 865-871. DOI:10.1016/j.neuroscience.2008.08.017 |
| [48] |
RORABAUGH J M, STRATFORD J M, ZAHNISER N R. Differences in bingeing behavior and cocaine reward following intermittent access to sucrose, glucose or fructose solutions[J]. Neuroscience, 2015, 301: 213-220. DOI:10.1016/j.neuroscience.2015.06.015 |
| [49] |
WANG J W, LI Y X, LUO P, et al. Oral supplementation with ginseng polysaccharide promotes food intake in mice[J]. Brain and Behavior, 2019, 9(9): e1340. |
| [50] |
LOW Y, LACY K, KEAST R. The role of sweet taste in satiation and satiety[J]. Nutrients, 2014, 6(9): 3431-3450. DOI:10.3390/nu6093431 |
| [51] |
HAJNAL A, SMITH G P, NORGREN R. Oral sucrose stimulation increases accumbens dopamine in the rat[J]. American Journal of Physiology:Regulatory, Integrative and Comparative Physiology, 2004, 286(1): R31-R37. DOI:10.1152/ajpregu.00282.2003 |




