氧气是人类和动物维持生命活动的重要条件,氧气在机体内的代谢产物除了通过还原生成水,还有1%~3%可通过电子传输转变为氧自由基及其活性衍生物,即活性氧(reactive oxygen species,ROS)。生理状态下,自由基的产生与清除处于适当的动态平衡以适应内外环境的变化[1]。当氧气供应不足,机体处于低氧状态下时,ROS过量产生,自由基稳衡态失衡,会发生低氧应激。根据发生低氧的动物与环境因素变化,动物低氧应激可分为3类:1)环境低氧,即外界环境中氧含量不足,机体不能摄取足够氧以维持正常的生理活动;2)病理低氧,由于疾病等引起某些生理障碍,到达动物体内部器官组织的氧气不足,造成机体应激与损伤,引起机体组织处于低氧状态;3)代谢低氧,旺盛的代谢活动引起生命活动所需耗氧量显著增加,超过机体正常生理动员能力,使机体组织处于低氧状态[2]。
低氧可激活低氧诱导因子(hypoxia-inducible factor,HIF)-1的表达。HIF-1是由α和β亚基组成的异二聚体转录因子,可介导多种细胞关键信号并调节相应的生物学功能。研究发现,低氧或缺氧状态可使HIF-1α和HIF复合物稳定,并使HIF复合物易位到细胞核中以启动相关靶基因表达[3],以此维持低氧状态下组织生理正常,例如乳腺增强葡萄糖摄取[4]、调整糖代谢途径[5]等。
低氧环境下机体的多种生理机制可促使细胞存活并适应低氧,维持自由基稳衡态。线粒体是氧的主要消耗者,也是活性氧的主要来源。在低氧条件下,它们交换或修饰呼吸链上不同的亚基,调整它们的新陈代谢,通过新生和自噬,控制它们的总量和代谢平衡[6]。HIF-1激活参与降低线粒体ROS的产生,保护线粒体免受损伤,线粒体生物合成的增加可能是线粒体抵御低氧应激的新策略[7]。本文主要从HIF-1适应性转录调节和线粒体功能变化角度,综述动物的低氧应激及其作用机制。
1 低氧应激的分类如前所述,动物的低氧应激可分为环境低氧、病理低氧和代谢低氧3种类型。
环境低氧是指动物处于氧含量不足的环境中(例如高原地区、地下矿井等),无法摄取足够的氧以满足正常生理活动所需。研究发现,处于高原地区的荷斯坦奶牛,可通过上调急性期反应,激活肝脏X受体(LXR)/类视黄醇X受体(RXR)和法尼酯衍生物X受体(FXR)/RXR信号通路,从而调节免疫稳态,使其适应高原低氧[8]。处于高海拔地区的拉达克牛群研究发现,外周血单个核细胞中HIF-1及其调控基因,即葡萄糖转运蛋白(GLUT)1、血管内皮生长因子和己糖激酶等表达增加,提示这些适应性调节在高海拔低氧应激时维持细胞稳态的重要性[9]。比较研究发现,处于高原地区的牦牛其垂体和输卵管中HIF-1α和HIF-2α mRNA表达水平均高于低海拔地区肉牛,这种调节机制使牦牛的繁殖功能更好地适应高海拔低氧环境[10]。
动物在疾病状态下,由于外界到达机体器官内的正常氧量不足,从而造成心脏、大脑和呼吸系统等的氧供应缺乏,严重时可发生低氧应激,即病理低氧,如炎症[11]、肿瘤[12]、心脑血管疾病[13]等。病理组织由于血栓可引起血管阻塞,组织静水压增加引起血管压缩,或组织细胞密度增加等原因会引起低氧。组织低氧通常通过脉管系统的重塑介导对疾病进展产生影响,例如血管生成和组织特异性血管结构的丧失等[14]。血液循环障碍会降低氧的输送,导致组织低氧,这种低氧现象在动脉粥样硬化、肺动脉高压和心力衰竭等心血管疾病中都会发生[15]。此外,氧气不足在肿瘤的休眠和代谢中起着重要作用,可增加干细胞活性,导致肿瘤的发生和发展[16]。
当动物过量运动或者剧烈代谢情况下,机体所需耗氧量超过生理动员能力,造成氧供给相对不足,从而导致组织代谢改变,可发生代谢低氧。例如,剧烈运动的骨骼肌、代谢紊乱的脂肪组织、高产泌乳的乳腺等,严重低氧可能危及动物生命。研究表明,运动过程中的骨骼肌耗氧量增加,会激活HIF-1表达,从而诱导参与血管生成和糖酵解的基因表达。HIF-1也可能抑制细胞耗氧量和线粒体的氧化代谢,使骨骼肌适应长期的有氧运动[17]。低氧可明显抑制肥胖动物脂肪细胞的胰岛素作用,增加脂肪分解和细胞死亡,促进脂肪细胞释放游离脂肪酸,抑制葡萄糖摄取[18]。有证据表明,在乳腺发育和泌乳过程中氧消耗量增加时可引起局部慢性低氧。在泌乳盛期奶牛的乳腺细胞,可通过增加GLUT1表达和HIF-1α依赖性的葡萄糖摄取来响应可能出现的低氧状态,也可通过非HIF-1α依赖性的GLUT8表达途径响应乳腺的低氧状态[4]。此外,我们前期研究发现,当奶山羊乳腺中的葡萄糖供给不足时,乳腺中低氧通路可被miR-19激活,进而出现ROS大量积累和乳腺细胞凋亡等现象[19],这与前人报道的生物在高原的低氧适应机制与葡萄糖代谢模式改变有关等结果[20]一致。基于这些结果,低氧效应成为乳腺发育和哺乳期调节的前沿性研究课题。
2 低氧应激与HIF-1的表达低氧应激可以引起细胞活力丧失、自噬、凋亡等现象,同时伴随着相关细胞器(如线粒体和内质网等)损伤[21]。研究发现,HIF-1α可能通过促进神经元细胞自噬的激活,导致低氧和缺血引起脑损伤[22];HIF-1α的适当表达可以减少与低氧相关的小胶质细胞的自噬细胞死亡[23],激活HIF-1α可通过与核因子-κB(NF-κB)等基因共表达,激活巨噬细胞、中性粒细胞等免疫细胞功能[24]。化学性低氧诱导的神经元凋亡是由早期HIF-1α稳定和后期内质网应激激活所调节的过程[25],内质网应激也是HIF-1活性的新诱因[26]。低氧预处理诱导HIF-1α在肝脏缺血/再灌注损伤下促进葡萄糖代谢并保护线粒体[27]。这些研究结果提示,HIF-1是机体低氧应激启动的关键分子。
HIF-1是Semenza等[28]研究促红细胞生成素(EPO)时发现的一种蛋白质复合物,广泛存在于慢性低氧细胞中,结合点位于EPO的3′端增强子第1部分,由50个左右核苷酸组成,是细胞在低氧条件下的关键调控蛋白质。HIF-1由2个亚基组成:氧敏感性HIF-1α与组成型活性HIF-1β[现已被克隆和描述为芳香烃受体核转运蛋白(aryl hydrocarbon receptor nuclear translocator,ARNT)]。HIF-1活性主要取决于细胞内HIF-1α的蛋白质水平,该水平与氧浓度成反比[14]。如图 1所示,当氧气充足(常氧状态)时,HIF-1α亚基在二价铁离子(Fe2+)存在情况下被脯氨酰羟化酶域(prolyl hydroxylase domain,PHD)蛋白羟基化,并被E3泛素连接酶希佩尔-林道蛋白(Von Hippel-Lindau protein,VHL)重新编码,导致亚基的立即泛素化,随后被蛋白酶体降解;当氧气不足(低氧状态)时,PHD活性降低,VHL无法识别未羟基化的HIF-1α。此时,HIF-1α被稳定下来,并与细胞核中的ARNT发生异二聚体化,形成HIF复合物,并与基因组中的缺氧反应元件(hypoxia response elements,HRE)结合,再与转录共激活因子[以E1A相关的300 ku蛋白(p300)/环磷酸腺苷反应元件结合蛋白(CREB)的结合蛋白(CBP)为例]相互作用,使特定的靶基因恢复转录活性,激活低氧适应相关基因的表达[29]。HIF-1的靶基因通过EPO介导红细胞生成,通过血管内皮生长因子诱导血管生成,从而增加氧气运输;或通过增加GLUT和糖酵解酶表达,在低氧状态下改善组织功能[30]。
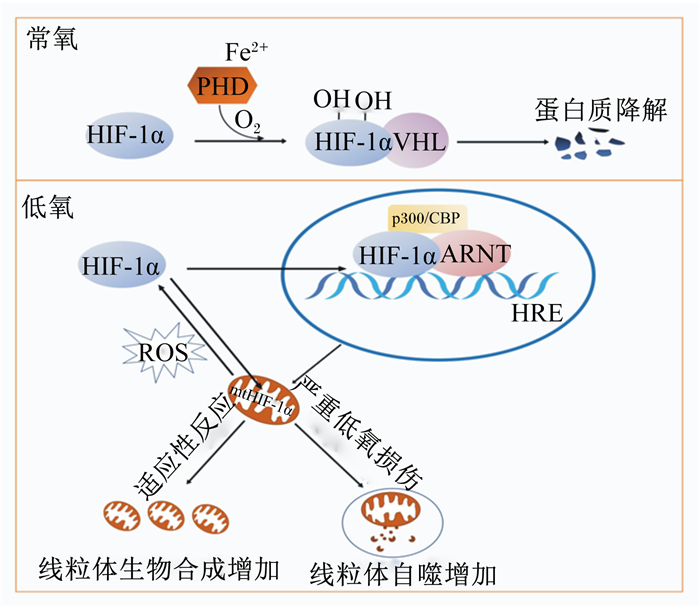
|
Fe2+:二价铁离子divalent iron ion;PHD:脯氨酰羟化酶域prolyl hydroxylase domain;O2:氧气oxygen;HIF-1α:低氧诱导因子-1α hypoxia-inducible factor-1α;VHL:希佩尔-林道蛋白Von Hippel-Lindau protein;ARNT:芳香烃受体核转运蛋白aryl hydrocarbon receptor nuclear translocator;HRE:缺氧反应元件hypoxia response elements;p300:E1A相关的300 ku蛋白E1A related 300 ku protein;CBP:环磷酸腺苷反应元件结合蛋白(CREB)的结合蛋白cAMP response element binding protein (CREB) binding protein;ROS:活性氧reactive oxygen species;mtHIF-1α:低氧诱导因子-1α亚群hypoxia-inducible factor-1α subgroup。 图 1 HIF-1感知氧气以及调控线粒体生物合成过程 Fig. 1 Processes for HIF-1 to sense oxygen and to regulate mitochondrial biosynthesis |
线粒体是细胞中耗氧量最大的细胞器,是细胞能量产生的动力源,线粒体本身也是氧感应的重要参与者,因此线粒体对胞内氧气浓度的敏感性很强。已有研究表明,线粒体是胞内ROS的主要来源[6],线粒体ROS的生成主要发生在氧化磷酸化过程中位于线粒体内膜的电子传递链上,电子传递链在复合物Ⅰ和复合物Ⅲ处的电子泄漏导致氧部分还原形成超氧化物。随后,超氧化物通过线粒体基质中的超氧化物歧化酶2和线粒体膜间隙中的超氧化物歧化酶1迅速转化为过氧化氢,在过氧化氢酶的作用下还原为水。在这个过程中产生的超氧化物和过氧化氢统称为线粒体ROS,超氧化物歧化酶和过氧化氢酶等抗氧化酶属于机体防御性抗氧化系统的一部分[31]。生理情况下,ROS的产生与清除防御系统处于动态平衡状态,适当的ROS可起到信号传导、调控细胞功能等生理作用;当ROS生成超过清除防御系统时,积累的ROS会损伤蛋白质、脂质、核酸等生物大分子,严重损伤的细胞可通过凋亡途径被清除[1]。研究发现,当细胞氧浓度偏低时,线粒体电子无法与受体氧充分结合,呼吸链中的氧与电子流之间将失去平衡,导致电子积累并泄漏,同时细胞防御系统如抗氧化酶等活性下降,造成呼吸链复合物中ROS生成过量,无法被及时清除,从而导致细胞DNA损伤、线粒体脂质过氧化、钙离子稳态破坏以及线粒体膜去极化等,使细胞功能发生障碍甚至死亡[32]。
为了减少ROS带来的损伤,线粒体主要通过融合和分裂、自噬和代谢改变适应低氧以维持稳态。研究发现,ROS增加可增强细胞外信号调节蛋白激酶(ERK)和磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)的信号途径,从而通过p70核糖体蛋白S6激酶1(p70S6K1)、真核翻译起始因子4E结合蛋白1(4E-BP1)、Rac1、组蛋白去乙酰化酶(HDAC)和哺乳动物雷帕霉素靶蛋白(mTOR)等调控因子诱导HIF-1蛋白合成[33]。HIF-1可激活B细胞淋巴瘤-2/腺病毒E1B相互作用蛋白3(BNIP3)蛋白表达,同时Beclin-1和重组人自体吞噬相关蛋白5(Atg5)蛋白以不依赖于HIF-1的方式表达,诱导线粒体自噬,清除损伤或有害的线粒体,避免ROS继续产生[34]。同时,HIF-1可通过直接激活编码乳酸脱氢酶A、丙酮酸脱氢酶激酶1、BNIP3、细胞色素C氧化酶亚基4-2、线粒体蛋白酶LON和miR-210靶基因的转录,调节氧化代谢和糖酵解间的平衡,降低ROS产生[35]。Li等[32]研究发现,HIF-1对线粒体功能调节并完全不依赖于传统认为的HIF-1核易位,一小部分HIF-1α亚群(称为mtHIF-1α)能以高度可重复的方式转运到线粒体,独立于其向核的转运而发生,不需要转录活性,提示mtHIF-1α可能是深入研究低氧应激抵御机制的新思路,即HIF-1α功能并不总是涉及其转录活性,可能发生在细胞核外的亚细胞。
研究发现,新的线粒体在细胞分裂之前合成,用以取代被自噬清除的受损或有害线粒体,这一过程称为“线粒体生物合成”[7],可以控制线粒体的更新、含量和数量,维持能量代谢和氧化还原反应的平衡。在炎症、低温、低氧等应激条件下,线粒体生物合成会增加,一方面满足能量供应的需求,另一方面减少胞内ROS累积,保证细胞功能稳定,维持细胞在应激等环境下的稳态[36]。通过在大鼠中用氯化钴(CoCl2)进行低氧处理,可增加骨骼肌中内皮型一氧化氮合成酶(eNOS)表达和一氧化氮产生,进而导致过氧化物酶体增殖物激活受体γ共激活因子-1α(PGC-1α)表达增加;PGC-1α可协调负责线粒体生物合成的基因,增加骨骼肌中线粒体生成、葡萄糖摄取和有氧呼吸引起的代谢,从而导致增强机体机能[37]。也有研究发现,在非泌乳奶牛中,局部低氧伴随着脂肪细胞的生长,通过血管新生、重构和增加线粒体DNA拷贝数增加线粒体生物合成,以补偿低氧状态[38]。在环境低氧下,机体可通过PGC-1α/雌激素受体相关受体α(ERRα)/线粒体融合基因2(Mfn2)轴调节,增加线粒体DNA拷贝数,提高线粒体氧化磷酸化水平,增加线粒体生物合成,以适应低氧[39]。慢性低氧暴露条件下低氧运动能够促进骨骼肌线粒体自噬,有效清除受损线粒体,促进线粒体生物合成,产生健康线粒体,维持线粒体数量阈值和功能,提高机体适应力[40]。病理低氧时,线粒体生物合成可能通过上调ROS清除系统(线粒体解偶联蛋白、超氧化物歧化酶2和谷胱甘肽过氧化物酶1),增强对缺血性损伤的心脏耐受性[41]。也有研究发现,当动物处于长期严重低氧损伤时,额外的线粒体生物合成和耗氧只会加剧细胞压力,此时HIF信号传导通常会降低线粒体总数量[7]。
Rabinovitch等[42]发现,线粒体ROS是磷酸腺苷活化蛋白激酶(AMPK)的生理激活剂,AMPK激活会触发PGC-1α依赖的线粒体生物合成增加,从而限制线粒体ROS产生。这些数据表明,调控线粒体生物合成也许是增强机体耐受低氧损伤的可能策略,但其与线粒体自噬之间相平衡的调节机制仍有待阐明。
4 小结低氧是动物面临环境、疾病、代谢变化的重要应激源,通过破坏自由基稳态诱发低氧应激,导致机体基因转录、信号传导、细胞凋亡、组织器官功能等一系列生理或病理变化,HIF-1是参与低氧补偿机制的关键转录因子。线粒体是细胞感应氧气、产生能量的关键场所,其功能改变可决定细胞的命运。低氧应激可导致线粒体中ROS增加,损害细胞功能,而HIF-1的激活通过多种机制调控线粒体的总量和能量代谢水平,降低ROS产生以保护线粒体功能。同时,增加线粒体生物合成可能是线粒体抵御低氧应激、提高机体适应性的重要过程。
现代集约化养殖业促进了畜牧生产力的提升,但也容易导致家畜出现多种应激和代谢性疾病,例如泌乳盛期时的奶牛乳腺面临低氧应激损害,出现代谢紊乱和一系列健康风险。而低氧应激仍是一个复杂且尚未完全了解的过程,细胞对低氧的反应可能由于细胞类型、低氧程度的不同而有所差异,但目前对低氧应激的阈值(氧分压)、低氧处理的时间(持续时间和/或间隔时间)等都尚未有明确的定义。线粒体动力学和数量控制在维持细胞增殖和凋亡平衡中起着核心作用。然而,这种平衡背后的分子机制仍然未知。深入研究低氧应激条件下HIF的调节与线粒体结构与功能变化,将为防治高原反应和代谢性疾病提供潜在靶点。
| [1] |
方允中, 顾景范, 郭长江. 自由基营养学[M]. 北京: 科学出版社, 2019: 20-30.
|
| [2] |
周兆年. 低氧与健康研究[J]. 中国基础科学, 2003(5): 20-25. |
| [3] |
SCHOEPFLIN Z R, SHAPIRO I M, RISBUD M V. Class Ⅰ and Ⅱa HDACs mediate HIF-1α stability through PHD2-dependent mechanism while HDAC6, a class Ⅱb member, promotes HIF-1α transcriptional activity in nucleus pulposus cells of the intervertebral disc[J]. Journal of Bone and Mineral Research, 2016, 31(6): 1287-1299. DOI:10.1002/jbmr.2787 |
| [4] |
SHAO Y, ZHAO F Q. Emerging evidence of the physiological role of hypoxia in mammary development and lactation[J]. Journal of Animal Science and Biotechnology, 2014, 5: 9. DOI:10.1186/2049-1891-5-9 |
| [5] |
PRABHAKAR N R, SEMENZA G L. Adaptive and maladaptive cardiorespiratory responses to continuous and intermittent hypoxia mediated by hypoxia-inducible factors 1 and 2[J]. Physiological Reviews, 2012, 92(3): 967-1003. DOI:10.1152/physrev.00030.2011 |
| [6] |
FUHRMANN D C, BRVNE B. Mitochondrial composition and function under the control of hypoxia[J]. Redox Biology, 2017, 12: 208-215. DOI:10.1016/j.redox.2017.02.012 |
| [7] |
THOMAS L W, ASHCROFT M. Exploring the molecular interface between hypoxia-inducible factor signalling and mitochondria[J]. Cellular and Molecular Life Sciences, 2019, 76(9): 1759-1777. DOI:10.1007/s00018-019-03039-y |
| [8] |
KONG Z W, ZHOU C S, CHEN L, et al. Multi-omics analysis reveals up-regulation of APR signaling, LXR/RXR and FXR/RXR activation pathways in Holstein dairy cows exposed to high-altitude hypoxia[J]. Animals, 2019, 9(7): 406. DOI:10.3390/ani9070406 |
| [9] |
VERMA P, SHARMA A, SODHI M, et al. Overexpression of genes associated with hypoxia in cattle adapted to trans Himalayan region of Ladakh[J]. Cell Biology International, 2018, 42(9): 1141-1148. DOI:10.1002/cbin.10981 |
| [10] |
HE X D, XIA Y, JIGE M T, et al. Adaptive response of reproduction to high-altitude hypoxic stress by altering mRNA expression of hypoxia-inducible factors in female yaks (Bos grunniens)[J]. Animal Biotechnology, 2019, 5: 1-3. |
| [11] |
ELTZSCHIG H K, CARMELIET P. Hypoxia and inflammation[J]. New England Journal of Medicine, 2011, 364(7): 656-665. DOI:10.1056/NEJMra0910283 |
| [12] |
HEDDLESTON J M, LI Z, LATHIA J D, et al. Hypoxia inducible factors in cancer stem cells[J]. British Journal of Cancer, 2010, 102(5): 789-795. DOI:10.1038/sj.bjc.6605551 |
| [13] |
SAVLA J J, LEVINE B D, SADEK H A. The effect of hypoxia on cardiovascular disease:friend or foe?[J]. High Altitude Medicine & Biology, 2018, 19(2): 124-130. |
| [14] |
IKEDA E. Cellular response to tissue hypoxia and its involvement in disease progression[J]. Pathology International, 2005, 55(10): 603-610. DOI:10.1111/j.1440-1827.2005.01877.x |
| [15] |
ABE H, SEMBA H, TAKEDA N. The roles of hypoxia signaling in the pathogenesis of cardiovascular diseases[J]. Journal of Atherosclerosis and Thrombosis, 2017, 24(9): 884-894. DOI:10.5551/jat.RV17009 |
| [16] |
PEZZUTO A, CARICO E. Role of HIF-1 in cancer progression:novel insights.A review[J]. Current Molecular Medicine, 2018, 18(6): 343-351. |
| [17] |
LINDHOLM M E, RUNDQVIST H. Skeletal muscle hypoxia-inducible factor-1 and exercise[J]. Experimental Physiology, 2015, 101(1): 28-32. |
| [18] |
YIN J, GAO Z G, HE Q, et al. Role of hypoxia in obesity-induced disorders of glucose and lipid metabolism in adipose tissue[J]. American Journal of Physiology:Endocrinology and Metabolism, 2008, 296(2): E333-E342. |
| [19] |
CAI J, WANG D M, LIANG S L, et al. Excessive supply of glucose elicits an NF-κB2-dependent glycolysis in lactating goat mammary glands[J]. FASEB Journal, 2020. DOI:10.1096/fj.201903088R |
| [20] |
DING D, LIU G J, HOU L, et al. Genetic variation in PTPN1 contributes to metabolic adaptation to high-altitude hypoxia in Tibetan migratory locusts[J]. Nature Communications, 2018, 9: 4991. DOI:10.1038/s41467-018-07529-8 |
| [21] |
JIN X L, WANG K, LIU H Y, et al. Protection of bovine mammary epithelial cells from hydrogen peroxide-induced oxidative cell damage by resveratrol[J]. Oxidative Medicine and Cellular Longevity, 2016, 2016: 2572175. |
| [22] |
NIU G H, ZHU D N, ZHANG X L, et al. Role of hypoxia-inducible factors 1α (HIF1α) in SH-SY5Y cell autophagy induced by oxygen-glucose deprivation[J]. Medical Science Monitor, 2018, 24: 2758-2766. DOI:10.12659/MSM.905140 |
| [23] |
WANG X T, MA J, FU Q, et al. Role of hypoxia-inducible factor-1α in autophagic cell death in microglial cells induced by hypoxia[J]. Molecular Medicine Reports, 2017, 15(4): 2097-2105. DOI:10.3892/mmr.2017.6277 |
| [24] |
D'IGNAZIO L, BANDARRA D, ROCHA S. NF-κB and HIF crosstalk in immune responses[J]. FEBS Journal, 2016, 283(3): 413-424. DOI:10.1111/febs.13578 |
| [25] |
LÓPEZ-HERNÁNDEZ B L, CEÑA V, POSADAS I. The endoplasmic reticulum stress and the HIF-1 signaling pathways are involved in the neuronal damage caused by chemical hypoxia[J]. British Journal of Pharmacology, 2015, 172(11): 2838-2851. DOI:10.1111/bph.13095 |
| [26] |
BELAIDI E, THOMAS A, BOURDIER G, et al. Endoplasmic reticulum stress as a novel inducer of hypoxia inducible factor-1 activity:its role in the susceptibility to myocardial ischemia-reperfusion induced by chronic intermittent hypoxia[J]. International Journal of Cardiology, 2016, 210: 45-53. DOI:10.1016/j.ijcard.2016.02.096 |
| [27] |
ZHUANG Z N, SEN G, JI Z P, et al. Hypoxia preconditioning induced HIF-1α promotes glucose metabolism and protects mitochondria in liver I/R injury[J]. Clinics and Research in Hepatology and Gastroenterology, 2015, 39(5): 610-619. DOI:10.1016/j.clinre.2014.12.012 |
| [28] |
SEMENZA G L, WANG G L. A nuclear factor induced by hypoxia via de novo protein synthesis binds to the human erythropoietin gene enhancer at a site required for transcriptional activation[J]. Molecular and Cellular Biology, 1992, 12(12): 5447-5454. DOI:10.1128/MCB.12.12.5447 |
| [29] |
JAAKKOLA P, MOLE D R, TIAN Y M, et al. Targeting of HIF-α to the von Hippel-Lindau Ubiquitylation complex by O2-regulated prolyl hydroxylation[J]. Science, 2001, 292(5516): 468-472. DOI:10.1126/science.1059796 |
| [30] |
KUMAR H, CHOI D K. Hypoxia inducible factor pathway and physiological adaptation:a cell survival pathway?[J]. Mediators of Inflammation, 2015, 2015: 584758. |
| [31] |
LI X Y, FANG P, MAI J T, et al. Targeting mitochondrial reactive oxygen species as novel therapy for inflammatory diseases and cancers[J]. Journal of Hematology & Oncology, 2013, 6: 9. |
| [32] |
LI H S, ZHOU Y N, LI L, et al. HIF-1α protects against oxidative stress by directly targeting mitochondria[J]. Redox Biology, 2019, 25: 101109. DOI:10.1016/j.redox.2019.101109 |
| [33] |
MOVAFAGH S, CROOK S, VO K. Regulation of hypoxia-inducible factor-1a by reactive oxygen species:new developments in an old debate[J]. Journal of Cellular Biochemistry, 2015, 116(5): 696-703. DOI:10.1002/jcb.25074 |
| [34] |
ZHANG H F, BOSCH-MARCE M, SHIMODA L A, et al. Mitochondrial autophagy is an HIF-1-dependent adaptive metabolic response to hypoxia[J]. Journal of Biological Chemistry, 2008, 283(16): 10892-10803. DOI:10.1074/jbc.M800102200 |
| [35] |
SEMENZA G L. Hypoxia-inducible factor 1:regulator of mitochondrial metabolism and mediator of ischemic preconditioning[J]. Biochimica et Biophysica Acta:Molecular Cell Research, 2011, 1813(7): 1263-1268. DOI:10.1016/j.bbamcr.2010.08.006 |
| [36] |
WENZ T. Regulation of mitochondrial biogenesis and PGC-1α under cellular stress[J]. Mitochondrion, 2013, 13(2): 134-142. DOI:10.1016/j.mito.2013.01.006 |
| [37] |
SAXENA S, SHUKLA D, BANSAL A. Augmentation of aerobic respiration and mitochondrial biogenesis in skeletal muscle by hypoxia preconditioning with cobalt chloride[J]. Toxicology and Applied Pharmacology, 2012, 264(3): 324-334. DOI:10.1016/j.taap.2012.08.033 |
| [38] |
LAUBENTHAL L, RUDA L, SULTANA N, et al. Effect of increasing body condition on oxidative stress and mitochondrial biogenesis in subcutaneous adipose tissue depot of nonlactating dairy cows[J]. Journal of Dairy Science, 2016, 100(6): 4976-4986. |
| [39] |
CHITRA L, BOOPATHY R. Altered mitochondrial biogenesis and its fusion gene expression is involved in the high-altitude adaptation of rat lung[J]. Respiratory Physiology & Neurobiology, 2014, 192: 74-84. |
| [40] |
ZHAO Y J, XIE C C, LI X H, et al. Effects of hypoxic exercise on skeletal muscle mitochondrial autophagy in obese rats[J]. Investigacion Clinica, 2019, 60(1): 20-26. |
| [41] |
MCLEOD C J, PAGEL I, SACK M N. The mitochondrial biogenesis regulatory program in cardiac adaptation to ischemia-a putative target for therapeutic intervention[J]. Trends in Cardiovascular Medicine, 2005, 15(3): 118-123. DOI:10.1016/j.tcm.2005.05.001 |
| [42] |
RABINOVITCH R C, SAMBORSKA B, FAUBERT B, et al. AMPK maintains cellular metabolic homeostasis through regulation of mitochondrial reactive oxygen species[J]. Cell Reports, 2017, 21(1): 1-9. |




