2. 硕腾(上海)企业管理有限公司, 上海 200050
2. Zoetis(Shanghai) Enterprise Management Co., Ltd., Shanghai 200050, China
温室气体排放是造成全球气候变暖的重要原因。据报道,过去130年间,全球地表平均温度上升了0.87 ℃,并正在以每10年0.2 ℃的速度增长[1]。据联合国政府间气候变化专门委员会(IPCC)预计,2030—2052年,全球气温将比前工业时代增加1.5 ℃[2]。甲烷(CH4)是反刍动物瘤胃厌氧发酵的天然产物,是仅次于二氧化碳的第二大温室气体,但同体积甲烷的温室潜能是二氧化碳的28~34倍[3]。据估测,农业甲烷排放量约占人类活动排放甲烷总量的50.6%[4],而反刍动物每年甲烷的排放量约占全球甲烷排放总量的16%[5]。2015年我国反刍动物甲烷排放量约为10.2 Tg,占全国甲烷排放总量的20.5%[6]。预计到2050年,世界人口将达到98亿[7],人类对肉类和牛奶的需求将分别比2010年增长73%和58%[8]。毋庸置疑,反刍动物饲养数量也将大幅增加,这将为控制甲烷等温室气体的排放带来巨大挑战。
1 降低反刍动物瘤胃甲烷生成的调控措施目前,降低反刍动物瘤胃甲烷生成的途径主要有3个:一是降低产甲烷菌的数量和活性[5]。通过直接或间接降低产甲烷菌的数量,均能降低瘤胃甲烷的生成。研究表明,去除原虫能够间接降低瘤胃产甲烷菌的数量[9],一些植物提取物及其代谢产物,如皂苷、单宁、大蒜素等,都具有降低瘤胃产甲烷菌数量的作用[10]。但瘤胃微生物具有自我调节能力,长期使用此类方法可能会使瘤胃微生物产生适应性,从而影响抑制甲烷产生的效果[11-12]。二是降低瘤胃氢气的生成或者添加耗氢化合物争夺氢[13]。反刍动物饲粮中添加的耗氢化合物可以被瘤胃微生物利用,通过代谢消耗一部分氢气,从而减少瘤胃甲烷的产生。主要的耗氢化合物及微生物有不饱和脂肪酸、延胡索酸、硫酸盐还原菌、产乙酸菌及酵母菌等[14]。三是添加特异性抑制剂,抑制甲烷生成途径中某些酶的活性,如2-溴乙烷磺酸钠(BES)、溴氯甲烷等[15]。但BES对瘤胃甲烷生成的抑制作用较短暂,且可能导致产甲烷菌产生耐性,而溴氯甲烷可能具有潜在的致癌性,危害人类和动物健康,因此二者无法应用于实际生产中[16]。
2 3-硝基酯-1-丙醇(3-NOP)的功能及抑制反刍动物甲烷生成的机制3-NOP是一种有机化合物,分子式为C3H7NO4[17]。研究表明,3-NOP抑制反刍动物瘤胃甲烷生成相对高效,可使瘤胃甲烷的产量减少20%~40%[8]。3-NOP性质相对稳定,在牛奶、肉中无残留[17-19]。针对3-NOP的安全性,Thiel等[19]进行了毒药物动力学(ADME)试验,分别检测了3-NOP在大鼠、哺乳山羊及肉牛体内的吸收、分布、代谢及排泄变化等指标,结果表明3-NOP可以安全地用于反刍动物生产。在小鼠上进行的埃姆斯致突变性检测和小鼠淋巴瘤试验结果表明,3-NOP及其在血浆中的代谢产物无遗传毒性和致突变性[17]。目前针对3-NOP在反刍动物上的安全性研究数量相对较少,还需要开展大量试验加以证实[20]。
反刍动物瘤胃甲烷的生成过程比较复杂,简而言之是二氧化碳在一系列酶的作用下被还原,依次生成甲酰甲烷呋喃、甲川四氢甲烷蝶呤、甲叉四氢甲烷蝶呤、甲基四氢甲烷蝶呤、甲基辅酶M,最后释放出甲烷[21]。根据碳代谢途径的差异,甲烷生成主要分为二氧化碳-氢气还原途径、甲基裂解途径和乙酸发酵途径[22]。上述3种生成甲烷的途径最终都汇集到甲基辅酶M的生成。甲基辅酶M与辅酶B结合,在甲基辅酶M还原酶(MCR)的催化下生成甲烷及辅酶B的杂硫化合物[23](图 1)。MCR是一种镍酶,由α2、β2、γ2 3个亚基和辅酶F430组成,它是催化瘤胃甲烷生成最后一步的关键酶[24-25]。F430是一种镍卟啉,是MCR活化中心的必要组成部分,目前仅在瘤胃产甲烷古菌中发现有该物质[26]。MCR中的镍结合在F430辅因子上,只有当镍为+1价时,F430才有活性。由于F430的氧化还原电势极低(<-600 mV),因此极易被氧化[24]。Duin等[27]采用分子对接试验发现,由于3-NOP与甲基辅酶M结构类似,可替代甲基辅酶M与MCR的活性位点结合,通过氧化MCR活性位点使其失活,从而抑制瘤胃甲烷的生成。也有研究表明,3-NOP可以通过减少瘤胃中产甲烷菌的数量来降低甲烷的生成。例如,Martínez-Fernández等[28]给绵羊饲粮中添加3-NOP后,绵羊瘤胃中产甲烷古菌的数量减少。Haisan等[29]在奶牛上的试验也发现了类似的产甲烷菌数量减少的现象。Meta分析显示,3-NOP可以降低瘤胃产甲烷古菌的数量,但对瘤胃中其他细菌和原虫的数量没有影响[30]。
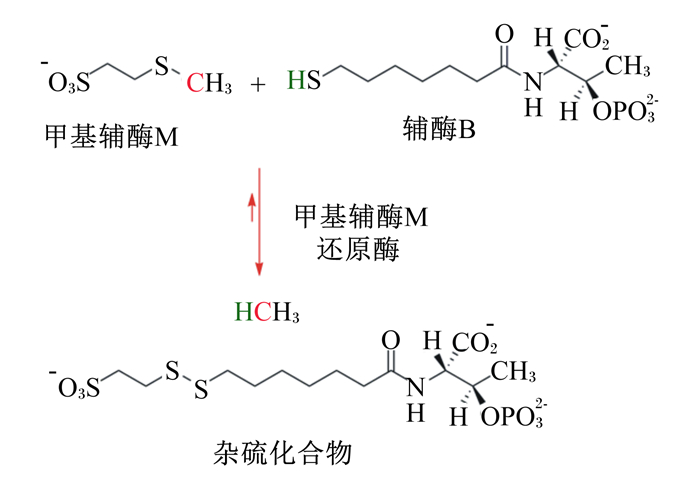
|
图 1 在甲基辅酶M还原酶的催化下甲基辅酶M与辅酶B结合生成甲烷 Fig. 1 Methane is formed by CH3-SCoM and HS-CoB under participation of MCR[24] |
3-NOP抑制反刍动物瘤胃甲烷生成的效率受到其添加水平的影响。Romero-Perez等[31]在安格斯肉牛饲粮中添加不同水平的3-NOP,每千克体重分别添加0、0.75、2.25和4.50 mg,发现4组肉牛瘤胃每天的甲烷产量随添加水平的升高而递减;Vyas等[32]给阉牛添加不同水平(0、50、75、100、150和200 mg/kg DM)的3-NOP,6组阉牛每头每天的甲烷产量也呈线性递减;Hristov等[33]给4组荷斯坦奶牛分别添加0、40、60和80 mg/kg DM的3-NOP,与空白组相比,饲喂3-NOP的3组奶牛每头每天的瘤胃甲烷产量依次下降了25%、31%和32%。而Meta分析显示,当饲粮每千克干物质中3-NOP的添加水平在0~280 mg时,随着添加水平的增加,瘤胃甲烷产量呈线性下降[30]。
饲粮的纤维含量也是影响3-NOP作用效果的因素。Vyas等[32]将阉牛分为3组,对照组不添加3-NOP,其他2组(高精料组和高粗饲料组)每天均添加200 mg/kg DM的3-NOP,与对照组相比,高精料组阉牛每天甲烷产量的下降幅度显著高于高粗饲料组(48.7% vs. 33.0%)。Meta分析显示,当反刍动物饲粮中中性洗涤纤维(NDF)含量从331 g/kg增加到341 g/kg时,3-NOP抑制甲烷生成的效率下降约1.64%[34]。上述结果说明,3-NOP在低纤维饲粮中具有更大的抑制瘤胃甲烷生成的潜力,造成这一结果的原因可能是由于饲喂低纤维饲粮的牛瘤胃中MCR的浓度低于饲喂高纤维饲粮牛瘤胃中的MCR浓度[35],因此,在低纤维饲粮中添加3-NOP可以更有效地抑制MCR的活性,从而更高效地抑制瘤胃甲烷生成。此外,3-NOP抑制反刍动物瘤胃甲烷生成的效率在不同牛品种间存在差异。Dijkstra等[34]发现,当给奶牛和肉牛饲粮中添加同等水平的3-NOP时,奶牛瘤胃甲烷产量的下降幅度显著高于肉牛(32.5% vs. 29.3%)。因此,若想让3-NOP对奶牛和肉牛的瘤胃甲烷生成产生相近的抑制效果,肉牛饲粮中需要添加更高水平的3-NOP。
3-NOP具有水溶性,进入瘤胃后会被吸收、代谢或稀释[33]。动物采食3-NOP后,在瘤胃内的停留时间长短影响着其抑制甲烷生成的效果。McGinn等[36]在饲粮中添加了125 mg/kg DM的3-NOP,肉牛采食后瘤胃甲烷产量明显下降,但几小时后,甲烷产量下降的幅度降低。Reynolds等[37]在奶牛中也发现了类似的效果,动物采食含3-NOP饲粮2 h后瘤胃甲烷产量就开始明显减少,但随后3-NOP抑制甲烷生成的效率有所减弱。因此,如果只是给反刍动物间断补充3-NOP,可能无法达到持续抑制瘤胃甲烷生成的目的,并可能会增加动物应激,因此将3-NOP与全混合日粮(TMR)混合饲喂或许是最佳的饲喂方式。
3.2 对反刍动物瘤胃发酵的影响瘤胃发酵参数是评价反刍动物瘤胃发酵模式的重要指标,主要包括瘤胃液pH、NH3-N浓度、挥发性脂肪酸(VFA)的摩尔比例以及总挥发性脂肪酸(TVFA)浓度等指标。有研究报道,饲喂3-NOP会提高反刍动物瘤胃液的pH。Romero-Perez等[38]给安格斯牛饲粮中每天加入2 g的3-NOP,瘤胃液pH从5.67上升到5.89。Martinez-Fernandez等[39]在婆罗门牛饲粮中每天加入60 mL的3-NOP,瘤胃液pH由6.87升高到6.96。Jayanegara等[30]指出,饲喂3-NOP使瘤胃液pH升高可能与瘤胃液中TVFA浓度下降有关。Melgar等[40]给荷斯坦奶牛饲粮中添加3-NOP,TVFA浓度下降了9.3%。Romero-Perez等[31]给安格斯肉牛饲粮添加4.5 mg/kg BW的3-NOP,瘤胃液中丙酸摩尔比例升高了22%,乙酸摩尔比例降低了15%,且丁酸、戊酸和异丁酸的摩尔比例随着3-NOP添加水平的增加而提高。正常情况下,反刍动物瘤胃内的微生物可以利用葡萄糖和氧化型辅酶Ⅰ(NAD+)生成丙酮酸、ATP和还原型辅酶Ⅰ(NADH)。随后,丙酮酸可进一步发酵成VFA,而NADH则被氧化为NAD+。NAD+和NADH之间的循环保证了葡萄糖酵解的顺利进行。此外,NADH转化为NAD+还可通过氢气的生成途径来完成。而一旦瘤胃内氢气的分压(PH2)提高时将影响NAD+的产量、葡萄糖的酵解及后续VFA的生成。瘤胃产甲烷菌可利用二氧化碳和氢气生成甲烷,然而当3-NOP在瘤胃内抑制了产甲烷菌生成甲烷时,PH2将增高,这会降低NAD+的生成并影响葡萄糖酵解过程,最终引起瘤胃TVFA浓度下降[41]。此外,添加3-NOP后瘤胃液中丙酸摩尔比例升高,可能是由于瘤胃中丙酸的合成与甲烷生成过程存在氢竞争的关系,当甲烷产量下降时,更多的氢可用于丙酸的合成[30]。Martínez-Fernández等[28]发现,饲喂3-NOP组绵羊的瘤胃液NH3-N浓度与对照组相比无显著差异。Romero-Perez等[31]指出,瘤胃内原虫以细菌为食,可分解菌体蛋白产生氨气(NH3),饲粮中添加3-NOP虽然会使古菌数量减少,但不会影响细菌和原虫的数量,这可能是造成瘤胃NH3-N浓度无显著变化的部分原因。
3.3 对反刍动物生产性能的影响Meta分析结果显示,3-NOP对采食量、产奶量无显著影响,但可改善奶牛的乳脂率以及肉牛的饲料效率[30]。Haisan等[29]给荷斯坦奶牛每天提供2.5 g的3-NOP,发现奶牛的干物质采食量和产奶量均无显著变化,乳脂率较对照组提高了0.32%。Hristov等[33]在荷斯坦奶牛饲粮中添加80 mg/kg DM的3-NOP,奶牛的干物质采食量和产奶量无显著变化,乳脂率比对照组提高了0.17%。Vyas等[42]在肉牛饲粮中添加200 mg/kg DM的3-NOP,肉牛的增重饲料比得到提高。Martinez-Fernandez等[39]给肉牛每天提供2.5 g的3-NOP,发现日增重较对照组提高了0.61 kg。饲喂3-NOP降低了瘤胃甲烷产量,降低了能量损失,所节约的能量可更多的用于泌乳牛乳脂的合成或肉牛的体增重[30, 39]。
4 小结3-NOP可通过氧化MCR的活性位点使其失活,从而高效抑制反刍动物瘤胃甲烷的生成。3-NOP对反刍动物的采食量和产奶量无显著影响,但可改善奶牛的乳脂率及肉牛的饲料效率,影响瘤胃的发酵模式,增加丙酸的产量。目前,针对3-NOP在动物生产中的应用已经开展了大量研究工作,但关于3-NOP安全性评价的研究较少,这也是3-NOP仍处于试验阶段,还未被商品化的主要原因。因此,未来可将3-NOP的安全性评价作为研究重点。此外,3-NOP在反刍动物生产中的应用效果受不同因素的影响,为了实现在不影响饲料消化率和动物生产性能的条件下,持续降低甲烷产量的目的,还需要对3-NOP的理想添加水平、补充方式做进一步探讨。
| [1] |
EDENHOFER O, SEYBOTH K.Intergovernmental panel on climate change (IPCC)[M]//SHOGREN J F.Encyclopedia of energy, natural resource, and environmental economics.Waltham: Elsevier, 2013: 48-56.
|
| [2] |
ALLEN M, BABIKER M, CHEN Y, et al.Summary for policy makers[EB/OL].[2020-03-16]. https://www.ipcc.ch/sr15/chapter/spm/.
|
| [3] |
UNGERFELD E M. Inhibition of rumen methanogenesis and ruminant productivity:a meta-analysis[J]. Frontiers in Veterinary Science, 2018, 5: 113. DOI:10.3389/fvets.2018.00113 |
| [4] |
ISLAM M, LEE S S. Advanced estimation and mitigation strategies:a cumulative approach to enteric methane abatement from ruminants[J]. Journal of Animal Science and Technology, 2019, 61(3): 122-137. DOI:10.5187/jast.2019.61.3.122 |
| [5] |
LAN W, YANG C L. Ruminal methane production:associated microorganisms and the potential of applying hydrogen-utilizing bacteria for mitigation[J]. Science of the Total Environment, 2019, 654: 1270-1283. DOI:10.1016/j.scitotenv.2018.11.180 |
| [6] |
黄满堂, 王体健, 赵雄飞, 等. 2015年中国地区大气甲烷排放估计及空间分布[J]. 环境科学学报, 2019, 39(5): 1371-1380. |
| [7] |
GROSSI G, GOGLIO P, VITALI A, et al. Livestock and climate change:impact of livestock on climate and mitigation strategies[J]. Animal Frontiers, 2019, 9(1): 69-76. DOI:10.1093/af/vfy034 |
| [8] |
BEAUCHEMIN K A, UNGERFELD E M, ECKARD R J, et al. Review:fifty years of research on rumen methanogenesis:lessons learned and future challenges for mitigation[J]. Animal, 2020, 14(Suppl.1): s2-s16. |
| [9] |
俎昊辰, 许静, 丛玉艳. 通过添加耗氢化合物调节瘤胃微生物实现甲烷减排[J]. 动物营养学报, 2019, 31(11): 4967-4972. |
| [10] |
JAYANEGARA A, WINA E, TAKAHASHI J. Meta-analysis on methane mitigating properties of saponin-rich sources in the rumen:influence of addition levels and plant sources[J]. Asian-Australasian Journal of Animal Sciences, 2014, 27(10): 1426-1435. DOI:10.5713/ajas.2014.14086 |
| [11] |
MORGAVI D P, JOUANY J P, MARTIN C, et al. Archaeal community structure diversity in the rumen of faunated and defaunated sheep[J]. International Congress Series, 2006, 1293: 127-130. DOI:10.1016/j.ics.2006.01.019 |
| [12] |
LI Z J, DENG Q, LIU Y F, et al. Dynamics of methanogenesis, ruminal fermentation and fiber digestibility in ruminants following elimination of protozoa:a meta-analysis[J]. Journal of Animal Science and Biotechnology, 2018, 9: 89. DOI:10.1186/s40104-018-0305-6 |
| [13] |
MELLER R A, WENNER B A, ASHWORTH J, et al. Potential roles of nitrate and live yeast culture in suppressing methane emission and influencing ruminal fermentation, digestibility, and milk production in lactating Jersey cows[J]. Journal of Dairy Science, 2019, 102(7): 6144-6156. DOI:10.3168/jds.2018-16008 |
| [14] |
JEYANATHAN J, MARTIN C, MORGAVI D P. The use of direct-fed microbials for mitigation of ruminant methane emissions:a review[J]. Animal, 2014, 8(2): 250-261. DOI:10.1017/S1751731113002085 |
| [15] |
PATRA A, PARK T, KIM M, et al. Rumen methanogens and mitigation of methane emission by anti-methanogenic compounds and substances[J]. Journal of Animal Science and Biotechnology, 2017, 8: 13. DOI:10.1186/s40104-017-0145-9 |
| [16] |
GRÄWERT T, HOHMANN H P, KINDERMANN M, et al. Inhibition of methyl-CoM reductase from Methanobrevibacter ruminantium by 2-bromoethanesulfonate[J]. Journal of Agricultural and Food Chemistry, 2014, 62(52): 12487-12490. DOI:10.1021/jf505056g |
| [17] |
THIEL A, SCHOENMAKERS A C M, VERBAAN I A J, et al. 3-NOP:mutagenicity and genotoxicity assessment[J]. Food and Chemical Toxicology, 2019, 123: 566-573. DOI:10.1016/j.fct.2018.11.010 |
| [18] |
DUVAL S, KINDERMANN M.Nitrooxy alkanoic acids and derivatives thereof in feed for reducing methane emission in ruminants, and/or to improve ruminant performance: US, 20120315339A1[P].2012-12-13.
|
| [19] |
THIEL A, RVMBELI R, MAIR P, et al. 3-NOP:ADME studies in rats and ruminating animals[J]. Food and Chemical Toxicology, 2019, 125: 528-539. DOI:10.1016/j.fct.2019.02.002 |
| [20] |
BLACK J, DAVISON T, FENNESSY P, et al.National livestock methane program-national needs and gaps analysis[J/OL].Meat & Livestock Australia, 2015, [2020-04-10].https://www.mla.com.au/research-and-development/search-rd-reports/final-report-details/Environment-On-Farm/National-Livestock-Methane-Program-National-Needs-and-Gaps-Analysis/3196.
|
| [21] |
DIMARCO A A, BOBIK T A, WOLFE R S. Unusual coenzymes of methanogenesis[J]. Annual Review of Biochemistry, 1990, 59: 355-394. DOI:10.1146/annurev.bi.59.070190.002035 |
| [22] |
MORGAVI D P, FORANO E, MARTIN C, et al. Microbial ecosystem and methanogenesis in ruminants[J]. Animal, 2010, 4(7): 1024-1036. DOI:10.1017/S1751731110000546 |
| [23] |
周玉珍, 汪伟, 金皓, 等. 能量耦合存在于产甲烷菌甲基辅酶M还原酶MCR活化过程[J]. 江苏农业科学, 2018, 46(23): 329-333. |
| [24] |
THAUER R K. Methyl (alkyl)-coenzyme M reductases:nickel F-430-containing enzymes involved in anaerobic methane formation and in anaerobic oxidation of methane or of short chain alkanes[J]. Biochemistry, 2019, 58(52): 5198-5220. DOI:10.1021/acs.biochem.9b00164 |
| [25] |
CASAÑAS M A A, RANGKASENEE N, KRATTENMACHER N, et al. Methyl-coenzyme M reductase A as an indicator to estimate methane production from dairy cows[J]. Journal of Dairy Science, 2015, 98(6): 4074-4083. DOI:10.3168/jds.2015-9310 |
| [26] |
MOORE S J, SOWA S T, SCHUCHARDT C, et al. Elucidation of the biosynthesis of the methane catalyst coenzyme F430[J]. Nature, 2017, 543(7643): 78-82. DOI:10.1038/nature21427 |
| [27] |
DUIN E C, WAGNER T, SHIMA S, et al. Mode of action uncovered for the specific reduction of methane emissions from ruminants by the small molecule 3-nitrooxypropanol[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(22): 6172-6177. DOI:10.1073/pnas.1600298113 |
| [28] |
MARTÍNEZ-FERNÁNDEZ G, ABECIA L, ARCO A, et al. Effects of ethyl-3-nitrooxy propionate and 3-nitrooxypropanol on ruminal fermentation, microbial abundance, and methane emissions in sheep[J]. Journal of Dairy Science, 2014, 97(6): 3790-3799. DOI:10.3168/jds.2013-7398 |
| [29] |
HAISAN J, SUN Y, GUAN L L, et al. The effects of feeding 3-nitrooxypropanol on methane emissions and productivity of Holstein cows in mid lactation[J]. Journal of Dairy Science, 2014, 97(5): 3110-3119. DOI:10.3168/jds.2013-7834 |
| [30] |
JAYANEGARA A, SARWONO K A, KONDO M, et al. Use of 3-nitrooxypropanol as feed additive for mitigating enteric methane emissions from ruminants:a meta-analysis[J]. Italian Journal of Animal Science, 2018, 17(3): 650-656. DOI:10.1080/1828051X.2017.1404945 |
| [31] |
ROMERO-PEREZ A, OKINE E K, MCGINN S M, et al. The potential of 3-nitrooxypropanol to lower enteric methane emissions from beef cattle[J]. Journal of Animal Science, 2014, 92(10): 4682-4693. DOI:10.2527/jas.2014-7573 |
| [32] |
VYAS D, ALEMU A W, MCGINN S M, et al. The combined effects of supplementing monensin and 3-nitrooxypropanol on methane emissions, growth rate, and feed conversion efficiency in beef cattle fed high-forage and high-grain diets[J]. Journal of Animal Science, 2018, 96(7): 2923-2938. DOI:10.1093/jas/sky174 |
| [33] |
HRISTOV A N, OH J, GIALLONGO F, et al. An inhibitor persistently decreased enteric methane emission from dairy cows with no negative effect on milk production[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(34): 10663-10668. DOI:10.1073/pnas.1504124112 |
| [34] |
DIJKSTRA J, BANNINK A, FRANCE J, et al. Short communication:antimethanogenic effects of 3-nitrooxypropanol depend on supplementation dose, dietary fiber content, and cattle type[J]. Journal of Dairy Science, 2018, 101(10): 9041-9047. DOI:10.3168/jds.2018-14456 |
| [35] |
VYAS D, MCGINN S M, DUVAL S M, et al. Optimal dose of 3-nitrooxypropanol for decreasing enteric methane emissions from beef cattle fed high-forage and high-grain diets[J]. Animal Production Science, 2016, 58(6): 1049-1055. |
| [36] |
MCGINN S M, FLESCH T K, BEAUCHEMIN K A, et al. Micrometeorological methods for measuring methane emission reduction at beef cattle feedlots:evaluation of 3-nitrooxypropanol feed additive[J]. Journal of Environmental Quality, 2019, 48(5): 1454-1461. DOI:10.2134/jeq2018.11.0412 |
| [37] |
REYNOLDS C K, HUMPHRIES D J, KIRTON P, et al. Effects of 3-nitrooxypropanol on methane emission, digestion, and energy and nitrogen balance of lactating dairy cows[J]. Journal of Dairy Science, 2014, 97(6): 3777-3789. DOI:10.3168/jds.2013-7397 |
| [38] |
ROMERO-PEREZ A, OKINE E K, MCGINN S M, et al. Sustained reduction in methane production from long-term addition of 3-nitrooxypropanol to a beef cattle diet[J]. American Society of Animal Science, 2015, 93(4): 1780-1791. |
| [39] |
MARTINEZ-FERNANDEZ G, DUVAL S, KINDERMANN M, et al. 3-NOP vs. halogenated compound:methane production, ruminal fermentation and microbial community response in forage fed cattle[J]. Frontiers in Microbiology, 2018, 9: 1582. DOI:10.3389/fmicb.2018.01582 |
| [40] |
MELGAR A, HARPER M T, OH J, et al. Effects of 3-nitrooxypropanol on rumen fermentation, lactational performance, and resumption of ovarian cyclicity in dairy cows[J]. Journal of Dairy Science, 2020, 103(1): 410-432. DOI:10.3168/jds.2019-17085 |
| [41] |
VAN LINGEN H J, PLUGGE C M, FADEL J G, et al. Thermodynamic driving force of hydrogen on rumen microbial metabolism:a theoretical investigation[J]. PLoS One, 2016, 11(10): e161362. |
| [42] |
VYAS D, MCGINN S M, DUVAL S M, et al. Effects of sustained reduction of enteric methane emissions with dietary supplementation of 3-nitrooxypropanol on growth performance of growing and finishing beef cattle[J]. Journal of Animal Science, 2016, 94(5): 2024-2034. DOI:10.2527/jas.2015-0268 |




