2. 中国农业科学院兰州畜牧与兽药研究所, 农业农村部兽用药物创制重点实验室, 兰州 730050
2. Key Laboratory of Veterinary Pharmaceutical Development, Ministry of Agricultural and Rural Affairs, Lanzhou Institute of Husbandry and Pharmaceutical Sciences, Chinese Academy of Agricultural Sciences, Lanzhou 730050, China
单宁作为一种植物次生代谢产物,广泛存在于植物的根、茎、叶及果实中[1]。早期研究认为单宁是饲料中主要的抗营养因子之一,可沉降蛋白质并进入动物体内与消化酶和激素等结合,从而引起家畜消化率和采食量的降低。近年来,随着研究的不断深入,发现饲粮中添加1%~2%的单宁对反刍动物具有独特的益处,如提高生产性能[2]、预防反刍动物臌胀病[3]、抑制寄生虫[4]及减少温室气体[5]和氮的排放[6],特别对免疫调节起着重要作用[7]。反刍动物瘤胃微生物生态群落是一个非常复杂的生物体系,不仅可以高效利用木质纤维素、非蛋白氮等成分,且在宿主营养物质消化、机体免疫、行为和健康等方面起着关键作用[8-9]。长期以来,人们通过在饲粮中添加抗生素、抗菌药物类生长促进剂,以维持动物健康、提高饲料利用率及促进动物生长,但大量使用抗生素导致动物机体正常菌群失调、病原微生物产生耐药性,并在畜产品(肉、蛋、奶、皮毛)中残留,进而直接威胁人类健康与环境安全[10]。近年来,单宁作为生长促进剂和抗生素的天然替代品引起了人们极大关注[11],尤其在改善家畜生产性能和畜产品品质等方面具有广阔的应用前景[2-7]。因此,本文通过综述单宁的结构与理化特性及其对瘤胃微生物区系和免疫功能的影响,以期为天然植物提取物作为反刍动物饲料添加剂在促进动物绿色健康生产方面提供理论支撑。
1 单宁的结构分类和特性单宁是分子质量从500~3 000 u不等的酚类物质,并随植物生长部位、生长阶段和生长条件(温度、光照、营养和暴露于食草环境)的不同,其含量和结构存在差异[12]。单宁化学结构比较复杂,大致可以分成3种:水解单宁(hydrolysable tannins,HT)、缩合单宁(condensed tannins,CT)和褐藻多酚(phlorotannins)[13],其中水解单宁和缩合单宁主要存在于陆生植物中,褐藻多酚则多存在于水生藻类之中。
水解单宁是由酚酸(没食子酸或六羟基二苯甲酸)酯化的多元醇(通常为D-葡萄糖)组成(图 1-A)[13],遇酸、碱或酯酶易于水解,且在反刍动物消化道中易被降解和吸收,对机体造成潜在的毒副作用[14]。与水解单宁相比,缩合单宁结构更为复杂,且只有在强氧化性和强酸性化合物存在的条件下才会发生解聚,其种类主要有儿茶素、表儿茶素、没食子儿茶素和表没食子儿茶素[13]。缩合单宁是由亲核的黄烷-3-醇和亲电的黄烷-3, 4-二醇单体通过C4-C8或C4-C6共价键连接而成的聚合物(图 1-B)[15]。大多数植物缩合单宁具有顺式-黄烷-3-醇亚基,特别是作为延伸单元,但在延伸单元中以反式-黄烷-3-醇亚基为主的缩合单宁相对较少[16-17]。褐藻多酚的结构在三类单宁中最为简单,它由间苯三酚(1, 3, 5-三羟基苯)聚合而成(图 1-C),不同的类型具有不同的聚合度,且化学组分差异很大[13]。不同种类单宁的差异不仅体现在结构上,理化性质也存在较大差异。植物中水解单宁对甲烷排放的抑制作用要大于缩合单宁[18]。与缩合单宁相比,水解单宁在动物小肠中的降解产物可能对反刍动物具有毒性[19]。此外,褐藻多酚作为褐藻细胞壁的主要结构成分具有抗紫外线辐射等功能,并在抗菌[20]、抗炎[21]、抗肿瘤[22]以及治疗糖尿病[23]等方面具有重要作用。
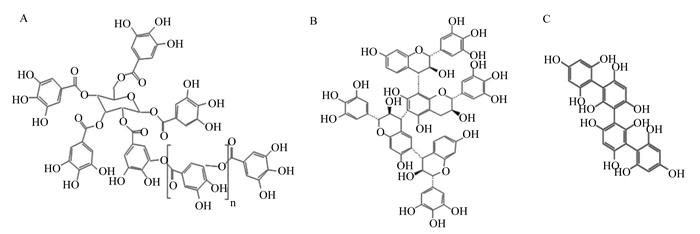
|
A:水解单宁hydrolysable tannins;B:缩合单宁condensed tannins;C:褐藻多酚phlorotannins。 图 1 3种常见单宁的分子结构式 Fig. 1 Molecular structure of three common tannins[13] |
近年来天然植物抗氧化活性方面的研究引起了人们极大关注,大多数植物性食品的抗氧化能力与它们中的酚类含量有关[24]。植物多酚如单宁及黄酮类化合物具有清除体内有害自由基的功能,在提高动物健康方面发挥着重要作用[25]。芦荟单宁可以通过提供1个氢原子或1个电子螯合水溶液中的金属离子中和自由基,表现出较强的抗氧化活性[26]。研究表明,单宁具有较强的抗氧化能力,在缓解与氧化应激相关的疾病中起着关键作用[27]。同时,植物单宁对1, 1-二苯基-2-三硝基苯肼(DPPH)自由基、2, 2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS+)自由基、超氧阴离子自由基和过氧化氢自由基等有较强的清除能力[28]。此外,植物单宁与商业抗氧化剂相比,其抗氧化活性高于羟基茴香醚(butylated hydroxyanisole,BHA)、α-生育酚(α-tocopherol)和水溶性维生素E,更接近二叔丁基对甲酚(butylated hydroxytoluene,BHT)[29]。核因子E2相关因子2(Nrf2)是一种存在于各种组织中的抗氧化剂转录因子,研究发现单宁能够提高细胞核中Nrf2蛋白表达水平,刺激Nrf2信号通路,提高机体抗氧化能力,并且单宁对羟基自由基诱导DNA氧化损伤具有保护作用[30]。
2.2 抗菌作用研究表明,植物中单宁具有显著的抗菌活性[31]。单宁对表皮葡萄球菌、大肠杆菌、枯草杆菌、黑穗病杆菌、金黄色葡萄球菌以及粪便链球菌都有显著的抑制效果[32]。植物中单宁对不同细菌的抑制程度存在差异,决明子叶单宁提取物的抗菌活性表明,与大肠杆菌和铜绿假单胞菌相比,化脓性链球菌和金黄色葡萄球菌的抗菌活性更敏感。缩合单宁对白色念珠菌、马氏菌和铜绿假单胞菌具有抑制作用[33-34]。扫描电镜和透射电镜观察表明,经过处理的白念珠菌细胞壁发生了明显的形态变化[35]。近些年来,研究发现单宁可以阻断细胞膜电子链传递和氧化磷酸化过程[36],从而达到抗菌的效果。金黄色葡萄球菌表现为对单宁高敏感性,可能是由于单宁能够直接与革兰氏阳性细菌膜上的肽聚糖层结合[37]。相反,由于革兰氏阴性菌的细胞壁周围有外膜,所以它们对抗菌作用的敏感性较低,导致对铜绿假单胞菌的活性较低[38]。
3 单宁对反刍动物瘤胃微生物及发酵特性的影响 3.1 单宁对反刍动物瘤胃微生物区系的影响瘤胃内的不同原核微生物(细菌和古生菌)、真核微生物(原虫和真菌)与宿主互利共生、相互作用,共同形成了复杂的瘤胃微生物区系[39-40]。原虫是瘤胃中体型最大的微生物并且在稳定瘤胃pH中发挥重要作用,但瘤胃中原虫对细菌的吞噬作用会造成瘤胃氮的无效循环,并且在这一过程中会造成能量的浪费[41]。研究发现,绵羊采食富含单宁酸的葡萄渣后瘤胃液中原虫数量显著减少[42],且不同植物来源的单宁均使纤毛虫数量平均下降12.3%,水解单宁和缩合单宁混合试验组纤毛虫数量平均下降36.2%,并且原虫数量随单宁浓度的增加而减少[43]。饲粮中添加银合欢缩合单宁(30 mg/g DM)[44]、白坚木缩合单宁(4.5 mg/g DM)[45]以及黑荆缩合单宁(25 mg/g DM)[46]均不同程度减少原虫的数量。饲粮中添加30 mg/g DM商品单宁发现山羊瘤胃中原虫数量显著降低[47]。然而,Vasta等[48]在绵羊饲粮中添加9.57% DM的白坚木单宁,可能由于瘤胃微生物对单宁产生适应性[49],绵羊瘤胃液中的原虫数量增多。随着测序技术的发展,对部分瘤胃微生物18S rRNA基因进行高通量测序发现,添加瘤牛体重2.5%的大分子质量缩合单宁显著减少其瘤胃中总原虫数量,特别是纤毛虫数量,其中真双毛属(Eudiplodinium)和多泡双毛属(Polyplastron)的相对丰度降低,而双毛虫属无甲亚属(Anoplodinium-diplodinium)的相对丰度则显著增加[50]。单宁对不同反刍动物瘤胃中的原虫产生的影响也存在差异,山羊的瘤胃微生物区系受单宁的影响程度较绵羊更显著[51]。
反刍动物瘤胃中真菌可以有效依附于植物纤维组织中,并在木质纤维降解中发挥重要作用[39]。缩合单宁通过抑制酶活性、螯合金属离子以及直接结合细胞膜上的蛋白质3种作用机制来影响瘤胃微生物[52]。在西门塔尔牛饲粮中添加13.0和26.0 g/kg DM的商品单宁后,发现对瘤胃中的真菌数量及总挥发性脂肪酸(VFA)含量无显著影响[53]。研究发现,添加100 mg/mL的水解单宁和缩合单宁对细菌有极显著的抑制作用,但对体外培养的12种真菌均未造成显著影响,其中水解单宁会破坏酵母细胞壁的完整性,而缩合单宁对酵母没有这种抑制作用[54]。真菌对单宁更强的耐受性可能是由于真菌被细胞壁包裹,细胞壁中主要成分壳多糖可以防止单宁与真菌的直接接触[32]。在反刍动物的肠道以及瘤胃液中发现可以降解单宁的蛋白酶[55]。通过体外培养发现真菌可以产生这种单宁降解酶[56]。当山羊每天采食100 g单宁提取物(板栗和白坚木)后,瘤胃中微生物厚壁菌门的数量显著减少,而拟杆菌门的数量显著增加[57];在饲粮添加含3.5%阿拉伯金合欢单宁后,山羊瘤胃中拟杆菌、梭状芽胞杆菌、变形杆菌和放线菌分别增加了20%、43%、38%和35%[58],这些结果表明,富含单宁的饲粮可能改变反刍动物胃肠道中的微生物种群丰富度,从而提高了纤维的高效降解。然而,由于单宁的结构和相对分子质量存在差异,且动物品种、添加剂量、饲养条件及饲养周期均可影响宿主微生物对单宁调控的响应。因此,不同种类单宁在瘤胃中的作用机制及其在反刍动物生产中的应用,还亟需深入研究。
3.2 单宁对反刍动物瘤胃甲烷排放的影响甲烷是一种重要的温室气体,其温室效应相当于二氧化碳的25倍。在全球范围内,反刍家畜每年生产约8 000万t的甲烷,约占全球甲烷总排放量的25%[59]。反刍家畜瘤胃微生物发酵产生的甲烷会造成5%~9%的饲粮总能的损失[60]。目前的研究已经确定瘤胃中主要的产甲烷古菌属为甲烷短杆菌属、甲烷微菌属和甲烷杆菌属[61-62]。研究发现,单宁对瘤胃甲烷菌、原虫具有毒性作用[63],对瘤胃甲烷产量影响的程度与单宁结构中羟基的数量呈正相关[44];同时,反刍动物甲烷排放量也会因单宁的化学结构、植物来源和浓度而异[64]。因此,饲粮中添加单宁在减少反刍动物甲烷排放中有着巨大潜力。体外试验表明,饲粮中添加单宁后干物质消化率增加3.6%,并且甲烷排放量减少3.2%;而体内试验则发现,添加单宁后山羊的干物质消化率增加,且甲烷日排放量减少了9.4%[65]。体外试验发现,瘤胃甲烷产量会随着银合欢缩合单宁分子质量的增加而显著降低,并且对干物质降解率影响不显著[66]。反刍动物在采食富含皂苷、单宁的植物后,其瘤胃甲烷产量和原虫活性会显著降低,并且饲粮中添加小分子质量商品缩合单宁能更加显著地降低瘤胃中甲烷菌的数量[67]。体外发酵试验证明,饲粮中添加60%和30%的金合欢(含60%的缩合单宁)可显著降低瘤胃甲烷产量[68]。Puchala等[69]也发现饲粮中添加单宁会抑制山羊瘤胃中产甲烷菌的活性。甲烷菌可以利用原虫产生的氢气(H2)合成甲烷,因此瘤胃中原虫数量和活性也会影响甲烷菌的相对丰度,低浓度(30 mg/g DM)的银合欢缩合单宁不仅可以降低瘤胃原虫数量,同时瘤胃甲烷排放量也减少47%[44],研究证明了瘤胃原虫与产甲烷菌之间存在外共生和内共生关系[70]。在饲粮中添加10%板栗和葡萄籽单宁分别可减少甲烷产量65%和24%,显著降低总产甲烷菌的相对丰度,尤其是反刍兽甲烷短杆菌(M.ruminantium)和甲烷热杆菌(M.stadtmanae),而这2种单宁组之间无显著差异,他们推测甲烷产量可能取决于微生物群落组成的变化[71]。单宁降低甲烷产量归因于单宁与甲烷细菌表面的蛋白质相结合,抑制了甲烷菌的生物活性[72],进一步使甲烷菌底物H2和醋酸盐的产量降低[18],从而降低了甲烷的产生。体外试验发现,底物中单宁的添加量与甲烷排放量呈负相关,但单宁添加量超过30 mg/g DM时,会降低干物质消化率[44]。然而,单宁与微生物多样性和种群动态之间的关系还有待确定。目前,已经有大量研究对植物次生代谢产物进行测定,但这些研究的结果往往不一致。瘤胃中的产甲烷菌与其他种类微生物之间的关系尚不明确。研究产甲烷菌和其他参与甲烷产生的微生物生态和生理学有助于阐明单宁减少甲烷排放的机制。
3.3 单宁对反刍动物过瘤胃蛋白的影响单宁在分子结构上是多种多样的,但都包含可与蛋白质结合的酚羟基[73]。研究表明,单宁是一种天然过瘤胃蛋白保护剂[74],在pH为5~7的条件下,单宁结构中大量的酚羟基和苯基可以与蛋白质的氨基、羧基作用形成单宁-蛋白质复合物,从而防止蛋白质被瘤胃微生物迅速降解,提高过瘤胃蛋白数量[75];当环境中的pH超出这一范围时,单宁会释放出蛋白质。研究发现,反刍动物瘤胃pH在5.8~6.8时蛋白质与单宁的结合比较稳定,使微生物难以降解;当单宁-蛋白质复合物经过pH为2.5的皱胃和pH在8~9的小肠时会发生分离,胃蛋白酶和胰蛋白酶会将蛋白质分解[76]。饲粮中添加3%~5%的缩合单宁可以增加过瘤胃蛋白的数量,提高皱胃和小肠对蛋白质的吸收效率,同时反刍动物饲粮中添加单宁可降低瘤胃可溶性氮和氨态氮含量,从而提高饲粮中蛋白质的利用效率以及减少机体氮的损失[77-78]。沉淀半数牛血清白蛋白所需大分子质量缩合单宁更少,表明其具有更高的蛋白质亲和力[80],因此,在饲粮中添加相对分子质量大的缩合单宁能够更显著地增加过瘤胃蛋白数量并提高蛋白质的利用率[79],并且当单宁分子中含有较多的羟基时,与蛋白质结合能力更强[81]。22.1 mg/g DM的百脉根缩合单宁能够抑制部分蛋白质降解菌的活性,降低瘤胃微生物对蛋白质的降解速度,增加蛋白质在肠道内的吸收[82]。然而,饲粮中缩合单宁浓度或化学结构不恰当时,会降低反刍动物对饲粮蛋白质的消化利用以及对必需氨基酸的吸收[73]。从整个消化系统来看,饲粮中添加25~35 mg/g DM白坚木单宁可以提高动物对蛋白质、中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)的消化吸收[83]。当单宁添加量超过6%时,会显著降低山羊瘤胃微生物对饲粮粗蛋白质表观消化率[51]。紫色达利菊中缩合单宁提高了瘤胃合成菌体蛋白的效率,而对瘤胃中干物质消化率无显著影响[84]。对于整个胃肠道来说,当饲粮中的蛋白质含量满足动物需要时,缩合单宁的优势就会显现出来;但当饲粮中蛋白质含量不足时,缩合单宁的存在具有降低蛋白质消化的风险且会影响动物的健康[85]。如果饲粮中存在足够的蛋白质或氨基酸,而其他营养物质是有限的(如碳水化合物或磷),缩合单宁也会表现出积极影响[86]。因此,单宁对瘤胃蛋白质消化的影响表现出剂量效应,单宁的结构也会对蛋白质消化产生影响,在添加单宁是还要注意营养物质的平衡。
4 单宁对反刍动物健康和生长的影响良好的免疫系统功能在动物生长及健康方面发挥着重要的作用。目前有多项试验证明单宁似乎具有替代抗生素的潜力,用缩合单宁干叶粉混合物饲喂羔羊后发现,1%和2%的混合物缩合单宁在促进羔羊生长、饲料利用率、抗氧化、体液免疫反应和抑制胃肠道线虫等方面有显著的积极影响[87]。采食添加2%、4%的富含单宁植物叶片粉末的饲粮后,对犊牛的血液生化指标、细胞免疫和体液免疫均有积极影响[88]。Pathak等[89]通过对绵羊进行捻转血毛线虫(H.contortus)感染建立模型,在饲粮中添加1.5%的叶面混合物缩合单宁饲养90 d后发现,添加缩合单宁组的抗溶血性弧菌免疫球蛋白G(IgG)和细胞免疫反应高于未添加缩合单宁组,并且绵羊粪中虫卵数量显著减少。近期研究表明,不同分子质量的缩合单宁对反刍动物免疫功能的影响各异,其中大分子质量的缩合单宁对反刍动物的免疫力效果更为显著[90]。
单宁不仅可以调控动物的免疫功能,也会对一些常见疾病起到辅助治疗的作用。新生犊牛腹泻是由传染性病原体引起的疾病,对于免疫力较低的犊牛来说非常容易感染,并且会造成巨大的经济损失。750 g/kg DM板栗单宁对犊牛腹泻具有有效的收敛作用,可以将犊牛腹泻的持续时间减少近4 h,这也说明了板栗单宁在治疗犊牛腹泻疾病方面具有一定的潜力[91]。肝脓肿是瘤胃酸中毒后发生的一种常见的饲养场疾病。尽管这种疾病通常没有明显症状,但会降低饲料效率,从而造成经济损失。采食含2.5 mg/g DM单宁饲粮的育肥牛患肝脓肿的概率显著降低,这可能是由于瘤胃中单宁对蛋白质起保护作用,增强了肠道对氨基酸的吸收,提高了免疫应答能力,进而降低了患肝脓肿的几率,这证明单宁可能具有潜在治疗或控制肝脓肿的作用;此外,试验发现单宁组的牛肝脏中也存在微小病变,这可能是因为单宁虽然抑制了肝脓肿,但对感染因子在肝脏的定植无影响[92]。单宁对反刍动物的免疫功能起到了非常积极的调控作用,并且对多种疾病都有抑制或缓解的作用,但是对单宁进入反刍动物体内调控免疫因子的作用机制尚不明确,仍需要深入研究。
5 小结单宁是普遍存在于自然界中的一类多酚类化合物,然而由于多年来对植物单宁的生物功能认识不足及生产中使用不当,致使单宁被认为是植物性饲料原料中重要的抗营养因子。大量的研究证实单宁具有显著的抗氧化、抗菌、抗寄生虫、增强机体免疫力等生物活性,是理想的抗生素替代品之一。在饲粮中添加适量的单宁有助于提高反刍动物饲粮蛋白质利用率、降低瘤胃甲烷排放、抑制寄生虫、预防瘤胃臌胀病等。虽然单宁对反刍动物具有多种积极的作用,但由于植物来源、分子结构及剂量效应,导致单宁对反刍动物生产性能的作用效果存在差异。这启示我们需对不同植物来源单宁的构效关系以及单宁的添加剂量进行深入探索,以期明晰不同分子结构类型以及不同剂量单宁的作用机理,实现单宁在饲料工业和动物生产中的应用。
| [1] |
李冬冬, 蔡超, 杨萌, 等. 基于单宁酸的功能材料研究进展[J]. 高分子通报, 2017(9): 10-20. |
| [2] |
PATHAK A K, DUTTA N, PATTANAIK A K, et al. Effect of condensed tannins from Ficus infectoria and Psidium guajava leaf meal mixture on nutrient metabolism, methane emission and performance of lambs[J]. Asian-Australasian Journal of Animal Sciences, 2017, 30(12): 1702-1710. DOI:10.5713/ajas.17.0060 |
| [3] |
WANG Y X, MAJAK W, MCALLISTER T A. Frothy bloat in ruminants:cause, occurrence, and mitigation strategies[J]. Animal Feed Science and Technology, 2012, 172(1/2): 103-114. |
| [4] |
HOSTE H, TORRES-ACOSTA J F J, SANDOVAL-CASTRO C A, et al. Tannin containing legumes as a model for nutraceuticals against digestive parasites in livestock[J]. Veterinary Parasitology, 2015, 212(1/2): 5-17. |
| [5] |
ABOAGYE I A, OBA M, CASTILLO A R, et al. Effects of hydrolyzable tannin with or without condensed tannin on methane emissions, nitrogen use, and performance of beef cattle fed a high-forage diet[J]. Journal of Animal Science, 2018, 96(12): 5276-5286. |
| [6] |
FOCANT M, FROIDMONT E, ARCHAMBEAU Q, et al. The effect of oak tannin (Quercus robur) and hops (Humulus lupulus) on dietary nitrogen efficiency, methane emission, and milk fatty acid composition of dairy cows fed a low-protein diet including linseed[J]. Journal of Dairy Science, 2019, 102(2): 1144-1159. DOI:10.3168/jds.2018-15479 |
| [7] |
KAWABATA K, YOSHIOKA Y, TERAO J. Role of intestinal microbiota in the bioavailability and physiological functions of dietary polyphenols[J]. Molecules, 2019, 24(2): 370. DOI:10.3390/molecules24020370 |
| [8] |
米见对, 廖新俤, 周建伟, 等. 反刍动物瘤胃微生物的建立过程与调控研究进展[J]. 家畜生态学报, 2019, 40(7): 1-8. |
| [9] |
牛化欣, 常杰, 胡宗福, 等. 基于组学技术研究反刍动物瘤胃微生物及其代谢功能的进展[J]. 畜牧兽医学报, 2019, 50(6): 1113-1122. |
| [10] |
龙潭, 马云飞, 曹健, 等. 益生菌对宠物犬的生长性能的影响[J]. 畜牧兽医科技信息, 2017(12): 115-116. |
| [11] |
彭凯, 王玉玺, 王国霞, 等. 缩合单宁的生物功能及其在动物生产中的应用[J]. 动物营养学报, 2020, 32(8): 3451-3460. |
| [12] |
KRAUS T E C, YU Z, PRESTON C M, et al. Linking chemical reactivity and protein precipitation to structural characteristics of foliar tannins[J]. Journal of Chemical Ecology, 2003, 29(3): 703-730. DOI:10.1023/A:1022876804925 |
| [13] |
HUANG Q Q, LIU X L, ZHAO G Q, et al. Potential and challenges of tannins as an alternative to in-feed antibiotics for farm animal production[J]. Animal Nutrition, 2017, 4(2): 137-150. |
| [14] |
LOFRANO G, MERIC S. A review on occurrence, measurement, toxicity and tannin removal processes from wastewaters[J]. Environmental Engineering and Management Journal, 2019, 18(1): 109-123. |
| [15] |
曹鹏, 段长青. 葡萄果实和葡萄酒中缩合单宁的研究进展[J]. 农业工程学报, 2004, 20(增刊): 5-12. |
| [16] |
HERNES P J, HEDGES J I. Tannin signatures of barks, needles, leaves, cones, and wood at the molecular level[J]. Geochimica et Cosmochimica Acta, 2004, 68(6): 1293-1307. DOI:10.1016/j.gca.2003.09.015 |
| [17] |
KLONGSIRIWET C, KARP A, HANLEY S, et al. Near infrared spectroscopy (NIRS) for screening condensed tannins in a willow germplasm collection[J]. Planta Medica, 2013, 79(13): PJ26. |
| [18] |
JAYANEGARA A, GOEL G, MAKKAR H P S, et al. Divergence between purified hydrolysable and condensed tannin effects on methane emission, rumen fermentation and microbial population in vitro[J]. Animal Feed Science and Technology, 2015, 209: 60-68. DOI:10.1016/j.anifeedsci.2015.08.002 |
| [19] |
汪海峰. 缩合单宁对反刍动物的营养作用[J]. 中国饲料, 2004(12): 26-28. |
| [20] |
JASWIR I, TOPE A H T, RAUS R A, et al. Study on anti-bacterial potentials of some malaysian brown seaweeds[J]. Food Hydrocolloids, 2014, 42: 275-279. DOI:10.1016/j.foodhyd.2014.03.008 |
| [21] |
JUNG H A, JIN S E, AHN B O, et al. Anti-inflammatory activity of edible brown alga Eisenia bicyclis and its constituents fucosterol and phlorotannins in LPS-stimulated RAW264.7 macrophages[J]. Food and Chemical Toxicology, 2013, 59: 199-206. DOI:10.1016/j.fct.2013.05.061 |
| [22] |
EL-KASSAS H Y, EL-SHEEKH M M. Cytotoxic activity of biosynthesized gold nanoparticles with an extract of the red seaweed corallina of cinalis on the MCF-7 human breast cancer cell line[J]. Asian Pacific Journal of Cancer Prevention, 2014, 15(10): 4311-4317. DOI:10.7314/APJCP.2014.15.10.4311 |
| [23] |
LEE S H, KO S C, KANG M C, et al. Octaphlorethol A, a marine algae product, exhibits antidiabetic effects in type 2 diabetic mice by activating AMP-activated protein kinase and upregulating the expression of glucose transporter 4[J]. Food and Chemical Toxicology, 2016, 91: 58-64. DOI:10.1016/j.fct.2016.02.022 |
| [24] |
SAXENA R, VENKAIAH K, ANITHA P, et al. Antioxidant activity of commonly consumed plant foods of India:contribution of their phenolic content[J]. International Journal of Food Sciences and Nutrition, 2007, 58(4): 250-260. DOI:10.1080/09637480601121953 |
| [25] |
ENUJIUGHA V N. The antioxidant and free radical-scavenging capacity of phenolics from African locust bean seeds (Parkia biglobosa)[J]. Advances in Food Sciences, 2010, 32(2): 88-93. |
| [26] |
BENZIDIA B, BARBOUCHI M, HAMMOUCH H, et al. Chemical composition and antioxidant activity of tannins extract from green rind of Aloe vera (L.) Burm.F[J]. Journal of King Saud University-Science, 2019, 31(4): 1175-1181. DOI:10.1016/j.jksus.2018.05.022 |
| [27] |
GÜLÇIN Í, BERASHVILI D, GEPDIREMEN A. Antiradical and antioxidant activity of total anthocyanins from Perilla pankinensis decne[J]. Journal of Ethnopharmacology, 2005, 101(1/2/3): 287-293. |
| [28] |
KHOMDRAM S D, SINGH P K. Polyphenolic compounds and free radical scavenging activity in eight Lamiaceae herbs of Manipur[J]. Notulae Scientia Biologicae, 2011, 3(2): 108-113. DOI:10.15835/nsb325638 |
| [29] |
GÜLÇIN Í, HUYUT Z, ELMASTAŞ M, et al. Radical scavenging and antioxidant activity of tannic acid[J]. Arabian Journal of Chemistry, 2010, 3(1): 43-53. DOI:10.1016/j.arabjc.2009.12.008 |
| [30] |
CHAI W M, WEI Q M, DENG W L, et al. Anti-melanogenesis properties of condensed tannins from Vigna angularis seeds with potent antioxidant and DNA damage protection activities[J]. Food and Function, 2019, 10(1): 99-111. DOI:10.1039/C8FO01979G |
| [31] |
MCALLISTER T A, WANG Y X, DIARRA M S, et al. Challenges of a one-health approach to the development of alternatives to antibiotics[J]. Animal Frontiers, 2018, 8(2): 10-20. DOI:10.1093/af/vfy002 |
| [32] |
ZARIN M A, WAN H Y, ISHA A, et al. Antioxidant, antimicrobial and cytotoxic potential of condensed tannins from Leucaena leucocephala hybrid-rendang[J]. Food Science and Human Wellness, 2016, 5(2): 65-75. DOI:10.1016/j.fshw.2016.02.001 |
| [33] |
SULAIMAN S, IBRAHIM D, KASSIM J, et al. Antimicrobial and antioxidant activities of condensed tannin from Rhizophora apiculata barks[J]. Journal of Chemical and Pharmaceutical Research, 2011, 3(4): 436-444. |
| [34] |
SANCHES A C C, LOPES G C, NAKAMURA C V, et al. Antioxidant and antifungal activities of extracts and condensed tannins from Stryphnodendron obovatum Benth[J]. Revista Brasileira de Ciências Farmacêuticas, 2005, 41(1): 101-107. DOI:10.1590/S1516-93322005000100012 |
| [35] |
松长青, 周本宏, 易慧兰, 等. 榴皮鞣质的抗菌活性及其对金黄色葡萄球菌的抗菌机制[J]. 中国医院药学杂志, 2016, 36(4): 259-265. |
| [36] |
葛珍珍.柿单宁调控胆固醇外流的分子机制研究[D].博士学位论文.武汉: 华中农业大学, 2017: 39-59.
|
| [37] |
AKIYAMA H, FUJⅡ K, YAMASAKI O, et al. Antibacterial action of several tannins against Staphylococcus aureus[J]. Journal of Antimicrobial Chemotherapy, 2001, 48(4): 487-491. DOI:10.1093/jac/48.4.487 |
| [38] |
YODA Y, HU Z Q, SHIMAMURA T, et al. Different susceptibilities of Staphylococcus and gram-negative rods to epigallocatechin gallate[J]. Journal of Infection and Chemotherapy, 2004, 10(1): 55-58. |
| [39] |
DEHORITY B A. Rumen microbiology[M]. Nottingham: Nottingham University Press, 2003.
|
| [40] |
YEOMAN C J, WHITE B A. Gastrointestinal tract microbiota and probiotics in production animals[J]. Annual Review of Animal Biosciences, 2014, 2: 469-86. DOI:10.1146/annurev-animal-022513-114149 |
| [41] |
郭冬生, 夏维福, 彭小兰, 等. 瘤胃原虫的生理作用及驱除原虫的研究[J]. 饲料研究, 2006(8): 42-45. |
| [42] |
ABARGHUEI M J, ROUZBEHAN Y, ALIPOUR D. The influence of the grape pomace on the ruminal parameters of sheep[J]. Livestock Science, 2010, 132(1/2/3): 73-79. |
| [43] |
BHATTA R, UYENO Y, TAJIMA K, et al. Difference in the nature of tannins on in vitro ruminal methane and volatile fatty acid production and on methanogenic archaea and protozoal populations[J]. Journal of Dairy Science, 2009, 92(11): 5512-5522. DOI:10.3168/jds.2008-1441 |
| [44] |
TAN H Y, SIEO C C, ABDULLAH N, et al. Effects of condensed tannins from Leucaena on methane production, rumen fermentation and populations of methanogens and protozoa in vitro[J]. Animal Feed Science and Technology, 2011, 169(3/4): 185-193. |
| [45] |
BENCHAAR C, MCALLISTER T A, CHOUINARD P Y. Digestion, ruminal fermentation, ciliate protozoal populations, and milk production from dairy cows fed cinnamaldehyde, quebracho condensed tannin, or Yucca schidigera saponin extracts[J]. Journal of Dairy Science, 2008, 91(12): 4765-4777. DOI:10.3168/jds.2008-1338 |
| [46] |
CARULLA J E, KREUZER M, MACHMVLLER A, et al. Supplementation of Acacia mearnsii tannins decreases methanogenesis and urinary nitrogen in forage-fed sheep[J]. Australian Journal of Agricultural Research, 2005, 56(9): 961-970. DOI:10.1071/AR05022 |
| [47] |
LIMA P R, APDINI T, FREIRE A S, et al. Dietary supplementation with tannin and soybean oil on intake, digestibility, feeding behavior, ruminal protozoa and methane emission in sheep[J]. Animal Feed Science and Technology, 2019, 249: 10-17. DOI:10.1016/j.anifeedsci.2019.01.017 |
| [48] |
VASTA V, YÁÑEZ-RUIZ D R, MELE M, et al. Bacterial and protozoal communities and fatty acid profile in the rumen of sheep fed a diet containing added tannins[J]. Applied and Environmental Microbiology, 2010, 76(8): 2549-2555. DOI:10.1128/AEM.02583-09 |
| [49] |
REVERÓN I, JIMÉNEZ N, CURIEL J A, et al. Differential gene expression by Lactobacillus plantarum WCFS1 in response to phenolic compounds reveals new genes involved in tannin degradation[J]. Applied and Environmental Microbiology, 2017, 83(7): e03387-16. |
| [50] |
SAMINATHAN M, GAN H M, ABDULLAH N, et al. Changes in rumen protozoal community by condensed tannin fractions of different molecular weights from a Leucaena leucocephala hybrid in vitro[J]. Journal of Applied Microbiology, 2017, 123(1): 41-53. DOI:10.1111/jam.13477 |
| [51] |
李大彪, 于永强, 王卫云, 等. 单宁和聚乙二醇对绵羊和山羊瘤胃微生物数量和营养物质表观消化率的影响[J]. 动物营养学报, 2015, 27(10): 3155-3162. |
| [52] |
MCSWEENEY C S, PALMER B, MCNEILL D M, et al. Microbial interactions with tannins:nutritional consequences for ruminants[J]. Animal Feed Science and Technology, 2001, 91(1/2): 83-93. |
| [53] |
杨凯.单宁酸对肉牛瘤胃发酵、微生物区系、甲烷排放及氮排泄的调控规律[D].博士学位论文.北京: 中国农业大学, 2017: 28-29..
|
| [54] |
LIM S H, IBRAHIM D, KASSIM J N. Antimicrobial activities of tannin extracted from Rhizophora apiculata barks[J]. Journal of Tropical Forest Science, 2006, 18(1): 59-65. |
| [55] |
AGUILAR C N, GUTIERREZ-SANCHEZ G. Review:sources, properties, applications and potential uses of tannin acyl hydrolase[J]. Food Science and Technology International, 2001, 7(5): 373-382. DOI:10.1106/69M3-B30K-CF7Q-RJ5G |
| [56] |
ICHIKAWA K, SHIONO Y, SHINTANI T, et al. Efficient production of recombinant tannase in Aspergillus oryzae using an improved glucoamylase gene promoter[J]. Journal of Bioscience and Bioengineering, 2020, 129(2): 150-154. DOI:10.1016/j.jbiosc.2019.08.002 |
| [57] |
MIN B R, WRIGHT C, HO P, et al. The effect of phytochemical tannins-containing diet on rumen fermentation characteristics and microbial diversity dynamics in goats using 16S rDNA amplicon pyrosequencing[J]. Agriculture, Food and Analytical Bacteriology, 2014, 4(3): 195-211. |
| [58] |
JAKHESARA S J, KORINGA P G, RAMANI U V, et al. Comparative study of tannin challenged rumen microbiome in goat using high throughput sequencing technology[J]. Developmental Microbiology and Molecular Biology, 2010, 1(1): 95-106. |
| [59] |
王胤晨, 袁扬, 张锦华, 等. 反刍动物瘤胃甲烷产生的营养调控[J]. 中国牛业科学, 2015, 41(3): 100-104. |
| [60] |
何忠武. 探讨影响奶牛瘤胃甲烷产生的因素[J]. 畜牧兽医杂志, 2016, 35(6): 55-58, 60. |
| [61] |
KUMAR S, PUNIYA A K, PUNIYA M, et al. Factors affecting rumen methanogens and methane mitigation strategies[J]. World Journal of Microbiology and Biotechnology, 2009, 25(9): 1557-1566. DOI:10.1007/s11274-009-0041-3 |
| [62] |
WALLACE R J, ROOKE J A, MCKAIN N, et al. The rumen microbial metagenome associated with high methane production in cattle[J]. BMC Genomics, 2015, 16: 839. DOI:10.1186/s12864-015-2032-0 |
| [63] |
PATRA A, PARK T, KIM M, et al. Rumen methanogens and mitigation of methane emission by anti-methanogenic compounds and substances[J]. Journal of Animal Science and Biotechnology, 2017, 8: 13. DOI:10.1186/s40104-017-0145-9 |
| [64] |
BEAUCHEMIN K A, KREUZER M, O'MARA F, et al. Nutritional management for enteric methane abatement:a review[J]. Australian Journal of Experimental Agriculture, 2008, 48(1/2): 21-27. |
| [65] |
PARTHASARATHI T, CHANDRA A S, RAMANA D B V, et al. Effect of feeding tanniferous diets on methane emissions in sheep[J]. The Pharma Innovation Journal, 2018, 7(4): 434-439. |
| [66] |
SAMINATHAN M, SIEO C C, ABDULLAH N, et al. Effects of condensed tannin fractions of different molecular weights from a Leucaena leucocephala hybrid on in vitro methane production and rumen fermentation[J]. Journal of the Science of Food and Agriculture, 2015, 95(13): 2742-2749. DOI:10.1002/jsfa.7016 |
| [67] |
赵微, 沈寿东, 李成云, 等. 不同相对分子质量缩合单宁对延边黄牛瘤胃总菌、溶纤维丁酸弧菌和产甲烷菌的影响[J]. 饲料研究, 2016(17): 53-57. |
| [68] |
RIRA M, CHENTLI A, BOUFENERA S, et al. Effects of plants containing secondary metabolites on ruminal methanogenesis of sheep in vitro[J]. Energy Procedia, 2015, 74: 15-24. DOI:10.1016/j.egypro.2015.07.513 |
| [69] |
PUCHALA R, ANIMUT G, PATRA A K, et al. Methane emissions by goats consuming Sericea lespedeza at different feeding frequencies[J]. Animal Feed Science and Technology, 2012, 175(1/2): 76-84. |
| [70] |
BHATTA R, SARAVANAN M, BARUAH L, et al. Effects of graded levels of tannin-containing tropical tree leaves on in vitro rumen fermentation, total protozoa and methane production[J]. Journal of Applied Microbiology, 2015, 118(3): 557-564. DOI:10.1111/jam.12723 |
| [71] |
WITZIG M, ZEDER M, RODEHUTSCORD M. Effect of the ionophore monensin and tannin extracts supplemented to grass silage on populations of ruminal cellulolytics and methanogens in vitro[J]. Anaerobe, 2018, 50: 44-54. DOI:10.1016/j.anaerobe.2018.01.012 |
| [72] |
BENTO M H L, MAKKAR H P S, ACAMOVIC T. Effect of mimosa tannin and pectin on microbial protein synthesis and gas production during in vitro fermentation of 15N-labelled maize shoots[J]. Animal Feed Science and Technology, 2005, 123-124: 365-377. DOI:10.1016/j.anifeedsci.2005.04.022 |
| [73] |
MIN B R, BARRY T N, ATTWOOD G T, et al. The effect of condensed tannins on the nutrition and health of ruminants fed fresh temperate forages:a review[J]. Animal Feed Science and Technology, 2003, 106(1/2/3/4): 3-19. |
| [74] |
CHEN Y Q, TIAN L B, YANG F Y, et al. Tannic acid accelerates cutaneous wound healing in rats via activation of the ERK 1/2 signaling pathways[J]. Advances in Wound Care, 2019, 8(7): 341-354. DOI:10.1089/wound.2018.0853 |
| [75] |
黎智峰, 高腾云, 周传社. 单宁对反刍动物养分利用的营养机制[J]. 家畜生态学报, 2007, 28(6): 97-103. |
| [76] |
王哲奇, 徐元庆, 石璐璐, 等. 热应激对反刍动物采食和瘤胃功能的影响[J]. 动物营养学报, 2019(8): 3448-3455. |
| [77] |
TEFEREDEGNE B. New perspectives on the use of tropical plants to improve ruminant nutrition[J]. Proceedings of the Nutrition Society, 2000, 59(2): 209-214. DOI:10.1017/S0029665100000239 |
| [78] |
袁英良, 唐丹, 赖宪明, 等. 缩合单宁对肉牛过瘤胃蛋白特性的影响[J]. 中国饲料, 2018(23): 29-32. |
| [79] |
刘思扬, 李丽莉, 尹云厚, 等. 饲喂不同相对分子质量缩合单宁对延边黄牛蛋白质消化吸收的影响[J]. 饲料研究, 2015(2): 1-4. |
| [80] |
SAMINATHAN M, TAN H Y, SIEO C C, et al. Polymerization degrees, molecular weights and protein-binding affinities of condensed tannin fractions, from a Leucaena leucocephala hybrid[J]. Molecules, 2014, 19(6): 7990-8010. DOI:10.3390/molecules19067990 |
| [81] |
HUANG X D, LIANG J B, TAN H Y, et al. Protein-binding affinity of Leucaena condensed tannins of differing molecular weights[J]. Journal of Agricultural and Food Chemistry, 2011, 59(19): 10677-10682. DOI:10.1021/jf201925g |
| [82] |
MIN B R, MCNABB W C, BARRY T N, et al. Solubilization and degradation of ribulose-1, 5-bisphosphate carboxylase/oxygenase (EC4.1.1.39;Rubisco) protein from white clover (Trifolium repens) and Lotus corniculatus by rumen microorganisms and the effect of condensed tannins on these processes[J]. The Journal of Agricultural Science, 2000, 134(3): 305-317. DOI:10.1017/S0021859699007698 |
| [83] |
PATRA A K, SAXENA J. Exploitation of dietary tannins to improve rumen metabolism and ruminant nutrition[J]. Journal of the Science of Food and Agriculture, 2011, 91(1): 24-37. DOI:10.1002/jsfa.4152 |
| [84] |
金龙.紫色达利菊提取缩合单宁对大肠杆菌和瘤胃氮代谢以及瘤胃微生物的影响[D].博士学位论文.哈尔滨: 东北农业大学, 2011: 13-15.
|
| [85] |
WAGHORN G. Beneficial and detrimental effects of dietary condensed tannins for sustainable sheep and goat production-progress and challenges[J]. Animal Feed Science and Technology, 2008, 147(1/2/3): 116-139. |
| [86] |
RIESTRA S P, MUIR J P, LAMBERT B D, et al. Phosphorus and other nutrient disappearance from plants containing condensed tannins using the mobile nylon bag technique[J]. Animal Feed Science and Technology, 2010, 156(1/2): 19-25. |
| [87] |
DUTTA N, DUBEY M, BANERJEE P S, et al. Effect of supplementing tanniferous tree leaves mixture on immune response and GI nematodes in kids[J]. Livestock Research for Rural Development, 2012, 24(2): 1-10. |
| [88] |
LAKHANI N, KAMRA D N, LAKHANI P, et al. Immune status and haemato-biochemical profile of buffalo calves supplemented with phytogenic feed additives rich in tannins, saponins and essential oils[J]. Tropical Animal Health and Production, 2019, 51(3): 565-573. DOI:10.1007/s11250-018-1727-z |
| [89] |
PATHAK A K, DUTTA N, BANERJEE P S, et al. Effect of condensed tannins supplementation through leaf meal mixture on voluntary feed intake, immune response and worm burden in Haemonchus contortus infected sheep[J]. Journal of Parasitic Diseases, 2016, 40(1): 100-105. DOI:10.1007/s12639-014-0455-1 |
| [90] |
吕忠蕾.不同分子量缩合单宁对延边黄牛瘤胃发酵及微生物区系的影响[D].硕士学位论文.延吉: 延边大学, 2014: 19-23.
|
| [91] |
BONELLI F, TURINI L, SARRI G, et al. Oral administration of chestnut tannins to reduce the duration of neonatal calf diarrhea[J]. BMC Veterinary Research, 2018, 14: 227. DOI:10.1186/s12917-018-1549-2 |
| [92] |
CABRAL C, REDONDO E A, DELGADO F O. Reduction of liver abscesses in feedlot cattle by the addition of tannins on diet[J]. RIA, 2019, 45(2): 211-215. |




