2. 中国水产科学研究院淡水渔业研究中心, 农业农村部淡水渔业和种质资源利用重点实验室, 无锡 214081
2. Key Laboratory for Genetic Breeding of Aquatic Animals and Aquaculture Biology, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, China
氨基酸营养是饲料营养的重要组成部分,明确养殖鱼类的氨基酸需要量是科学、高效的饲料配方的关键,并且随着近年来水产动物氨基酸营养研究的深入,人们发现氨基酸营养在提高鱼类品质、调控鱼体代谢、增强鱼体的免疫能力等方面也显示出了巨大潜力。团头鲂(Megalobrama amblyocephala),俗称武昌鱼、鳊鱼,隶属鲤形目(Cypriniformes),鲤科(Cyprinidate),鲂属(Megalobrama),是我国淡水养殖的主要经济鱼类之一。团头鲂具有成活率高、生长较快、容易饲养和捕捞、含肉率高、味道鲜美和营养价值高等优点,深受消费者和养殖者的喜爱。团头鲂产业规模不断扩大,2018年全国团头鲂年产量达78万余t[1]。然而在世界范围内鱼粉资源短缺、价格上涨、养殖水域污染日益加重的大环境下,团头鲂养殖业也正在遭受着养殖效益欠佳、疾病频发等问题的困扰。能否利用向植物蛋白质源中补充氨基酸的形式来替代鱼粉从而节约养殖成本,能否利用氨基酸营养对于鱼体免疫、代谢的调控作用来增强鱼体免疫能力,改善鱼类品质进而提高养殖效益,相关学者已做出初步探索。本文就近几十年来在团头鲂氨基酸营养研究方面取得的成果展开综述,以期为更加优质、绿色、高效的团头鲂人工配合饲料的研发提供科学参考。
1 团头鲂的氨基酸需求蛋白质营养生理一直是水产动物营养研究的热点[2]。在水产配合饲料中,蛋白质的含量和质量是决定鱼类生长快慢和健康状况的关键因素,同时也是影响饲料总成本的关键因素[3]。蛋白质不能直接被鱼体吸收利用,必须在肠道经肠蛋白酶等消化分解为氨基酸方可被吸收利用,因此,鱼类对蛋白质的需求实质上是对氨基酸的需求,特别是对必需氨基酸的需求,即生物体自身不能合成或合成的速度不能满足机体的需要,必须从外部获取的氨基酸的需求。
1.1 团头鲂必需氨基酸需求量研究表明,团头鲂的必需氨基酸种类与其他鱼类相同,包括以下10种:赖氨酸(Lys)、蛋氨酸(Met)、精氨酸(Arg)、组氨酸(His)、亮氨酸(Leu)、异亮氨酸(Ile)、苯丙氨酸(Phe)、苏氨酸(Thr)、缬氨酸(Val)和色氨酸(Trp)[4]。为更好地满足鱼类的氨基酸需求,20世纪50年代末,Halver等[5]定量测定了大鳞大马哈鱼(Oncorhynchus keta)的10种必需氨基酸需要,即采用单因素浓度梯度试验设计法,再利用剂量-效应模型来确定必需氨基酸的需要量。20世纪80年代,陆茂英等[6]在该方法的基础上,以鱼体氨基酸组成作为参考标准,首次测定了1龄团头鲂5种必需氨基酸的需要量(表 1)。而时至今日,我国团头鲂养殖无论是从养殖条件还是养殖模式上与之前相比都有了明显的改变,因此,先前数据可能已不具备指导现阶段生产的能力。同时,随着时间的推移和人们研究的深入,团头鲂饲料的最适氨基酸含量的评价标准和分析模型也逐渐多元化,从最初的仅以增重率和饵料系数等生长性能作为评价标准,剂量-效应作为分析模型,到如今的以特定生长率、蛋白质效率、氮沉积率等指标共同作为判据,同时运用析因模型、二阶多项式回归模型等作为分析模型,研究对象的生长阶段也从成鱼阶段转向氨基酸需求更为旺盛的幼鱼阶段,以求更精确的数据来更好得服务养殖业。
|
|
表 1 团头鲂养成鱼(>50 g)部分必需氨基酸需要量(干物质基础) Table 1 Selected amino acid requirement of pre-adult blunt snout bream (>50 g) (DM basis) |
基于新的研究方法和模型,相关研究人员开展了团头鲂成鱼对蛋氨酸、赖氨酸、精氨酸需要量的测定工作以及幼鱼阶段对10种必需氨基酸需要量的研究(表 1和表 2)。
|
|
表 2 团头鲂幼鱼(<50 g)必需氨基酸的需要量(干物质基础) Table 2 Requirement of amino acids of juvenile blunt snout bream (< 50 g) (DM basis) |
饲料蛋白质水平和饲料蛋白质源的质量是影响团头鲂氨基酸需求的重要因素之一,主要体现在2方面:1)鱼粉、豆粕、菜籽粕等作为团头鲂人工配合饲料中常用的蛋白质源,它们之间存着氨基酸组成上的差异,而这往往会表现为团头鲂对不同蛋白质源的消化利用能力上的差异。姜雪姣等[20]的研究发现,团头鲂对玉米中各项氨基酸表观消化率较低,特别是赖氨酸,作为玉米中的第一限制性氨基酸,其消化率仅为30.84%,而碎米中赖氨酸表观消化率则较高,达到91.25%。这可能进一步影响到鱼类生长性能,从而导致需要量的估值偏差。此外,饲料中的蛋白质水平同样也会影响氨基酸需求量,Kim等[21]在虹鳟(Oncorhynchus mykiss)中研究发现当饲料蛋白质含量从24%提高到35%以后,精氨酸的需要量从6.67%降低至4.03%。2)棉籽粕、豆粕等植物蛋白质源中通常含有抗营养因子,一些抗营养因子会直接对水产养殖动物产生毒害作用。周群兰[22]发现饲喂高水平菜籽粕饲料时,团头鲂幼鱼的生长受到抑制,这可能因为菜籽粕中存在如异硫氰酸酯、植酸、单宁等抗营养物质,从而导致团头鲂摄食率和饲料利用率降低,进而影响鱼体生长。
1.2.2 不同氨基酸之间的相互作用饲料的几种特定氨基酸之间存在着特定的相互作用,如拮抗作用、互补作用等,也会影响鱼体对氨基酸的吸收,其中比较显著的是特定氨基酸之间的拮抗作用,以赖氨酸-精氨酸的拮抗作用最为典型。
有关赖氨酸与精氨酸之间的拮抗作用,在陆生动物的研究中早已被证实。廖英杰等[23]发现团头鲂幼鱼血清中精氨酸和赖氨酸的含量呈相反趋势,推测团头鲂也存在该拮抗作用。而后,Ren等[13]、Liang等[24]的后续研究也进一步证实在团头鲂中确实存在精氨酸与赖氨酸的拮抗作用。这种拮抗作用的出现可能与氨基酸结构有关,精氨酸和赖氨酸同属碱性氨基酸,在被生物体吸收时由相同转运系统负责转运,存在着吸收竞争,故会产生拮抗作用[25]。但在虹鳟[26]、牙鲆(Paralichthys olivaceus)[27]、鲫鱼(Carassis auratus gibelio var.CAS Ⅲ)[28]的相关研究中则未发现赖氨酸与精氨酸之间的拮抗作用,这可能与物种特异性有关。此外,Ren等[14]还发现团头鲂支链氨基酸之间也存在拮抗作用,在团头鲂饲料中补充异亮氨酸后发现血浆中异亮氨酸含量显著增加,而血浆缬氨酸和亮氨酸含量呈相反的趋势。Wilson等[29]在斑点叉尾(Ictalurus punctatus)研究中发现,当饲料中亮氨酸摄入量低于最适量时,会对其血清异亮氨酸和缬氨酸含量产生显著影响。Yamamoto等[30]对虹鳟的研究中也报道了这种支链氨基酸之间的拮抗作用。
基于不同试验鱼为什么会产生不同的试验结果,是否还有其他尚未发现的氨基酸互作、氨基酸之间的相互作用如何合理利用到实际生产上等问题,仍有待于进一步研究探索。
2 氨基酸对团头鲂生理功能的影响及其影响机制氨基酸作为信号分子参与机体多种生理进程的调控受到了越来越多的关注[31]。在高等动物中的研究已表明,氨基酸除作为代谢底物参与蛋白质的合成外,还可作为一种信号因子引起不同的细胞应答,并通过相关细胞通路的介导,调控下游效应因子,从而实现蛋白质的合成与降解、基因表达与抑制以及其他营养素的新陈代谢,最终表现为宏观性状的差异[31-33]。
2.1 氨基酸与鱼体代谢 2.1.1 蛋白质合成代谢研究人员发现,在饲料中添加一定水平的蛋氨酸[7]、赖氨酸[11]、苏氨酸[12]、亮氨酸[15]、苯丙氨酸[17]、组氨酸[19]、精氨酸[24]等均有利于提高团头鲂体蛋白质合成效率,促进鱼体蛋白质沉积。研究表明,添加氨基酸之所以能够提高鱼体蛋白质沉积量,除可通过建立氨基酸平衡提高蛋白质合成效率外,更重要的是氨基酸可作为信号因子激活以雷帕霉素靶蛋白(TOR)信号通路为代表的蛋白质合成信号通路,从而调节团头鲂蛋白质代谢。TOR是一种高度保守的丝氨酸/苏氨酸激酶,它调控多种细胞活动,其中最重要的就是蛋白质的翻译起始调控[34-35]。在人类和大鼠上的研究表明,饲料补充亮氨酸可激活在翻译起始中起重要作用的TOR信号通路从而调控蛋白质合成[36]。Liang等[37]发现在团头鲂饲料中补充适量的亮氨酸可以激活TOR信号因子,进而磷酸化下游S6蛋白激酶1(S6K1),进一步调控mRNA的翻译,从而调控团头鲂的蛋白质合成代谢。在异亮氨酸[14]、组氨酸[19]、精氨酸[24]的试验中也发现了类似结果。此外,氨基酸除可磷酸化TOR下游的S6K1外,还可通过磷酸化TOR下游的eIF4E结合蛋白1(eIF4EBP1)来调控蛋白质合成[38-39]。而团头鲂蛋白质分解代谢相关研究尚未见报道,因此,团头鲂蛋白质代谢相关调控机制尚不清晰还需进一步研究。
2.1.2 糖脂代谢有关氨基酸与机体糖脂代谢的研究由来已久,早在20世纪50年代, 人们就发现氨基酸除了作为蛋白质合成底物外,同时也是糖异生底物[40-41]。试验发现,受试者在静脉注射氨基酸后,血浆中的胰岛素含量显著升高[42-43],表明氨基酸可能在机体糖代谢中发挥着重要作用,而后陆续的研究结果表明,氨基酸尤其是支链氨基酸以及芳香族氨基酸在机体糖脂代谢中发挥重要作用。Liang等[37]研究发现, 当饲料亮氨酸水平适宜(1.72%)时,亮氨酸会通过调控TOR-蛋白激酶B(Akt)信号通路核心因子基因mRNA和蛋白的表达水平,提高胰岛素信号通路敏感性和糖代谢能力,促进胰岛素分泌和糖酵解,从而降低血糖;而过量的亮氨酸水平(2.94%)会导致S6K1的mRNA和蛋白水平的高表达,并通过负反馈调控机制降低胰岛素受体底物-1(IRS-1)、磷脂酰肌醇3激酶(PI3K)、Akt等胰岛素信号通路相关mRNA和蛋白表达水平,进而降低胰岛素通路的敏感性和糖代谢能力,导致胰岛素抵抗,从而促进糖异生,引发高血糖现象。在团头鲂精氨酸研究中也发现:适宜水平(2.31%)精氨酸能促进糖代谢,而过量水平(2.70%)则形成胰岛素抵抗,导致高血糖(图 1)[44]。同样在苯丙氨酸[17]、组氨酸[19]的研究中也发现类似结果。有趣的是,氨基酸的糖调控机制似乎是特异性的,Ji等[18]研究发现,团头鲂血糖含量会随着饲料色氨酸水平的升高而降低,在达到3.95 g/kg后开始升高,并且胰岛素样生长因子-1(IGF-1)含量在低色氨酸水平(0.79 g/kg)时最高, 高色氨酸水平(2.80 g/kg)的饲料则显著降低了IGF-1的mRNA水平。IGF-1是一种生物活性肽,在分子结构和功能上与胰岛素相似[45],研究表明,IGF-1的含量和表达水平受氨基酸等营养状态的影响[46],并且Bouraoui等[47]研究发现,IGF-1比胰岛素更能促进葡萄糖代谢,这就说明可能是低色氨酸水平导致IGF-1的高表达,从而降低血糖。团头鲂中氨基酸调控脂肪代谢相关研究较少。仅有少量研究发现,部分氨基酸除可调控机体糖代谢外,还可参与脂肪合成调控。饲料中适宜水平的精氨酸[44]、亮氨酸[37]可通过上调脂肪酸合成酶(FAS)和乙酰辅酶A羧化酶(ACC)等脂肪合成核心基因的表达,从而促进脂肪合成和提高团头鲂幼鱼体脂肪含量。这与在色氨酸[37]研究中发现的结果类似,当色氨酸水平为3.95 g/kg时,全身脂肪含量显著上升。而在异亮氨酸研究中则发现,适宜饲料异亮氨酸水平(14.2 g/kg)会显著降低全身脂肪含量,并且内脏脂肪指数也显著降低[14]。这表明不同氨基酸对鱼体脂肪代谢的调控作用不尽相同。有关于不同氨基酸对于鱼体脂肪代谢调控机制仍需继续深入研究。
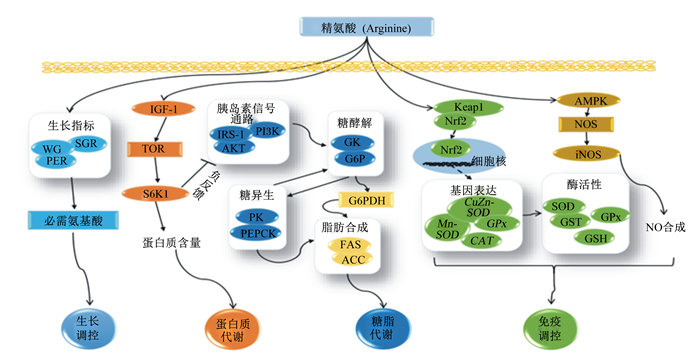
|
WG:增重weight gain;SGR:特定生长率specific growth rate;PER:蛋白质效率protein efficiency ratio;GK:葡萄糖激酶glucose kinase; G6P:葡萄糖-6-磷酸酶glucose-6-phosphatase;G6PDH:葡萄糖-6-磷酸脱氢酶glucose-6-phosphate dehydrogenase;PK:丙酮酸激酶pyruvate kinase;PEPCK:磷酸烯醇丙酮酸羧激酶phosphoenolpyruvate carboxy kinase;CuZn-SOD:铜锌超氧化物歧化酶Cu/Zn superoxide dismutase;CAT:过氧化氢酶catalase;SOD:超氧化物歧化酶superoxide dismutase;GST:谷胱甘肽巯基转移酶glutathione thiol transferase;IGF-1:胰岛素样生长因子-1 insulin like growth factor-1; TOR:雷帕霉素靶蛋白mammalian target of rapamycin; AKT:蛋白激酶B protein kinase; S6K1:S6蛋白激酶1 S6 protein kinase 1;ISR-1:胰岛素受体底物-1 insulin receptor substrate-1;PI3K:磷脂酰肌醇3激酶phosphatidylinositol 3 kinase; FAS:脂肪酸合成酶fatty acid synthetase; ACC:乙酰辅酶A羧化酶acetyl-CoA carboxylase; Keap1:Kelch样环氧氯丙烷相关蛋白-1 Kelch-like epichlorohydrin related proteins-1;Nrf2:核因子2相关因子nuclear factor 2 correlation factor; GPx:过氧化物酶peroxidase; AMPK:腺苷酸活化蛋白激酶AMP-activated protein kinase;NOS:一氧化氮合成酶nitric oxide synthetase; iNOS:诱导型一氧化氮合成酶inducible nitric oxide synthase;GSH:谷胱甘肽glutathione; NO:一氧化氮nitric oxide。 图 1 团头鲂饲料精氨酸营养生理研究 Fig. 1 Study on nutritional physiology of dietary arginine in blunt snout bream[13, 24, 44, 53, 73] |
高密度、集约化的养殖模式在增加养殖效益的同时,也会在一定程度加大养殖生物所受到的应激,增加养殖生物的患病风险,并且水体环境较为复杂,传统化学药品对鱼病的治疗作用并不理想,所以鱼病一旦爆发养殖效益就会“大打折扣”,甚至于“颗粒无收”。为减少对化学药品的依赖和氧化应激对鱼体的损伤,降低鱼病带来的经济损失,通过向饲料中添加氨基酸、益生菌及甘露寡糖等特定的营养素来增强免疫功能的“营养免疫”研究,受到了越来越多的关注[48]。蛋白质和氨基酸是构成机体免疫系统的物质基础,目前关于氨基酸营养与免疫系统的相关研究在哺乳动物上已有广泛报道,而水产动物氨基酸营养免疫研究起步较晚,近年来才逐步开展。
2.2.1 抗氧化能力鱼体的抗氧化能力主要由非酶防御[谷胱甘肽(GSH)]和抗氧化酶[如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)]2部分组成[49-50]。丙二醛(MDA)是一种脂质过氧化物,可以反映机体的过氧化状态[51]。Ji等[52]在团头鲂色氨酸研究中发现,0.28%的色氨酸水平显著降低了团头鲂血浆中的MDA含量,说明色氨酸对团头鲂的脂质过氧化有抑制作用。这与精氨酸[53]、组氨酸[54]中的研究结果相类似:适宜水平的精氨酸、组氨酸可以显著降低鱼体中的MDA含量。并且类似结果在草鱼(Ctenophyngodon Idella)[55]中也有报道。GSH是一种能清除O2-和H2O2的小分子非抗氧化酶清除剂,在色氨酸的研究中,发现饲料随色氨酸水平的增加,GSH含量也在不断增加,在0.40%色氨酸水平下达到最大值。这与团头鲂组氨酸研究中的报道[54]相一致。以上研究结果都表明,一些特定氨基酸可以通过调控以GSH为代表的非酶抗氧化物质的含量,来提高鱼体的抗氧化能力。
抗氧化酶是鱼体抗氧化能力的另一个重要组成部分,抗氧化酶和基因是鱼体防御氧化应激的主要细胞保护机制[56],提高鱼体抗氧化能力可有效降低养殖活动中由于氧化应激而对养殖鱼类产生的危害。Liang等[53]在团头鲂精氨酸研究中发现,适宜饲料精氨酸水平(1.62%)显著提高团头鲂锰超氧化物歧化酶(Mn-SOD)、谷胱甘肽过氧化物酶(GPx)、CAT等活性。类似结果在色氨酸[52]、组氨酸[54]的研究中也有报道。在鱼类中,抗氧化酶活性与其mRNA水平密切相关[57],而抗氧化基因的表达已被证明主要受红系衍生的核因子2相关因子(Nrf2)-Kelch样环氧氯丙烷相关蛋白1(Keap1)信号通路的调控[58],Keap1是Nrf2的细胞抑制因子,会阻碍Nrf2的核转移与表达[58],Keap1解离后,Nrf2移入细胞核内,调控下游抗氧化基因表达[59]。氨基酸营养可以激活Nrf2-Keap1信号通路,Liang等[53]研究发现,适宜的饲料精氨酸水平可使团头鲂幼鱼肠道Nrf2基因相对表达水平上调,而Keap1的基因相对表达水平与Nrf2基因相对表达水平呈相反的趋势,Mn-SOD、GPx等抗氧化酶基因的相对表达水平与Nrf2基因相对表达水平呈正相关。这说明饲料适宜精氨酸水平可能通过抑制Keap1基因相对表达水平,诱导激活Nrf2基因表达,从而增强下游抗氧化基因的表达(图 1)。此外,研究还发现色氨酸[52]、组氨酸[54]、亮氨酸[60]、苏氨酸[61]同样可以影响活Nrf2-Keap1信号通路,从而调控下游抗氧化酶基因的表达。
2.2.2 免疫调节 2.2.2.1 血液学参数血液学参数可以有效反映鱼体的生理状态与健康状况[62-63],其中补体3(C3)、补体4(C4)、免疫球蛋白M(IgM)的含量可充分反映鱼体的免疫能力。研究发现,适宜水平的精氨酸[53]、亮氨酸[60]、苏氨酸[61]均可提高血浆中红细胞跟血红蛋白等的含量,其中亮氨酸和苏氨酸还可提高血浆C3、IgM含量,而组氨酸[54]则对血浆参数无显著影响。在哺乳动物中,Tan等[64]报道,最佳的饮食精氨酸水平可以增加早期断奶仔猪的白细胞数量。有关氨基酸与血液学参数的具体影响机制有待进一步研究。
2.2.2.2 免疫因子炎症被认为是鱼类免疫反应的主要部分,主要由细胞因子介导[65]。肿瘤坏死因子-α(TNF-α)和白细胞介素-8(IL-8)以及白细胞介素-1β(IL-1β)是鱼类体内重要的促炎细胞因子[66],白细胞介素-10(IL-10)和转化生长因子-β(TGF-β)是鱼体内主要的抗炎细胞因子,可抑制炎症反应[67]。Yang等[54]研究发现当饲料中组氨酸水平适宜时,可抑制团头鲂体内促炎细胞因子(IL-8和TNF-α)的mRNA表达水平,并上调抗炎细胞因子(IL-10和TGF-β)的mRNA表达水平,从而预防或减轻鱼体炎症反应。与之相似,在色氨酸[52]、精氨酸[53]、亮氨酸[60]、苏氨酸[61]的营养免疫研究中也发现了类似结果。并且在Liang等[53]进行的精氨酸研究中发现,最佳精氨酸水平显著抑制核转录因子-κB(NF-κB)基因相对表达水平,且与IL-1β和TNF-α基因相对表达水平呈正相关,此外,抗炎细胞因子基因相对表达与NF-κB基因相对表达水平呈负相关。这表明精氨酸可能是通过下调NF-κB基因相对表达水平,从而抑制促炎细胞因子基因表达,在团头鲂色氨酸研究[52]以及Wang等[68]在草鱼中的研究也报道了类似结果。
一氧化氮(NO)为生物体内的活性氮自由基,也是一种重要的信使分子,在调节机体免疫功能和炎症反应方面起着关键性作用,机体心血管系统、神经系统和免疫系统稳态都需要NO的参与[69-71]。精氨酸是生理水平上最具功能的氨基酸[72],它除了可提高机体抗氧化能力、介导炎症因子产生、促进免疫球蛋白合成[53]之外,还是NO的唯一供氮前体。Liang等[73]研究发现,在正常状态下(未注射嗜水气单胞菌),适宜的精氨酸水平可以增加团头鲂血清NO含量,提高一氧化氮合成酶(NOS)和诱导型一氧化氮合成酶(iNOS)的活性,而在在攻毒试验中发现,当团头鲂受到外源性嗜水气单胞菌应激时,会导致团头鲂血清NO含量和NOS和iNOS的活性激增,从而去抵抗嗜水气单胞菌产生的应激作用。而这种调控作用是由于精氨酸可以激活腺苷酸活化蛋白激酶(AMPK)-NO信号通路,调控下游NOS及iNOS基因的表达,从而促进NO合成(图 1)。
2.3 氨基酸与生长性能氨基酸对于机体蛋白质、糖脂代谢以及抗氧化能力、免疫的调控最终表现为生长上的差异。在团头鲂研究中,研究人员发现在饲料中添加适宜水平的蛋氨酸[10]、赖氨酸[11]、苏氨酸[12]、精氨酸[13]、异亮氨酸[14]、亮氨酸[15]、缬氨酸[16]、苯丙氨酸[17]、色氨酸[18]、组氨酸[19],10种必需氨基酸均可有效促进团头鲂幼鱼生长,并且蛋氨酸、赖氨酸、异亮氨酸、缬氨酸还可提高饲料蛋白质利用率,降低饲料系数,而当氨基酸水平缺乏或者过量时则会降低团头鲂的生长性能。研究进一步发现,适宜的饲料氨基酸水平可以激活以血浆IGF-1[18-19, 24]等为代表的生长调节核心元件的基因表达,从而提高鱼类的生长。
团头鲂饲料中补充10种必需氨基酸的营养生理功能如表 3所示。
|
|
表 3 团头鲂饲料中补充10种必需氨基酸的生理功能 Table 3 Physiological function of adding ten kinds of essential amino acids to diet of blunt snout bream |
鱼粉作为一种氨基酸含量高且组成合理的原料已被广泛运用到各种渔用配合饲料中,但因其在世界范围内需求不断增加,但资源产量逐年减少,价格逐年升高,为保证水产养殖业的健康可持续发展,寻求植物蛋白质等替代蛋白质源已经成为鱼类营养研究的热点[75],而玉米蛋白粉、豆粕等植物蛋白质源存在先天不足——自身氨基酸模式组成不合理。对于机体来说,只有当饲料中的各种氨基酸尤其是必需氨基酸组成越平衡即越接近“理想蛋白质模式”,机体吸收、生长性能才越好。理想蛋白质的相关研究已在猪等畜禽中广泛开展[76],近年来也有若干试验研究理想蛋白质模式在鱼类中的应用[77-81]。相关学者通过研究已经建立了团头鲂10种必需氨基酸数据库,并以此为基础构建了团头鲂氨基酸平衡模式。在此基础上,有学者[82-83]开展了在团头鲂人工配合饲料中利用植物蛋白质源替代鱼粉的相关研究,研究发现在以植物蛋白质作为主要蛋白质源的沉性及浮性膨化饲料中,通过补充必需氨基酸后完全可以替代以鱼粉等为主要蛋白质源的饲料,且均未对生长性能、饲料利用率和鱼体组成产生任何不良影响。但在其他水产动物如大菱鲆(Psetta maxima)[84]、大西洋鳕鱼(Gadus morhua L.)[85]等的研究中则报道了相反结果:生长性能并未得到改善,造成差异的原因可能是由于鱼类在食性、年龄、基础饲料、饲料适口性和环境条件方面的特殊性造成的[82]。
4 小结在国内外科研工作者的共同努力下,团头鲂必需氨基酸营养数据库已初步构建完毕,并且在氨基酸营养与团头鲂免疫、代谢调控方面也取得长足的进展。更为重要的,在利用氨基酸平衡模式通过补充晶体氨基酸的方式使植物蛋白质源作为主要饲料蛋白质源替代传统动物蛋白质源方面也取得突破性的进展,这些都为更加绿色、经济、高效的团头鲂人工配合饲料的研发提供了科学参考。水产养殖业的发展离不开优质水产饲料,Li等[86]学者立足于“新时期”提出了水产饲料的新方向,即朝着“功能性与环境导向”发展。而氨基酸营养在增强机体特定生理功能,调节鱼体氨氮排放方面已显示出巨大潜力,因此,在今后水产饲料开发中氨基酸营养也必将继续扮演重要“角色”。
| [1] |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 中国渔业统计年鉴-2019[M]. 北京: 中国农业出版社, 2019: 25.
|
| [2] |
任鸣春, 周群兰, 缪凌鸿, 等. 团头鲂营养需求与健康研究进展[J]. 水产学报, 2015, 39(5): 761-768. |
| [3] |
周凡, 邵庆均. 鱼类必需氨基酸营养研究进展[J]. 饲料与畜牧, 2010(8): 20-26. |
| [4] |
JOBLING M. National Research Council (NRC):Nutrient requirements of fish and shrimp[J]. Aquaculture International, 2012, 20(3): 601-602. DOI:10.1007/s10499-011-9480-6 |
| [5] |
HALVER J E, DELONG D C, MERTZ E T. Nutrition of salmonoid fishes:Ⅴ.Classification of essential amino acids for chinook salmon[J]. The Journal of Nutrition, 1957, 63(1): 95-105. DOI:10.1093/jn/63.1.95 |
| [6] |
陆茂英, 石文雷, 刘梅珍, 等. 团头鲂对饲料中五种必需氨基酸的需要量[J]. 水产学报, 1992, 16(1): 40-49. |
| [7] |
LIANG H L, REN M C, HABTE-TSION H M, et al. Dietary methionine requirement of pre-adult blunt snout bream, (Megalobrama amblycephala Yih, 1955)[J]. Journal of Applied Ichthyology, 2016, 32(6): 1171-1178. DOI:10.1111/jai.13117 |
| [8] |
宋长友, 任鸣春, 谢骏, 等. 不同生长阶段团头鲂的赖氨酸需要量研究[J]. 上海海洋大学学报, 2016, 25(3): 396-405. |
| [9] |
ZHAO Z X, REN M C, XIE J, et al. Dietary arginine requirement for blunt snout bream (Megalobrama amblycephala) with two fish sizes associated with growth performance and plasma parameters[J]. Turkish Journal of Fisheries and Aquatic Sciences, 2017, 17(1): 171-179. |
| [10] |
LIAO Y J, REN M C, LIU B, et al. Dietary methionine requirement of juvenile blunt snout bream (Megalobrama amblycephala) at a constant dietary cystine level[J]. Aquaculture Nutrition, 2014, 20(6): 741-752. DOI:10.1111/anu.12131 |
| [11] |
廖英杰, 刘波, 任鸣春, 等. 赖氨酸对团头鲂幼鱼生长、血清生化及游离必需氨基酸的影响[J]. 水产学报, 2013, 37(11): 1716-1724. |
| [12] |
HABTE-TSION H, LIU B, REN M C, et al. Dietary threonine requirement of juvenile blunt snout bream (Megalobrama amblycephala)[J]. Aquaculture, 2015, 437: 304-311. DOI:10.1016/j.aquaculture.2014.12.018 |
| [13] |
REN M C, LIAO Y J, XIE J, et al. Dietary arginine requirement of juvenile blunt snout bream, Megalobrama amblycephala[J]. Aquaculture, 2013, 414-415: 229-234. DOI:10.1016/j.aquaculture.2013.08.021 |
| [14] |
REN M, HABTE-TSION H M, LIU B, et al. Dietary isoleucine requirement of juvenile blunt snout bream, Megalobrama amblycephala[J]. Aquaculture Nutrition, 2017, 23(2): 322-330. DOI:10.1111/anu.12396 |
| [15] |
REN M C, HABTE-TSION H M, LIU B, et al. Dietary leucine level affects growth performance, whole body composition, plasma parameters and relative expression of TOR and TNF-α in juvenile blunt snout bream, Megalobrama amblycephala[J]. Aquaculture, 2015, 448: 162-168. DOI:10.1016/j.aquaculture.2015.06.008 |
| [16] |
REN M C, HABTE-TSION H M, LIU B, et al. Dietary valine requirement of juvenile blunt snout bream (Megalobrama amblycephala Yih, 1955)[J]. Journal of Applied Ichthyology, 2015, 31(6): 1086-1092. DOI:10.1111/jai.12911 |
| [17] |
REN M C, LIU B, HABTE-TSION H M, et al. Dietary phenylalanine requirement and tyrosine replacement value for phenylalanine of juvenile blunt snout bream, Megalobrama amblycephala[J]. Aquaculture, 2015, 442: 51-57. DOI:10.1016/j.aquaculture.2015.02.029 |
| [18] |
JI K, LIANG H, CHISOMO-KASIYA H, et al. Effects of dietary tryptophan levels on growth performance, whole body composition and gene expression levels related to glycometabolism for juvenile blunt snout bream, Megalobrama amblycephala[J]. Aquaculture Nutrition, 2018, 24(5): 1474-1483. DOI:10.1111/anu.12684 |
| [19] |
WILSON-AROP O M, LIANG H, GE X, et al. Dietary histidine requirement of juvenile blunt snout bream (Megalobrama amblycephala)[J]. Aquaculture Nutrition, 2018, 24(3): 1122-1132. DOI:10.1111/anu.12651 |
| [20] |
姜雪姣, 梁丹妮, 刘文斌, 等. 团头鲂对8种非常规饲料原料中营养物质的表观消化率[J]. 水产学报, 2011, 35(6): 932-939. |
| [21] |
KIM K I. Re-evaluation of protein and amino acid requirements of rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 1997, 151(1/2/3/4): 3-7. |
| [22] |
周群兰.棉粕和菜粕经TOR、AAR信号通路调控团头鲂生长及肠道微生态的研究[D].博士学位论文.南京: 南京农业大学, 2016.
|
| [23] |
廖英杰, 刘波, 任鸣春, 等. 精氨酸对团头鲂幼鱼生长、血清游离精氨酸和赖氨酸、血液生化及免疫指标的影响[J]. 中国水产科学, 2014, 21(3): 549-559. |
| [24] |
LIANG H L, REN M C, HABTE-TSION H M, et al. Dietary arginine affects growth performance, plasma amino acid contents and gene expressions of the TOR signaling pathway in juvenile blunt snout bream, Megalobrama amblycephala[J]. Aquaculture, 2016, 461: 1-8. DOI:10.1016/j.aquaculture.2016.04.009 |
| [25] |
KAUSHIK S J, FAUCONNEAU B. Effects of lysine administration on plasma arginine and on some nitrogenous catabolites in rainbow trout[J]. Comparative Biochemistry and Physiology Part A:Physiology, 1984, 79(3): 459-462. DOI:10.1016/0300-9629(84)90546-2 |
| [26] |
KACZANOWSKI T C, BEAMISH F W H. Dietary essential amino acids and heat increment in rainbow trout (Oncorhynchus mykiss)[J]. Fish Physiology and Biochemistry, 1996, 15(2): 105-120. DOI:10.1007/BF01875590 |
| [27] |
ALAM M S, TESHIMA S I, KOSHIO S, et al. Arginine requirement of juvenile Japanese flounder Paralichthys olivaceus estimated by growth and biochemical parameters[J]. Aquaculture, 2002, 205(1/2): 127-140. |
| [28] |
TU Y Q, XIE S Q, HAN D, et al. Dietary arginine requirement for gibel carp (Carassis auratus gibelio var.CAS Ⅲ) reduces with fish size from 50 g to 150 g associated with modulation of genes involved in TOR signaling pathway[J]. Aquaculture, 2015, 449: 37-47. DOI:10.1016/j.aquaculture.2015.02.031 |
| [29] |
WILSON R P, POE W E, ROBINSON E H. Leucine, isoleucine, valine and histidine requirements of fingerling channel catfish[J]. The Journal of Nutrition, 1980, 110(4): 627-633. DOI:10.1093/jn/110.4.627 |
| [30] |
YAMAMOTO T, SHIMA T, FURUITA H. Antagonistic effects of branched-chain amino acids induced by excess protein-bound leucine in diets for rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 2004, 232(1/2/3/4): 539-550. |
| [31] |
NAIR K S, SHORT K R. Hormonal and signaling role of branched-chain amino acids[J]. The Journal of Nutrition, 2005, 135(6): 1547S-1552S. DOI:10.1093/jn/135.6.1547S |
| [32] |
GALLINETTI J, HARPUTLUGIL E, MITCHELL J R. Amino acid sensing in dietary-restriction-mediated longevity:roles of signal-transducing kinases GCN2 and TOR[J]. Biochemical Journal, 2012, 449(1): 1-10. |
| [33] |
许丹丹, 何艮. 氨基酸感知与代谢调控的研究进展[J]. 动物营养学报, 2015, 27(2): 342-351. |
| [34] |
JOUSSE C, AVEROUS J, BRUHAT A, et al. Amino acids as regulators of gene expression:molecular mechanisms[J]. Biochemical and Biophysical Research Communications, 2004, 313(2): 447-452. DOI:10.1016/j.bbrc.2003.07.020 |
| [35] |
SEO J, FORTUNO Ⅲ E S, SUH J M, et al. Atf4 regulates obesity, glucose homeostasis, and energy expenditure[J]. Diabetes, 2009, 58(11): 2565-2573. DOI:10.2337/db09-0335 |
| [36] |
LI F N, YIN Y L, TAN B, et al. Leucine nutrition in animals and humans:mTOR signaling and beyond[J]. Amino Acids, 2011, 41(5): 1185-1193. DOI:10.1007/s00726-011-0983-2 |
| [37] |
LIANG H L, MOKRANI A, CHISOMO-KASIYA H, et al. Dietary leucine affects glucose metabolism and lipogenesis involved in TOR/PI3K/Akt signaling pathway for juvenile blunt snout bream Megalobrama amblycephala[J]. Fish Physiology and Biochemistry, 2019, 45(2): 719-732. DOI:10.1007/s10695-018-0594-x |
| [38] |
GINGRAS A, KENNEDY S G, OLEARY M A, et al. 4E-BP1, a repressor of mRNA translation, is phosphorylated and inactivated by the Akt(PKB) signaling pathway[J]. Genes & Development, 1998, 12(4): 502-513. |
| [39] |
JEFFERSON L S, KIMBALL S R. Amino acid regulation of gene expression[J]. The Journal of Nutrition, 2001, 131(9): 2460S-2466S. DOI:10.1093/jn/131.9.2460S |
| [40] |
吕子全, 郭非凡. 氨基酸感应与糖脂代谢调控的研究进展[J]. 生命科学, 2013, 25(2): 152-157. |
| [41] |
FELIG P. Amino acid metabolism in man[J]. Annual Review of Biochemistry, 1975, 44(1): 933-955. |
| [42] |
VAN LOON L J C, KRUIJSHOOP M, MENHEERE P P C A, et al. Amino acid ingestion strongly enhances insulin secretion in patients with long-term type 2 diabetes[J]. Diabetes Care, 2003, 26(3): 625-630. DOI:10.2337/diacare.26.3.625 |
| [43] |
VAN LOON C L U C. Amino acids as pharmaco-nutrients for the treatment of type 2 diabetes[J]. Immunology Endocrine & Metabolic Agents in Medicinal Chemistry, 2007, 7(1): 39-48. |
| [44] |
LIANG H L, HABTE-TSION H M, GE X P, et al. Dietary arginine affects the insulin signaling pathway, glucose metabolism and lipogenesis in juvenile blunt snout bream Megalobrama amblycephala[J]. Scientific Reports, 2017, 7: 7864. DOI:10.1038/s41598-017-06104-3 |
| [45] |
ENES P, SANCHEZ-GURMACHES J, NAVARRO I, et al. Role of insulin and IGF-Ⅰ on the regulation of glucose metabolism in European sea bass (Dicentrarchus labrax) fed with different dietary carbohydrate levels[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2010, 157(4): 346-353. |
| [46] |
BRAMELD J M, GILMOUR R S, BUTTERY P J. Glucose and amino acids interact with hormones to control expression of insulin-like growth factor-Ⅰ and growth hormone receptor mRNA in cultured pig hepatocytes[J]. The Journal of Nutrition, 1999, 129(7): 1298-1306. DOI:10.1093/jn/129.7.1298 |
| [47] |
BOURAOUI L, CAPILLA E, GUTIÉRREZ J, et al. Insulin and insulin-like growth factor Ⅰ signaling pathways in rainbow trout (Oncorhynchus mykiss) during adipogenesis and their implication in glucose uptake[J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2010, 299(1): R33-R41. DOI:10.1152/ajpregu.00457.2009 |
| [48] |
KIRON V. Fish immune system and its nutritional modulation for preventive health care[J]. Animal Feed Science and Technology, 2012, 173(1/2): 111-133. |
| [49] |
MARTÍNEZ-ÁLVAREZ R M, MORALES A E, SANZ A. Antioxidant defenses in fish:biotic and abiotic factors[J]. Reviews in Fish Biology and Fisheries, 2005, 15(1): 75-88. |
| [50] |
JOS Á, PICHARDO S, PRIETO A I, et al. Toxic cyanobacterial cells containing microcystins induce oxidative stress in exposed tilapia fish (Oreochromis sp.) under laboratory conditions[J]. Aquatic Toxicology, 2005, 72(3): 261-271. DOI:10.1016/j.aquatox.2005.01.003 |
| [51] |
RANA T, BERA A K, DAS S, et al. Effect of chronic intake of arsenic-contaminated water on blood oxidative stress indices in cattle in an arsenic-affected zone[J]. Ecotoxicology and Environmental Safety, 2010, 73(6): 1327-1332. DOI:10.1016/j.ecoenv.2010.06.002 |
| [52] |
JI K, LIANG H L, REN M C, et al. Effects of dietary tryptophan levels on antioxidant status and immunity for juvenile blunt snout bream (Megalobrama amblycephala) involved in Nrf2 and TOR signaling pathway[J]. Fish & Shellfish Immunology, 2019, 93: 474-483. |
| [53] |
LIANG H L, MOKRANI A, JI K, et al. Effects of dietary arginine on intestinal antioxidant status and immunity involved in Nrf2 and NF-κB signaling pathway in juvenile blunt snout bream, Megalobrama amblycephala[J]. Fish & Shellfish Immunology, 2018, 82: 243-249. |
| [54] |
YANG Q, LIANG H L, MOKRANI A, et al. Dietary histidine affects intestinal antioxidant enzyme activities, antioxidant gene expressions and inflammatory factors in juvenile blunt snout bream (Megalobrama amblycephala)[J]. Aquaculture Nutrition, 2019, 25(1): 249-259. DOI:10.1111/anu.12847 |
| [55] |
WEN H L, FENG L, JIANG W D, et al. Dietary tryptophan modulates intestinal immune response, barrier function, antioxidant status and gene expression of TOR and Nrf2 in young grass carp (Ctenopharyngodon idella)[J]. Fish & Shellfish Immunology, 2014, 40(1): 275-287. |
| [56] |
MOURENTE G, DÍAZ-SALVAGO E, BELL J G, et al. Increased activities of hepatic antioxidant defence enzymes in juvenile gilthead sea bream (Sparus aurata L.) fed dietary oxidised oil:attenuation by dietary vitamin E[J]. Aquaculture, 2002, 214(1/2/3/4): 343-361. |
| [57] |
FONTAGNÉ-DICHARRY S, LATAILLADE E, SURGET A, et al. Antioxidant defense system is altered by dietary oxidized lipid in first-feeding rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 2014, 424-425: 220-227. DOI:10.1016/j.aquaculture.2014.01.009 |
| [58] |
MA Q. Role of nrf2 in oxidative stress and toxicity[J]. Annual Review of Pharmacology and Toxicology, 2013, 53: 401-426. DOI:10.1146/annurev-pharmtox-011112-140320 |
| [59] |
KANG M I, KOBAYASHI A, WAKABAYASHI N, et al. Scaffolding of Keap1 to the actin cytoskeleton controls the function of Nrf2 as key regulator of cytoprotective phase 2 genes[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(7): 2046-2051. DOI:10.1073/pnas.0308347100 |
| [60] |
LIANG H L, MOKRANI A, JI K, et al. Dietary leucine modulates growth performance, Nrf2 antioxidant signaling pathway and immune response of juvenile blunt snout bream (Megalobrama amblycephala)[J]. Fish & Shellfish Immunology, 2018, 73: 57-65. |
| [61] |
HABTE-TSION H, REN M C, LIU B, et al. Threonine modulates immune response, antioxidant status and gene expressions of antioxidant enzymes and antioxidant-immune-cytokine-related signaling molecules in juvenile blunt snout bream (Megalobrama amblycephala)[J]. Fish & Shellfish Immunology, 2016, 51: 189-199. |
| [62] |
KADER M A, KOSHIO S, ISHIKAWA M, et al. Supplemental effects of some crude ingredients in improving nutritive values of low fishmeal diets for red sea bream, Pagrus major[J]. Aquaculture, 2010, 308(3/4): 136-144. |
| [63] |
CONGLETON J L, WAGNER T. Blood-chemistry indicators of nutritional status in juvenile salmonids[J]. Journal of Fish Biology, 2006, 69(2): 473-490. DOI:10.1111/j.1095-8649.2006.01114.x |
| [64] |
TAN B, LI X G, KONG X F, et al. Dietary l-arginine supplementation enhances the immune status in early-weaned piglets[J]. Amino Acids, 2009, 37(2): 323-331. DOI:10.1007/s00726-008-0155-1 |
| [65] |
HAN J H, ULEVITCH R J. Limiting inflammatory responses during activation of innate immunity[J]. Nature Immunology, 2005, 6(12): 1198-1205. DOI:10.1038/ni1274 |
| [66] |
MULDER I E, WADSWORTH S, SECOMBES C J. Cytokine expression in the intestine of rainbow trout (Oncorhynchus mykiss) during infection with Aeromonas salmonicida[J]. Fish & Shellfish Immunology, 2007, 23(4): 74-759. |
| [67] |
OPAL S M, DEPALO V A. Anti-inflammatory cytokines[J]. Chest, 2000, 117(4): 1162-1172. DOI:10.1378/chest.117.4.1162 |
| [68] |
WANG B, FENG L, JIANG W D, et al. Copper-induced tight junction mRNA expression changes, apoptosis and antioxidant responses via NF-κB, TOR and Nrf2 signaling molecules in the gills of fish:preventive role of arginine[J]. Aquatic Toxicology, 2015, 158: 125-137. DOI:10.1016/j.aquatox.2014.10.025 |
| [69] |
ALICAN I, KUBES P. A critical role for nitric oxide in intestinal barrier function and dysfunction[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 1996, 270(2): G225-G237. DOI:10.1152/ajpgi.1996.270.2.G225 |
| [70] |
ZHENG L, PAN Y Y, FENG Y H, et al. L-arginine supplementation in mice enhances NO production in spleen cells and inhibits Plasmodium yoelii transmission in mosquitoes[J]. Parasites & Vectors, 2015, 8: 326. |
| [71] |
李倜宇, 石璐璐, 闫素梅, 等. 壳聚糖对泌乳中期奶牛一氧化氮免疫调节途径的影响[J]. 动物营养学报, 2020, 32(2): 726-735. |
| [72] |
BUENTELLO J A, GATLIN Ⅲ D M. The dietary arginine requirement of channel catfish (Ictalurus punctatus) is influenced by endogenous synthesis of arginine from glutamic acid[J]. Aquaculture, 2000, 188(3/4): 311-321. |
| [73] |
LIANG H L, JI K, GE X P, et al. Effects of dietary arginine on antioxidant status and immunity involved in AMPK-NO signaling pathway in juvenile blunt snout bream[J]. Fish & Shellfish Immunology, 2018, 78: 69-78. |
| [74] |
HABTE-TSION H, REN M, LIU B, et al. Threonine affects digestion capacity and hepatopancreatic gene expression of juvenile blunt snout bream (Megalobrama amblycephala)[J]. The British journal of nutrition, 2015, 114(4): 533-543. DOI:10.1017/S0007114515002196 |
| [75] |
LECH G P, REIGH R C. Plant products affect growth and digestive efficiency of cultured Florida pompano (Trachinotus carolinus) fed compounded diets[J]. PLoS One, 2012, 7(4): e34981-e34992. DOI:10.1371/journal.pone.0034981 |
| [76] |
TUITOEK K, YOUNG L G, DE LANGE C F, et al. The effect of reducing excess dietary amino acids on growing-finishing pig performance: an elevation of the ideal protein concept[J]. Journal of Animal Science, 1997, 75(6): 1575-1583. DOI:10.2527/1997.7561575x |
| [77] |
FURUYA W M, PEZZATO L E, BARROS M M, et al. Use of ideal protein concept for precision formulation of amino acid levels in fish-meal-free diets for juvenile Nile tilapia (Oreochromis niloticus L.)[J]. Aquaculture Research, 2004, 35(12): 1110-1116. DOI:10.1111/j.1365-2109.2004.01133.x |
| [78] |
GREEN J A, HARDY R W. The optimum dietary essential amino acid pattern for rainbow trout (Oncorhynchus mykiss), to maximize nitrogen retention and minimize nitrogen excretion[J]. Fish Physiology and Biochemistry, 2002, 27(1/2): 97-108. DOI:10.1023/B:FISH.0000021878.81647.6e |
| [79] |
ROLLIN X, MAMBRINI M, ABBOUDI T, et al. The optimum dietary indispensable amino acid pattern for growing Atlantic salmon (Salmo salar L.) fry[J]. British Journal of Nutrition, 2003, 90(5): 865-876. DOI:10.1079/BJN2003973 |
| [80] |
叶元土, 林仕梅, 罗莉, 等. 饲料必需氨基酸的平衡效果对草鱼生长的影响[J]. 饲料工业, 1999, 20(3): 39-41. |
| [81] |
REN M C, HE J Y, LIANG H L, et al. Use of supplemental amino acids on the success of reducing dietary protein levels for Jian carp (Cyprinus carpio var.Jian)[J]. Aquaculture Nutrition, 2019, 25(3): 567-576. DOI:10.1111/anu.12879 |
| [82] |
AHMED M, LIANG H L, KASIYA H C, et al. Complete replacement of fish meal by plant protein ingredients with dietary essential amino acids supplementation for juvenile blunt snout bream (Megalobrama amblycephala)[J]. Aquaculture Nutrition, 2019, 25(1): 205-214. DOI:10.1111/anu.12844 |
| [83] |
MOKRANI A, LIANG H L, JI K, et al. Essential amino acids supplementation to practical diets affects growth, feed utilization and glucose metabolism-related signalling molecules of blunt snout bream (Megalobrama amblycephala)[J]. Aquaculture Research, 2019, 50(2): 557-565. |
| [84] |
REGOST C, ARZEL J, KAUSHIK S J. Partial or total replacement of fish meal by corn gluten meal in diet for turbot (Psetta maxima)[J]. Aquaculture, 1999, 180(1/2): 99-117. |
| [85] |
HANSEN A C, ROSENLUND G, KARLSEN Ø, et al. Total replacement of fish meal with plant proteins in diets for Atlantic cod (Gadus morhua L.)Ⅰ-Effects on growth and protein retention[J]. Aquaculture, 2007, 272(1/2/3/4): 599-611. |
| [86] |
LI P, MAI K, TRUSHENSKI J, et al. New developments in fish amino acid nutrition:towards functional and environmentally oriented aquafeeds[J]. Amino Acids, 2009, 37(1): 43-53. DOI:10.1007/s00726-008-0171-1 |




