2. 浙江农业科学院农产品质量标准研究所, 杭州 310021;
3. 浙江大学动物科学学院, 杭州 310058
2. Institute of Quality and Standard for Agro-Products, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China;
3. College of Animal Sciences, Zhejiang University, Hangzhou 310058, China
动物胃肠道中栖息着大量的微生物,这些微生物群落分布在肠道的不同部位并保持着相对稳定和平衡,有益菌和致病菌在肠道内保持着一定比例,维持动物的生长发育和健康[1-2]。当动物处于应激状态时,肠道菌群的动态平衡被打破,这对动物的生长代谢造成一定的影响[3]。仔猪早期断奶是现代养猪发展的必然要求,由此产生的断奶应激使仔猪出现肠道功能障碍、采食量降低和腹泻等症状[4]。大量的研究表明,在饲粮中添加益生菌可以有效地改善断奶仔猪的肠道菌群结构,提升仔猪的平均日增重[5-8]。丁酸梭菌(Clostridium butyricum)作为益生菌类的饲料添加剂,可有效地改善畜禽肠道健康,增强机体免疫,促进畜禽生长,促进肠道对饲粮中营养物质的消化、吸收和利用,提高畜禽的生长性能[9-10];同时还可以有效地促进宿肠道中拟杆菌、粪杆菌、粪链球菌等有益菌的增殖,抑制肠道内大肠杆菌、幽门螺杆菌、迟缓爱德华氏菌、沙门氏菌、产气荚膜梭菌等病原菌的生长和黏附[11]。我们的前期研究也表明,丁酸梭菌可降低产肠毒素大肠杆菌黏附因子和产肠毒素基因表达,抑制产肠毒素大肠杆菌诱导的IPEC-J2细胞炎症反应,降低其对IPEC-J2细胞的损伤作用[12]。郑有秀等[4]研究表明,饲粮中添加500和2 000 mg/kg丁酸梭菌,断奶仔猪的空肠绒毛高度较对照组分别显著提高了35.71%和47.36%,血清免疫球蛋白A和免疫球蛋白G含量也显著升高,腹泻率降低。前期针对益生菌对断奶仔猪菌群结构上的研究主要集中于对大肠段(盲肠和结肠)或者是通过采集粪便样品[5, 8-9],而小肠段是仔猪消化吸收的主要器官,在断奶过程中更易受到食物变化和环境应激的影响,但针对丁酸梭菌等益生菌对小肠段菌群结构的研究甚少。因此,本研究通过在饲粮中添加不同水平的丁酸梭菌,采用高通量测序和定量聚合酶链反应(qPCR)技术研究其对断奶仔猪空肠菌群结构的影响,为丁酸梭菌研发和推广应用提供理论依据。
1 材料与方法 1.1 试验材料丁酸梭菌由湖北某生物产业有限公司提供;试验用仔猪为“杜×长×大”三元杂交仔猪。
1.2 试验设计试验选取(25±1)日龄、体重为(6.24±0.32) kg的健康仔猪162头,随机分为3个组,每组3个重复,每个重复18头猪。对照组饲喂基础饲粮,试验组分别在基础饲粮中添加500(CB500组)和2 000 mg/kg(CB2000组)丁酸梭菌。基础饲粮参照NRC(2012)营养需要配制,其组成及营养水平与郑有秀等[4]前期研究报道相同。
试验期为30 d,期间自由采食和饮水,按常规方法进行预防免疫和饲养管理。试验结束前1天19:00开始禁食,禁食12 h,然后对试验猪进行称重。
1.3 样品采集仔猪称重后从各组随机选取6头仔猪(每个重复2头仔猪),屠宰后迅速采集空肠中段内容物。液氮速冻后置于干冰中转运至实验室,-80 ℃保存。
1.4 DNA提取和16S rRNA基因扩增PCR反应采用QIAamp DNA Stool Mini Kit(QIAGEN,加拿大)试剂盒提取各空肠内容物样品中微生物基因组DNA,使用引物341F(5′-CCTAYGGGRBGCASCAG-3′)和806R(5′-GGACTACNNGGGTATCTAAT-3′)对细菌16S rRNA基因V3~V4区进行扩增。通过Illumina Hiseq平台对扩增区域进行测序。使用QIIME2软件对测序数据进行分析,按照97%相似性对非重复序列进行操作分类单元(OTU)分析[1]。使用Sliva和RPD数据库对所有OTU的代表性序列进行物种匹配。采用主坐标分析(PCoA)进行样品间beta多样性分析。采用SparCC算法评估菌群间相互作用的网络关系,聚类是基于Girvan-Newman算法来计算,网络图采用R语言的igraph软件包作图[13]。
1.5 细菌qPCR分析参照Xu等[14]和于光辉等[3]的引物序列(表 1)对空肠中的肠杆菌科、大肠杆菌、乳酸杆菌和双歧杆菌的相对丰度进行qPCR分析。qPCR在ABI7500型定量PCR仪(ABI,美国)中进行,其体系为10 μL体系,其中包含了5.0 μL SYBR Green qPCR mix,上、下游引物各0.5 μL。反应条件为95 ℃预变性2 min;95 ℃变性15 s;58 ℃退火延伸45 s,进行40个循环,每个样品设置3个重复。最终依据测得的Ct值与标准曲线比较计算样品中DNA的拷贝数。
|
|
表 1 引物序列 Table 1 Primer sequences |
采用SPSS 20.0统计软件进行单因素方差分析(one-way ANOVA),采用Duncan氏法进行多重比较,P<0.05表示差异显著,0.05 < P<0.10表示有变化趋势,结果以平均值和均值标准误(SEM)表示。
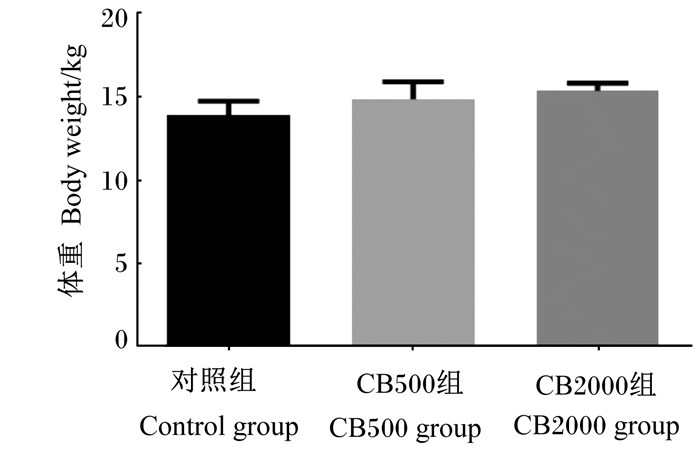
2 结果与分析 2.1 丁酸梭菌对断奶仔猪体重的影响由图 1可知,随着饲粮中丁酸梭菌添加水平的升高,断奶仔猪平均体重呈现上升趋势,CB500组和CB2000组分别比对照组提高了7.06%(P=0.198)和10.66%(P=0.072)。
|
图 1 丁酸梭菌对断奶仔猪体重的影响 Fig. 1 Effects of Clostridium butyricum on body weight of weaned piglets |
由表 2可知,各样品的覆盖度指数均大于0.99,说明该测序结果已基本覆盖样本的多样性。进行alpha多样性分析表明,CB2000组的OTU数量显著高于对照组(P<0.05),同时香农指数显著高于对照组(P<0.05),这表明在饲粮中添加丁酸梭菌可使断奶仔猪空肠内容物中菌群多样性增加。
|
|
表 2 各组样品测序概况 Table 2 Overview of sequencing results of each group |
由图 2可知,对断奶仔猪空肠中的菌群结构进行分析表明,在门水平上,优势菌门主要是厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、蓝藻菌门(Cyanobacteria)、广古菌门(Euryarchaeota)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes),占仔猪空肠菌群的99.87%以上。与对照组相比,CB500组和CB2000组拟杆菌门相对丰度显著升高(P<0.05),广古菌门相对丰度显著降低(P<0.05),放线菌门相对丰度有增加的趋势(P=0.055),而厚壁菌门、蓝藻菌门相对丰度无显著差异(P>0.05)。

|
Firmicutes:厚壁菌门;Actinobacteria:放线菌门;Cyanobacteria:蓝藻菌门;Euryarchaeota:广古菌门;Proteobacteria:变形菌门;Bacteroidetes:拟杆菌门;Staphylococcus:葡萄球菌属;Dietzia:迪茨氏菌属;Methanobrevibacter:甲烷短杆菌属;Lactobacillus:乳酸杆菌属;Clostridium:梭菌属;Streptococcus:链球菌属;Corynebacterium:棒状杆菌属;Weissella:魏斯氏菌属;Roseburia:罗斯氏菌属;Others:其他。下图同The same as below。 图 2 丁酸梭菌对断奶仔猪空肠菌群结构的影响 Fig. 2 Effects of Clostridium butyricum on microbial community structure in jejunum of weaned piglets |
在属水平上,SMB53、葡萄球菌属(Staphylococcus)、迪茨氏菌属(Dietzia)、甲烷短杆菌属(Methanobrevibacter)、乳酸杆菌属(Lactobacillus)、梭菌属(Clostridium)、链球菌属(Streptococcus)、棒状杆菌属(Corynebacterium)、魏斯氏菌属(Weissella)和罗斯氏菌属(Roseburia)为相对丰度最高的10个属。其中,CB500组和CB2000组迪茨氏菌属、链球菌属和罗斯氏菌属相对丰度显著升高(P<0.05),甲烷杆菌属相对丰度显著降低(P<0.05),SMB53、乳酸杆菌属、梭菌属、棒状杆菌属和魏斯氏菌属相对丰度无显著差异(P>0.05)。
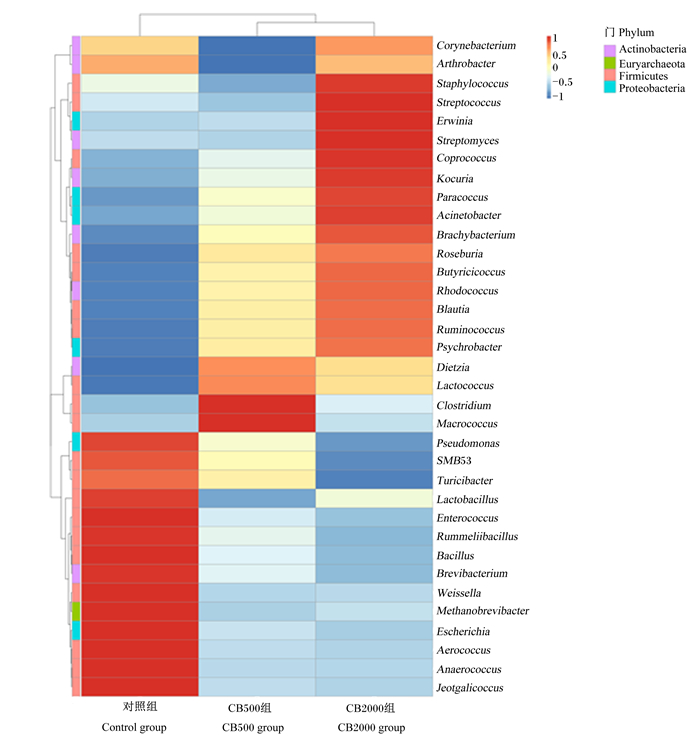
由图 3可知,通过热图展示仔猪空肠中相对丰度最高的35种细菌菌属发现,与对照组相比,CB500组和CB2000组假单胞菌属(Pseudomonas)和埃希氏菌属(Escherichia)等条件致病菌的相对丰度显著降低(P<0.05),而粪球菌属(Coprococcus)、罗斯氏菌属、Butyricicoccus、布劳特氏菌属(Blautia)和瘤胃球菌属(Ruminococcus)的相对丰度显著升高(P<0.05)。
|
Arthrobacter:节杆菌属;Erwinia:欧文氏菌属;Streptomyces:链霉菌属;Coprococcus:粪球菌属;Kocuria:考克氏菌属;Paracoccus:副球菌属;Acinetobacter:不动杆菌属;Brachybacterium:短状杆菌属;Rhodococcus:红球菌属;Blautia:布劳特氏菌属;Ruminococcus:瘤胃球菌属;Psychrobacter:嗜冷杆菌属;Lactococcus:乳球菌属;Macrococcus:巨型球菌属;Pseudomonas:假单胞菌属;Enterococcus:肠球菌属;Rummeliibacillus:鲁梅尔芽孢杆菌属;Bacillus:芽孢杆菌属;Brevibacterium:短杆菌属;Escherichia:埃希氏菌属;Aerococcus:气球菌属。下图同The same as below。 图 3 断奶仔猪空肠菌群结构热点图(前35种菌属) Fig. 3 Heatmap of microbial community structure (top 35 genera) in jejunum of weaned piglets |
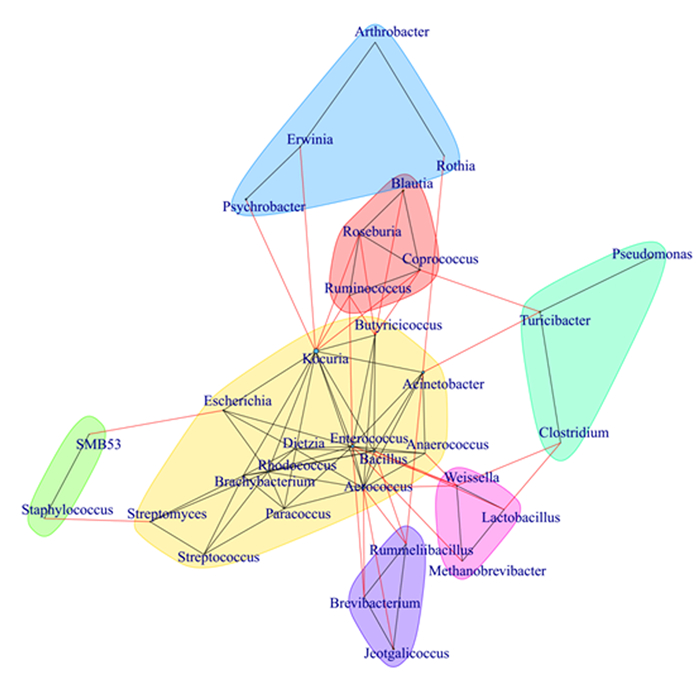
由图 4可知,属水平的菌群网络结构分析显示,仔猪空肠菌群存在显著的交互作用,特别是粪球菌属、罗斯氏菌属、布劳特氏菌属和瘤胃球菌属等存在显著的交互聚类,且均与Butyricicoccus存在交互作用。
|
Rothia:罗氏菌属。 图 4 断奶仔猪菌群属水平的网络结构分析 Fig. 4 Network structure analysis of microbiota in jejunum of weaned piglets at genus level |
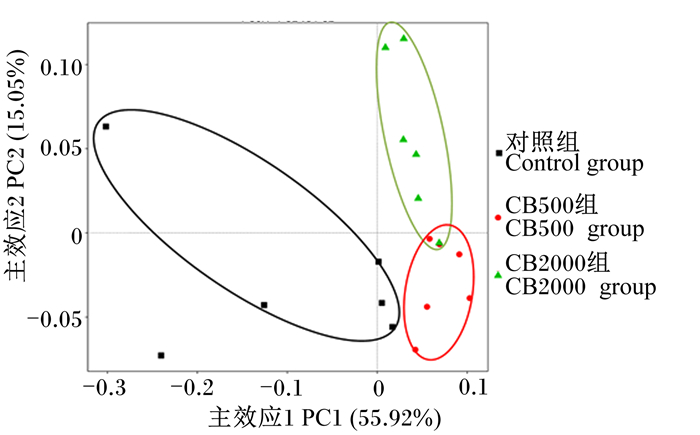
由图 5可知,通过主坐标分析发现,对照组和丁酸梭菌组有显著不同的聚类,同时不同添加水平的丁酸梭菌组聚类也存在一定的差异,这表明3组间的菌群结构存在差异。
|
图 5 断奶仔猪空肠菌群结构主坐标分析 Fig. 5 PCoA of microbial community structure in jejunum of weaned piglets |
由表 3可知,qPCR对断奶仔猪空肠特定菌群定量分析结果表明,与对照组相比,CB500组和CB2000组肠杆菌科和大肠杆菌的相对丰度显著降低(P<0.05),而丁酸梭菌处理对乳酸杆菌与双歧杆菌的相对丰度无显著影响(P>0.05)。
|
|
表 3 丁酸梭菌对断奶仔猪空肠特定菌群相对丰度的影响 Table 3 Effects of Clostridium butyricum on relative abundance of certain bacteria in jejunum of weaned piglets |
丁酸梭菌对于促进动物的消化吸收和肠道健康具有重要的调节作用[4-5, 9]。丁酸梭菌的主要代谢产物丁酸是肠道上皮细胞的主要能量物质,能促进肠道上皮细胞增殖,改善断奶应激产生的肠道黏膜损伤。郑有秀等[4]和Casas等[15]等研究表明,在断奶仔猪饲粮中添加丁酸梭菌可提高肠道绒毛高度和绒毛高度/隐窝深度值。同时,丁酸梭菌有增强肠道屏障功能的作用,Zong等[16]研究表明在断奶仔猪饲粮中添加丁酸梭菌可提高肠道紧密连接蛋白包括闭合蛋白-1(claudin-1)、封闭蛋白(occludin)和紧密连接蛋白-1(ZO-1)mRNA的表达量。丁酸梭菌代谢产生的其他物质包括各种酶类、维生素,可以补充机体所需的营养素和提高肠道对饲粮中营养物质的消化、吸收与利用率,改善畜禽生产性能[8-9]。此外,许多研究也发现,饲粮中添加益生菌可以提高肠道中阳离子氨基酸运载体1(CAT1)、小肽转运体1(PepT1)和碱性氨基酸转运载体(rBAT)的mRNA表达量,促进营养物质的吸收转运[17-19]。在本研究中,饲粮中添加丁酸梭菌有提高断奶仔猪体重的趋势,这与庞敏[5]和孙健等[20]研究结果一致。这说明益生菌可以改变猪肠道结构和营养物质转运载体的表达,促进肠道对营养物质的吸收,提高生长性能。
肠道微生物对于动物的生长和健康起着重要的作用[2, 7]。一般来说,肠道微生物多样性越高,越有利于动物的肠道健康[6]。孙健等[20]研究表明,饲粮添加丁酸梭菌组仔猪香农指数高于对照组。本研究同样发现,CB2000组仔猪空肠菌群的香农指数显著高于对照组。通常情况下肠道菌群多样性越高,菌群之间的相互依赖越强,当机体遭受断奶等应激刺激或外界环境波动较大时,菌群能更好地保持动态平衡[21]。仔猪断奶后,消化道pH会显著升高,使消化酶活性降低,肠道结构发生变化同时还导致肠道菌群絮乱,病原菌大量增殖,引起仔猪腹泻[3-5]。本试验通过高通量测序技术发现,在门水平上,各组的厚壁菌门的相对丰度都在75%左右;与对照组相比,CB500组和CB2000组拟杆菌门相对丰度均显著提高,广古菌门相对丰度显著降低。我们前期在肉鸡中的研究也表明,在饲粮中添加丁酸梭菌可提高肉鸡盲肠拟杆菌门相对丰度[22]。在属水平上,与对照组相比,丁酸梭菌组假单胞菌属和埃希氏菌属等条件致病菌的相对丰度显著降低。同时,qPCR结果也表明丁酸梭菌可显著降低断奶仔猪空肠的肠杆菌科和大肠杆菌的相对丰度。李玉鹏等[23]研究表明,在断奶仔猪饲粮中添加5×105 CFU/g丁酸梭菌可减少空肠中大肠杆菌数量。梁明振等[24]的研究结果表明,在断奶仔猪饲粮中添加丁酸梭菌可减少盲肠和结肠大肠杆菌数量。我们的研究还发现丁酸梭菌可使仔猪空肠中粪球菌属、罗斯氏菌属、Butyricicoccus、布劳特氏菌属和瘤胃球菌属等的相对丰度显著升高,且该5个属的菌群存在显著的交互作用,这些细菌可以分解抗性淀粉和纤维等难以消的物质,产生短链脂肪酸,使肠道pH下降,抑制有害菌的定植,有益于肠道健康[25-27]。这也在一定程度上解释了我们前期报道的丁酸梭菌处理使仔猪腹泻率降低的原因[4]。
4 结论在饲粮中添加适宜水平的丁酸梭菌可使断奶仔猪空肠菌群多样性增加,假单胞菌属、埃希氏菌属和肠杆菌等条件致病菌的相对丰度显著降低,粪球菌属、罗斯氏菌属、Butyricicoccus、布劳特氏菌属等有利于肠道健康菌群的相对丰度升高,从而有效改善仔猪肠道菌群结构。
| [1] |
徐娥, 杨华, 刘秀婷, 等. 大约克猪肠道不同部位的菌群结构和短链脂肪酸含量研究[J]. 动物营养学报, 2019, 31(10): 4509-4518. |
| [2] |
XIAO Y P, KONG F L, XIANG Y, et al. Comparative biogeography of the gut microbiome between Jinhua and Landrace pigs[J]. Scientific Reports, 2018, 8: 5985. DOI:10.1038/s41598-018-24289-z |
| [3] |
于光辉, 姜建阳, 张华, 等. 仔猪断奶应激对肠道微生物菌群影响的研究[J]. 中国兽医杂志, 2019, 55(4): 44-47. |
| [4] |
郑有秀, 王超, 邹晓庭, 等. 丁酸梭菌对断奶仔猪生长性能、肠道结构和免疫功能的影响[J]. 动物营养学报, 2018, 30(7): 2683-2689. |
| [5] |
庞敏.益生菌制剂对断奶仔猪肠道黏膜屏障功能的影响及其机理的研究[D].硕士学位论文.北京: 中国农业科学院, 2016.
|
| [6] |
SU Y, YAO W, PEREZ-GUTIERREZ O N, et al. 16S ribosomal RNA-based methods to monitor changes in the hindgut bacterial community of piglets after oral administration of Lactobacillus sobrius S1[J]. Anaerobe, 2008, 14(2): 78-86. DOI:10.1016/j.anaerobe.2007.12.004 |
| [7] |
MODESTO M, D'AIMMO M R, STEFANINI I, et al. A novel strategy to select Bifidobacterium strains and prebiotics as natural growth promoters in newly weaned pigs[J]. Livestock Science, 2009, 122(2/3): 248-258. |
| [8] |
EFSA Panel on Additives and Products or Substances used in Animal Feed (FEEDAP). Scientific opinion on Miya-Gold (Clostridium butyricum) as a feed additive for weaned piglets, minor weaned porcine species and minor avian species[J]. EFSA Journal, 2011, 9(1): 1951. DOI:10.2903/j.efsa.2011.1951 |
| [9] |
赵敏孟, 单昊书, 沈永华, 等. 丁酸梭菌在畜禽生产中的应用研究进展[J]. 动物营养学报, 2018, 30(7): 2467-2472. |
| [10] |
桂国弘, 徐娥, 杨华, 等. 丁酸梭菌调节肠道健康的作用机制[J]. 饲料研究, 2016(22): 42-46. |
| [11] |
曹广添, 刘婷婷, 周琳, 等. 丁酸梭菌对致病菌和有益菌的体外作用效果研究[J]. 中国饲料, 2012(4): 16-19. |
| [12] |
杨华, 施杏芬, 桂国弘, 等. 丁酸梭菌对产肠毒素大肠杆菌刺激猪肠道上皮细胞炎症反应的抑制效果[J]. 动物营养学报, 2019, 31(12): 5688-5695. |
| [13] |
WANG X F, TSAI T C, DENG F L, et al. Longitudinal investigation of the swine gut microbiome from birth to market reveals stage and growth performance associated bacteria[J]. Microbiome, 2019, 7: 109. DOI:10.1186/s40168-019-0721-7 |
| [14] |
XU J, VERBRUGGHE A, LOURENÇO M R, et al. The response of canine faecal microbiota to increased dietary protein is influenced by body condition[J]. BMC Veterinary Research, 2017, 13: 374. DOI:10.1186/s12917-017-1276-0 |
| [15] |
CASAS G A, BLAVI L, CROSS T W L, et al. Inclusion of the direct-fed microbial Clostridium butyricum in diets for weanling pigs increases growth performance and tends to increase villus height and crypt depth, but does not change intestinal microbial abundance[J]. Journal of Animal Science, 2020, 98(1): skz372. DOI:10.1093/jas/skz372 |
| [16] |
ZONG X, WANG T H, LU Z Q, et al. Effects of Clostridium butyricum or in combination with Bacillus licheniformis on the growth performance, blood indexes, and intestinal barrier function of weanling piglets[J]. Livestock Science, 2019, 220: 137-142. DOI:10.1016/j.livsci.2018.12.024 |
| [17] |
杨广达, 王丽, 易宏波, 等. 罗伊氏乳杆菌LR1对断奶仔猪血清生化指标和肠道营养物质转运载体mRNA表达的影响[J]. 动物营养学报, 2018, 30(11): 4589-4600. |
| [18] |
吴云鹏.植物乳杆菌调节猪肠上皮细胞屏障功能和转运载体的研究[D].博士学位论文.广州: 华南农业大学, 2016.
|
| [19] |
周响艳.猪肠道碱性氨基酸转运载体mRNA的表达及营养调控[D].博士学位论文.广州: 华南农业大学, 2007.
|
| [20] |
孙健, 乔立东, 雷莉辉, 等. 丁酸梭菌对断奶仔猪生长性能及肠道菌群结构的影响[J]. 黑龙江畜牧兽医, 2019(12): 103-105. |
| [21] |
HOOPER L V, LITTMAN D R, MACPHERSON A J. Interactions between the microbiota and the immune system[J]. Science, 2012, 336(6086): 1268-1273. DOI:10.1126/science.1223490 |
| [22] |
肖英平, 杨彩梅, 代兵, 等. 基于高通量测序的丁酸梭菌对肉鸡盲肠菌群结构的影响[J]. 浙江农业学报, 2017, 29(3): 373-379. |
| [23] |
李玉鹏, 李海花, 王柳懿, 等. 丁酸梭菌对断奶仔猪生长性能、肠道屏障功能和血清细胞因子含量的影响[J]. 动物营养学报, 2017, 29(8): 2961-2968. |
| [24] |
梁明振, 李莉, 刘浩. 丁酸梭状芽孢杆菌对断奶仔猪肠道微生物区系的影响[J]. 中国畜牧杂志, 2013, 49(23): 64-67. |
| [25] |
SCHWIERTZ A, TARAS D, SCHÄFER K, et al. Microbiota and SCFA in lean and overweight healthy subjects[J]. Obesity, 2010, 18(1): 190-195. |
| [26] |
BLAUT M. Gut microbiota and energy balance:role in obesity[J]. Proceedings of the Nutrition Society, 2015, 74(3): 227-234. DOI:10.1017/S0029665114001700 |
| [27] |
ZHANG J C, GUO Z, XUE Z S, et al. A phylo-functional core of gut microbiota in healthy young Chinese cohorts across lifestyles, geography and ethnicities[J]. The ISME Journal, 2015, 9(9): 1979-1990. DOI:10.1038/ismej.2015.11 |




