2. 华南理工大学食品科学与工程学院, 广州 510640
2. College of Food Science and Engineering, South China University of Technology, Guangzhou 510640, China
抗生素类饲料添加剂从20世纪60年代开始在促进家禽生长和防治疾病等方面发挥了重要作用。但近年来出现的畜禽产品药物超标、细菌耐药性增强等问题,严重威胁人类健康。随着农业农村部2019年7月发布第194号公告,我国于2020年起全面禁止除中草药外的所有促生长类药物添加剂。因此,寻找合适的抗生素替代品、促进动物肠道健康是畜牧业亟需解决的问题。
丁酸是肠道微生物发酵难消化碳水化合物生成的一种短链脂肪酸(short-chain fatty acids,SCFAs),是动物后段肠道上皮生长的主要能源物质[1]。研究显示,丁酸能促进肠系膜淋巴结发育,调节抗炎信号通路[2],改善肠道上皮屏障功能[3]。肠道内源性丁酸多产生于大肠,小肠中丁酸浓度较低。因此,在家禽生产中使用丁酸类添加剂被认为是提高前肠段丁酸浓度的有效途径。但未经包被或包被不完整的丁酸盐在到达远端小肠有效部位时已被大量释放,从而降低丁酸的效价。三丁酸甘油酯(glycerol tributyarate,GTB)是一种依靠脂肪酶水解释放丁酸的新型丁酸类添加剂,其可减少丁酸在前段胃肠道的释放,增加后段肠道中丁酸的释放和吸收,从而提高其益生效价。研究显示,与丁酸钠相比,饲粮中添加GTB能显著提高动物的生长性能,降低料重比(F/G)[4]。将益生元与益生菌结合形成的合生元(synbiotic,SYN)是利用益生菌发酵益生元产生SCFAs发挥其益生作用。研究显示,SYN可通过竞争性排斥病原细菌或由益生菌对内源性共生微生物区系产生影响的途径促使肠道细菌代谢产物发生改变,从而调节菌株在肠道中定植和繁殖,改善肉鸡的日增重、F/G及盲肠微生物数量[5]。因此,丁酸类添加剂与SYN组合可能从发酵底物、益生菌、代谢产物3个层面调节肠道微生物,提升动物肠道健康,改善动物生长性能。
目前,有关丁酸类添加剂和SYN的研究多集中于两者单独添加的效果,而对于丁酸类添加剂与SYN组合使用的研究较少。本试验旨在研究饲粮中丁酸类添加剂及其与SYN组合对肉鸡生长性能、肠道微生物、肠道免疫及屏障功能基因表达的影响,探究不同类型丁酸添加剂与SYN替代促生长抗生素维持肉鸡生长性能的微生物学机制。
1 材料与方法 1.1 试验材料包膜丁酸钠(coated sodium butyrate,CSB)为市售产品,有效含量为45%;GTB由广东某生物科技股份有限公司提供,有效含量为35%;SYN由植物乳杆菌(活菌数≥1.0×1010 CFU/g)、枯草芽孢杆菌(活菌数≥5.0×109 CFU/g)、酵母细胞壁多糖(有效含量≥5%)组成;杆菌肽锌(BAC-Zn)为市售产品,有效含量为15%。
1.2 试验设计与饲养管理选取1日龄健康罗斯(Ross)308白羽肉鸡720只(公母各占1/2),随机分为6组,每组6个重复,每个重复20只鸡。对照(NC)组饲喂不含抗生素的玉米-豆粕型基础饲粮,试验组在基础饲粮中分别添加10 mg/kg BAC-Zn(BAC-Zn组)、1 g/kg CSB(CSB组)、1 g/kg CSB+0.5 g/kg SYN(CSB+SYN组)、1 g/kg GTB(GTB组)、1 g/kg GTB+0.5 g/kg SYN(GTB+SYN组)。试验期42 d。基础饲粮参照NRC(1994)进行配制,并制成颗粒料,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(饲喂基础) Table 1 Composition and nutrient levels of basal diets (as-fed basis) |
饲养试验采用3层立体笼养(190 cm×54 cm×38 cm),自由采食和饮水。试验期间采取自然光照,并按照常规饲养和免疫程序进行饲养和免疫。每周记录采食量,观察试验鸡的健康状况。
1.3 生长性能与样品采集于1、21和42日龄时早晨对试验鸡进行逐一称重,试验期间以重复为单位记录采食量,计算平均日增重(ADG)、平均日采食量(ADFI)和F/G。饲养试验结束后,每个重复选取1只接近平均体重的试验鸡,颈静脉放血致死;解剖后迅速分离肠道组织,无菌环境取出空肠和盲肠食糜于-80 ℃保存,用于总DNA提取和SCFAs浓度测定;将空肠和盲肠组织用无菌磷酸盐缓冲液(PBS)冲洗后剪碎保存于冻存管中,-80 ℃保存,用于RNA提取。
1.4 指标测定 1.4.1 空肠和盲肠食糜总DNA提取及实时荧光定量PCR采用粪便基因组DNA试剂盒[天根生化科技(北京)有限公司]提取空肠和盲肠食糜总DNA。采用特异性引物(表 2),使用CFX96 PCR System(Bio-Rad,美国)和SYBR(TaKaRa,中国)对总细菌(total bacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacterodietes)、梭菌Ⅳ(Clostridium cluster Ⅳ)、梭菌ⅪⅤa(Clostridium cluster ⅪⅤa)、大肠杆菌(Escherichia coli)和乳酸杆菌(Lactobacillus)进行实时荧光定量PCR分析,以lg每克食糜基因拷贝数计算菌群拷贝数[6]。
|
|
表 2 细菌实时荧光定量PCR引物序列 Table 2 Primer sequences of bacteria for real-time qPCR |
称取0.5 g盲肠食糜于1 mL生理盐水中,混匀后取0.8 mL上清液,按5:1的比例加入25%偏磷酸巴豆酸混匀,-20 ℃过夜保存。解冻后12 000×g离心5 min,取上清液过滤后采用气相色谱仪(岛津,日本)进行SCFAs浓度测定[11]。
1.4.3 空肠和盲肠组织总RNA提取及实时荧光定量PCR取约0.1 g空肠或盲肠组织,采用液氮研磨法对肠道组织进行匀浆,使用EASYspin Plus组织/细胞RNA试剂盒(艾德莱,北京)提取总RNA,使用试剂盒法合成cDNA(TaKaRa,日本)。以cDNA为模板,使用CFX96 PCR System(Bio-Rad,美国)进行实时荧光定量PCR,特异性引物见表 3。定量结果以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参基因,每个样品3个重复孔,以2-△△Ct计算目的基因的mRNA相对表达量。
|
|
表 3 基因实时荧光定量PCR引物序列 Table 3 Primer sequences of genes for real-time qPCR |
试验数据采用SPSS 18.0统计软件进行单因素方差分析(one-way ANOVA),差异显著时使用Duncan氏法进行多重比较检验。所有数据均以平均值和SEM表示,P < 0.05为差异显著。
2 结果 2.1 丁酸类添加剂及其与SYN组合对肉鸡生长性能的影响由表 4可知,与NC和BAC-Zn组相比,饲粮中添加GTB显著降低肉鸡1~21日龄时的F/G(P < 0.05),添加CSB显著提高22~42日龄时的ADFI(P < 0.05),添加CSB+SYN或GTB+SYN显著提高1~21日龄时的ADG(P < 0.05),显著降低1~21日龄时的F/G(P < 0.05)。
|
|
表 4 丁酸类添加剂及其与SYN组合对肉鸡生长性能的影响 Table 4 Effects of butyric acids additives alone or combination with SYN on growth performance of broilers |
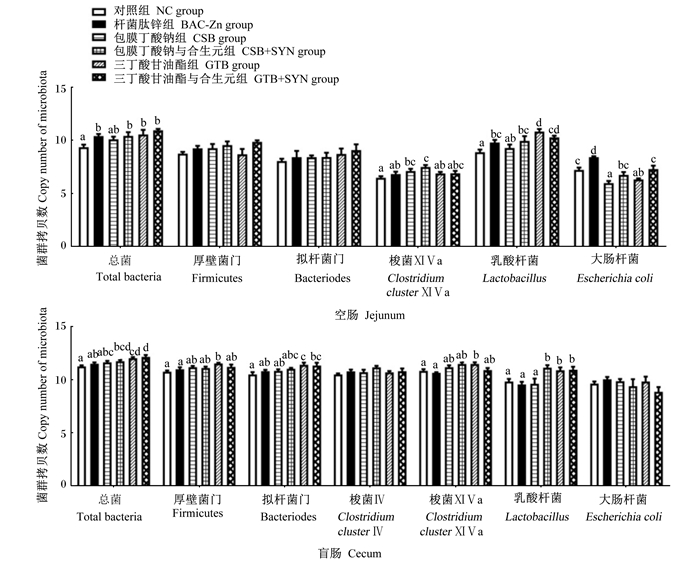
由图 1可知,与BAC-Zn组相比,饲粮中添加CSB显著降低肉鸡空肠食糜中大肠杆菌数量;添加GTB显著提高空肠食糜中乳酸杆菌数量及盲肠食糜中总细菌、厚壁菌门、拟杆菌门、梭菌ⅪⅤa、乳酸杆菌数量(P < 0.05),显著降低空肠食糜中大肠杆菌数量(P < 0.05);添加CSB+SYN显著提高空肠食糜中梭菌ⅪⅤa数量及空肠和盲肠食糜中乳酸杆菌数量(P < 0.05);添加GTB+SYN显著提高盲肠食糜中总细菌和乳酸杆菌数量(P < 0.05),显著降低空肠食糜中大肠杆菌数量(P < 0.05)。
|
数据柱标注不同小写字母表示差异显著(P < 0.05)。下图同。 Value columns with different small letter superscripts mean significant difference (P < 0.05). The same as below. 图 1 丁酸类添加剂及其与SYN组合对肉鸡肠道食糜中微生物数量的影响 Fig. 1 Effects of butyric acids additives alone or combination with SYN on intestinal chyme microbiota numbers of broilers |
由表 5可知,与NC组相比,饲粮中添加CSB+ SYN、GTB和GTB+SYN均显著提高肉鸡盲肠食糜中总SCFAs、乙酸和丙酸浓度(P < 0.05)。与BAC-Zn组相比,饲粮中添加GTB+SYN显著提高肉鸡盲肠食糜中总SCFAs和乙酸浓度(P < 0.05)。
|
|
表 5 丁酸类添加剂及其与SYN组合对肉鸡盲肠食糜中SCFAs浓度的影响 Table 5 Effects of butyric acids additives alone or combination with SYN on cecal chyme SCFAs concentration of broilers |
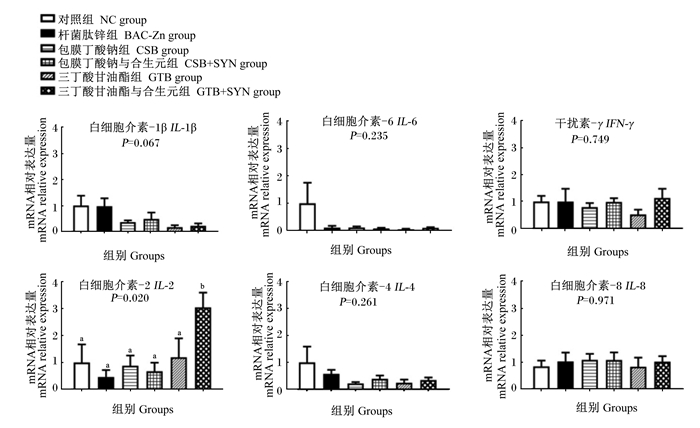
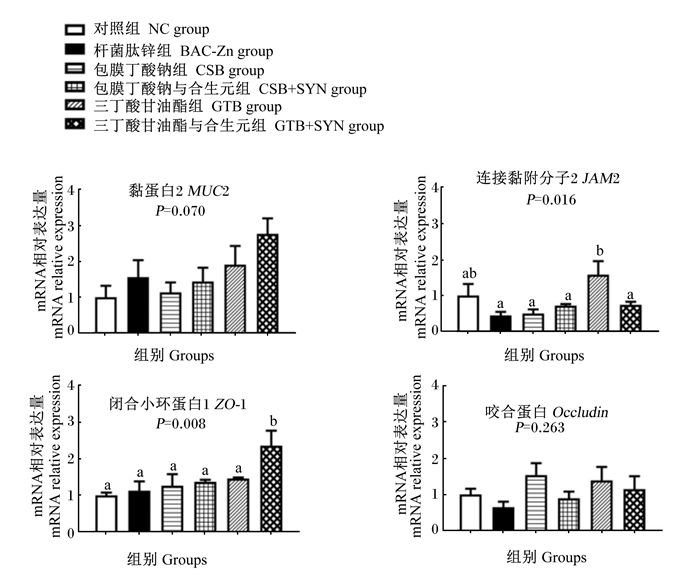
由图 2和图 3可知,与BAC-Zn组相比,饲粮中添加GTB显著提高肉鸡空肠组织连接黏附分子2(JAM2)的mRNA相对表达量(P < 0.05),添加GTB+SYN显著提高空肠组织白细胞介素-2(IL-2)和闭合小环蛋白-1(ZO-1)的mRNA相对表达量(P < 0.05),添加CSB及CSB+SYN对空肠组织炎症因子和紧密连接蛋白的mRNA相对表达量均无显著影响(P < 0.05)。
|
图 2 丁酸类添加剂及其与SYN组合对肉鸡空肠组织炎症因子mRNA相对表达量的影响 Fig. 2 Effects of butyric acids additives alone or combination with SYN on mRNA relative expression levels of jejunum inflammatory cytokines of broilers |
|
图 3 丁酸类添加剂及其与SYN组合对肉鸡空肠组织紧密连接蛋白mRNA相对表达量的影响 Fig. 3 Effects of butyric acids additives alone or combination with SYN on mRNA relative expression levels of jejunum tight junction protein of broilers |
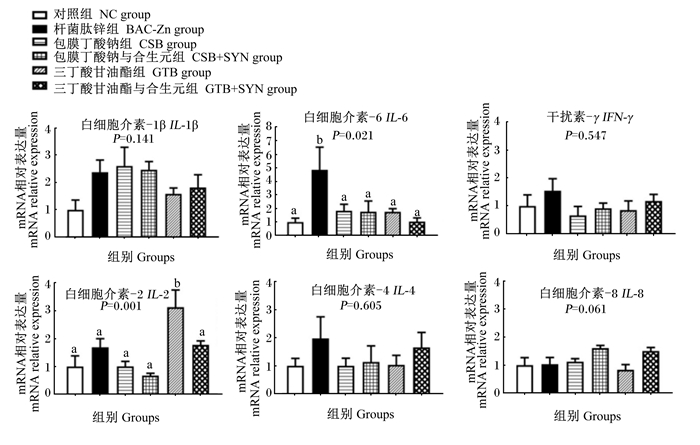
由图 4可知,与NC组相比,饲粮中添加BAC-Zn显著提高肉鸡盲肠组织白细胞介素-6(IL-6)的mRNA相对表达量(P < 0.05)。与NC和BAC-Zn组相比,饲粮中添加GTB显著提高肉鸡盲肠组织IL-2的mRNA相对表达量(P < 0.05)。
|
图 4 丁酸类添加剂及其与SYN组合对肉鸡盲肠组织炎症因子mRNA相对表达量的影响 Fig. 4 Effects of butyric acids additives alone or combination with SYN on mRNA relative expression levels of cecum inflammatory cytokines of broilers |
由图 5可知,与NC和BAC-Zn组相比,饲粮中添加CSB+SYN显著提高肉鸡盲肠组织黏蛋白2(MUC2)的mRNA相对表达量(P < 0.05),添加GTB+SYN显著提高盲肠组织JAM2和ZO-1的mRNA相对表达量(P < 0.05)。与NC组相比,饲粮中单独添加CSB或GTB均可显著提高盲肠组织咬合蛋白(Occludin)的mRNA相对表达量(P < 0.05)。
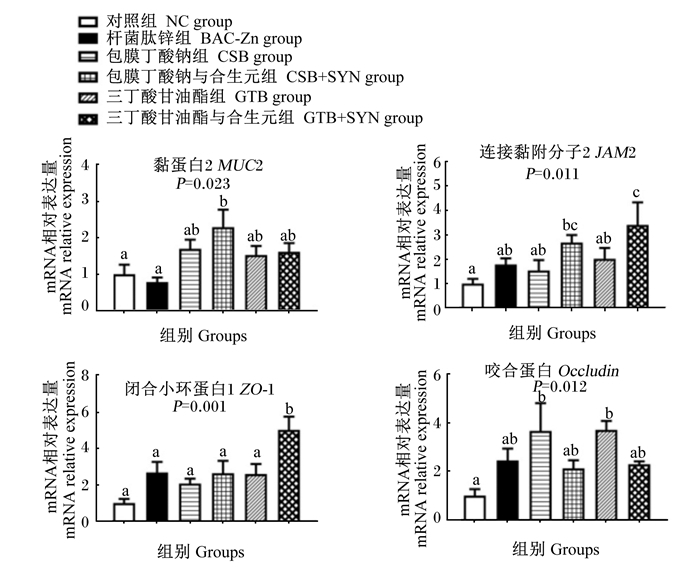
|
图 5 丁酸类添加剂及其与SYN组合对肉鸡盲肠组织紧密连接蛋白mRNA相对表达量的影响 Fig. 5 Effects of butyric acids additives alone or combination with SYN on mRNA relative expression levels of cecum tight junction protein of broilers |
丁酸作为动物后段肠道上皮细胞主要的能量来源,已被证明具有促进动物生长和维持肠道健康的作用。丁酸添加剂产品形式不同造成其在畜禽养殖中的效果不一。Jan等[16]研究显示,饲粮中添加300 mg/kg CSB对肉鸡8~28日龄时的生长性能无显著影响。随佳佳[17]将375 mg/kg CSB与芽孢杆菌组合饲喂肉鸡,发现未对1~21日龄时的生长性能产生显著影响。本研究中,1 g/kg CSB与SYN组合使用显著提高肉鸡1~21日龄时的ADG,并显著降低1~21日龄时的F/G。CSB是一种强碱弱酸盐,当包被不完整时,易与胃肠道中的酸根离子结合,在胃肠道前端释放,无法完全到达以丁酸作为能量来源的后段肠道。因此,CSB效价损失可能是导致肉鸡生长性能未提高的主要原因。SYN可以丰富肠道中菌群数量,优化肠道微生物环境,进而促进动物生长[18]。CSB与SYN组合使用可改善肉鸡的生长性能,体现了SYN较单一益生添加剂更为显著的促生长作用。GTB在肠道中经过脂肪酶的分解缓释丁酸,能有效到达动物肠道后段,更好地发挥促生长作用。曹阳[19]研究显示,饲粮中添加500 mg/kg GTB显著降低肉鸡1~21日龄时的F/G。张浩等[20]研究显示,500 mg/kg丁酸甘油酯可显著降低肉鸡1~21日龄时的F/G,并增加21日龄时的体重。上述结果与本研究中1 g/kg GTB及其与SYN组合显著降低肉鸡1~21日龄时F/G的结果类似。故GTB对肉鸡前期的促生长效果优于后期,CSB需与SYN联用才能有类似的促生长效果。
3.2 丁酸类添加剂及其与SYN组合对肉鸡肠道食糜中微生物数量的影响肠道微生物在维持动物肠道健康和生长性能等方面具有重要作用。研究显示,饲粮中长期添加低剂量抗生素在促进动物生长的同时也会干扰肠道菌群,破坏肠道微生物屏障,损害肠道健康[21]。而采用绿色添加剂替代促生长抗生素能促进肠道有益菌增殖,维护动物肠道健康。本研究中,与BAC-Zn组相比,GTB及其与SYN组合饲喂肉鸡均可显著增加肉鸡盲肠食糜中总细菌数量,表明GTB可增加肠道总细菌数量和菌群多样性,提升肠道菌群结构稳定性。梭菌ⅪⅤa是动物肠道中重要的产丁酸菌,使用抗生素会抑制梭菌ⅪⅤa生长,减少肠道内源性丁酸供给,阻碍肠黏膜更新,削弱肠道屏障[22]。本研究中,饲粮中添加CSB和GTB分别提高肉鸡空肠和盲肠食糜中梭菌ⅪⅤa数量。梭菌ⅪⅤa数量的增加有利于提升肠道中丁酸生成量,促进肠道上皮生长,增强物理屏障,抵抗病原菌入侵[23]。此外,饲粮中添加GTB+SYN还能显著提高肉鸡盲肠食糜中乳酸杆菌数量。乳酸杆菌是动物肠道内最丰富的有益菌[24-25],GTB在全肠道释放的丁酸有效降低肠道食糜pH,促进乳酸杆菌的增殖,而SYN则可通过提供益生元确保乳酸杆菌在消化道中的良好存活性。由此可知,GTB与SYN在促进肠道有益菌增殖上具有较好的互助作用。CSB在肠道前端过早释放消耗可能是导致其促进益生菌增殖较弱的原因。本研究中,GTB和CSB能显著降低空肠食糜中的大肠杆菌数量。大肠杆菌是肠道内最常见的致病菌,研究显示,肠道内包括丁酸在内的SCFAs可通过降低大肠杆菌胞浆内pH,破坏嘌呤完整性,阻碍DNA合成,抑制大肠杆菌生长[26]。综上所述,与CSB相比,GTB具有更好促进肠道有益菌增殖、增加肠道菌群多样性的作用,且SYN能增强其益生作用。
3.3 丁酸类添加剂及其与SYN组合对肉鸡盲肠食糜中SCFAs浓度的影响SCFAs是肠道微生物发酵未分解碳水化合物的主要产物,包括乙酸、丙酸和丁酸,是后段小肠和大肠上皮细胞生长的能量来源,在促进动物肠道生长、维护肠道健康中扮演着重要角色[27]。本研究中,GTB替代10 mg/kg BAC-Zn可提高肉鸡盲肠食糜中总SCFAs浓度。饲粮中长期添加抗生素会引起肠道内菌群结构发生变化,影响SCFAs生成[22],GTB通过在动物肠道中释放丁酸降低肠道pH,增加肠道中耐酸力强的有益菌数量,促进部分SCFAs及乳酸生成,加快肠道上皮细胞生长发育,巩固肠道健康[28]。此外,SYN与GTB或CSB的组合均较单一添加提高了肉鸡盲肠食糜中总SCFAs、乙酸和丙酸浓度。SYN中的益生元为肠道内SCFAs的生成提供了发酵底物,从而增加了肠道SCFAs的生成,有效提升了丁酸类添加剂的益生作用。然而,本研究中丁酸类添加剂单独使用或与SYN组合使用均未对盲肠食糜中丁酸浓度产生显著影响,这可能与脂溶性丁酸分子在细胞膜上快速扩散而被细胞大量消耗有关[29]。
3.4 丁酸类添加剂及其与SYN组合对肉鸡肠道炎症因子和紧密连接蛋白mRNA表达的影响在动物肠道中,微生物及其代谢产物对调节炎症反应具有重要作用。长期饲喂抗生素可能造成动物肠道菌群失调,导致病原菌过度繁殖,从而诱导上皮细胞分泌IL-6等炎性细胞因子,引发炎症反应[30]。因此,本研究中长期添加10 mg/kg BAC-Zn造成盲肠组织IL-6的mRNA表达量显著增加,说明肉鸡肠道可能产生了炎症。而IL-2是一种由CD4+和CD8+细胞分泌的淋巴因子,是细胞免疫应答中的重要抗炎细胞因子。前人研究表明,乳酸杆菌等益生菌可直接作用于白细胞,调节其产生IL-2等抗炎细胞因子,提升肠道抗炎能力[31]。本研究中,GTB单独和与SYN组合添加分别上调了盲肠和空肠组织IL-2的mRNA表达量。提示丁酸类添加剂及其与SYN组合可能通过促进乳酸杆菌增殖,调节肠道组织抗炎因子的合成,维护动物的肠道健康。
MUC2是肠道黏液屏障的重要组成部分,其对抵御病原菌入侵和保护肠道健康具有重要作用[32]。研究表明,乙酸具有调节杯状细胞增殖、分化及促进MUC2分泌的功能[33]。本研究中,CSB与SYN组合上调肉鸡盲肠组织MUC2的mRNA表达可能与盲肠中乙酸浓度的升高有关。除黏液屏障外,由肠上皮细胞、紧密连接蛋白及黏附分子蛋白构成的物理屏障也是维持肠道健康的关键。本研究中,GTB上调了空肠组织JAM2的mRNA表达,GTB与SYN组合则上调了空肠组织ZO-1和盲肠组织JAM2和ZO-1的mRNA表达。一方面,GTB和SYN可以促进乳酸杆菌增殖,乳酸杆菌则通过激活肌球蛋白轻链(myosin light chain,MLC)磷酸化调节紧密连接蛋白的mRNA表达;另一方面,丁酸作为肠道上皮细胞的能量物质,能直接促进肠道上皮细胞增殖和分化,增强肠道上皮紧密连接[34]。肠道组织紧密连接蛋白表达的增加,可降低肠道通透性,减少病原菌入侵[35]。本研究结果也表明,GTB较CSB能更有效地在肠道后段释放丁酸,增加肠道上皮能量供给,加强肉鸡肠道屏障功能,维持肠道健康,提高动物生长性能。
4 结论① CSB和GTB单独替代BAC-Zn可调节肉鸡的空肠菌群结构,改善肠道微生物组成。
② GTB可通过增加肠道有益菌数量和SCFAs生成,调节炎症因子和肠道屏障相关基因表达,提高肉鸡生长性能,SYN能一定程度上提高其益生作用。
| [1] |
WÄCHTERSHÄUSER A, STEIN J. Rationale for the luminal provision of butyrate in intestinal diseases[J]. European Journal of Nutrition, 2000, 39(4): 164-171. DOI:10.1007/s003940070020 |
| [2] |
MEIJER K, DE VOS P, PRIEBE M G, et al. Butyrate and other short-chain fatty acids as modulators of immunity:what relevance for health?[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2010, 13(6): 715-721. DOI:10.1097/MCO.0b013e32833eebe5 |
| [3] |
LONRUST L, DUCATELLE R, VAN DRIESSCHE K, et al. Steering endogenous butyrate production in the intestinal tract of broilers as a tool to improve gut health[J]. Frontiers in Veterinary Science, 2015, 2: 75. |
| [4] |
杨玲, 胡群兵.三丁酸甘油酯和包膜丁酸钠对肉仔鸡生长性能的影响[C]//中国畜牧兽医学会动物营养学分会第十二次动物营养学术研讨会论文集.武汉: 中国农业大学出版社, 2016.
|
| [5] |
MOOKIAH S, SIEO C C, RAMASAMY K, et al. Effects of dietary prebiotics, probiotic and synbiotics on performance, caecal bacterial populations and caecal fermentation concentrations of broiler chickens[J]. Journal of the Science of Food and Agriculture, 2014, 94(2): 341-348. DOI:10.1002/jsfa.6365 |
| [6] |
SUZUKI M T, TAYLOR L T, DELONG E F. Quantitative analysis of small-subunit rRNA genes in mixed microbial populations via 5'-nuclease assays[J]. Applied and Environmental Microbiology, 2000, 66(11): 4605-4614. DOI:10.1128/AEM.66.11.4605-4614.2000 |
| [7] |
GUO X L, XIA X J J, TANG R Y, et al. Real-time PCR quantification of the predominant bacterial divisions in the distal gut of Meishan and Landrace pigs[J]. Anaerobe, 2008, 14(4): 224-228. DOI:10.1016/j.anaerobe.2008.04.001 |
| [8] |
MATSUKI T, WATANABE K, FUJIMOTO J, et al. Use of 16S rRNA gene-targeted group-specific primers for real-time PCR analysis of predominant bacteria in human feces[J]. Applied and Environmental Microbiology, 2004, 70(12): 7220-7228. DOI:10.1128/AEM.70.12.7220-7228.2004 |
| [9] |
KHAFIPOUR E, LI S C, PLAIZIER J C, et al. Rumen microbiome composition determined using two nutritional models of subacute ruminal acidosis[J]. Applied and Environmental Microbiology, 2009, 75(22): 7115-7124. DOI:10.1128/AEM.00739-09 |
| [10] |
HUIJSDENS X W, Linskens R K, MAK M, et al. Quantification of bacteria adherent to gastrointestinal mucosa by real-time PCR[J]. Journal of Clinical Microbiology, 2002, 40(12): 4423-4427. DOI:10.1128/JCM.40.12.4423-4427.2002 |
| [11] |
秦为琳. 应用气相色谱测定瘤胃挥发性脂肪酸方法的研究改进[J]. 南京农业大学学报, 1982(4): 110-116. |
| [12] |
GADDE U, OH S T, LEE Y S, et al. The Effects of direct-fed microbial supplementation, as an alternative to antibiotics, on growth performance, gut immune status, and epithelial barrier gene expression in broiler chickens[J]. Probiotics and Antimicrobial Proteins, 2017, 9(4): 397-405. DOI:10.1007/s12602-017-9275-9 |
| [13] |
ABDUL-CAREEM M F, HUNTER B D, SARSON A J, et al. Marek's disease virus-induced transient paralysis is associated with cytokine gene expression in the nervous system[J]. Viral Immunology, 2006, 19(2): 167-176. |
| [14] |
BRISBIN J T, GONG J H, PARVIZI P, et al. Effects of lactobacilli on cytokine expression by chicken spleen and cecal tonsil cells[J]. Clinical and Vaccine Immunology, 2010, 17(9): 1337-1343. DOI:10.1128/CVI.00143-10 |
| [15] |
DE BOEVER S, VANGESTEL C, DE BACKER P, et al. Identification and validation of housekeeping genes as internal control for gene expression in an intravenous LPS inflammation model in chickens[J]. Veterinary Immunology and Immunopathology, 2008, 122(3/4): 310-317. |
| [16] |
CZERWIŃSKI J, HØJBERG O, SMULIKOWSKA S, et al. Effects of sodium butyrate and salinomycin upon intestinal microbiota, mucosal morphology and performance of broiler chickens[J]. Archives of Animal Nutrition, 2012, 66(2): 102-116. DOI:10.1080/1745039X.2012.663668 |
| [17] |
随佳佳.饲用复合芽孢杆菌和包膜丁酸钠对肉鸡生长性能、氮代谢及排泄物氨逸失的影响[D].硕士学位论文.杭州: 浙江大学, 2016.
|
| [18] |
CHEN Y P, WEN C, ZOU Y M. Dietary synbiotic incorporation as an alternative to antibiotic improves growth performance, intestinal morphology, immunity and antioxidant capacity of broilers[J]. Journal of the Science of Food and Agriculture, 2018, 98(9): 3343-3350. DOI:10.1002/jsfa.8838 |
| [19] |
曹阳.三丁酸甘油酯对肉鸡生产性能和肠道发育影响的研究[D].硕士学位论文.泰安: 山东农业大学, 2016.
|
| [20] |
张浩, 董磊, 王英俊, 等. 丁酸甘油酯对肉鸡生长性能、养分表观消化率、屠宰性能、肠道形态及微生物菌群的影响[J]. 中国畜牧兽医, 2016, 43(8): 2013-2019. |
| [21] |
UBEDA C, PAMER E G. Antibiotics, microbiota, and immune defense[J]. Trends in Immunology, 2012, 33(9): 459-466. DOI:10.1016/j.it.2012.05.003 |
| [22] |
YOUNG V B, SCHMIDT T M. Antibiotic-associated diarrhea accompanied by large-scale alterations in the composition of the fecal microbiota[J]. Journal of Clinical Microbiology, 2004, 42(3): 1203-1206. DOI:10.1128/JCM.42.3.1203-1206.2004 |
| [23] |
MURAKAMI M, IWAMOTO J, HONDA A, et al. Detection of gut dysbiosis due to reduced Clostridium subcluster ⅪⅤa using the fecal or serum bile acid profile[J]. Inflammatory Bowel Diseases, 2018, 24(5): 1035-1044. DOI:10.1093/ibd/izy022 |
| [24] |
CRESCI G, NAGY L E, GANAPATHY V. Lactobacillus GG and tributyrin supplementation reduce antibiotic-induced intestinal injury[J]. Journal of Parenteral and Enteral Nutrition, 2013, 37(6): 763-774. DOI:10.1177/0148607113486809 |
| [25] |
FULLER R. Probiotics in man and animals[J]. The Journal of Applied Bacteriology, 1989, 66(5): 365-378. DOI:10.1111/j.1365-2672.1989.tb05105.x |
| [26] |
余东游, 孙健栋, 麻剑雄, 等. 三丁酸甘油酯的生物学功能及其在畜牧生产中的应用[J]. 中国畜牧杂志, 2014, 50(17): 91-95. |
| [27] |
VENEGAS D P, DE LA FUENTE M K, LANDSKRON G, et al. Short chain fatty acids (SCFAs)-mediated gut epithelial and immune regulation and its relevance for inflammatory bowel diseases[J]. Frontiers in Immunology, 2019, 10: 277-293. DOI:10.3389/fimmu.2019.00277 |
| [28] |
RAMSAY A G, SCOTT K P, MARTIN J C, et al. Cell-associated α-amylases of butyrate-producing Firmicutes bacteria from the human colon[J]. Microbiology, 2006, 152(11): 3281-3290. DOI:10.1099/mic.0.29233-0 |
| [29] |
GU Y, SONG Y, YIN H, et al. Dietary supplementation with tributyrin prevented weaned pigs from growth retardation and lethal infection via modulation of inflammatory cytokines production, ileal FGF19 expression, and intestinal acetate fermentation[J]. Journal of Animal Science, 2017, 95(1): 226-238. |
| [30] |
YAP I K S, LI J V, SARIC J, et al. Metabonomic and microbiological analysis of the dynamic effect of vancomycin-induced gut microbiota modification in the mouse[J]. Journal of Proteome Research, 2008, 7(9): 3718-3728. DOI:10.1021/pr700864x |
| [31] |
KELLY C J, ZHENG L, CAMPBELL E, et al. Crosstalk between microbiota-derived short-chain fatty acids and intestinal epithelial HIF augments tissue barrier function[J]. Cell Host & Microbe, 2015, 17(5): 662-671. |
| [32] |
CORNICK S, KUMAR M, MOREAU F, et al. VAMP8-mediated MUC2 mucin exocytosis from colonic goblet cells maintains innate intestinal homeostasis[J]. Nature Communications, 2019(10): 4306. |
| [33] |
VAN DER SLUIS M, DE KONING B A E, DE BRUIJN A C J M, et al. MUC2-deficient mice spontaneously develop colitis, indicating that MUC2 is critical for colonic protection[J]. Gastroenterology, 2006, 131(1): 117-129. DOI:10.1053/j.gastro.2006.04.020 |
| [34] |
ZOU X, JI J, QU H, et al. Effects of sodium butyrate on intestinal health and gut microbiota composition during intestinal inflammation progression in broilers[J]. Poultry Science, 2019, 98(10): 4449-4456. DOI:10.3382/ps/pez279 |
| [35] |
吴云鹏.植物乳杆菌调节猪肠上皮细胞屏障功能和转运载体的研究[D].博士学位论文.广州: 华南农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10564-1016923607.htm
|




