肠道不仅是营养物质代谢、消化和吸收的主要器官,在信号识别、内源性活性分子形成以及机体黏膜屏障等方面也发挥着重要作用[1]。此外,肠道上皮是一个由多种类型细胞组成的复杂系统,在发育和分化过程中不断进行着基因表达的持续更新和改变,在很大程度上影响着孵化后肉鸡的生长潜力[2-3]。但雏鸡刚出壳时,肠道发育尚不完善,其生长、发育及健康情况直接决定着肉鸡的生长、抗病及免疫等方面[3]。在肉禽生产中,尽早地促进幼禽肠道的功能完善将有利于提高饲粮养分利用率,进而更大程度地发挥其生长潜力和提高机体的抗病能力[4]。因此,有必要在幼禽饲粮中进行营养干预,从而维持雏鸡肠道健康和提高机体免疫机能。
谷氨酰胺(glutamine,Gln)是血液中含量丰富的氨基酸,是肠上皮细胞、淋巴细胞及肠黏膜细胞等快速增殖细胞的主要能量来源[5]。Gln是幼龄动物的一种营养性必需氨基酸,具有重要的生理功能。研究表明,饲粮添加Gln可以增加肉鸡体重,促进肠道生长及发育[6]。并且,饲粮添加Gln能够提高动物生长性能,维持肠道健康及功能,促进免疫器官发育,增强机体免疫机能[6-8]。但到目前为止,有关Gln对肉鸡肠道免疫机能影响的研究还较少。因此,本试验研究了饲粮添加谷氨酰胺对黔东南小香鸡生长性能、免疫性能及肠道黏膜免疫的影响,以期为黔东南小香鸡早期饲粮的科学配制及开发利用提供参考依据。
1 材料与方法 1.1 试验材料及主要仪器Gln含量为99.10%。主要仪器包括FA-1004型电子天平(上海精密科学仪器有限公司)、UV759紫外可见分光光度计(上海精密科学仪器有限公司)、Sigma2-16KL型低温高速离心机(Sigma公司,美国)、LX400-掌式离心机(海门市其林贝尔仪器制造有限公司)、QL-901-型漩涡混匀器(海门市其林贝尔仪器制造有限公司)、Infinite 200酶标仪(TECAN公司,瑞士)、净化工作台(苏州华宏净化技术有限公司)、微量分光光度计(NanoDrop公司,美国)、普通PCR扩增仪(Eppendorf公司,美国)、荧光定量PCR仪(Bio-Rad公司,美国)。
1.2 试验设计选择90只1日龄体重相近的健康雄性黔东南小香鸡,随机分成3个组,每组5个重复,每个重复6只鸡。对照组饲喂基础饲粮,试验组在基础饲粮的基础上分别添加0.5%和1.0%的Gln。基础饲粮参照我国《鸡饲养标准》[9](NY/T 33—2004)配制,其组成及营养水平如表 1所示。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
饲养试验在贵州省榕江山农发展有限公司进行。试验前鸡舍严格消毒,所有鸡只进行笼养,6只/笼。整个饲养期,鸡只自由采食及饮水,每天饲喂3次。舍内温度、相对湿度、光照等严格按照常规饲养管理要求进行,按照常规免疫程序进行鸡只免疫,试验期为21 d。
1.4 试验样品采集 1.4.1 血清样品采集在试验结束前1天,所有鸡只进行8 h断料(自由饮水)。于试验第21天08:00,每组选择10只(每个重复2只鸡)符合群体均重的鸡进行颈部静脉放血宰杀,将血液采集至10 mL离心管中,倾斜静置,便于血清的析出。于4 ℃,2 500 r/min条件下离心15 min,收集血清并分装,保存于-20 ℃条件下待测。
1.4.2 免疫器官样品采集将放血完的肉鸡(每组10只,每个重复2只)立即打开腹腔,分别摘取脾脏、胸腺和法氏囊等免疫器官,用精密天平进行称重,用于免疫器官指数的测定。
1.4.3 空肠黏膜样品采集在空肠中部采集5 cm左右的肠段,用手术剪纵向剖开肠段,用预冷的生理盐水冲洗干净食糜后,用载玻片刮取肠黏膜至2 mL冻存管中,保存于液氮中待测。
1.5 测定指标与方法 1.5.1 生长性能试验第1天和第21天,以重复为单位对黔东南小香鸡进行空腹称重,用以计算平均日增重(average daily gain, ADG)。在试验期间,以重复为单位分别记录每天的投料量及剩料重,用以计算平均日采食量(average daily feed intake, ADFI)及料重比(feed to gain ratio,F/G)。
1.5.2 免疫器官指数鸡屠宰后,打开腹腔,分别摘取脾脏、胸腺和法氏囊,用精密天平称量鲜重并记录,用以计算免疫器官指数。免疫器官指数计算公式如下:

|
血清免疫球蛋白A(immunoglobulin A,IgA)、免疫球蛋白G(immunoglobulin G,IgG)及免疫球蛋白M(immunoglobulin M,IgM)含量均采用商品化试剂盒进行测定,操作步骤按照试剂盒说明书进行,所用试剂盒均购自南京建成生物工程研究所。
1.5.4 空肠黏膜分泌型免疫球蛋白A(secretory immunoglobulin A,sIgA)含量采用商品化试剂盒进行空肠黏膜sIgA含量的测定,操作步骤按照试剂盒说明书进行,所用试剂盒购自南京建成生物工程研究所。
1.5.5 空肠黏膜黏蛋白1(MUC1)和黏蛋白2(MUC2)mRNA表达水平利用RNAiso Plus试剂(产品编号:D9108A,TaKaRa公司,日本)进行空肠黏膜总RNA的提取,操作步骤按照试剂说明进行。利用微量分光光度计将提取的RNA进行浓度测定。根据NCBI数据库进行肠道黏膜MUC1及MUC2引物的设计(引物序列如表 2所示)。实时荧光定量PCR检测采用SYBR Green染料法,在CFX ConnectTM PCR仪器上进行,SYBR Premix Ex Taq试剂盒购自TaKaRa公司,操作步骤按试剂盒说明书操作,以β-肌动蛋白(β-actin)为内参。基因表达水平的计算参照Livak等[10]的方法进行。所有样品测定3次。
|
|
表 2 实时荧光定量PCR引物序列 Table 2 Primer sequences for real-time PCR |
应用SPSS 20.0中的一般线性模型进行方差分析,若差异显著则进一步利用Duncan氏法进行多重比较。结果以平均值±标准差表示,P < 0.05表示差异显著。
2 结果 2.1 饲粮添加Gln对黔东南小香鸡生长性能的影响饲粮添加Gln对黔东南小香鸡生长性能的影响如表 3所示。与对照组相比,饲粮添加0.5%的Gln显著增加了黔东南小香鸡ADG(P < 0.05),但对ADFI及F/G没有显著影响(P>0.05);饲粮添加1.0%的Gln显著增加了黔东南小香鸡ADG及ADFI(P < 0.05),显著降低了F/G(P < 0.05)。并且,1.0% Gln添加组的ADG显著高于0.5% Gln添加组(P < 0.05),但2组之间ADFI及F/G差异不显著(P>0.05)。
|
|
表 3 饲粮添加Gln对黔东南小香鸡生长性能的影响 Table 3 Effects of dietary Gln on growth performance of Qiandongnan Xiaoxiang chickens |
饲粮添加Gln对黔东南小香鸡免疫器官指数的影响如表 4所示。与对照组相比,饲粮添加0.5%的Gln显著增加了黔东南小香鸡胸腺指数(P < 0.05),但对脾脏指数和法氏囊指数无显著影响(P>0.05);饲粮添加1.0%的Gln显著增加了黔东南小香鸡胸腺指数、脾脏指数及法氏囊指数(P < 0.05)。并且,1.0% Gln添加组的胸腺指数、脾脏指数及法氏囊指数均显著高于0.5% Gln添加组(P < 0.05)。
|
|
表 4 饲粮添加Gln对黔东南小香鸡免疫器官指数的影响 Table 4 Effects of dietary Gln on immune organ indexes of Qiandongnan Xiaoxiang chickens |
饲粮添加Gln对黔东南小香鸡血清免疫球蛋白含量的影响如表 5所示。与对照组相比,饲粮添加0.5%的Gln显著提高了黔东南小香鸡血清IgG含量(P < 0.05),但对血清IgA及IgM含量没有显著影响(P>0.05);饲粮添加1.0%的Gln显著增加了血清IgA、IgG及IgM含量(P < 0.05)。并且,1.0% Gln添加组的血清IgA、IgG及IgM含量均显著高于0.5% Gln添加组(P < 0.05)。
|
|
表 5 饲粮添加Gln对黔东南小香鸡血清免疫球蛋白含量的影响 Table 5 Effects of dietary Gln on serum immunoglobulin contents of Qiandongnan Xiaoxiang chickens |
饲粮添加Gln对黔东南小香鸡空肠黏膜sIgA含量的影响如图 1所示。与对照组相比,饲粮添加0.5%的Gln对黔东南小香鸡空肠黏膜sIgA含量没有显著影响(P>0.05);饲粮添加1.0%的Gln显著增加了黔东南小香鸡空肠黏膜sIgA含量(P < 0.05)。并且,1.0% Gln添加组空肠黏膜sIgA含量显著高于0.5% Gln添加组(P < 0.05)。
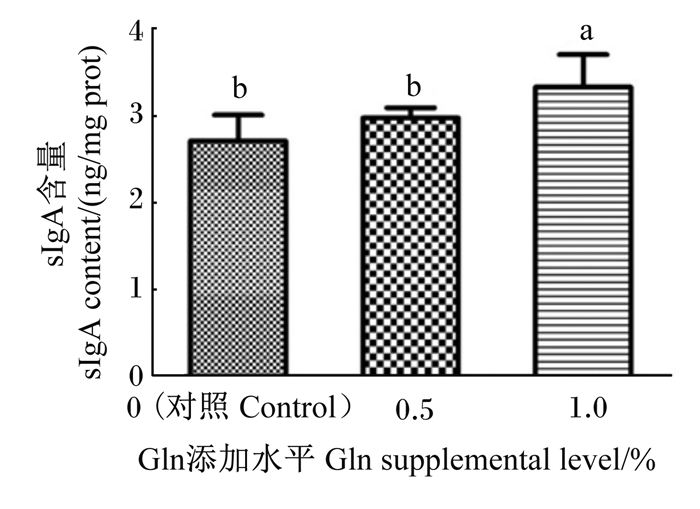
|
数据柱标相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下图同。 Value columns with the same small letter mean no significant difference (P > 0.05), while with different small letters mean significant difference (P < 0.05). The same as below. 图 1 饲粮添加Gln对黔东南小香鸡空肠黏膜sIgA含量的影响 Fig. 1 Effects of dietary Gln on content of sIgA in jejunal mucosa of Qiandongnan Xiaoxiang chickens |
饲粮添加Gln对黔东南小香鸡空肠黏膜MUC1和MUC2 mRNA表达水平的影响如图 2所示。与对照组相比,饲粮添加0.5%的Gln对空肠黏膜MUC1和MUC2 mRNA表达水平没有显著影响(P>0.05);饲粮添加1.0%的Gln显著增加了空肠黏膜MUC1和MUC2 mRNA表达水平(P < 0.05)。并且,1.0% Gln添加组的空肠黏膜MUC1和MUC2 mRNA表达水平均显著高于0.5% Gln添加组(P < 0.05)。
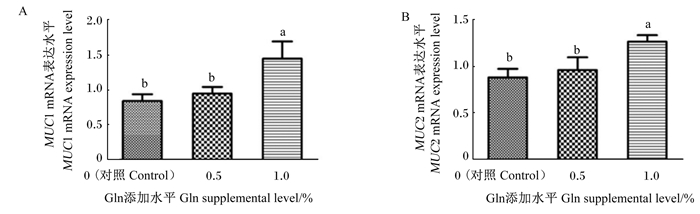
|
图 2 饲粮添加Gln对黔东南小香鸡空肠黏膜MUC1及MUC2 mRNA表达水平的影响 Fig. 2 Effects of dietary Gln on mRNA expression levels of MUC1 and MUC2 in jejunal mucosa of Qiandongnan Xiaoxiang chickens |
本研究发现,饲粮添加0.5%的Gln仅显著增加了黔东南小香鸡ADG,但对ADFI及F/G没有影响。然而,饲粮添加1.0%的Gln显著增加了黔东南小香鸡ADG及ADFI,并显著降低了F/G。这意味着Gln对黔东南小香鸡生长性能的促进作用具有剂量依赖性。饲粮添加Gln有利于促进肉鸡生长性能。Xue等[11]研究表明,与对照组(饲粮Gln添加水平为0)相比,饲粮添加1.0%的Gln显著增加了肉鸡ADG及ADFI,显著降低了F/G,这与本试验的结果一致。Dai等[12]研究也得到了类似的结果。但Sakamoto等[6]研究表明,饲粮添加1.0%的Gln对14日龄肉鸡生长性能没有显著影响,这与本研究的结果并不一致。造成差异的原因可能是由于饲粮Gln添加时间长短的不同引起。
3.2 饲粮添加Gln对黔东南小香鸡免疫器官指数的影响免疫器官指数是评价家禽免疫状态的重要指标[13]。胸腺、脾脏及法氏囊是禽类的主要免疫器官,而免疫器官发育情况与机体免疫性能的强弱有着密切的联系[14]。胸腺是机体重要的中枢免疫器官,而法氏囊和脾脏分别是禽类所特有的主导体液免疫的中枢淋巴器官和外周淋巴器官[15]。通常认为,胚胎发育后期至出雏后20日龄是家禽免疫器官快速发育的时期。本研究发现,饲粮添加0.5%的Gln仅显著增加了黔东南小香鸡胸腺指数,饲粮1.0%的Gln显著增加了黔东南小香鸡胸腺指数、脾脏指数及法氏囊指数。王中华等[16]选用1日龄爱拔益加(AA)肉鸡为试验动物,在其饲粮中分别添加0、0.5%、1.0%及1.5%的Gln,结果发现,饲粮添加0.5%、1.0%及1.5%的Gln显著增加了肉鸡胸腺指数及脾脏指数,并且以饲粮添加1.0%的Gln效果最好。研究证实,饲粮添加Gln能够促进免疫器官的发育和成熟,提高机体免疫机能,具体表现为:胸腺内胸腺小叶数量增加,法氏囊内淋巴滤泡数量增多,脾脏内脾小结增多、增大[17-18]。以上结果表明,饲粮添加Gln可能通过加强免疫细胞增殖分化,促进胸腺、脾脏及法氏囊等免疫器官的发育,增强机体的细胞免疫和体液免疫功能。Gln对免疫器官发育的促进作用可能是由于饲粮添加Gln为机体免疫器官的发育提供了丰富的嘌呤、嘧啶等活性前体物质,从而促进了免疫器官的生长发育[19-20]。
3.3 饲粮添加Gln对黔东南小香鸡血清免疫球蛋白含量的影响IgA、IgG及IgM主要由B淋巴细胞分泌,在体液免疫中起着重要作用。机体免疫球蛋白含量的高低在一定程度上反映了机体免疫机能的状况[21]。本试验结果表明,饲粮添加1.0%的Gln显著增加了血清IgA、IgG及IgM含量。这与Bartell[22]的研究结果相似,其研究表明饲粮添加1.0%的Gln显著增加了肉鸡血清IgA、IgG及IgM含量。Bartell等[23]以Cobb肉鸡为试验对象,在其饲粮中添加1.0%的Gln,结果发现饲粮添加1.0%的Gln显著增加了21日龄肉鸡血清IgA及IgG含量。IgG及IgM是T辅助细胞依赖性抗体,是T辅助细胞响应的指示物[24]。研究表明,Gln能够促进CD4+(辅助性T细胞的一种)的增殖[25]。这意味着Gln可能通过提高辅助性T细胞的增殖或免疫球蛋白合成而增加血清IgG或IgM的含量。这些结果提示,饲粮添加1.0%的Gln能增加免疫球蛋白分泌量,提高机体体液免疫水平。
3.4 饲粮添加Gln对黔东南小香鸡空肠黏膜免疫的影响肠道上皮细胞作为肠道上皮组织发挥消化、吸收、内外分泌等主要功能,是构成黏膜屏障的重要组成部分,其增殖、分化和凋亡的程度直接与肠道的健康密切相关。并且,肠黏膜能分泌特异性和非特异性物质构建肠道的免疫屏障,避免病原菌在肠道的吸附与定植,有效地保护肠道健康[26]。肠道黏膜固有层浆细胞分泌产生的sIgA是肠道黏膜重要的防御机制,能阻止外来毒素及抗原的入侵[27]。在肠黏膜中,sIgA不仅能消除抗原,还能抵抗黏膜中蛋白酶溶解作用,进而保护肠黏膜,发挥其免疫效应[28]。研究表明,饲粮添加Gln显著增加了肠黏膜中sIgA浆细胞数量,增加肠道sIgA含量[8, 29]。并且,Wu等[30]以小鼠为模型,在其饲粮中添加Gln,结果发现,Gln通过调控肠道微生物群及T细胞依赖性及非依赖性途径促进了肠道sIgA的分泌。本试验结果表明,饲粮添加1.0%的Gln显著增加了黔东南小香鸡空肠黏膜sIgA含量,这也与血清免疫球蛋白(IgA、IgG及IgM)含量增加的结果相一致,这表明饲粮添加Gln提高了机体体液免疫水平。由此可知,饲粮添加Gln有利于改善肉鸡肠道免疫机能,促进肠道黏膜屏障的发育,但具体的机制还有待于进一步的研究。
肠道上皮细胞间散布着大量的杯状细胞,能够分泌肠道黏蛋白。这些黏蛋白与肠道黏膜表面的水和电解质混合,在肠上皮形成化学屏障,保护肠黏膜免受化学和机械损伤[31-32]。在肠黏膜中,MUC1和MUC2是最主要的黏蛋白。MUC1是主要存在于上皮细胞表面的膜结合型黏蛋白,参与肠先天免疫和获得性免疫,增强肠道黏膜免疫;MUC2为分泌型黏蛋白,参与维持消化道正常功能及防御病原微生物入侵的功能,是肠道黏蛋白的主要成分[33]。本研究发现,饲粮添加1.0%的Gln显著增加了黔东南小香鸡肠道黏膜MUC1和MUC2 mRNA表达水平。但就我们所知,到目前为止,有关Gln对肉鸡肠道黏膜MUC1和MUC2 mRNA表达水平的影响还未见报道。邢深[34]在仔猪上的研究表明,饲粮添加Gln显著增加了小肠上皮杯状细胞数量,显著增加了空肠MUC2 mRNA表达水平。高玉琪等[35]以獭兔为研究对象的结果表明,饲粮添加Gln显著增加了回肠黏膜MUC1 mRNA表达水平。这可能是由于饲粮添加Gln刺激了肠隐窝干细胞增殖并转化为杯状细胞,从而增加肠道黏蛋白的分泌,进而增强肠道的免疫性能。
4 结论饲粮添加1.0%的Gln能够提高黔东南小香鸡生长性能、免疫性能及肠道免疫机能。
| [1] |
GAO T, ZHAO M M, ZHANG L, et al. In ovo feeding of L-arginine regulates intestinal barrier functions of posthatch broilers by activating the mTOR signaling pathway[J]. Journal of the Science of Food and Agriculture, 2018, 98(4): 1416-1425. DOI:10.1002/jsfa.8609 |
| [2] |
TAKO E, FERKET P R, UNI Z. Effects of in ovo feeding of carbohydrates and beta-hydroxy-beta-methylbutyrate on the development of chicken intestine[J]. Poultry Science, 2004, 83(12): 2023-2028. DOI:10.1093/ps/83.12.2023 |
| [3] |
师昆景, 吴灵英. 肉禽早期肠道发育的营养调控[J]. 家禽科学, 2007, 29(4): 51-54. |
| [4] |
UNI Z, TAKO E, GAL-GARBER O, et al. Morphological, molecular, and functional changes in the chicken small intestine of the late-term embryo[J]. Poultry Science, 2003, 82(11): 1747-1754. DOI:10.1093/ps/82.11.1747 |
| [5] |
WU G, BAZER F W, JOHNSON G A, et al. Triennial growth symposium:important roles for L-glutamine in swine nutrition and production[J]. Journal of Animal Science, 2011, 89(7): 2017-2030. DOI:10.2527/jas.2010-3614 |
| [6] |
SAKAMOTO M I, MURAKAMI A E, SILVEIRA T G V, et al. Influence of glutamine and vitamin E on the performance and the immune responses of broiler chickens[J]. Brazilan Journal of Poultry Science, 2006, 8(4): 243-249. DOI:10.1590/S1516-635X2006000400007 |
| [7] |
刘艳芬, 马建升, 黄银姬, 等. 谷氨酰胺对肉仔鸡免疫器官发育及免疫功能的影响[J]. 中国兽医学报, 2006, 26(5): 567-569. |
| [8] |
XING S, ZHANG B L, LIN M, et al. Effects of alanyl-glutamine supplementation on the small intestinal mucosa barrier in weaned piglets[J]. Asian-Australas Journal of Animal Science, 2017, 30(2): 236-245. |
| [9] |
中华人民共和国农业部.NY/T 33-2004鸡饲养标准[S].北京: 中国农业出版社, 2004.
|
| [10] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ct method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [11] |
XUE G D, BAREKATAIN R, WU S B, et al. Dietary L-glutamine supplementation improves growth performance, gut morphology, and serum biochemical indices of broiler chickens during necrotic enteritis challenge[J]. Poultry Science, 2018, 97(4): 1334-1341. DOI:10.3382/ps/pex444 |
| [12] |
DAI S F, WANG L K, WEN A Y, et al. Dietary glutamine supplementation improves growth performance, meat quality and colour stability of broilers under heat stress[J]. British Poultry Science, 2009, 50(3): 333-340. DOI:10.1080/00071660902806947 |
| [13] |
郑肖川.冬凌草甲素对肉鸡免疫应激调控作用研究[D].硕士学位论文.南京: 南京农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10307-1017260415.htm
|
| [14] |
李国军.酵母对脂多糖诱导黄羽肉鸡急性炎症反应的影响[D].硕士学位论文.长沙: 湖南农业大学, 2016. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZGXJ201610007329.htm
|
| [15] |
张芬鹊.细菌脂多糖和地塞米松应激对肉仔鸡肠黏膜功能的影响[D].硕士学位论文.晋中: 山西农业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10113-1015635225.htm
|
| [16] |
王中华, 黄修奇, 杨艳玲. 谷氨酰胺对肉仔鸡生长、屠宰性能和免疫器官指数的影响[J]. 中国家禽, 2011, 33(18): 64-65. |
| [17] |
张敏, 邹晓庭, 孙亚丽, 等. 谷氨酰胺对1~3周龄肉仔鸡免疫功能的影响[J]. 畜牧兽医学报, 2009, 40(10): 1494-1498. |
| [18] |
李升和, 王珏, 范光丽, 等. 谷氨酰胺对肉鸡免疫器官胚后发育的影响[J]. 中国兽医学报, 2006, 26(1): 74-78. |
| [19] |
WANG B, WU G Y, ZHOU Z G, et al. Glutamine and intestinal barrier function[J]. Amino Acids, 2015, 47(10): 2143-2154. DOI:10.1007/s00726-014-1773-4 |
| [20] |
邓留坤.胚胎注射谷氨酰胺对肉仔鸡早期生长发育的影响[D].硕士学位论文.杨凌: 西北农林科技大学.2010.
|
| [21] |
王丽.谷氨酰胺对断奶仔猪免疫应激调节作用及其分子机制的研究[D].硕士学位论文.沈阳: 沈阳农业大学.2017. http://cdmd.cnki.com.cn/Article/CDMD-10157-1017123307.htm
|
| [22] |
BARTELL S M.The effect of supplemental glutamine on growth performance, development of the gastrointestinal tract, and immune response of broiler chicks[D].Ph.D.Thesis.Georgia, USA: The University of Georgia, 2003.
|
| [23] |
BARTELL S M, BATAL A B. The Effect of supplemental glutamine on growth performance, development of the gastrointestinal tract, and humoral immune response of broilers[J]. Poultry Science, 2007, 86(9): 1940-1947. DOI:10.1093/ps/86.9.1940 |
| [24] |
MATHERS A R, CUFF C F. Role of interleukin-4(IL-4) and IL-10 in serum immunoglobulin G antibody responses following mucosal or systemic reovirus infection[J]. Journal of Virology, 2004, 78(7): 3352-3360. DOI:10.1128/JVI.78.7.3352-3360.2004 |
| [25] |
YEH S L, YEH C L, LIN M T, et al. Effects of glutamine-supplemented total parenteral nutrition on cytokine production and T cell population in septic rats[J]. Journal of Parenteral and Enteral Nutrition, 2001, 25(5): 269-274. DOI:10.1177/0148607101025005269 |
| [26] |
VIGGIANO D, IANIRO G, VANELLA G, et al. Gut barrier in health and disease:focus on childhood[J]. European Review for Medical and Pharmacological Sciences, 2015, 19(6): 1077-1085. |
| [27] |
MACPHERSON A J, HUNZIKER L, MCCOY K, et al. IgA responses in the intestinal mucosa against pathogenic and non-pathogenic microorganisms[J]. Microbes and Infection, 2001, 3(12): 1021-1035. DOI:10.1016/S1286-4579(01)01460-5 |
| [28] |
叶亚玲.Ala-Gln对断奶仔猪体液免疫及肠黏膜细胞免疫的调控作用[D].硕士学位论文.南昌: 江西农业大学.2014. http://cdmd.cnki.com.cn/article/cdmd-10410-1014402431.htm
|
| [29] |
刘涛.谷氨酰胺对早期断奶仔猪肠道营养与免疫功能影响机理的研究[D].博士学位论文.武汉: 华中农业大学.2002. http://d.wanfangdata.com.cn/Thesis/Y468778
|
| [30] |
WU M M, XIAO H, LIU G, et al. Glutamine promotes intestinal sIgA secretion through intestinal microbiota and IL-13[J]. Molecular Nutrition & Food Research, 2016, 60(7): 1637-1648. |
| [31] |
PATEL K K, MIYOSHI H, BEATTY W L, et al. Autophagy proteins control goblet cell function by potentiating reactive oxygen species production[J]. EMBO Journal, 2013, 32(24): 3130-3144. DOI:10.1038/emboj.2013.233 |
| [32] |
KHAN W I. Physiological changes in the gastrointestinal tract and host protective immunity:learning from the mouse-Trichinella spiralis model[J]. Parasitology, 2008, 135(6): 671-682. DOI:10.1017/S0031182008004381 |
| [33] |
冯奇.日粮NDF水平对断奶獭兔肠MUC1、MUC2与FASN表达的影响[D].硕士学位论文.杨凌: 西北农林科技大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10712-1013346034.htm
|
| [34] |
邢深.日粮添加丙氨酰谷氨酰胺对仔猪小肠黏膜屏障功能的影响[D].硕士学位论文.南京: 南京农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10307-1017259767.htm
|
| [35] |
高玉琪, 任战军, 胡志刚, 等. 日粮添加不同水平谷氨酰胺对幼龄獭兔免疫性能及回肠黏蛋白基因表达的影响[J]. 中国兽医学报, 2016, 36(4): 655-660. |




