2. 中国农业科学院家禽研究所, 扬州 225125;
3. 绿康生化股份有限公司, 南平 353400
2. Poultry Institute, Chinese Academy of Agricultural Sciences, Yangzhou 225125, China;
3. Lifecome Biochemistry Co., Ltd., Nanping 353400, China
在畜禽生产中,抗生素为畜禽养殖业发展带来了巨大的收益,但同时也产生了很大的负面影响,如畜禽产品中抗生素的残留、病原菌对抗生素的耐药性、正常微生物菌群失调等[1-3]。近年来,随着大众对抗生素认识的提高及相关法律法规的出台,抗生素的使用逐步规范。众多学者也在积极寻找抗生素的替代品,益生菌是目前的研究热点之一,已作为添饲料加剂用于畜禽生产中。其中,枯草芽孢杆菌(Bacillus subtilis)是常见的益生菌之一。
枯草芽孢杆菌是革兰氏阳性菌,具有良好的耐高温、耐酸性和耐胆盐能力,即使在极端环境下,也可诱导产生抗逆性很强的内源孢子[4],适应环境能力很强。很多研究表明,枯草芽孢杆菌具有良好的促生长作用,可以提高禽类的生长性能和免疫力[5-8],改善营养物质的消化吸等[9]。有研究认为,枯草芽孢杆菌的促生长作用可能是由于其对特定肠道微生物的影响,包括增加有益菌的数量、减少某些致病菌的数量[10-12]。虽然当下已有很多枯草芽孢杆菌替代抗生素的研究[13-14],但基于微生物测序技术,对抗生素及其替代品枯草芽孢杆菌对家禽肠道微生物群落的影响进行比较、分析并评价其替代效果的研究还很少。因此,本试验研究了枯草芽孢杆菌和抗生素杆菌肽锌作为饲料添加剂对肉鸡生长性能的影响,采用16S rDNA测序法比较了枯草芽孢杆菌和杆菌肽锌对家禽肠道微生物群落的影响,为抗生素替代品枯草芽孢杆菌在家禽产业中的效益评价提供了更全面的视角。
1 材料与方法 1.1 试验动物和材料1日龄雄性爱拔益加(AA)肉鸡270只,购于江苏京海禽业集团。枯草芽孢杆菌(LIFEGUFS-S 200),活菌数≥2.0×1010 CFU/g。杆菌肽锌预混剂(BZn),每100 g产品中有15 g(60万单位)的有效杆菌肽锌。
1.2 试验设计及饲养管理将270只体重(42.11±0.10) g的1日龄雄性肉鸡随机分为3组,每组6个重复,每个重复15只鸡。阴性对照组(negative control group,NC组)饲喂基础饲粮,阳性对照组(positive control group,PC组)在基础饲粮中添加250 g/t杆菌肽锌,试验组(Bacillus subtilis group,BS组)在基础饲粮中添加750 g/t枯草芽孢杆菌。试验期为42 d,分为2个阶段,第1阶段为1~21日龄,第2阶段为22~42日龄。2个试验阶段的基础饲粮参照NRC(1994)标准配制,基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets (air-dry basis) |
试验在中国农业科学院家禽科学研究所的试验基地进行,采用网上平养模式。试验初始温度为33 ℃,随后每周降低2~3 ℃,直至26 ℃。相对湿度60%左右。每天24 h光照。试验期间鸡自由采食和饮水,并按照正常免疫程序进行免疫接种。
1.3 样品采集与指标测定在21和42日龄时提前禁食4 h,分别称取每个重复鸡的体重及剩余料重,然后统计每个组的平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G),并计算欧洲效益指数(EPI)。

|
42日龄时,提前禁食4 h,然后每个重复随机选取1只与平均重相近的鸡,颈静脉放血致死,解剖后剪取十二指肠中段、空肠前1/4段以及回肠中段的肠道组织1~2 cm,去掉食糜,用4%多聚甲醛溶液固定。各样品依次以乙醇梯度递增脱水,然后将样本用二甲苯清洗后,嵌入石蜡中,加工成切片,然后进行苏木精-伊红(HE)染色。制作好的切片用阳性荧光显微镜(DM4000B,Leica Microsystems,Wetzlar,德国)测量绒毛高度和隐窝深度,计算绒毛高度/隐窝深度(V/C)。收集盲肠食糜,置于液氮暂存,后转入-80 ℃保存,由北京Novogene公司进行DNA提取和16S rDNA扩增子测序分析。
1.4 DNA提取与测序文库构建根据说明书提示,使用D5625-02 DNA试剂盒(Omega Bio-Tek Inc.,美国)从每只鸡的盲肠内容物中提取总基因组DNA。DNA提取后,用ND-2000型纳米滴分光光度计(Nano Drop Technologies,美国)分析其浓度和纯度。然后将DNA保存至-20 ℃备用。采用聚合酶链式反应(PCR)对细菌16S rDNA的V4结构域进行扩增。扩增产物用2%琼脂糖凝胶电泳提取,混合均匀后,用GeneJET凝胶提取试剂盒(Thermo Fisher Scientific,美国)纯化。使用Ion Plus Fragment Library Kit建库试剂盒(Thermo Fisher Scientific,美国)构建文库。经过Qubit定量和文库测试后,所构建的文库由IonS5TMXL测序平台测序。
1.5 质量过滤与序列数据分析基于IonS5TMXL测序平台,采用单端测序方法构建一个小片段文库。通过切割和过滤读取获得最终的有效数据。在有效数据的基础上,将序列聚类成具有97%同源性的操作分类单元(OTUs),然后利用OTUs序列和Silva132数据库进行物种注释分析。根据物种注释,通过计算α多样性和β多样性,并比较各组间的差异,揭示不同处理下群落结构的差异。使用Shannon、Simpson、Chao1和Observed_species指数,基于OTUs计算α多样性指数。采用主坐标分析法(PCoA)、算术平均加权对群法(UPGMA)、相似性分析法(ANOSIM)、多重反应排列法(MRPP)、方差分析法(Adonis)和LEfSe等方法分析不同群体间群落结构的差异,即β多样性。
1.6 数据处理与统计分析所有数据用Excel 2010进行初步处理,然后用SPSS 21.0软件进行统计和单因素方差分析(one-way ANOVA),用LSD法进行组间多重比较,结果用平均值±标准误表示,P < 0.05为差异显著,P < 0.01为差异极显著。
2 结果 2.1 枯草芽孢杆菌对肉鸡生长性能的影响由表 2可知,BS组的21日龄平均体重和1~21日龄平均日增重极显著低于PC组(P < 0.01),但BS组与NC组、PC组与NC组之间差异不显著(P>0.05);3组之间的1~21日龄平均日采食量和料重比没有显著差异(P>0.05)。
|
|
表 2 枯草芽孢杆菌对肉鸡生长性能的影响 Table 2 Effects of Bacillus subtilis on growth performance of broilers |
BS组的42日龄平均体重极显著高于NC组(P < 0.01),PC组显著高于NC组(P < 0.05),但BS组与PC组之间差异不显著(P>0.05);BS组的22~42日龄平均日增重极显著高于NC组(P < 0.01),BS组与NC组、PC组与NC组之间差异不显著(P>0.05);BS组的22~42日龄平均日采食量显著高于NC组(P < 0.05),料重比显著低于NC组(P < 0.05),但BS组与PC组、PC组与NC组之间差异不显著(P>0.05)。
BS组的1~42日龄平均日增重极显著高于NC组(P < 0.01),PC组显著高于NC组(P < 0.05),BS组与PC组之间没有显著差异(P>0.05);BS组和PC组的1~42日龄料重比显著低于NC组(P < 0.05),但BS组与PC组之间没有显著差异(P>0.05);PC组的欧洲效益指数极显著高于NC组(P < 0.01),BS组显著高于NC组(P < 0.05),BS组与PC组之间没有显著差异(P>0.05);3组之间的1~42日龄平均日采食量和死亡率没有显著差异(P>0.05)。
2.2 枯草芽孢杆菌对肉鸡肠道形态的影响由表 3可知,BS组的回肠V/C显著高于NC组(P < 0.05),3组之间的十二指肠和空肠V/C无显著差异(P>0.05)。3组之间的十二指肠、空肠和回肠的绒毛高度和隐窝深度没有显著差异(P>0.05)。
|
|
表 3 枯草芽孢杆菌对肉鸡肠道形态的影响 Table 3 Effects of Bacillus subtilis on intestinal morphology of broilers |
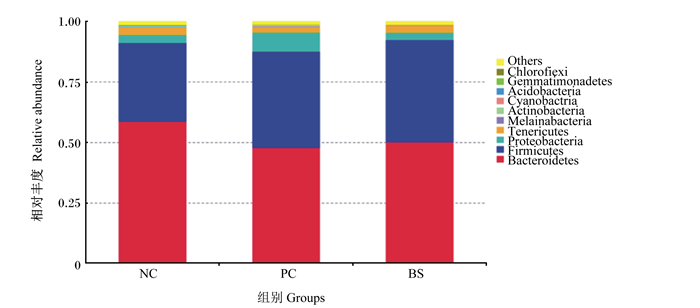
图 1展示了42日龄肉鸡盲肠微生物门水平的相对丰度排行前10位的微生物。从图中可以看出,各组盲肠菌群以拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、无壁菌门(Tenericutes)、黑水仙菌门(Melainabacteria)、放线菌门(Actinobacteria)、蓝藻菌门(Cyanobactria)和酸杆菌门(Acidobacteria)为主。其中,Bacteroidetes和Firmicutes为优势菌门,占微生物群落总数的80%以上。
|
Bacteroidetes:拟杆菌门;Firmicutes:厚壁菌门;Proteobacteria:变形菌门;Tenericutes:无壁菌门;Melainabacteria:黑水仙菌门;Actinobacteria:放线菌门;Cyanobactria:蓝藻菌门;Acidobacteria:酸杆菌门;Gemmatimonadetes:芽单胞菌门;Chlorofiexi:绿弯菌门;Others:其他。 图 1 42日龄肉鸡盲肠微生物门水平上的相对丰度(前10位)柱形图 Fig. 1 Column chart of relative abundance (top 10) at phylum level in caecum microbiota of broilers at 42 days of age |
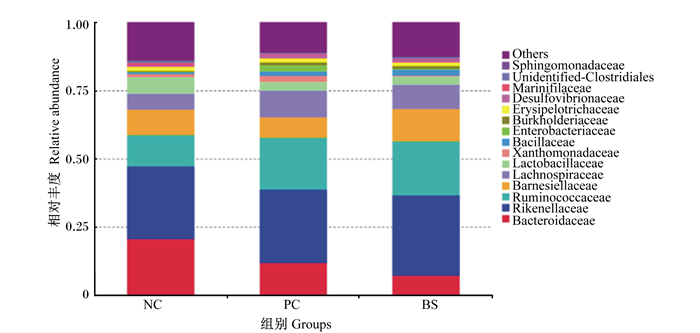
图 2展示了42日龄肉鸡盲肠微生物科水平的相对丰度排行前15位的微生物。从图中可以看出,各组主要含有拟杆菌科(Bacteroidaceae)、理研菌科(Rikenellaceae)、瘤胃球菌科(Ruminococcaceae)、巴恩斯氏菌科(Barnesiellaceae)、毛螺旋菌科(Lachnospiraceae)、乳酸细菌科(Lactobacillaceae)、黄单孢菌科(Xanthomonadaceae)、芽胞杆菌科(Bacillaceae)、肠杆菌科(Enterobacteriaceae)、柏克氏菌科(Burkholderiaceae)、韦荣球菌科(Erysipelotrichaceae)和脱硫弧菌科(Desulfovibrionaceae)等。与NC组相比,BS组的Firmicutes中的Ruminococcaceae相对丰度明显增加,PC组的Firmicutes中的Lachnospiraceae相对丰度也明显增加。NC组的Bacteroidaceae相对丰度大于PC组,PC组大于BS组。NC组和BS组的Barnesiellaceae相对丰度高于PC组。NC组的Lachnospiraceae相对丰度最低。与NC组相比,PC组的Xanthomonadaceae相对丰度增加,PC组和BS组的Bacillaceae相对丰度增加,但NC组的Enterobacteriaceae相对丰度高于PC组和BS组。PC组和BS组的盲肠微生物在科水上的分布更相似。
|
Bacteroidaceae:拟杆菌科;Rikenellaceae:理研菌科;Ruminococcaceae:瘤胃球菌科;Barnesiellaceae:巴恩斯氏菌科;Lachnospiraceae:毛螺旋菌科;Lactobacillaceae:乳酸细菌科;Xanthomonadaceae:黄单孢菌科;Bacillaceae:芽胞杆菌科;Enterobacteriaceae:肠杆菌科;Burkholderiaceae:柏克氏菌科;Erysipelotrichaceae:韦荣球菌科;Desulfovibrionaceae:脱硫弧菌科;Marinifilaceae:海百合科;Unidentified-Clostridiales:未分类梭菌科;Sphingomonadaceae:鞘脂单胞菌科;Others:其他。 图 2 42日龄肉鸡盲肠微生物科水平上的相对丰度(前15位)柱形图 Fig. 2 Column chart of relative abundance (top 15) at family level in cecal microbiota of broilers at 42 days of age |
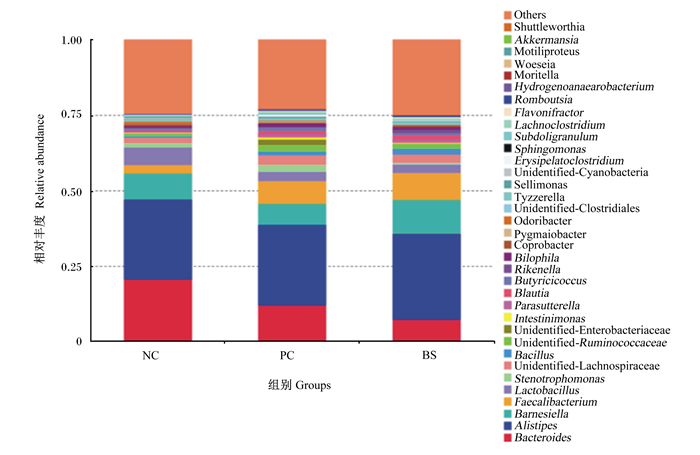
图 3展示了42日龄肉鸡盲肠微生物属水平相对丰度前35位的微生物。从图中可以看出,这35个微生物大约占群落总数的75%,主要是拟杆菌属(Bacteroides)、另枝菌属(Alistipes)、巴恩斯氏菌属(Barnesiella)、粪杆菌属(Faecalibacterium)、乳酸杆菌属(Lactobacillus)、寡养单胞菌属(Stenotrophomonas)、未分类毛螺菌科(unidentified-Lachnospiraceae)、芽孢杆菌属(Bacillus)、丁酸球菌属(Butyricicoccus)等。与NC相比,BS组的Firmicutes中的Faecalibacterium、黄杆菌属(Flavonifractor)和劳特氏菌属(Blautia)相对丰度增加,PC组的Firmicutes中的丹毒梭菌属(Erysipelatoclostridium)、Flavonifractor、氢厌氧小杆菌属(Hydrogenoanaearobacterium)相对丰度增加。NC组的Bacteroides和Lactobacillus相对丰度高于PC组和BS组,Faecalibacterium相对丰度则低于PC组和BS组。PC组的Barnesiella相对丰度低于NC组和BS组,Stenotrophomonas和未分类肠杆菌科(unidentified-Enterobacteriaceae)相对丰度高于NC组和BS组。BS组的Bacillus相对丰度高于PC组,PC组高于NC组。PC组35个微生物的相对丰度之和要高于NC组和BS组,大于75%。
|
Bacteroides:拟杆菌属;Alistipes:另枝菌属;Barnesiella:巴恩斯氏菌属;Faecalibacterium:粪杆菌属;Lactobacillus:乳酸杆菌属;Stenotrophomonas:寡养单胞菌属;Unidentified-Lachnospiraceae:未分类毛螺菌科;Bacillus:芽孢杆菌属;Unidentified-Ruminococcaceae:未分类瘤胃球菌科;Unidentified-Enterobacteriaceae:未分类肠杆菌科: Parasutterella:副萨特氏菌属;Blautia:劳特氏菌属;Butyricicoccus:丁酸球菌属;Rikenella:文肯菌属;Bilophila:嗜胆菌属;Unidentified-Clostridiales:未分类梭菌科;Unidentified-Cyanobacteria:未分类蓝藻菌科;Erysipelatoclostridium:丹毒梭菌属;Sphingomonas:鞘脂单胞菌属;Subdoligranulum:罕见小球菌属;Lachnoclostridium:瘤胃梭菌属;Flavonifractor:黄杆菌属;Romboutsia:罗姆布茨菌属;Hydrogenoanaearobacterium:氢厌氧小杆菌属;Akkermansia:艾克曼菌属;Others:其他。 图 3 42日龄肉鸡盲肠微生物属水平上的相对丰度(前35位)柱形图 Fig. 3 Column chart of relative abundance (top 35) at genus level in cecal microbiota of broilers at 42 days of age |
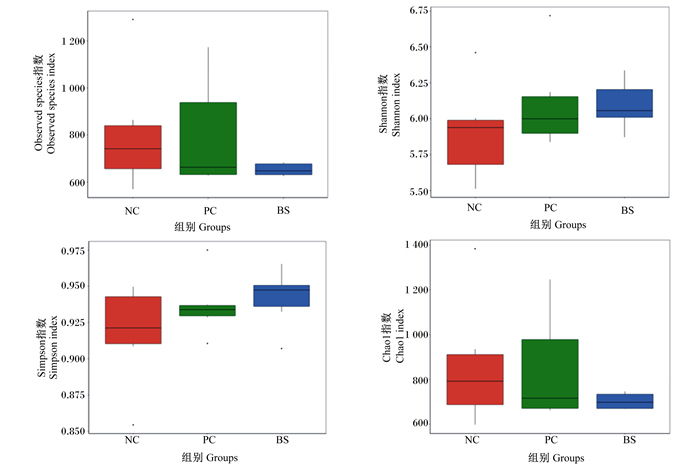
表 4和图 4分别是Observed species、Shannon、Simpson、Chao1指数的秩和检验和箱型图,展示了NC组、PC组和BS组的α多样性结果。由表可知,各组之间42日龄肉鸡盲肠生物群落α多样性指数差异不显著(P>0.05)。
|
|
表 4 42日龄肉鸡盲肠微生物α多样性指数秩和检验 Table 4 Wilcox test of α diversity index in cecal microbiota of broilers at 42 days of age |
|
图 4 42日龄肉鸡盲肠微生物α多样性指数箱型图 Fig. 4 Box plots of α diversity index in cecal microbiota of broilers at 42 days of age |
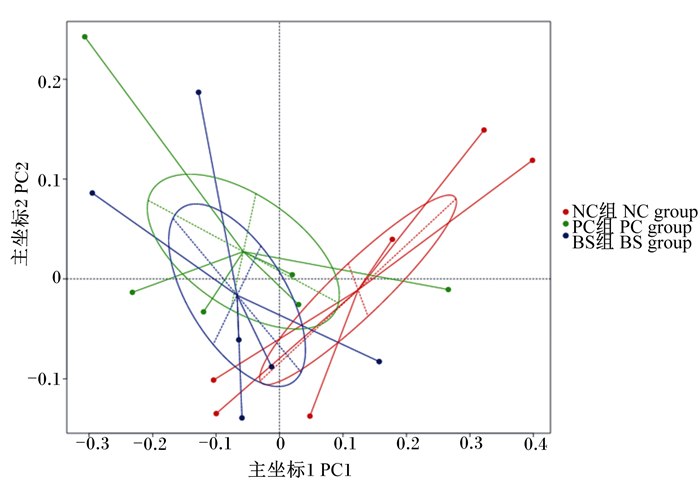
图 5是42日龄肉鸡盲肠微生物β多样性的PCoA聚类圈分析图。从图中可以看出,NC组、PC组和BS组的微生物群落是有部分相似性的,但PC组和BS组的物种组成更相似,群落结构相似度更高。ANOSIM、MRPP和Adonis是一系列用于检验群体间群落结构差异的非参数方法。由表 5可知,各组之间42日龄肉鸡盲肠微生物β多样性指数(ANOSIM、MRPP、Adonis)差异不显著(P>0.05)。
|
图 5 42日龄肉鸡盲肠微生物PCoA聚类圈分析图 Fig. 5 PCoA clustering circle plot in cecal microbiota of broilers at 42 days of age |
|
|
表 5 42日龄肉鸡盲肠微生物β多样性指数 Table 5 β diversity index in cecal microbiota of 42 days old broilers |
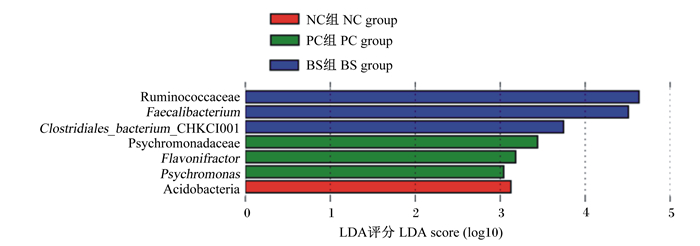
图 6是LEfSe分析柱形图展示了LDA评分大于设定值(默认值为3)的微生物,即组间具有统计差异的生物标志物(biomarker),图中柱子越长代表该微生物影响越大。虽然3组之间β多样性差异不显著(P>0.05),但仍然有具有相对丰度显著差异(P<0.05)的物种。如图所示,NC组有1种,是门水平的Acidobacteria;PC组有3种,分别是科水平的冷单胞菌科(Psychromonadaceae)以及属水平的Flavonifractor和冷单胞菌属(Psychromonas);BS组有3种,分别是科水平的Ruminococcaceae,属水平的Faecalibacterium和种水平的梭状芽孢杆菌_CHKCI001(Clostridiales_bacterium_CHKCI001)。
|
Ruminococcaceae:瘤胃球菌科;Faecalibacterium:粪杆菌属;Clostridiales_bacterium_CHKCI001:梭状芽孢杆菌_CHKCI001;Psychromonadaceae:冷单胞菌科;Flavonifractor:黄杆菌属;Psychromonas:冷单胞菌属;Acidobacteria:酸杆菌门。 图 6 42日龄肉鸡盲肠微生物LEfSe分析柱形图 Fig. 6 Column chart of LEfSe analysis in cecal microbial of broilers at 42 days of age |
在家禽养殖业中,生长性能的好坏与肉鸡的经济效益密切相关,其衡量指标主要有平均日增重、平均日采食量、料重比等。欧洲效益指数是通过对鸡群的体重、成活率、料重比、生产管理等指标进行综合性评价,体现盈利的高低,指数越大表明盈利越多。众多研究表明,枯草芽孢杆菌作为饲料添加剂能显著提高肉鸡的生长性能[8, 15-16]。本试验研究结果表明,饲粮添加枯草芽孢杆菌并未提高肉鸡1~21日龄的生长性能,BS组的各项指标均低于NC组和PC组,而BS组的肉鸡22~42日龄生长性能各项指标均优于NC组和PC组,说明枯草芽孢杆菌对肉鸡前期的生长发育影响不大,主要在后期发挥作用。这与余东游等[17]的研究结果一致。有研究表明,芽孢杆菌对鸡平均日增重的影响是累积性的[18],这可能是引起本试验结果的原因。此外,本试验中,饲粮添加枯草芽孢杆菌和杆菌肽锌能显著提高肉鸡1~42日龄的平均日增重和欧洲效益指数,降低料重比。从全期来看,饲粮添加枯草芽孢杆菌可以提高肉鸡的生长性能和经济效益,说明其促生长效果不亚于杆菌肽锌,可能是由于枯草芽孢杆菌可以产生多种消化酶,促进了肉鸡对营养物质的吸收[19]。但是也有部分研究显示枯草芽孢杆菌对肉鸡的生长性能没有影响[14],这可能是由于与本试验添加的枯草芽孢杆菌的种类和添加水平不同造成。
3.2 枯草芽孢杆菌对肉鸡肠道形态的影响众所周知,肠道形态是衡量肠道健康的重要指标,绒毛高度和隐窝深度分别是衡量肠道消化吸收功能和细胞成熟率的主要指标[20]。V/C的增加可提供有利于消化吸收营养物质的肠道环境[21]。Lee等[5]研究表明,饲粮中添加枯草芽孢杆菌可以促进小肠上皮细胞的生长,增加小肠绒毛高度,提高营养物质的吸收。然而,本试验中,十二指肠、空肠和回肠的绒毛高度和隐窝深度不受添加枯草杆菌或杆菌肽锌的影响。而BS组回肠V/C最高,显著高于NC组,说明枯草芽孢杆菌一定程度上改善了回肠肠道形态。
3.3 枯草芽孢杆菌对肉鸡盲肠微生物组成的影响肠道微生物菌群的平衡有利于保持动物机体的健康。枯草芽孢杆菌是需氧菌,进入肠道后可以迅速消耗游离氧,抑制有害需氧菌的繁殖[10]。众多研究表明,枯草芽孢杆菌可以提高肉仔鸡肠道中乳酸菌的数量,降低大肠杆菌数量[22]。Ma等[23]在肉鸡饲粮中添加枯草芽孢杆菌后,盲肠中蝙蝠弧菌(Vampirovibrio)、大肠杆菌/志贺氏菌(Escherichia/Shigella)和狄氏副拟杆菌(Parabacteroides)等有害菌的相对丰度降低。
在本研究中,各组肉鸡盲肠微生物在门水平上的相对丰度没有显著差异。其中,拟杆菌和厚壁菌是优势菌群,占微生物群落总数的80%以上。这与以往的研究相一致,Bacteroidetes和Firmicutes在鸡的门水平上构成了大多数微生物群落,它们在能量的产生和代谢中起着重要作用[24-26]。值得一提的是,有报道指出鸡盲肠群落的优势菌门是Firmicutes[27-28],但也有报道称,其优势菌门是Bacteroidetes[26, 29]。本试验结果表明,Bacteroidetes是42日龄肉仔鸡盲肠微生物群落的优势菌门。这可能是由于所选鸡的年龄、品种和地区差异,这也表明鸡盲肠微生物区系在发生变化。本研究所评估的是肉鸡在生长后期,即鸡的整个生产周期中的最终定植的菌群。
先前的研究表明,肥胖小鼠体内有大量的Ruminococcaceae[30],并且动脉僵硬与Ruminococcaceae相对丰度呈负相关[31]。在本研究中,BS组的Ruminococcaceae相对丰度明显高于NC组,这可能与BS组肉鸡平均日增重的提高有关。Lachnospiraceae是一种可以在肠道内产正丁酸的微生物,可能与宿主能量调节和肠黏膜完整性有关[32]。Ruminococcaceae和Lachnospiraceae含有产生短链脂肪酸(SCFAs)的科[33-34],而SCFAs通过影响肠道pH抑制肠道致病菌的生长繁殖,是肉鸡获得良好生长性能的前提和保证。但据报道,Lachnospiraceae与人类疾病有关,如腹腔疾病和溃疡性结肠炎[35]。因此,本的研究中,PC组的Lachnospiraceae相对丰度增加并不一定完全是一个好现象。
Flavonifractor属于Firmicutes中的Ruminococcaceae,有助于丁酸盐的产生[36]。众所周知,在动物饲粮中添加一定量的丁酸盐有利于提高饲料转化率和生长性能[37]。在本研究中,PC组和BS组的Flavonifractor相对丰度均高于NC组,这与提高肉鸡的生长性能有关。
Erysipelatoclostridium属于Firmicutes中的Erysipelotrichaceae。据报道,高相对丰度的Erysipelatoclostridium可能与降低蛋鸡的料蛋比有关[38],但也可能是一种机会致病菌[39],可能与代谢综合征和痛风等疾病有关[40-41]。Hydrogenoanaearobacterium是一种通过含硫氨基酸的降解产生硫化物的蛋白水解菌,能裂解植物化合物的芳香环生成SCFAs[42]。然而,也有报道称,Hydrogenoanaearobacterium与肥胖和糖尿病表型密切相关[43]。PC组良好的生长性能可能与Erysipelatoclostridium和Hydrogenoanaearobacterium的相对丰度增加有关,但也可能有导致某些疾病的潜在风险。
Blautia是一种革兰氏阳性菌,能降解不同类型的碳水化合物,产生乙酸、乳酸等代谢产物[44],Faecalibacterium是鸡盲肠中一种重要的丁酸生产菌[45]。二者都能为机体提供能量,减少炎症,其含量的增加与宿主的肠道健康有关[46-48]。BS组生长性能的提升可能与有利于肠道健康的Blautia和Faecalibacterium相对丰度增加有关。
综上所述,通过对常见微生物的分析,抗生素和枯草芽孢杆菌良好的促生长性能作用可能与Flavonifractor、Blautia、Faecalibacterium、Erysipelatoclostridium和Hydrogenoanaearobacterium的相对丰度增加有关,但PC组Erysipelatoclostridium和Hydrogenoanaearobacterium的相对丰度升高可能会引起某些疾病的发生。
3.4 枯草芽孢杆菌对肉鸡盲肠微生物多样性的影响微生物群落多样性常用α多样性和β多样性来表示,二者的侧重点不同。α多样性常用于分析样本内的微生物群落多样性[49]。通过对单样本进行多样性分析,可以反映样本内的微生物群落的丰富度和多样性。β多样性是对不同样本的微生物群落构成进行比较分析,通过多种指标可以反映。PCoA是通过一系列的特征值和特征向量排序从多维数据中提取出最主要的元素和结构。LEfSe分析是一种用于发现和解释高维度数据生物标识(基因、通路和分类单元等)的分析工具,可以进行2个或多个分组的比较,它强调统计意义和生物相关性,能够在组与组之间寻找具有统计学差异的生物标识。本试验的研究结果显示,各组之间的盲肠微生物多样性差异并不显著,这与一些研究结果不一致[38, 50]。影响肠道微生物多样性的因素有很多种。有研究表明,鸡的肠道微生物菌群多样性本身要低于其他动物,这可能是因为鸡本身肠道较短,食物会很快通过肠段[51]。在鸡的发育过程中,前肠的微生物多样性增加大约在第14天达到高峰,之后保持稳定或略有下降[52]。Li等[53]的研究发现,枯草芽孢杆菌虽然增加了21日龄肉鸡回肠的微生物多样性,但并未影响42日龄的肠道微生物多样性,与本试验结果一致。此外,肠道微生物菌群的多样性受年龄的影响更大[54]。这些原因可能是导致本试验中盲肠微生物多样性未改变的原因。
4 结论饲粮添加枯草芽孢杆菌可以提高肉鸡后期(22~42日龄)生长性能,且全期(1~42日龄)效果不低于抗生素杆菌肽锌,其良好的促生长效果可能与盲肠中与碳水化合物分解和丁酸、丁酸盐产生有关的Flavonifractor、Blautia、Faecalibacterium相对丰度增加有关。
| [1] |
BARTON M D. Antibiotic use in animal feed and its impact on human healt[J]. Nutrition Research Reviews, 2000, 13(2): 279-299. DOI:10.1079/095442200108729106 |
| [2] |
VAN DEN BOGAARD A E J M, LONDON N, STOBBERINGH E E. Antimicrobial resistance in pig faecal samples from the Netherlands (five abattoirs) and Sweden[J]. Journal of Antimicrobial Chemotherapy, 2000, 45(5): 663-671. DOI:10.1093/jac/45.5.663 |
| [3] |
SØRUM H, SUNDE M. Resistance to antibiotics in the normal flora of animals[J]. Veterinary Research, 2001, 32(3/4): 227-241. DOI:10.1051/vetres:2001121 |
| [4] |
李春凤, 林显华, 谷巍. 枯草芽孢杆菌在饲料生产及环境防治中的应用[J]. 中国饲料, 2013(1): 10-12, 17. |
| [5] |
LEE K W, LEE S H, LILLEHOJ H S, et al. Effects of direct-fed microbials on growth performance, gut morphometry, and immune characteristics in broiler chickens[J]. Poultry Science, 2010, 89(2): 203-216. DOI:10.3382/ps.2009-00418 |
| [6] |
MOLNÁR A K, PODMANICZKY B, KÜRTI P, et al. Effect of different concentrations of Bacillus subtilis on immune response of broiler chickens[J]. Probiotics and Antimicrobial Proteins, 2011, 3(1): 8-14. DOI:10.1007/s12602-011-9063-x |
| [7] |
JEONG J S, KIM I H. Effect of Bacillus subtilis C-3102 spores as a probiotic feed supplement on growth performance, noxious gas emission, and intestinal microflora in broilers[J]. Poultry Science, 2014, 93(12): 3097-3103. DOI:10.3382/ps.2014-04086 |
| [8] |
NGUYEN A T V, NGUYEN D V, TRAN M T, et al. Isolation and characterization of Bacillus subtilis CH 16 strain from chicken gastrointestinal tracts for use as a feed supplement to promote weight gain in broilers[J]. Letters in Applied Microbiology, 2015, 60(6): 580-588. DOI:10.1111/lam.12411 |
| [9] |
赵姝娴, 贾俊涛, 赵宇飞. 枯草芽孢杆菌和菊粉对产蛋后期蛋鸡生产性能、蛋品质及肠道绒毛形态的影响[J]. 中国饲料, 2018(24): 44-48. |
| [10] |
秦瑶, 王苇, 郭秉娇, 等. 2株枯草芽孢杆菌对大肠杆菌和沙门氏菌的体外抑菌试验研究[J]. 中国畜牧兽医, 2014, 41(1): 207-210. |
| [11] |
GUO X H, LI D F, LU W Q, et al. Screening of Bacillus strains as potential probiotics and subsequent confirmation of the in vivo effectiveness of Bacillus subtilis MA139 in pigs[J]. Antonie van Leeuwenhoek, 2006, 90(2): 139-146. DOI:10.1007/s10482-006-9067-9 |
| [12] |
WU B Q, ZHANG T, GUO L Q, et al. Effects of Bacillus subtilis KD1 on broiler intestinal flora[J]. Poultry Science, 2011, 90(11): 2493-2499. DOI:10.3382/ps.2011-01529 |
| [13] |
CAVAZZONI V, ADAMI A, CASTROVILLI C. Performance of broiler chickens supplemented with Bacillus coagulans as probiotic[J]. British Poultry Science, 1998, 39(4): 526-529. DOI:10.1080/00071669888719 |
| [14] |
LEE K W, LILLEHOJ H S, JANG S I, et al. Effects of salinomycin and Bacillus subtilis on growth performance and immune responses in broiler chickens[J]. Research in Veterinary Science, 2014, 97(2): 304-308. DOI:10.1016/j.rvsc.2014.07.021 |
| [15] |
PARK J H, KIM I H. Supplemental effect of probiotic Bacillus subtilis B2A on productivity, organ weight, intestinal Salmonella microflora, and breast meat quality of growing broiler chicks[J]. Poultry Science, 2014, 93(8): 2054-2059. DOI:10.3382/ps.2013-03818 |
| [16] |
潘康成, 王振华, 张钧利, 等. 枯草芽孢杆菌制剂对肉鸡生长性能的影响研究[J]. 饲料广角, 2004(21): 33-35. |
| [17] |
余东游, 毛翔飞, 秦艳, 等. 枯草芽孢杆菌对肉鸡生长性能及其抗氧化和免疫功能的影响[J]. 中国畜牧杂志, 2010, 46(3): 22-25. |
| [18] |
胡长庆, 赵京扬, 杨季芳, 等. 芽孢杆菌对鸡生长性能和盲肠细菌群落的影响[J]. 中国畜牧兽医, 2008, 35(10): 32-34. |
| [19] |
张晓慧.枯草芽孢杆菌对AA鸡生长性能的影响及其机理研究[D].硕士学位论文.湛江: 广东海洋大学, 2013.
|
| [20] |
PAIVA D, WALK C, MCELROY A. Dietary calcium, phosphorus, and phytase effects on bird performance, intestinal morphology, mineral digestibility, and bone ash during a natural necrotic enteritis episode[J]. Poultry Science, 2014, 93(11): 2752-2762. DOI:10.3382/ps.2014-04148 |
| [21] |
MONTAGNE L, PLUSKE J R, HAMPSON D J. A review of interactions between dietary fibre and the intestinal mucosa, and their consequences on digestive health in young non-ruminant animals[J]. Animal Feed Science and Technology, 2003, 108(1/2/3/4): 95-117. |
| [22] |
易中华, 胥传来, 计成, 等. 果寡糖和枯草芽孢杆菌对肉鸡肠道菌群数量及生产性能的影响[J]. 中国畜牧杂志, 2005, 41(12): 11-14. |
| [23] |
MA Y B, WANG W W, ZHANG H J, et al. Supplemental Bacillus subtilis DSM 32315 manipulates intestinal structure and microbial composition in broiler chickens[J]. Scientific Reports, 2018, 8: 15358. DOI:10.1038/s41598-018-33762-8 |
| [24] |
AHIR V B, KORINGA P G, BHATT V D, et al. Metagenomic analysis of poultry gut microbes[J]. Indian Journal of Poultry Science, 2010, 45(2): 111-114. |
| [25] |
OAKLEY B B, LILLEHOJ H S, KOGUT M H, et al. The chicken gastrointestinal microbiome[J]. FEMS Microbiology Letters, 2014, 360(2): 100-112. DOI:10.1111/1574-6968.12608 |
| [26] |
PANDIT R J, HINSU A T, PATEL N V, et al. Microbial diversity and community composition of caecal microbiota in commercial and indigenous Indian chickens determined using 16S rDNA amplicon sequencing[J]. Microbiome, 2018, 6: 115. DOI:10.1186/s40168-018-0501-9 |
| [27] |
AWAD W A, MANN E, DZIECIOL M, et al. Age-related differences in the luminal and mucosa-associated gut microbiome of broiler chickens and shifts associated with Campylobacter jejuni infection[J]. Frontiers inCellular and Infection Microbiology, 2016, 6: 154. |
| [28] |
MANCABELLI L, FERRARIO C, MILANI C, et al. Insights into the biodiversity of the gut microbiota of broiler chickens[J]. Environmental Microbiology, 2016, 18(12): 4727-4738. DOI:10.1111/1462-2920.13363 |
| [29] |
SHAUFI M A M, SIEO C C, CHONG C W, et al. Deciphering chicken gut microbial dynamics based on high-throughput 16S rRNA metagenomics analyses[J]. Gut Pathogens, 2015, 7: 4. DOI:10.1186/s13099-015-0051-7 |
| [30] |
RAZA G S, PUTAALA H, HIBBERD A A, et al. Polydextrose changes the gut microbiome and attenuates fasting triglyceride and cholesterol levels in Western diet fed mice[J]. Scientific Reports, 2017, 7: 5294. DOI:10.1038/s41598-017-05259-3 |
| [31] |
MENNI C, LIN C H, CECELJA M, et al. Gut microbial diversity is associated with lower arterial stiffness in women[J]. European Heart Journal, 2018, 39(25): 2390-2397. DOI:10.1093/eurheartj/ehy226 |
| [32] |
LIN Z, YE W, ZU X P, et al. Integrative metabolic and microbial profiling on patients with Spleen-yang-deficiency syndrome[J]. Scientific Reports, 2018, 8: 6619. DOI:10.1038/s41598-018-24130-7 |
| [33] |
NAVA G M, STAPPENBECK T S. Diversity of the autochthonous colonic microbiota[J]. Gut Microbes, 2011, 2(2): 99-104. DOI:10.4161/gmic.2.2.15416 |
| [34] |
ZENG X L, GAO X X, PENG Y, et al. Higher risk of stroke is correlated with increased opportunistic pathogen load and reduced levels of butyrate-producing bacteria in the gut[J]. Frontiers in Cellular and Infection Microbiology, 2019, 9: 4. DOI:10.3389/fcimb.2019.00004 |
| [35] |
LI S Y, WANG Z L, YANG Y, et al. Lachnospiraceae shift in the microbial community of mice faecal sample effects on water immersion restraint stress[J]. AMB Express, 2017, 7: 82. DOI:10.1186/s13568-017-0383-4 |
| [36] |
MENG Q W, SUN S S, LUO Z, et al. Maternal dietary resveratrol alleviates weaning-associated diarrhea and intestinal inflammation in pig offspring by changing intestinal gene expression and microbiota[J]. Food & Function, 2019, 10(9): 5626-5643. |
| [37] |
张雪艳.不同丁酸盐对蛋鸡生产性能、养分代谢率、蛋品质及肠道微生物影响的研究[D].硕士学位论文.郑州: 河南农业大学, 2007.
|
| [38] |
GUO J R, DONG X F, LIU S, et al. High-throughput sequencing reveals the effect of Bacillus subtilis CGMCC 1.921 on the cecal microbiota and gene expression in ileum mucosa of laying hens[J]. Poultry Science, 2018, 97(7): 2543-2556. |
| [39] |
ZHAO Y, LI K, LUO H Q, et al. Comparison of the intestinal microbial community in ducks reared differently through high-throughput sequencing[J]. BioMed Research International, 2019, 2019: 9015054. DOI:10.1155/2019/9015054 |
| [40] |
SMITH-BROWN P, MORRISON M, KRAUSE L, et al. Dairy and plant based food intakes are associated with altered faecal microbiota in 2 to 3 year old Australian children[J]. Scientific Reports, 2016, 6: 32385. DOI:10.1038/srep32385 |
| [41] |
SHAO T J, SHAO L, LI H C, et al. Combined signature of the fecal microbiome and metabolome in patients with gout[J]. Frontiers in Microbiology, 2017, 8: 268. DOI:10.3389/fmicb.2017.00268 |
| [42] |
LI D Y, CHEN H Q, MAO B Y, et al. Microbial biogeography and core microbiota of the rat digestive tract[J]. Scientific Reports, 2017, 7: 45840. DOI:10.1038/srep45840 |
| [43] |
JUNG M J, LEE J, SHIN N R, et al. Chronic repression of mTOR complex 2 induces changes in the gut microbiota of diet-induced obese mice[J]. Scientific Reports, 2016, 6: 30887. DOI:10.1038/srep30887 |
| [44] |
LIU C X, FINEGOLD S M, SONG Y L, et al. Reclassification of Clostridium coccoides, Ruminococcus hansenii, Ruminococcus hydrogenotrophicus, Ruminococcus luti, Ruminococcus productus and Ruminococcus schinkii as Blautia coccoides gen.nov., comb.nov., Blautia hansenii comb.nov., Blautia hydrogenotrophica comb.nov., Blautia luti comb.nov., Blautia producta comb.nov., Blautia schinkii comb.nov.and description of Blautia wexlerae sp.nov., isolated from human faeces[J]. International Journal of Systematic and Evolutionary Microbiology, 2008, 58: 1896-1902. |
| [45] |
DUNCAN S H, HOLD G L, HARMSEN H J M, et al. Growth requirements and fermentation products of Fusobacterium prausnitzii, and a proposal to reclassify it as Faecalibacterium prausnitzii gen.nov.comb.nov[J]. International Journal of Systematic and Evolutionary Microbiology, 2002, 52(6): 2141-2146. |
| [46] |
BIDDLE A, STEWART L, BLANCHARD J, et al. Untangling the genetic basis of fibrolytic specialization by Lachnospiraceae and Ruminococcaceae in diverse gut communities[J]. Diversity, 2013, 5(3): 627-640. |
| [47] |
YANG J Y, BINDELS L B, MUNOZ R R S, et al. Disparate metabolic responses in mice fed a high-fat diet supplemented with maize-derived non-digestible feruloylated oligo- and polysaccharides are linked to changes in the gut microbiota[J]. PLoS One, 2016, 11(1): e0146144. DOI:10.1371/journal.pone.0146144 |
| [48] |
ABAIDULLAH M, PENG S W, KAMRAN M, et al. Current findings on gut microbiota mediated immune modulation against viral diseases in chicken[J]. Viruses, 2019, 11(8): 681. DOI:10.3390/v11080681 |
| [49] |
LI B, ZHANG X X, GUO F, et al. Characterization of tetracycline resistant bacterial community in saline activated sludge using batch stress incubation with high-throughput sequencing analysis[J]. Water Research, 2013, 47(13): 4207-4216. |
| [50] |
CAO G T, DAI B, WANG K L, et al. Bacillus licheniformis, a potential probiotic, inhibits obesity by modulating colonic microflora in C57BL/6J mice model[J]. Journal of Applied Microbiology, 2019, 127(3): 880-888. |
| [51] |
WEI S, MORRISON M, YU Z. Bacterial census of poultry intestinal microbiome[J]. Poultry Science, 2013, 92(3): 671-683. |
| [52] |
HUANG P, ZHANG Y, XIAO K P, et al. The chicken gut metagenome and the modulatory effects of plant-derived benzylisoquinoline alkaloids[J]. Microbiome, 2018, 6: 211. DOI:10.1186/s40168-018-0590-5 |
| [53] |
LI C L, WANG J, ZHANG H J, et al. .Intestinal morphologic and microbiota responses to dietary Bacillus spp.in a broiler chicken model[J]. Frontiers in Physiology, 2018, 9: 1968. DOI:10.3389/fphys.2018.01968 |
| [54] |
BALLOU A L, ALI R A, MENDOZA M A, et al. Development of the chick microbiome:how early exposure influences future microbial diversity[J]. Frontiers in Veterinary Science, 2016, 3: 2. DOI:10.3389/fvets.2016.00002 |




