2. 内蒙古农业大学兽医学院, 呼和浩特 010018
2. College of Veterinary Medicine, Inner Mongolia Agricultural University, Hohhot 010018, China
随着人们生活水平的逐步提高,膳食结构也在不断改善。牛肉具有低脂肪、低胆固醇、高蛋白质及富含微量元素等优点,在人们所食用的肉产品中所占份额逐年增加[1]。2018年我国牛肉折算胴体基础的总产量达732.5万t,已成为世界第三大牛肉生产国。但牛肉市场仍供不应求,2018年我国牛肉进口量为103.98万t,同比增长51.42%[2]。在这一形势下,国家出台各项政策不断加大肉牛标准化规模养殖推进力度,引导发展农牧结合及高效利用当地粗饲料资源,以推动肉牛标准化、产业化发展[3]。
放牧家畜的整个生长发育过程都是在天然草场进行,其采食的饲粮多为自然生长的牧草,相较于舍饲生产方式,放牧饲养可极大地降低反刍动物饲养成本[4]。但随着人们对草原的不合理利用,导致草原退化已成为全球普遍现象,目前我国内蒙古和新疆等重要牧区草原退化较为严重[5-6]。牧草的质量和产量往往无法满足家畜的生长发育需要,放牧家畜仅采食牧草可导致增重缓慢。Wu[7]等研究了补充精料对早期断奶牦牛犊的影响,发现补充精料可显著提高犊牛平均日增重和各项体尺指标。研究发现,补饲精料可提高杂交肉牛的体尺指标,并显著提高平均日增重[8-9];暖季放牧牦牛合理补饲精料可极显著提高放牧牦牛的平均日增重和经济效益[10]。有研究发现,随着饲粮能量水平的增加,锦江牛血清葡萄糖(GLU)含量呈逐渐上升的趋势,血清生长激素(GH)和胰岛素(INS)含量显著升高[11];王泳杰等[12]通过利用不同营养调控方式培育牦牛,结果表明补饲精料可促进牦牛补偿生长,且可显著提高其抗氧化能力。绵羊方面的补饲研究表明,通过补饲全价颗粒饲料可显著提高妊娠后期绵羊血清GLU含量,有利于改善其机体内环境,提高母羊的生长性能[13]。
目前,关于放牧补饲的研究大多集中于断奶前和育肥阶段的家畜,育成牛的补饲研究鲜有报道[14-15]。断奶后至配种前的母牛均称为育成牛,育成期是牛机体发育最旺盛的时期,其特点是可塑性极强,该阶段的营养状况与母牛未来的繁育和生长性能紧密相关[16]。因此,本试验以育成期放牧西门塔尔母牛为研究对象,通过测定其牧草采食量并结合草场内的牧草营养成分,根据肉牛营养需要所划定的营养需求标准进行合理精准补饲,探讨补饲对育成期放牧肉牛生长性能及血清抗氧化能、生化指标的影响,以期为放牧条件下育成牛培育中补饲的重要性提供数据支持,为放牧条件下育成牛高效养殖提供理论指导。
1 材料与方法 1.1 试验设计与饲粮本试验于2019年6—8月在内蒙古自治区赤峰市阿鲁科尔沁旗巴彦温都尔牧户牧场进行。选取体型、体重[(211.65±4.25) kg]相近的健康7月龄育成期西门塔尔母牛24头,按照体重相近原则随机分为2组,每组12头牛。放牧组在天然草场自然放牧,放牧天然草场中的牧草主要包括禾本科的糙隐子草、羊草、狗尾草和灌木植物沙柳、沙棘和锦鸡儿,各阶段放牧草场牧草概略养分见表 1;补饲组在与放牧组同等放牧条件的基础上,进行精料补饲。预试期8 d,正试期60 d,分为试验前期(第1~30天)和试验后期(第31~60天)2个阶段。补饲组的精料补饲量在试验前期为每头牛1.2 kg/d,试验后期为每头牛1.6 kg/d。补饲组的精料配制是根据牧草概略养分和采食量的测定结果,参照NRC肉牛营养需要进行配制,其组成及营养水平见表 2。试验期间各组试验牛在放牧草场自由采食、自由饮水(草场内有天然河流贯穿放牧草场和牛舍);补饲组在每天19:00补饲精料。
|
|
表 1 放牧草场牧草概略养分(干物质基础) Table 1 General nutrients of forage grass in grazing pasture (DM basis) |
|
|
表 2 精料组成及营养水平(干物质基础) Table 2 Composition and nutrient levels of the concentrate (DM basis) |
采用内外源指示剂结合法测定放牧牛的DMI,选取体况相近的放牧牛6头,每天08:30和18:30以胶囊形式喂服三氧化二铬(Cr2O3)各1次,每次每头牛12 g。预试期3 d,正试期7 d。正试期每天定时采集粪便200 g,将每头牛每天的粪样混合均匀阴干保存,用以测定粪中的Cr2O3含量,采用72-1分光光度计比色法[17]测定。采用人工模拟采样法采集牧草,现场跟群观察放牧牛采食牧草的种类和部位,连续7 d每天采集牧草2 000 g,混匀,保存于-20 ℃冰箱备用。牧草、粪样中的盐酸不溶灰分(acid insoluble ash,AIA)含量采用4 mol/L AIA法。根据放牧牛采食牧草中干物质AIA含量、粪样中干物质含量及粪中干物质AIA含量按以下公式计算出放牧牛DMI:
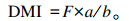
|
式中:DMI为干物质采食量;F为粪样中干物质含量;a为粪中干物质AIA含量;b为采食牧草中干物质AIA含量。
1.3 牧草和精料营养成分的测定牧草和精料营养成分的测定指标包括干物质、粗蛋白质、粗灰分、粗纤维、粗脂肪含量和总能,参照张丽英[18]的方法进行测定。
1.4 生长性能指标的测定正试期开始和结束时当日清晨出牧前对各试验牛进行体尺和体重测量,并计算整个试验期的平均日增重(ADG)。采用皮卷尺测量记录各试验牛的体高、体斜长和胸围。
1.5 血清抗氧化、生化指标的测定正试期开始和结束时当日清晨出牧前使用真空非抗凝采血管对试验牛空腹颈静脉采血,静置30 min,3 000 r/min离心10 min,分离血清,-80 ℃保存,用于检测血清抗氧化、生化指标。
血清抗氧化指标:总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性、丙二醛(MDA)含量均采用南京建成生物工程研究所提供的酶联免疫吸附试验(ELISA)检测盒测定,具体操作步骤按照试剂盒说明书进行。
血清生化指标:甲状腺素(T4)、三碘甲状腺原氨酸(T3)、GH、INS、GLU、胰岛素样生长因子-1(IGF-1)、尿素氮(UN)含量均采用北京华英生物技术研究所提供的试剂盒测定,具体操作步骤按照试剂盒说明书进行。
1.7 数据统计与分析数据采用SPSS 19.0软件对数据进行统计分析。2个试验组的组间数据比较采用单因素方差分析(one-way ANOVA),第1天和第60天数据比较采用独立样本t检验。结果以平均值±标准差表示,以P<0.05为差异显著性水平。
2 结果 2.1 育成期补饲对放牧牛生长性能和体尺指标的影响由表 3可知,第1天,放牧组和补饲组之间的体重和各项体尺指标无显著差异(P>0.05)。第60天,补饲组的体重、ADG和体高均显著高于放牧组(P<0.05),但放牧组和补饲组之间的体斜长和胸围无显著差异(P>0.05)。第60天,放牧组和补饲组的体斜长与第1天无显著差异(P>0.05),体重、体高、胸围均显著高于第1天(P<0.05)。
|
|
表 3 育成期补饲对放牧牛生长性能和体尺指标的影响 Table 3 Effects of supplementary feeding on growth performance and body size indexes of grazing cows during growing period |
由表 4可知,与第1天相比,第60天放牧组的血清MDA含量呈下降趋势,血清T-AOC、GSH-Px活性均呈上升趋势,但差异均不显著(P>0.05);第60天放牧组的血清SOD活性显著升高(P<0.05)。与第1天相比,第60天补饲组的血清MDA含量显著下降(P<0.05),血清T-AOC及GSH-Px、SOD活性均显著升高(P<0.05)。第60天,补饲组的血清T-AOC及GSH-Px、SOD活性均显著高于放牧组(P<0.05),血清MDA含量显著低于放牧组(P<0.05)。
|
|
表 4 育成期补饲对放牧牛血清抗氧化指标的影响 Table 4 Effects of supplementary feeding on serum antioxidant indexes of grazing cows during growing period |
由表 6可知,与第1天相比,第60天补饲组的血清T4、GLU、GH、IGF-1和INS含量均显著升高(P<0.05);血清UN和T3含量呈升高趋势,但差异不显著(P>0.05)。与第1天相比,第60天放牧组的血清T4、GLU、UN、GH和IGF-1含量呈上升趋势,但差异不显著(P>0.05)。第60天,补饲组的血清T4、GLU、GH、IGF-1和INS含量均显著高于放牧组(P<0.05);血清T3和UN含量高于放牧组,但差异不显著(P>0.05)。
|
|
表 6 育成期补饲对放牧牛血清生化指标的影响 Table 6 Effects of supplementary feeding on serum biochemical indexes of grazing cows during growing period |
体尺指标是指牛体各部位数量化的指标,不仅直观反映了牛体格的大小,且间接反映出牛生长阶段饲养管理水平;体尺和体重均是衡量牛生长发育的重要指标,两者与牛的生长性能密切相关[19]。动物机体各项体尺的增长实际是机体骨骼生长的过程[20]。周家文等[21]通过进行西杂牛(西门塔尔×云南黄牛)补饲试验,发现补饲组体尺和体重均显著高于对照组;王鸿泽[22]研究发现牦牛ADG随着饲粮能量水平的提高而显著增加。本研究表明,补饲精料可显著提高育成牛ADG,由此可见,补饲精料对育成牛生长性能的提高有重要作用,与前人研究结果一致。这是由于补饲精料可有效地弥补天然牧草营养不足的限制,以满足育成牛的生长发育需要,保持营养平衡,促进其发挥出最大的增重潜力。
本研究表明,补饲精料可显著提高育成牛的体高;补饲组和放牧组的体斜长和胸围均呈现增长趋势,但2组之间无显著差异,这可能是由于育成牛身体各部位的生长速度不同所导致。刁其玉[23]提出肉牛最先生长的是骨骼和四肢,其次为体长和肌肉,最终才是脂肪,这验证了本试验中由于补饲精料有效地满足了其生长发育的需要,但其生长发育规律为先纵向发展即体高的增加,因此育成牛体高呈显著增长。牧草营养成分无法满足育成牛生长发育需要时,通过补饲可有效地促进其体重和体尺的发育,更高效地发挥生产潜力。因此,对放牧条件下根据草场牧草营养和育成牛的生长发育进行合理的补饲精料是必要的。
3.2 育成期补饲对放牧牛血清抗氧化指标的影响动物在正常生长代谢过程中会产生含氧自由基,若不能被及时清除,体内积累的自由基可通过破坏细胞的结构和功能,使生物膜中的不饱和脂类发生脂质过氧化并形成脂质过氧化物,其最终产物即是MDA[24]。动物机体生物膜功能一旦遭到破坏,将进而损伤蛋白质及核酸等生物大分子,导致机体代谢功能产生紊乱。动物机体自身具有广泛的抗氧化防御机制,哺乳动物体内抗氧化防御机制包括酶促体系和非酶促体系两大抗氧化防御体系,酶促体系中的主要抗氧化酶有T-AOC、GSH-Px及SOD[25]。GSH-Px可通过清除体内过多的自由基以抑制机体脂质过氧化;SOD是机体内一种重要的抗氧化酶,在清除自由基和防止生物大分子损伤等方面具有重要作用;T-AOC代表机体防御体系的抗氧化能力[26-28]。由于抗氧化酶系统不断地清除体内产生的自由基,因此自由基的产生和清除处于动态平衡中,从而保护机体在正常生长代谢过程中免受氧化应激损伤。本试验中,与放牧组相比,补饲精料显著增强了育成牛血清中T-AOC及SOD、GSH-Px活性,降低了MDA含量,表明补饲精料可提高放牧条件下育成牛的抗氧化能力。Sun等[29]研究发现,维生素A具有提高抗氧化能力的作用,饲粮中添加维生素A可提高奶牛血清SOD活性。近年来研究发现,饲粮中添加维生素E可通过调节SOD和CAT活性以缓解动物机体的氧化应激,且微量元素硒、铜、锌及锰均具有提高动物机体内抗氧化酶活性的功能[30]。以上结果均与本研究结果一致,由此可见补饲组所采食精料中所添加的非酶类抗氧化剂可显著增强育成牛抗氧化能力,但具体是维生素类还是微量矿物元素类非酶类抗氧化剂增强了育成牛的抗氧化能力,抑或是两者的协同调控作用,目前尚不清楚。本课题组未来将对育成牛血清中维生素和微量矿物元素的含量进行比较研究,且针对非酶类抗氧化剂缓解肉牛氧化应激的机理进行深入研究探讨。
3.3 育成期补饲对放牧牛血清生化指标的影响血清生化指标可反映动物机体营养水平及机体代谢状态。T3和T4是调节机体代谢的重要激素,其两者含量的高低和动物新陈代谢的效率具有密切关系[30]。GH在动物机体内的主要生理功能是促进蛋白质合成、脂肪分解及增强机体组织生长,其在下丘脑-垂体-性腺(HPG)轴中起主要作用[31]。本研究结果表明,补饲组血清T4、GH和IGF-1含量显著高于放牧组。这与前人的研究结果一致,认为是由于放牧组的饲粮营养水平较高,增强了其机体内营养物质的合成代谢,从而增加了机体内T4和GH的合成与分泌,最终促进育成牛的生长与增重;而IGF-1是一种在GH产生生理作用时所需的活性蛋白质多肽物质,其含量的高低受到垂体分泌的GH调控,因此其含量也随之升高。
GLU是动物生长发育及代谢所必需的主要能量来源,反刍动物体内GLU来源是通过糖异生途径产生和消化道吸收[32]。本研究结果表明,补饲组血清GLU含量显著高于放牧组,其原因可能是随着补饲组摄入能量的提高,可有效地增强育成牛的糖代谢,促进其生长发育。INS可促进糖类的贮存,本试验中补饲组血清INS含量较高,可能是由于GLU含量的升高,反馈性调节INS分泌。动物机体血清UN含量与饲粮蛋白质水平呈正相关。另外,本试研究结果表明,与放牧组相比,补饲组血清UN含量有升高的趋势,但差异不显著,可能是由于补饲组的精料组成中富含蛋白质的豆粕添加比例较低所致。
4 结论补饲精料可增强放牧饲养条件下育成牛的抗氧化能力和免疫功能,提高血清中生长相关激素含量,有效促进育成牛生长发育。
| [1] |
和立文.全株玉米青贮品质评价及其对肉牛育肥性能和牛肉品质的影响[D].博士学位论文.北京: 中国农业大学, 2017.
|
| [2] |
曹兵海, 李俊雅, 王之盛, 等. 2018年肉牛牦牛产业技术发展报告[J]. 中国畜牧杂志, 2019, 55(3): 133-137. |
| [3] |
刘森挥.我国肉牛养殖业全要素生产率变动及提升路径研究[D].博士学位论文.长春: 吉林农业大学, 2019.
|
| [4] |
The PLoS One Staff. Correction:long-term ecological research in southern Brazil grasslands:effects of grazing exclusion and deferred grazing on plant and arthropod communities[J]. PLoS One, 2020, 15(2). |
| [5] |
OTSAMO A, ÅDJERS G, HADI T S, et al. Evaluation of reforestation potential of 83 tree species planted on Imperata cylindrica dominated grassland—a case study from South Kalimantan, Indonesia[J]. New Forests, 1997, 14(2): 127-143. DOI:10.1023/A:1006566321033 |
| [6] |
郑淑华, 黄国安, 王烨, 等. 东乌珠穆沁旗草原退化原因简析[J]. 内蒙古草业, 2012, 24(1): 1-4. |
| [7] |
WU S R, CUI Z H, CHEN X D, et al. Changed caecal microbiota and fermentation contribute to the beneficial effects of early weaning with alfalfa hay, starter feed, and milk replacer on the growth and organ development of yak calves[J]. Animals, 2019, 9(11): 921. DOI:10.3390/ani9110921 |
| [8] |
李琰琰.内蒙古草原放牧肉牛育肥期补饲量的研究[D].硕士学位论文.哈尔滨: 东北农业大学, 2016.
|
| [9] |
刘莹莹.补饲水平对放牧杂交肉牛生产性能和血液生化指标的影响[D].硕士学位论文.长沙: 湖南农业大学, 2008.
|
| [10] |
郝力壮.牦牛暖季补饲对改善肉品质的作用及机理研究[D].博士学位论文.兰州: 兰州大学, 2019.
|
| [11] |
王微.6~10月龄锦江黄牛蛋白质和能量需要量及其代谢规律研究[D].硕士学位论文.南昌: 江西农业大学, 2012.
|
| [12] |
王泳杰, 王之盛, 胡瑞, 等. 不同营养调控方式对牦牛僵牛生长发育、血常规、血浆抗氧化和免疫指标的影响[J]. 动物营养学报, 2018, 30(4): 1344-1352. |
| [13] |
扎木嘎.不同营养水平日粮对母羊繁殖性能影响的研究[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2016.
|
| [14] |
张莹.自然放牧与放牧补饲育肥对呼伦贝尔羔羊与呼杜杂一代羔羊脂肪与蛋白质代谢的影响[D].博士学位论文.呼和浩特: 内蒙古农业大学, 2016.
|
| [15] |
温琦.放牧补饲条件下绒山羊羯羔与母羔育肥性能、屠宰性能及肉品质的比较研究[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2018.
|
| [16] |
昝林森. 牛生产学[M]. 3版. 北京: 中国农业出版社, 2017.
|
| [17] |
任继周. 草业科学研究方法[M]. 北京: 中国农业出版社, 1998.
|
| [18] |
张丽英. 饲料分析及饲料质量检测技术[M]. 3版. 北京: 中国农业大学出版社, 2007: 48-80, 140-150.
|
| [19] |
李文, 刘小林, 文利侠, 等. 中国荷斯坦后备奶牛生长发育规律的研究[J]. 畜牧兽医杂志, 2007, 26(5): 19-21, 24. |
| [20] |
任万平, 居来提, 张浩, 等. 暖季草场放牧补饲新疆褐牛公犊血清钙、磷水平对其生长的影响[J]. 新疆农业科学, 2013, 50(4): 759-765. |
| [21] |
周家文, 李志敏. 补饲对西杂犊牛生长发育的影响[J]. 养殖与饲料, 2008(2): 74-76. |
| [22] |
王鸿泽.日粮能量水平对舍饲育肥牦牛生产性能、瘤胃发酵及肌内脂肪代谢的影响[D].硕士学位论文.成都: 四川农业大学, 2015.
|
| [23] |
刁其玉. 优质后备奶牛的营养与培育[J]. 乳业科学与技术, 2009, 32(3): 101-105. |
| [24] |
AKHALAYA M Y, PLATONOV A G, BAIZHUMANOV A A. Short-term cold exposure improves antioxidant status and general resistance of animals[J]. Bulletin of Experimental Biology and Medicine, 2006, 141(1): 26-29. DOI:10.1007/s10517-006-0084-5 |
| [25] |
陈雯雯, 李津, 郑威, 等. 高温高湿对奶水牛生理和抗氧化指标的影响[J]. 广西畜牧兽医, 2012, 28(4): 226-228. |
| [26] |
刘庆华.娟荷杂交牛耐热性能研究[D].博士学位论文.南京: 南京农业大学, 2009.
|
| [27] |
SIEGEL H S, LATIMER J W. Interaction of high temperature and Salmonella pullorum antigen concentration on serum agglutinin and corticosteroid responses in White Rock chickens[J]. Poultry Science, 1984, 63(12): 2483-2491. DOI:10.3382/ps.0632483 |
| [28] |
崔恒敏, 陈怀涛. 动物红细胞免疫功能的研究进展[J]. 中国兽医科技, 2003, 33(5): 23-27. |
| [29] |
SUN D S, JIN X, SHI B L, et al. Dietary Yucca schidigera extract improved growth performance and liver antioxidative function in broilers[J]. Italian Journal of Animal Science, 2017, 16(4): 677-684. DOI:10.1080/1828051X.2017.1302826 |
| [30] |
张颖, 姚旋, 宋宜云, 等. 甲状腺激素与代谢调控[J]. 生命科学, 2013, 25(2): 176-183. |
| [31] |
于讳茹.血浆GH在奶牛产后的变化特征及其与亚临床酮病的相关性[D].硕士学位论文.南宁: 广西大学, 2018.
|
| [32] |
CHELIKANI P K, AMBROSE D J, KEISLER D H, et al. Effects of dietary energy and protein density on plasma concentrations of leptin and metabolic hormones in dairy heifers[J]. Journal of Dairy Science, 2009, 92(4): 1430-1441. DOI:10.3168/jds.2008-1385 |




