养羊业的发展受多种因素的制约,包括养殖方式的选择、不同品种的选育和环境因素的变化等。热应激作为限制全球畜牧业生产的重要因素之一,对绵羊的生产、繁殖、免疫和健康福利都有重要影响。有研究发现,山羊血清中肿瘤坏死因子-α(TNF-α)和干扰素-γ(IFN-γ)含量在38 ℃急性热应激条件下4~8 h持续升高,而TNF-α作为机体应激反应过程中产生和释放最早的炎症介质,过量分泌不但会造成组织损伤,还能够诱导其他炎症因子释放,最终损伤机体免疫功能[1-2]。Manish等[3]评估了夏季热应激对Beetal山羊氧化应激相关参数的影响,结果表明应激状态下山羊血红蛋白、维生素C和维生素E的含量降低,谷胱甘肽过氧化物酶(GPx)的活性下降。Zhang等[4]对ICR小鼠的睾丸进行42 ℃的热处理后发现,热应激可以通过上调自噬相关蛋白7(autophagy related protein 7, Atg7)的表达引发生殖细胞的自噬和凋亡,而这2种机制能够协同诱导细胞死亡,最终破坏精子的生成。
绵羊养殖是养羊业的重要组成部分,尽管其抗旱耐寒的特性尤为突出,但在地中海盆地等热带、亚热带地区依然会受到高温环境的严重影响,如采食量降低、电解质失衡、生长性能下降、抗病能力减弱甚至导致死亡,为畜牧业的生产和发展造成不可估量的损失[5-6]。然而目前关于热应激对家畜影响的研究多集中在集约化程度较高的猪、禽等动物上,反刍动物中的研究则以奶牛居多。有关热应激对绵羊免疫、抗氧化功能及相关基因表达影响的研究却鲜有报道。了解热应激期间绵羊体内免疫和抗氧化系统受损的生物学机制可能有助于制定缓解策略并开发潜在的营养干预措施。因此,本试验模拟舍饲绵羊处在不同温度条件下,测定其血清免疫和抗氧化指标及相关基因相对表达量的变化,旨在探究长期慢性热应激对绵羊血清免疫和抗氧化指标以及相关基因相对表达量的影响,为科学健康养殖绵羊提供理论依据。
1 材料与方法 1.1 试验设计本试验于2017年7月31日至2017年8月27日在内蒙古农业大学试验牧场开展。选取平均体重为(63.11±4.82) kg、毛丛自然长度为(9.47±1.18) cm的3岁健康杜蒙杂交母羊18只,随机分为3组,每组6只羊。对照组绵羊处于舍内自然温度环境(25.23 ℃);适温组舍内安置空调,调节舍内气温处于适宜温度(19.60 ℃);高温组舍内安置电暖气,调整舍内环境为高温环境(27.19 ℃)。试验期共28 d,试验羊自由饮水,每天于08:00和15:00各饲喂全混合日粮1次,每次保证有5%的剩余料量,按照NRC(2007)饲养标准配制基础饲粮,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
分别于试验第14和28天08:00空腹采集颈静脉血样于非抗凝采血管和含乙二胺四乙酸(EDTA)的抗凝采血管中,3 000×g离心20 min后分别收集血清和白细胞。血清-20 ℃保存,白细胞中加入Trizol(TaKaRa)混匀并存于-80 ℃,用于总RNA的提取和后续指标的测定。
1.3 测定指标及方法 1.3.1 温湿度及温湿指数(THI)的测定试验期间,于羊舍中部距地面1.5 m高处悬挂日记型自记式温湿度记录仪(ZJI-2A型,上海隆拓仪器设备有限公司),避免试验羊触碰,每天测量并记录试验期羊舍的温度和相对湿度(相对湿度分别为自然舍内/安置电暖器/安置空调条件下的相对湿度),采用Marai等[6]的方法计算THI,计算公式如下:
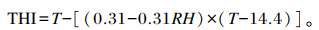
|
式中:T为畜舍摄氏温度(℃);RH为畜舍相对湿度(%)。
依据Marai等[6]的方法确定绵羊发生热应激的THI阈值为22.2,THI < 22.2时表示无热应激;22.2≤THI≤23.3时处于轻度热应激;23.3 < THI≤25.6时为中度热应激;THI>25.6时为重度热应激。
1.3.2 血清免疫指标的测定血清中免疫球蛋白A(IgA)、免疫球蛋白G(G)、免疫球蛋白M(M)和白细胞介素-1(IL-1)、白细胞介素-2(IL-2)及TNF-α的含量采用酶联免疫吸附试验(ELISA)试剂盒(瑞星生物科技有限公司)测定,按照说明书要求进行操作。
1.3.3 血清抗氧化指标的测定血清中总抗氧化能力(T-AOC)与过氧化氢酶(CAT)、GPx、总超氧化物歧化酶(T-SOD)活性以及脂质过氧化产物丙二醛(MDA)含量采用比色法,通过南京建成生物工程研究所的试剂盒测定。
1.3.4 总RNA提取、反转录和实时荧光定量PCR反应采用Trizol法从白细胞中提取总RNA,紫外分光光度法测定总RNA的浓度和纯度。按照Prime ScriptTM RT reagent Kit with gDNA Eraser(TaKaRa)说明书进行反转录,采用TB GreenTM Premix Ex TaqTM试剂盒(TaKaRa)进行实时荧光定量PCR反应,程序如下:95 ℃预变性30 s;95 ℃变性5 s,退火60 s,72 ℃延伸20 s,40个循环。绵羊IL-1β、IL-2、TNF-α、CAT、GPx、超氧化物歧化酶1(SOD1)、超氧化物歧化酶2(SOD2)、核转录因子2(Nrf2)和内参β-肌动蛋白(β-actin)引物序列如表 2所示,由北京六合华大基因科技有限公司合成,各目的基因的相对表达量根据2-△△Ct法计算。
|
|
表 2 引物序列 Table 2 Primer sequences |
试验数据采用SAS 9.0软件进行单因素方差分析(one-way ANOVA),采用Duncan氏法进行多重比较,P<0.05表示差异显著。结果以平均值(mean)±标准差(SD)表示。
2 结果与分析 2.1 羊舍THI的日变化试验期间各羊舍温度和相对湿度均不相同,监测并计算3组羊舍28 d的日平均温度和相对湿度(表 3),其中对照组日平均温度为21.30~28.74 ℃,全天平均温度为25.23 ℃;适温组日平均温度为17.53~22.44 ℃,全天平均温度为19.60 ℃;高温组日平均温度为23.16~31.03 ℃,全天平均温度为27.19 ℃。对照组日平均相对湿度为48.43%~91.47%,全天平均相对湿度为70.30%;适温组日平均相对湿度为68.64%~90.89%,全天平均相对湿度为81.73%;高温组日平均相对湿度为54.49%~70.06%,全天平均相对湿度为67.98%。
|
|
表 3 试验期不同羊舍的日平均温度和相对湿度 Table 3 Daily mean temperature and relative humidity in different sheds during test period |
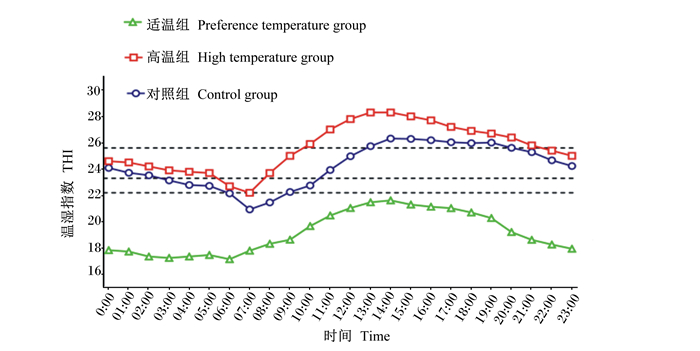
如图 1所示,适温组THI在试验全期均低于22.2,表明该组绵羊整个试验期处于非热应激状态;高温组每日平均最低THI为22.2,由此判断试验期间该组绵羊处于持续热应激状态;对照组THI监测结果表明该组试验羊每日处于4 h(06:00~09:00)无热应激、20 h热应激状态。综上判断,高温组绵羊遭受热应激程度最严重,且持续时间最长。
|
图 1 试验期不同羊舍温湿指数日变化曲线 Fig. 1 Diurnal variation curve of temperature and humidity index in different sheds during test period |
由表 4可知,在试验第14天,适温组血清IgG含量显著高于对照组和高温组(P < 0.05),而对照组又显著高于高温组(P < 0.05);高温组血清TNF-α含量显著高于适温组(P < 0.05);对照组和高温组血清IL-2含量显著高于适温组(P < 0.05),而对照组又显著高于高温组(P < 0.05);各组间其他免疫指标差异不显著(P>0.05)。在试验第28天,适温组血清IgG含量显著高于对照组和高温组(P < 0.05),血清IgM含量显著高于对照组和高温组(P < 0.05);适温组血清中IgA和IL-2含量显著高于高温组(P < 0.05);高温组血清IL-1含量显著高于适温组和对照组(P < 0.05);各组间血清TNF-α含量则无显著差异(P>0.05)。
|
|
表 4 热应激对绵羊血清免疫指标的影响 Table 4 Effects of heat stress on serum immune indexes of sheep (n=6) |
由表 5可知,在试验第14天,高温组白细胞IL-2和TNF-α基因相对表达量与适温组相比分别显著升高28.17%和27.37%(P < 0.05),适温组白细胞IL-2基因相对表达量相较于对照组显著降低40.85%(P < 0.05),而IL-1β基因的相对表达量无显著变化(P>0.05)。在试验第28天,高温组白细胞IL-1β基因的相对表达量显著高于对照组和适温组(P < 0.05),而白细胞IL-2和TNF-α基因的相对表达量无显著变化(P>0.05)。
|
|
表 5 热应激对绵羊白细胞中IL-1β、IL-2和TNF-α基因相对表达量的影响 Table 5 Effects of heat stress on relative expression levels of IL-1β, IL-2 and TNF-α genes in leukocytes of sheep (n=6) |
由表 6可知,在试验第14天,适温组血清CAT活性显著高于对照组和高温组(P < 0.05),而对照组又显著高于高温组(P < 0.05);对照组血清GPx活性显著高于适温组和高温组(P < 0.05),T-SOD活性显著高于适温组和高温组(P < 0.05);适温组血清T-AOC显著高于高温组(P < 0.05),而高温组血清MDA含量显著高于其他组(P < 0.05)。在试验第28天,适温组血清CAT活性显著高于对照组和高温组(P < 0.05),GPx活性显著高于对照组和高温组(P < 0.05),而对照组又显著高于高温组(P < 0.05);适温组血清T-SOD活性显著高于对照组和高温组(P < 0.05),T-AOC含量显著高于对照组和高温组(P < 0.05),而MDA含量显著低于高温组(P < 0.05)。
|
|
表 6 热应激对绵羊血清抗氧化指标的影响 Table 6 Effects of heat stress on serum antioxidant indexes of sheep (n=6) |
由表 7可知,在试验第14天,对照组和高温组白细胞CAT基因的相对表达量相较于适温组分别显著下降34.00%和50.56%(P < 0.05),而SOD2基因的相对表达量分别显著升高42.86%和35.71%(P < 0.05),Nrf2基因的相对表达量分别显著升高25.00%和13.75%(P < 0.05);与对照组相比,适温组和高温组白细胞GPx基因相对表达量分别显著下降13.64%和9.89%(P < 0.05)。在试验第28天,相较于适温组,对照组和高温组白细胞CAT基因相对表达量分别显著下降31.00%和77.03%(P < 0.05),SOD2基因相对表达量分别显著下降23.00%和39.77%(P < 0.05),且高温组白细胞CAT基因相对表达量显著低于对照组(P < 0.05);各组间白细胞GPx和Nrf2基因相对表达量差异不显著(P>0.05)。此外,在试验全期,各组间白细胞SOD1基因相对表达量无显著差异(P>0.05)。
|
|
表 7 热应激对绵羊白细胞中CAT、GPx、SOD1、SOD2和Nrf2基因相对表达量的影响 Table 7 Effects of heat stress on relative expression levels of CAT, GPx, SOD1, SOD2 and Nrf2 genes in leukocytes of sheep (n=6) |
绵羊作为一种耐热性较强的畜牧品种,具有较宽的等热区:5~25 ℃,但高环境温度仍会对其产生负面影响[7]。其中高温影响机体免疫系统的机制十分复杂,包括体温的变化、营养分配的协调性转变、行为和激素的适应性改变和氧化应激等[8]。有研究发现,热应激可以诱导奶牛产生氧化应激,而过量产生的活性氧(ROS)与免疫细胞细胞膜中的不饱和脂肪酸发生反应后能够损伤机体的免疫细胞,使血液中的白细胞数和单核细胞数下降,从而影响机体的免疫功能[9-11]。免疫球蛋白作为体液免疫的重要组成部分,不仅能够促进单核细胞和巨噬细胞的吞噬作用,还可以与抗原结合产生多种生物学效应,在机体的特异性免疫应答中发挥十分重要的作用[12]。Tao等[13]关于评估荷斯坦奶牛妊娠后期母体热应激对犊牛免疫功能影响的研究表明:与非应激组相比,应激组犊牛血清IgG含量显著下降了32.9%,这提示母体孕期热应激可能会进一步影响子代的免疫功能。与前人研究结果相似,在本试验条件下,热应激显著降低了试验后期绵羊血清IgA、IgG和IgM的含量,从而抑制了机体的免疫功能。这可能与热应激抑制了淋巴细胞的增殖、降低了淋巴细胞与中性粒细胞的比例有关[14-15]。
TNF-α、IL-1等促炎细胞因子作为炎症早期反应的主要前炎性因子,能够与多种免疫细胞上的受体结合,发挥免疫调控作用,但随着其分泌量的增加,机体的炎症反应会加剧,最终造成组织损伤,降低机体免疫功能。本试验中,热应激显著增加了试验前期绵羊血清TNF-α含量和试验后期绵羊血清IL-1的含量,这与马燕芬等[16]的研究结果相一致。此外,热应激作为一种重要的环境刺激,对动物组织或细胞中mRNA的表达也会造成影响。Strong等[17]研究指出,妊娠后期母体热应激能够升高犊牛白细胞中TNF-α基因表达量。本研究中,热应激显著上调了绵羊白细胞TNF-α和IL-1β基因相对表达量,这表明热应激可能通过升高TNF-α和IL-1β基因相对表达量来增加二者的分泌量,从而加速机体炎症反应的发生,损伤机体免疫功能。已有研究表明,TNF-α和IL-1等多种细胞因子的表达和分泌受核转录因子kappa B(NF-κB)信号通路的调控,而如前所述,热应激可以诱导机体发生氧化应激,细胞中过量生成的ROS能够作为信号分子激活NF-κB通路[18-19]。由此,基于前人及本试验的研究结果可以推测,热应激能够使绵羊血清TNF-α和IL-1的含量和白细胞中基因相对表达量升高,可能是由于ROS作为第二信使,通过泛素化和磷酸化NF-κB的抑制蛋白IκB(inhibitor kappa B, IκB),参与NF-κB的入核表达,进而促进了下游相关基因的转录[20]。IL-2能够刺激T细胞增殖分化,激活单核细胞和巨噬细胞,在调节反刍动物免疫反应中发挥重要作用,其水平的高低是衡量机体细胞免疫功能的重要标志[21-22]。本试验条件下,热应激显著降低了试验后期绵羊血清IL-2的含量。这与Sun等[23]的研究结果一致,即42 ℃组奶牛外周血淋巴细胞(PBMCs)中的IL-2含量显著低于37 ℃组,这表明热应激能够抑制机体的免疫功能。该结果可能与以下推测有关:热应激通过增加绵羊体内的皮质醇含量,抑制辅助型T细胞1型(Th1)免疫反应并刺激T细胞2型(Th2)免疫反应,从而抑制IL-2的分泌[24-25]。值得注意的是,在本试验中,热应激显著升高了试验前期IL-2的含量和基因相对表达量,这可能与试验前期机体为抵抗不利环境提高细胞免疫水平有关[26]。此外,应激状态下免疫系统的调节十分复杂,除NF-кB信号通路之外,促分裂素原活化蛋白激酶(MAPK)、一氧化氮(NO)和Kelch样环氧氯丙烷相关蛋白-1-核因子E2相关因子2/抗氧化反应元件信号通路(Keap1-Nrf2-ARE)等通路与免疫同样息息相关[27],关于这些信号通路是如何影响热应激状态下绵羊免疫功能的具体机制仍需进一步证实和探究。
3.2 热应激对绵羊血清抗氧化指标及相关基因相对表达量的影响热应激能够升高机体代谢水平,使细胞产生过量且无法被及时清除的ROS,造成机体氧化损伤,而脂质过氧化的副产物——MDA是衡量机体脂质氧化损伤程度的可靠指标[28-29]。抗氧化酶系统在缓解动物氧化应激的过程中发挥重要作用,其中SOD能够催化O2-生成过氧化氢(H2O2),CAT和GPx可以进一步将H2O2转化为H2O[29]。已有研究发现,热应激可以通过抑制SOD和GPx的活性降低肉牛的抗氧化功能,增加机体的氧化损伤[30]。本试验结果表明,热应激可以显著降低试验第28天绵羊白细胞CAT、SOD2基因相对表达量和血清CAT、GPx、T-SOD的活性以及T-AOC,并增加MDA的含量,这表明热应激可能通过下调绵羊抗氧化酶基因的相对表达量抑制其活性,加速细胞和组织的脂质过氧化反应。
已有研究表明,Nrf2可以通过结合ARE调控下游抗氧化酶(如CAT、GPx和SOD)的转录和表达,在机体抵御氧化应激的过程中发挥重要作用[31]。本研究测定了热应激期间绵羊白细胞中Nrf2基因相对表达量,结果表明,在试验第14天,热应激组绵羊白细胞Nrf2基因相对表达量显著高于适温组。此外,本研究发现热应激升高了试验前期对照组血清GPx的活性及其在白细胞中基因相对表达量,这可能是由于应激前期ROS通过修饰Keap1上的半胱氨酸残基,激活了Nrf2入核表达。而随着热应激严重程度和持续时间的增加,大量CAT、GPx和SOD被堆积的ROS消耗,最终导致了氧化酶活性下降。另有研究表明,NF-кB通路下游的p65蛋白能够降低Nrf2的DNA结合活性,导致Nrf2信号通路激活障碍,这可能也是试验后期热应激抑制抗氧化酶活性的原因之一[32]。此外,乙酰化和甲基化等多种因素都能够影响酶的活性,但关于热应激是否通过以上因素影响抗氧化酶的活性尚不明确,且除Keap1-Nrf2-ARE通路外,热应激是否通过其他多条通路调控绵羊抗氧化功能,仍需进一步研究[28]。
4 结论在本研究中,长期慢性热应激可以降低绵羊血清中IgA、IgG、IgM以及抗炎因子IL-2的含量,提高血清炎性因子TNF-α和IL-1的含量及其在白细胞基因相对表达量;抑制血清CAT、GPx、T-SOD的活性并下调白细胞CAT和SOD2基因相对表达量,降低血清T-AOC,增加MDA含量,这表明长期慢性热应激能够降低绵羊的抗氧化功能,抑制机体的免疫水平。
| [1] |
彭孝坤.急性冷热应激对肉羊生理生化指标和HSP70家族基因表达的影响[D].硕士学位论文.杨凌: 西北农林科技大学, 2019.
|
| [2] |
KIM J M, KIM S S, LEE Y D. Fas-associated factor 1 promotes in neurofibrillary tangle-mediated cell death of basal forebrain cholinergic neurons in P301L transgenic mice[J]. NeuroReport, 2015, 26(13): 767-772. DOI:10.1097/WNR.0000000000000423 |
| [3] |
MANISH K, JINDAL R, NAYYAR S. Influence of heat stress on antioxidant status in Beetal goats[J]. Indian Journal of Small Ruminants, 2011, 17(2): 178-181. |
| [4] |
ZHANG M Q, JIANG M, BI Y, et al. Autophagy and apoptosis act as partners to induce germ cell death after heat stress in mice[J]. PLoS One, 2012, 7(7): e41412. DOI:10.1371/journal.pone.0041412 |
| [5] |
CAROPRESE M, ALBENZIO M, BRUNO A, et al. Effects of shade and flaxseed supplementation on the welfare of lactating ewes under high ambient temperatures[J]. Small Ruminant Research, 2012, 102(2/3): 177-185. |
| [6] |
MARAI I F M, EI-DARAWANY A A, FADIEL A, et al. Physiological traits as affected by heat stress in sheep—a review[J]. Small Ruminant Research, 2007, 71(1/2/3): 1-12. |
| [7] |
DA COSTA M J R P, DA SILVA R G, DE SOUZA R C. Effect of air temperature and humidity on ingestive behaviour of sheep[J]. International Journal of Biometeorology, 1992, 36(4): 218-222. DOI:10.1007/BF02726401 |
| [8] |
LACETERA N.Effect of environment on immune functions[M]//COLLIER R J, COLLIER J L.Environmental physiology of livestock.Chichester (England): Wiley-Blackwell, 2012: 165-179.
|
| [9] |
BERNABUCCI U, RONCHI B, LACETERA N, et al. Markers of oxidative status in plasma and erythrocytes of transition dairy cows during hot season[J]. Journal of Dairy Science, 2002, 85(9): 2173-2179. DOI:10.3168/jds.S0022-0302(02)74296-3 |
| [10] |
DE LA FUENTE M. Effects of antioxidants on immune system ageing[J]. European Journal of Clinical Nutrition, 2002, 56(Suppl.3): S5-S8. |
| [11] |
赵宗胜, 米拉古丽, 江华, 等. 冷、热应激对奶牛血液生理生化指标影响[J]. 中国奶牛, 2011(22): 18-22. |
| [12] |
XU Y Q, WANG Z Q, QIN Z, et al. Effects of chitosan addition on growth performance, diarrhoea, anti-oxidative function and serum immune parameters of weaned piglets[J]. South African Society for Animal Science, 2018, 48(1): 142-150. DOI:10.4314/sajas.v48i1.16 |
| [13] |
TAO S, MONTEIRO A P A, THOMPSON I M, et al. Effect of late-gestation maternal heat stress on growth and immune function of dairy calves[J]. Journal of Dairy Science, 2012, 95(12): 7128-7136. DOI:10.3168/jds.2012-5697 |
| [14] |
LACETERA N, BERNABUCCI U, SCALIA D, et al. Lymphocyte functions in dairy cows in hot environment[J]. International Journal of Biometeorology, 2005, 50(2): 105-110. DOI:10.1007/s00484-005-0273-3 |
| [15] |
WEGNER T N, SCHUH J D, NELSON F E, et al. Effect of streess on blood leucocyte and milk somatic cell counts in dairy cows[J]. Journal of Dairy Science, 1976, 59(5): 949-956. DOI:10.3168/jds.S0022-0302(76)84303-2 |
| [16] |
马燕芬, 陈琦, 杜瑞平, 等. 热应激对奶山羊瘤胃上皮细胞屏障通透性的影响[J]. 中国农业科学, 2013, 46(21): 4478-4485. |
| [17] |
STRONG R A, SILVA E B, CHENG H W, et al. Acute brief heat stress in late gestation alters neonatal calf innate immune functions[J]. Journal of Dairy Science, 2015, 98(11): 7771-7783. DOI:10.3168/jds.2015-9591 |
| [18] |
LAWRENCE T, FONG C. The resolution of inflammation:anti-inflammatory roles for NF-κB[J]. The International Journal of Biochemistry & Cell Biology, 2010, 42(4): 519-523. |
| [19] |
OGANDO D G, PAZ D, CELLA M, et al. The fundamental role of increased production of nitric oxide in lipopolysaccharide-induced embryonic resorption in mice[J]. Reproduction, 2003, 125(1): 95-110. DOI:10.1530/rep.0.1250095 |
| [20] |
XIAO W H. Advances in NF-κB signaling transduction and transcription[J]. Cellular and Molecular Immunology, 2004, 1(6): 425-435. |
| [21] |
JUN C, ZHOU Y X, JIN X D, et al. Expression of interleukin-2 in Candidal balanoposthitis and its clinical significance[J]. Chinese Medical Journal, 2011, 124(17): 2776-2778. |
| [22] |
ZHAO K, HE W Q, GAO W, et al. Orf virus DNA vaccines expressing ORFV 011 and ORFV 059 chimeric protein enhances immunogenicity[J]. Virology Journal, 2011, 8: 562. DOI:10.1186/1743-422X-8-562 |
| [23] |
SUN Y H, LIU J, YE G P, et al. Protective effects of zymosan on heat stress-induced immunosuppression and apoptosis in dairy cows and peripheral blood mononuclear cells[J]. Cell Stress and Chaperones, 2018, 23(5): 1069-1078. DOI:10.1007/s12192-018-0916-z |
| [24] |
NAZIFI S, SAEB M, ROWGHANI E, et al. The influences of thermal stress on serum biochemical parameters of Iranian fat-tailed sheep and their correlation with triiodothyronine (T3), thyroxine (T4) and cortisol concentrations[J]. Comparative Clinical Pathology, 2003, 12(3): 135-139. DOI:10.1007/s00580-003-0487-x |
| [25] |
WIEGERS G J, STEC I E M, STERZER P, et al.Glucocorticoids and the immune response[M]//STECKLER T, KALIN N H, REUL J M H M.Handbook of stress and the brain.Amsterdam: Elsevier, 2005.
|
| [26] |
CARROLL J A, FORSBERG N E. Influence of stress and nutrition on cattle immunity[J]. Veterinary Clinics of North America:Food Animal Practice, 2007, 23(1): 105-149. DOI:10.1016/j.cvfa.2007.01.003 |
| [27] |
齐晓龙.共轭亚油酸对产蛋鸡抗氧化机能的影响[D].博士学位论文.北京: 中国农业科学院, 2013: 10-15.
|
| [28] |
GUAN K L, XIONG Y. Regulation of intermediary metabolism by protein acetylation[J]. Trends in Biochemical Sciences, 2011, 36(2): 108-116. |
| [29] |
AHMAD H, TIAN J K, WANG J J, et al. Effects of dietary sodium selenite and selenium yeast on antioxidant enzyme activities and oxidative stability of chicken breast meat[J]. Journal of Agricultural and Food Chemistry, 2012, 60(29): 7111-7120. DOI:10.1021/jf3017207 |
| [30] |
王玲, 罗宗刚, 蔡明成, 等. 热应激对肉牛血清离子、酶活性、抗氧化及免疫指标的影响[J]. 西南师范大学学报(自然科学版), 2017, 42(12): 37-41. |
| [31] |
WANG R, PAUL V J, LUESCH H. Seaweed extracts and unsaturated fatty acid constituents from the green alga Ulva lactuca as activators of the cytoprotective Nrf2-ARE pathway[J]. Free Radical Biology and Medicine, 2013, 57: 141-153. DOI:10.1016/j.freeradbiomed.2012.12.019 |
| [32] |
李慧.NF-κB通路负调控Keap1-Nrf2通路及其分子机制研究[D].硕士学位论文.天津: 天津大学, 2009.
|




