2. 西藏自治区日喀则市亚东县农牧综合服务中心, 日喀则 857600
2. Yadong County Pastoral Service Centers of Tibet Autonomous Region Shigatse, Shigatse 857600, China
大气中温室气体浓度的升高导致全球气候变暖,温室气体主要包括二氧化碳(CO2)、甲烷(CH4)和氧化亚氮(N2O),在100年时间尺度上,CH4的全球变暖潜力(global warming potential, GWPs)是CO2的28倍[1]。农牧业温室气体排放量约占全球人为温室气体排放总量的25.5%。在全球范围内,反刍动物生产是人为CH4排放的主要来源,每年的全球温室气体排放贡献率高达14.5%[2]。CH4主要是饲料底物在反刍动物瘤胃中进行发酵,在产甲烷菌等的作用下生成的,瘤胃CH4产量占80%~95%,大肠CH4产量占5%~20%[3]。
牦牛主要分布在青藏高原高寒地区,分布区海拔高达3 000~5 000 m,牦牛是能够适应高寒气候(低氧、强紫外线、低气温、降水多变)且能充分利用高寒草地资源的特种家畜[4]。我国的牦牛约有1 600万头,占世界牦牛总量95%以上,主要分布在新疆、西藏、青海、甘肃、四川和云南等地,我国是世界上主要的牦牛种质资源库和牦牛畜产品生产区[5]。青海现有牦牛约478.69万头,占全国牦牛总数的36%,是牦牛第一大省,也是牦牛资源最集中的地区之一[6-7]。作为高寒地区重要的反刍家畜,牦牛是高原地区主要的温室气体排放源,根据联合国政府间气候变化专门委员会(Intergovernmental Panel on Climate Change,IPCC)(2006)推荐方法和Ding等[8]实测牦牛CH4数据,估算发现青海省牦牛1年CH4排放量约56.18万t。同时有研究表明,降低反刍动物瘤胃CH4产量不仅对缓解温室效应有重要意义,还可以降低反刍动物瘤胃发酵过程中的能量损失,提高饲料的转化利用率[9-10]。因此,目前反刍动物CH4排放和减排技术开发成为研究热点。
目前的研究表明,通过饲粮营养调控和一些添加剂(脂类、有机酸、卤代化合物、硝酸盐、单宁、酚类单体及其他植物次级代谢物等)可以有效降低反刍动物CH4排放,获得较为持久的抑制CH4排放效果[11-12]。据研究,饲粮中每增加1%的脂肪含量,可以减少CH4排放4%~5%[13]。然而,脂类物质添加超过干物质采食量的7%时,会影响饲粮采食量、食物纤维消化,从而降低产奶量和日增重[14]。研究表明,采用人工瘤胃双外流发酵罐(Rusitec fermenters)[15]、绵羊[16]、肉牛[17-18]和奶牛[19-20]作为研究对象,向其饲粮中添加油脂类(大豆、椰子、普通油菜籽、双低油菜籽等)可以减少CH4排放19%~62%。青海省是全国优质油菜生产基地,常年种植油菜面积稳定在300万亩(1亩≈666.67 m2)左右,菜籽饼粕也是迄今青海省农作物中数量最大、蛋白质含量最高的饲料原料,年产量约22万t,其粗蛋白质(CP)含量约占25%,在青海省常用饲料原料中蛋白质含量仅次于豆粕[21],适量添加到羔羊饲粮中可显著提高羔羊的生长性能和饲料转化效率[22]。因此,双低油菜籽及其加工副产物成为青海高原牦牛主要的优质蛋白质和能量补充剂。
本试验通过计算48 h体外模拟累计产气量(GP)、产气动力学参数,并测定体外干物质消失率(IVDMD)及瘤胃液pH和氨态氮(NH3-N)、微生物蛋白(MCP)、挥发性脂肪酸(VFA)含量及CH4产量等指标,评价饲粮中不同水平双低菜籽油对牦牛体外瘤胃液发酵特征及CH4产量的影响,以期为合理使用双低油菜及其加工副产物配制低碳型牦牛补饲饲粮提供理论支撑。
1 材料与方法 1.1 原料采集与测定青稞、青贮燕麦草、甜菜渣和油菜籽均采自青海省大通县丰聚种养殖专业合作社。样品收集后,带回实验室经65 ℃干燥制成风干样,粉碎后过1 mm筛网,编号密封保存以备用。
干物质(DM)含量采用GB/T 6435—2014[23]中的方法测定,CP含量采用GB/T 6432—2018[24]中的方法测定,粗灰分(Ash)含量采用GB/T 6438—2007[25]中的方法测定,钙(Ca)、磷(P)含量参照张丽英[26]《饲料分析及饲料质量检测技术》中的方法进行测定。中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)含量采用Van Soest[27]的方法测定,所用仪器为ANKOM 200i半自动纤维分析仪测定。总能(GE)采用美国绝热型氧弹热量计Parr 6100型测定,精准称取0.8 g左右风干基础的样品,经专用的压片机压片成型,放入专用坩锅中进仪器测定其GE。粗脂肪(EE)含量采用ANKOM XT15i自动脂肪分析仪测定。计算公式为:
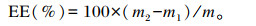
|
式中:m为样品质量(g);m1为提取前烘干后样品+滤袋质量(g);m2为提取后烘干后样品+滤袋质量(g)。
1.2 试验设计参考《肉牛饲养标准》[28](NY/T 815—2004)和《牦牛营养研究论文集》[29]中相关能量与蛋白质研究文献,按照150 kg牦牛日增重500 g设计牦牛基础饲粮的精料配方。采用单因素4水平试验设计,按照精粗比50 : 50混匀青贮燕麦草和以菜籽粕、菜籽饼、破碎的油菜籽及菜籽油配制的4种精料,得到双低菜籽油水平分别为3.26%(Ⅰ组)、4.58%(Ⅱ组)、5.45%(Ⅲ组)和6.27%(Ⅳ组)的试验饲粮作为发酵底物。试验饲粮组成及营养水平见表 1。
|
|
表 1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
试验选用3头体重相近、体况相似的成年阉牦牛作为瘤胃液供体动物,采用单栏饲养,每日饲喂2次(08:00和18:00),试验期间保证牦牛自由饮水。瘤胃液供体牦牛的基础饲粮为燕麦干草和精料,精粗比为3 : 2,基础饲粮组成及营养水平见表 2。
|
|
表 2 基础饲粮组成及营养水平(干物质基础) Table 2 Composition and nutrient levels of the basal diet (DM basis) |
瘤胃液的采集步骤及人工瘤胃缓冲液的配制参考Menke等[31]方法进行。每组使用分析天平分别准确称取(0.400±0.005) g混合饲粮风干样,每个采样时间点各设置3个平行,空白对照设置为不加任何样,放置在100 mL发酵培养管(Hvberle LABORTECHNIK,德国)中,用40 mL稀释后的瘤胃消化液(瘤胃液:缓冲液=1 : 2)进行体外发酵。分别在体外模拟发酵的3、6、9、12、18、24、36和48 h时记录产气量。在每次需要排气时进行气体样品采集,用干净的10 mL注射器针头扎入培养管前端的乳胶管抽取气体至10 mL刻度处,在抽取过程中要同时慢慢推动活塞,保证采气均匀。随后将注射器中气体精确排至5 mL刻度,快速打入提前编好号的真空采血管中,用胶带缠裹密封放置4 ℃冰箱中保存,待测。
在体外发酵12、24、48 h后收集各3个平行的发酵底物用以计算IVDMD;在体外发酵48 h收集发酵液测定pH及NH3-N、MCP、VFA含量。使用HANNA HI221型台式酸度计测定发酵液pH,测定前先对该酸度计使用相应标准液进行校正;参照冯宗慈等[32]改进的比色法测定发酵液NH3-N含量;使用南京建成生物工程研究所提供试剂盒测定发酵液MCP含量,方法为考马斯亮蓝法;参考相关文献[33-34],使用日本岛津GC-2014型气相色谱仪,并依据所用仪器性能设定合适的试验条件对发酵气体中CH4产量及发酵液VFA含量进行测定;体外发酵12、24、48 h的IVDMD依据Bodas等[35]的方法进行测定与计算:

|
各时间点产气量按照如下公式计算:

|
采用经典数学模型,模型公式为:
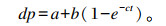
|
式中:dp是t时刻的产气量(mL);a是快速降解部分的产气量(mL),b是慢速降解部分的产气量(mL);c是慢速降解部分的产气速率(%/h),a+b是理论总产气量(mL),t是发酵时间(h)[36]。
1.6 统计分析试验数据采用Excel 2016进行数据初步整理,用SPSS 19.0统计分析软件进行单因素方差分析,并用Duncan氏法进行组间多重比较,并应用GLM程序对不同水平双低菜籽油与CH4产量进行线性回归及Pearson相关性分析。P < 0.05为差异显著,P < 0.01为差异极显著。结果用平均值表示,变异程度用均值标准误(SEM)表示。
2 结果 2.1 不同双低菜籽油水平饲粮的体外瘤胃发酵产气动态变化由表 3可知,各组12和24 h产气量均无显著差异(P>0.05);Ⅰ组48 h产气量显著高于Ⅱ、Ⅳ组(P < 0.05),Ⅳ组48 h产气量最低,显著低于其他各组(P < 0.05)。12、24和48 h产气量均在Ⅰ组达到最大值,Ⅳ组达到最小值。对于产气规律拟合参数,各组快速降解部分的产气量和慢速降解部分的产气速率均无显著差异(P>0.05);Ⅰ组慢速降解部分的产气量显著高于Ⅱ、Ⅳ组(P < 0.05),Ⅳ组慢速降解部分的产气量最低,显著低于其他各组(P < 0.05);Ⅰ组理论总产气量最高,显著高于其他各组(P < 0.05)。
|
|
表 3 不同双低菜籽油水平饲粮的体外瘤胃发酵产气动态变化 Table 3 Dynamic changes of gas production by rumen fermentation in vitro of different levels of double-low rapeseed oil diets |
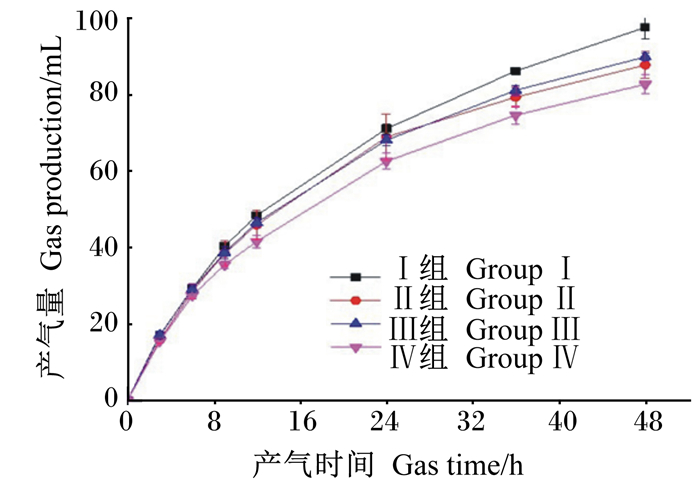
由图 1可知,随着产气时间的增加,各组产气量逐渐升高。
|
图 1 体外发酵产气量动态变化 Fig. 1 Dynamic changes of gas production by rumen fermentation in vitro |
由表 4可知,48 h发酵后,各组发酵液的pH及NH3-N、MCP含量均无显著差异(P>0.05),Ⅱ组发酵液的pH最低(7.04),Ⅱ组发酵液的NH3-N含量最高(12.19 mg/dL),Ⅰ组发酵液的MCP含量最高(5.52 mg/mL);Ⅳ组发酵液的乙酸和总挥发性脂肪酸(TVFA)含量显著高于Ⅰ、Ⅱ组(P < 0.05);Ⅲ组发酵液的异丁酸和异戊酸含量最高,均极显著高于其他各组(P < 0.01);Ⅳ组发酵液的丁酸含量最高,极显著高于其他各组(P < 0.01);各组发酵液的丙酸、戊酸含量和乙酸/丙酸均无显著差异(P>0.05)。
|
|
表 4 不同双低菜籽油水平饲粮的48 h体外瘤胃发酵参数 Table 4 Rumen fermentation parameters in vitro of different levels of double-low rapeseed oil diets for 48 h |
由表 5可知,各组12和48 h IVDMD均无显著差异(P>0.05)。Ⅲ组24 h IVDMD最高(37.56%),与Ⅰ、Ⅱ组无显著差异(P>0.05),显著高于Ⅳ组(P < 0.05)。
|
|
表 5 不同双低菜籽油水平饲粮的IVDMD Table 5 IVDMD of different levels of double-low rapeseed oil diets |
由表 6可知,Ⅲ组发酵液的12 h CH4产量最低,极显著低于其他各组(P < 0.01);Ⅳ组发酵液的24 h CH4产量最低,极显著低于Ⅰ、Ⅱ组(P < 0.01);Ⅳ组发酵液的48 h CH4产量最低,极显著低于其他各组(P < 0.01)。
|
|
表 6 不同双低菜籽油水平饲粮的体外发酵CH4产量 Table 6 CH4 production by fermentation in vitro of different levels of double-low rapeseed oil diets |
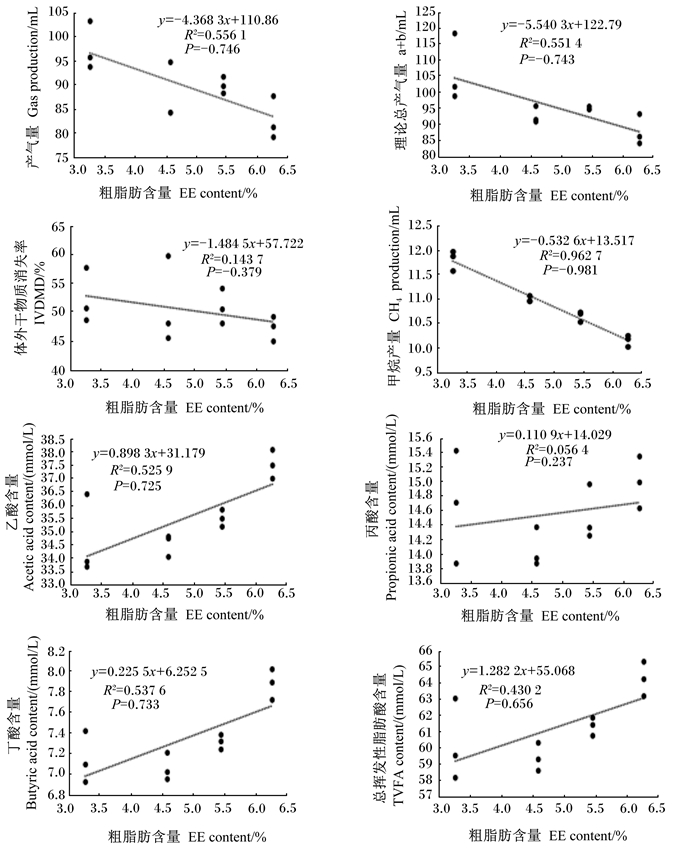
由图 2可知,48 h产气量、理论总产气量(a+b)和IVDMD均与饲粮EE含量呈现相反的变化趋势,并均在Ⅲ组出现转折点,但相关性均不显著(P>0.05)。乙酸、丙酸、丁酸和TVFA含量均与饲粮EE含量呈现一致变化趋势,但相关性也均不显著(P>0.05)。仅有CH4产量与饲粮EE含量呈极显著负相关关系(P < 0.01)。
|
图 2 不同双低菜籽油水平饲粮的体外发酵指标与EE含量相关性 Fig. 2 Correlation coefficient between EE content and fermentation parameters in vitro of different levels of double-low rapeseed oil diets |
产气量能够表现瘤胃微生物活动的总体趋势及干物质的消化水平,其与饲料的可发酵性营养成分含量及瘤胃微生物的活性呈正相关,即当瘤胃液中瘤胃微生物活性越高,可消化营养成分越多,其发酵情况越好,产气量越高[37]。本试验中,48 h产气量、慢速降解部分的产气量及理论总产气量在不同双低菜籽油水平饲粮之间呈降低趋势,并均在Ⅳ组有最小值,表明饲粮中油脂含量达到5.45%以上,在一定程度上会抑制产气量。陆燕等[38]研究大蒜油及脱臭大蒜油对体外产气量的影响,得出添加300 mg/L以上的大蒜油会显著降低产气量,而添加500 mg/L以上的脱臭大蒜油反而会显著提高产气量。拜彬强等[39]利用体外发酵法评价了不同物候期天然牧草与油菜籽组合的发酵特性,同样得出20%油菜籽添加组理论最大产气量极显著低于5%油菜籽添加组和对照组。本试验结果与上述研究结果基本一致。本试验中,Ⅲ组CP含量低于Ⅰ组,但Ⅲ组体外发酵产气指标与对照组无显著差异。CP作为饲粮品质的重要构成组分,其含量也与饲粮营养价值呈正相关[40]。韩璐璐[41]通过ANKOM RFS型体外产气测量系统发现不同CP水平(12%、14%、16%和18%)饲粮对绵羊瘤胃体外产气量的影响显著,总产气量趋势为18%组>12%组>16%组>14%组。而王芳等[42]、Rodriguez等[43]、Soltan等[44]均指出饲粮CP水平与产气量呈负相关。上述研究结果的不一致可能是因为饲粮CP水平不是唯一影响产气量的因素,还受到碳水化合物水平等因素的影响。
3.2 不同双低菜籽油水平饲粮对体外瘤胃发酵参数的影响瘤胃内环境参数如pH、NH3-N含量等均可以反映机体营养情况,是评定饲料营养价值的重要指标。瘤胃pH是影响瘤胃发酵的重要衡量指标之一,一般在5.5~7.5变动,适宜瘤胃微生物生长及正常发酵的pH在6.5左右,当pH < 6.2时,分解纤维的细菌活性将受到抑制[45]。研究指出,瘤胃NH3-N含量是反映瘤胃微生物对饲料中蛋白质分解能力及吸收速率动态平衡的重要指标,而且在一定范围内,NH3-N作为瘤胃微生物合成MCP的原材料,与MCP合成速度相关,且NH3-N主要来自外源性(饲草)蛋白质及瘤胃内源性非蛋白氮物质的降解,进而一般与采食的蛋白质含量成正比[46]。本试验中,双低菜籽油水平的增加对发酵液pH及NH3-N、MCP含量均无显著影响。pH为7.04~7.09,在Ⅱ组达到最低(7.04),但不影响正常发酵;孙璐等[47]采用体外发酵法研究发现,不同添加水平双低菜籽油对发酵液pH无显著影响,与本试验结果一致。本试验中,发酵液NH3-N和MCP含量均在Ⅲ组达到最低值,这与Ⅲ组饲粮CP含量相对偏低有直接关系。石宁等[48]采用体外产气法研究4种植物油(桉叶油、山苍子油、肉桂油和茴香油)对羊瘤胃液体外发酵参数的影响,发现添加桉叶油和肉桂油对发酵液pH无显著影响;除了茴香油,添加其他植物油均对发酵液NH3-N含量无显著影响。
VFA是反映瘤胃发酵的重要指标之一,是碳水化合物发酵得到的主要产物,也是动物机体能量主要来源及乳脂、体脂合成的主要原料。VFA所提供的瘤胃可发酵能量占到饲粮可消化能的60%以上[49]。本试验中,随着饲粮中双低菜籽油水平的提高,发酵液乙酸、丙酸和TVFA含量均在Ⅳ组达到最大值;异丁酸、丁酸和异戊酸含量均在Ⅲ组或Ⅳ组达到最大值;而乙酸/丙酸在数值上呈现上升趋势。Zhang等[50]通过在体外培养发现,随亚麻酸比例的提高,发酵液TVFA含量也随之升高,且亚麻酸单独添加效果显著好于亚油酸单独添加。但杨舒黎[51]研究发现,奶牛饲粮中添加4%植物油会显著降低瘤胃液丁酸和TVFA含量。以上研究表明,饲粮中添加油脂对瘤胃发酵TVFA含量的影响比较复杂,与添加的种类、剂量及形式相关,也受试验动物年龄、生理状态不同的影响。
3.3 不同双低菜籽油水平饲粮对IVDMD的影响IVDMD在一定程度上均能够反映饲料在瘤胃中的消化难易度,是衡量饲料利用率的重要指标,并与体外累积产气量具有高度正相关性,即IVDMD越高,其累积产气量也就越大。粗饲料在瘤胃中的降解主要是瘤胃微生物和其分泌相应酶的相互作用,而纤维作为被其利用的大量结构性碳水化合物,纤维降解率是影响反刍家畜生长性能的重要指标[52]。本试验中,随着饲粮中双低菜籽油水平的提高,48 h IVDMD与理论最大产气量变化趋势一致,均随着饲粮EE含量的提高而逐渐降低。该现象表明在饲粮中油脂含量较高时,对体外发酵具有一定的抑制作用。金恩望等[53]也利用体外产气法研究发现添加高剂量3种植物精油(茶树油、肉桂油和丁香油)时对瘤胃体外发酵IVDMD具有极显著的降低作用;Beauchemin等[54]研究在泌乳期奶牛饲粮中添加破碎的向日葵籽、亚麻籽或油菜籽对其瘤胃发酵、CH4排放和牛奶产量的影响,结果表明饲喂向日葵籽和亚麻籽与对照组相比显著降低了DM和有机物的消化率,而饲喂油菜籽与对照组相比消化率均无显著差异。本试验中,随着饲粮中双低菜籽油水平的提高,体外瘤胃发酵液TVFA含量升高,而IVDMD却下降。造成这一现象的原因可能与本试验双低油菜籽的添加形式有关,据报道,饲粮中添加未保护油脂对瘤胃发酵有明显抑制作用,添加纯油脂时饲粮非结构性碳水化合物的消化率增加而NDF和ADF消化率降低[55],油脂直接对瘤胃纤维分解菌有毒害作用或影响微生物的活动强度[56]。此外,也可能与饲粮EE含量的增加有直接关系,体外试验的发酵液VFA含量是一段时间发酵后的累积结果。
3.4 不同双低菜籽油水平饲粮对体外发酵CH4产量的影响反刍动物产生CH4的主要途径是瘤胃内产甲烷菌利用氢气(H2)和二氧化碳(CO2)进行还原反应生成CH4,占主导地位,大约82%的瘤胃CH4来自此途径。而H2和CO2主要是由采食饲料中碳水化合物在瘤胃内进行厌氧发酵,瘤胃微生物将碳水化合物降解生成的[57]。有研究报道,降低反刍动物瘤胃内CH4产量不仅可以缓解温室效应,还可以减少瘤胃发酵过程中能量的损失,提高饲料的利用率[10]。本试验中,随着饲粮中双低菜籽油水平的增加,3个时间点的累积CH4产量均明显下降。与Ⅰ组相比,Ⅳ组48 h CH4产量降低了13.89%。张春梅[58]研究了不同精粗比饲粮在体外情况下添加亚麻酸(高粗料、高粗料添加5%亚麻酸、高精料和高精料添加5%亚麻酸)对湖羊CH4排放的影响,发现亚麻酸的添加分别显著降低了CH4排放量17.3%和33.8%;林波等[59]研究发现,添加牛至油和肉桂油的最理想剂量是50 mg/L,可以分别降低13.3%和21.2%的CH4含量。以上研究均表明添加一定量的植物油可以有效调控瘤胃发酵,减少CH4产量。
3.5 不同双低菜籽油水平饲粮的发酵指标与其EE含量的相关性分析饲粮脂肪作为动物的重要能量营养素,在反刍动物饲粮中适度添加油脂可以保障和提高动物机体所需能量。本试验中,仅有CH4产量与饲粮EE含量呈极显著负相关关系,并利用饲粮EE含量(x)预测其体外CH4产量(y)的方程为:y=-0.53x+13.52 (R2=0.962 7),表明饲粮EE含量可作为理想的单一预测因子。有研究表明,饲粮中每增加1%的脂肪含量,可以减少CH4排放4%~5%[13]。KirchgeΒner等[60]通过对60头肉牛的营养代谢试验的大量数据进行研究分析,利用饲粮营养成分EE、CP、粗纤维(CF)和无氮浸出物(NFE)的摄入量(kg/d)得到CH4产量预测模型:CH4(g/d)=63+79×CF+10×NFE+26×CP-212×EE[60]。以上研究均表明CH4产量与饲粮EE含量呈负相关关系,本试验结果与之相似。
4 结论① 随着饲粮中双低菜籽油水平的增加,48 h产气量、产气动力学参数和IVDMD均呈下降趋势,有效降低了CH4产量,提高了TVFA含量,对其他瘤胃发酵参数无显著影响。
② 饲粮EE含量(x)与体外CH4产量(y)呈极显著负相关关系,拟合方程为:y=-0.53x+13.52 (R2=0.962 7),可作为预测体外CH4产量的理想指标。
| [1] |
Intergovernmental Panel on Climate Change.2006 IPCC guidelines for national greenhouse gas inventories[R]. Intergovernmental Panel on Climate Change, 2006.
|
| [2] |
O'MARA F, RYAN M, CONNOLLY J, et al.Climate change-estimation of emissions of greenhouse gases from agriculture and strategies for their reduction (2000-LS-5.1.1)[C]//[s.l.]: Environmental Protection Agency, 2007.
|
| [3] |
SUGORO I, NURYANTHI N, ERMADEVI D N I, et al. The effect of fitosan supplementation on methane production in cow's rumen liquid by in vitro method[J]. IOP Conference Series:materials science and engineering, 2019, 546(2): 22-28. |
| [4] |
WOODWARD S L, WAGHORN G C, THOMSON N A.Supplementing dairy cows with oils to improve performance and reduce methane-does it work?[C]//Proceedings of the New Zealand Society of Animal Production, [s.l.]: [s.n.], 2006, 66: 176.
|
| [5] |
ZHANG L, SUN B Z, XIE P, et al. Using near infrared spectroscopy to predict the physical traits of Bos grunniens meat[J]. LWT-Food Science and Technology, 2015, 64(2): 602-608. DOI:10.1016/j.lwt.2015.06.022 |
| [6] |
牛春娥, 张利平, 孙俊锋, 等. 我国牦牛资源现状及其产品开发利用前景分析[J]. 安徽农业科学, 2009, 37(17): 8003-8005. |
| [7] |
罗毅皓, 刘书杰. 青海大通牦牛肉氨基酸及风味分析[J]. 食品科技, 2010, 35(2): 106-110, 113. |
| [8] |
DING X Z, LONG R J, KREUZER M, et al. Methane emissions from yak (Bos grunniens) steers grazing or kept indoors and fed diets with varying forage:concentrate ratio during the cold season on the Qinghai-Tibetan plateau[J]. Animal Feed Science and Technology, 2010, 162(3/4): 91-98. |
| [9] |
XUE B, WANG L Z, YAN T. Methane emission inventories for enteric fermentation and manure management of yak, buffalo and dairy and beef cattle in China from 1988 to 2009[J]. Agriculture, Ecosystems & Environment, 2014, 195: 202-210. |
| [10] |
章永松, 柴如山, 付丽丽, 等. 中国主要农业源温室气体排放及减排对策[J]. 浙江大学学报(农业与生命科学版), 2012, 38(1): 97-107. |
| [11] |
KUMAR S, CHOUDHURY P K, CARRO M D, et al. New aspects and strategies for methane mitigation from ruminants[J]. Applied Microbiology and Biotechnology, 2014, 98(1): 31-44. |
| [12] |
邵凤君, 金家志. 减少反刍动物甲烷排放的措施[J]. 国外农业环境保护, 1992, 4: 4-14. |
| [13] |
BRASK M, LUND P, WEISBJERG M R, et al. Methane production and digestion of different physical forms of rapeseed as fat supplements in dairy cows[J]. Journal of Dairy Science, 2013, 96(4): 2356-2365. DOI:10.3168/jds.2011-5239 |
| [14] |
GRAINGER C, BEAUCHEMIN K A. Can enteric methane emissions from ruminants be lowered without lowering their production?[J]. Animal Feed Science and Technology, 2011, 166-167: 308-320. DOI:10.1016/j.anifeedsci.2011.04.021 |
| [15] |
PATRA A K. Enteric methane mitigation technologies for ruminant livestock:a synthesis of current research and future directions[J]. Environmental Monitoring and Assessment, 2012, 184(4): 1929-1952. DOI:10.1007/s10661-011-2090-y |
| [16] |
DOHME F, MACHMVLLER A, WASSERFALLEN A, et al. Comparative efficiency of various fats rich in medium-chain fatty acids to suppress ruminal methanogenesis as measured with Rusitec[J]. Canadian Journal of Animal Science, 2000, 80(3): 473-484. DOI:10.4141/A99-113 |
| [17] |
BEAUCHEMIN K A, MCGINN S M. Methane emissions from beef cattle:effects of fumaric acid, essential oil, and canola oil[J]. Journal of Animal Science, 2006, 84(6): 1489-1496. DOI:10.2527/2006.8461489x |
| [18] |
JORDAN E, KENNY D, HAWKINS M, et al. Effect of refined soy oil or whole soybeans on intake, methane output, and performance of young bulls[J]. Journal of Animal Science, 2006, 84(9): 2418-2425. DOI:10.2527/jas.2005-354 |
| [19] |
DING X Z, LONG R J, ZHANG Q, et al. Reducing methane emissions and the methanogen population in the rumen of Tibetan sheep by dietary supplementation with coconut oil[J]. Tropical Animal Health and Production, 2012, 44(7): 1541-1545. DOI:10.1007/s11250-012-0103-7 |
| [20] |
ODONGO N E, OR-RASHID M M, KEBREAB E, et al. Effect of supplementing myristic acid in dairy cow rations on ruminal methanogenesis and fatty acid profile in milk[J]. Journal of Dairy Science, 2007, 90(4): 1851-1858. DOI:10.3168/jds.2006-541 |
| [21] |
徐亮, 唐国永, 杜德志. 我国双低油菜多功能利用及青海省发展潜力分析[J]. 青海大学学报, 2019, 37(3): 41-48. |
| [22] |
王志有, 侯生珍, 王兴福. 双低菜籽饼在育肥羔羊精料中的适宜添加量[J]. 安徽农业科学, 2011, 39(6): 3600-3602. |
| [23] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB/T 6435—2014饲料中水分的测定[S].北京: 中国标准出版社, 2015.
|
| [24] |
全国饲料工业标准化技术委员会.GB/T 6432—2018饲料中粗蛋白的测定凯氏定氮法[S].北京: 中国标准出版社, 2018.
|
| [25] |
全国饲料工业标准化技术委员会.GB/T 6438—2007饲料中粗灰分的测定[S].北京: 中国标准出版社, 2007.
|
| [26] |
张丽英. 饲料分析及饲料质量检测技术[M]. 4版.北京: 中国农业大学出版社, 2016.
|
| [27] |
VAN SOEST P J. Development of a comprehensive system of feed analyses and its application to forages[J]. Journal of Animal Science, 1967, 26(1): 119-128. DOI:10.2527/jas1967.261119x |
| [28] |
美国国家研究委员会.奶牛营养需要[M]. 6版.周建民译.北京: 科学技术文献出版社, 1992.
|
| [29] |
胡令浩. 牦牛营养研究论文集[M]. 西宁: 青海人民出版社, 1997.
|
| [30] |
冯仰廉, 王加启, 杨红建, 等. 肉牛饲养标准[M]. 北京: 中国农业出版社, 2004.
|
| [31] |
MENKE K H, STEINGASS H. Estimation of the energetic feed value obtained from chemical analysis and in vitro gas production using rumen fluid[J]. Animal Research and Development, 1988, 28(1): 7-55. |
| [32] |
冯宗慈, 高民. 通过比色测定瘤胃液氨氮含量方法的改进[J]. 畜牧与饲料科学, 2010, 31(6/7): 37. |
| [33] |
曹庆云, 周武艺, 朱贵钊, 等. 气相色谱测定羊瘤胃液中挥发性脂肪酸方法研究[J]. 中国饲料, 2006(24): 26-28. |
| [34] |
王加启. 反刍动物营养学研究方法[M]. 北京: 中国出版集团现代教育出版社, 2011.
|
| [35] |
BODAS R, LÓPEZ S, FERNÁNDEZ M, et al. In vitro screening of the potential of numerous plant species as antimethanogenic feed additives for ruminants[J]. Animal Feed Science and Technology, 2008, 145(1/2/3/4): 245-258. |
| [36] |
ØRSKOV E R, MCDONALD I. The estimation of protein degradability in the rumen from incubation measurements weighted according to rate of passage[J]. The Journal of Agricultural Science, 1979, 92(2): 499-503. DOI:10.1017/S0021859600063048 |
| [37] |
雷冬至, 金曙光, 乌仁塔娜. 用体外产气法评价不同粗饲料与相同精料间的组合效应[J]. 饲料工业, 2009, 30(3): 30-33. |
| [38] |
陆燕, 林波, 王恬, 等. 大蒜油对体外瘤胃发酵、甲烷生成和微生物区系的影响[J]. 动物营养学报, 2010, 22(2): 386-392. |
| [39] |
拜彬强, 郝力壮, 刘书杰, 等. 不同物候期天然牧草与油菜籽组合发酵特性研究[J]. 家畜生态学报, 2016, 37(2): 45-52. |
| [40] |
赵方媛, 杜文华, 田新会. 饲料型小黑麦品系的秸秆产量及其营养品质研究[J]. 草地学报, 2019, 27(4): 913-920. |
| [41] |
韩璐璐.体外模拟环境下日粮粗蛋白水平对绵羊瘤胃发酵和养分降解的影响[D].硕士学位论文.沈阳: 沈阳农业大学, 2016.
|
| [42] |
王芳, 徐元君, 牛俊丽, 等. 体外产气法评价反刍动物饲料营养价值的研究[J]. 中国畜牧兽医, 2016, 43(1): 76-83. |
| [43] |
RODRIGUEZ R, MOTA M, CASTRILLO C, et al. In vitro rumen fermentation of the tropical grass Pennisetum purpureum and mixtures with browse legumes:effects of tannin contents[J]. Journal of Animal Physiology and Animal Nutrition, 2010, 94(6): 696-705. DOI:10.1111/j.1439-0396.2010.01001.x |
| [44] |
SOLTAN Y A, MORSY A S, SALLAM S M A, et al. Comparative in vitro evaluation of forage legumes (prosopis, acacia, atriplex, and leucaena) on ruminal fermentation and methanogenesis[J]. Journal of Animal and Feed Sciences, 2012, 21(4): 759-772. DOI:10.22358/jafs/66148/2012 |
| [45] |
余苗, 钟荣珍, 周道玮, 等. 不同生育期虎尾草的体外发酵产气特性[J]. 草业科学, 2014, 31(5): 956-964. |
| [46] |
GARCÍA-GONZÁLEZ R, GONZÁLEZ J S, LÓPEZ S. Decrease of ruminal methane production in Rusitec fermenters through the addition of plant material from Rhubarb (Rheum spp.) and Alder Buckthorn (Frangula alnus)[J]. Journal of Dairy Science, 2010, 93(8): 3755-3763. DOI:10.3168/jds.2010-3107 |
| [47] |
孙璐, 柴沙驼, 崔占鸿, 等. 不同添加水平菜籽油对放牧牦牛瘤胃发酵的影响[J]. 中国饲料, 2012(10): 18-20. |
| [48] |
石宁, 贾淼, 李艳玲. 体外产气法研究植物精油对肉羊体外瘤胃发酵参数及甲烷产量的影响[J]. 动物营养学报, 2019, 31(1): 274-284. |
| [49] |
杨凯.单宁酸对肉牛瘤胃发酵、微生物区系、甲烷排放及氮排泄的调控规律[D].博士学位论文.北京: 中国农业大学, 2017.
|
| [50] |
ZHANG C M, YI X W, YUAN Z P, et al. Effects of adding mixtures of linoleic acid and linolenic acid with different proportions on rumen fermentation and methanogenesis in vitro[J]. Journal of Animal Nutrition, 2008, 20(2): 223-227. |
| [51] |
杨舒黎.日粮添加豆油和胡麻油对奶牛瘤胃细菌及发酵参数的影响[D].博士学位论文.北京: 中国农业科学院, 2007.
|
| [52] |
薛艳锋, 郝力壮, 刘书杰, 等. 玉树州藏嵩草草地牧草营养价值评定与营养载畜量[J]. 草业科学, 2015, 32(10): 1660-1667. |
| [53] |
金恩望, 王加启, 卜登攀, 等. 利用体外产气法研究植物精油对瘤胃体外发酵和甲烷生成的影响[J]. 中国农业大学学报, 2013, 18(3): 120-127. |
| [54] |
BEAUCHEMIN K A, MCGINN S M, BENCHAAR C, et al. Crushed sunflower, flax, or canola seeds in lactating dairy cow diets:effects on methane production, rumen fermentation, and milk production[J]. Journal of Dairy Science, 2009, 92(5): 2118-2127. DOI:10.3168/jds.2008-1903 |
| [55] |
周庆安, 李云甫, 张君慧, 等. 保护性脂肪在反刍动物营养中的应用[J]. 中国油脂, 2002, 27(5): 77-79. |
| [56] |
曲永利, 苗树君. 反刍动物日粮中蛋白质和脂肪水平对粗纤维消化率的影响[J]. 黄牛杂志, 2003, 29(1): 54-57. |
| [57] |
李春华, 高艳霞, 曹玉凤, 等. 影响反刍动物瘤胃甲烷产生的因素及调控措施[J]. 黑龙江畜牧兽医, 2010(8): 33-34. |
| [58] |
张春梅.植物油及十八碳不饱和脂肪酸对瘤胃甲烷生成和微生态的影响[D].博士学位论文.杭州: 浙江大学, 2008.
|
| [59] |
林波, 纪苗苗, 梁权, 等. 肉桂油和牛至油及其主要成分对体外瘤胃发酵和甲烷产生的影响[J]. 中国兽医学报, 2011, 31(2): 279-282, 287. |
| [60] |
KIRCHGEΒNER M, WINDISCH W, MVLLER H L.Nutritional factors for the quantification of methane production[C]//ENGELHARDT W V, LEONHARD-MAREK S, BREVES G, et al.Ruminant physiology: digestion, metabolism, growth and reproduction.Proceedings of the Eighth International Symposium on Ruminant Physiology.Stuttgart: Ferdinand Enke Verlag, 1995, 3: 17-31.
|




