2. 中国农业大学食品科学与营养工程学院, 北京 100083
2. College of Food Science & Nutritional Engineering, China Agricultural University, Beijing 100083, China
我国作为养羊大国,羊只存栏量和羊肉产量居于世界首位,但是相较于其他畜牧业发达国家,养殖技术还比较落后,规模化水平不高,生产效率较低。我国绵羊平均胴体重仅有15 kg/只,远低于养羊业发达的澳大利亚和爱尔兰[1]。近些年来,随着科技的发展,在猪、禽类、鱼类养殖过程中精准营养技术越来越成熟完善,饲料转化率不断提高,猪和肉鸡的料重比可分别达到2.5~3.0和1.8~2.0[2],因此精准营养也是肉羊产业发展的必由之路。但是,在配制肉羊饲粮时,采用的往往却是国外的饲养标准,而我国肉羊产业经过长期的发展以及引进国外的优良品种,肉羊品种资源丰富,只靠国外饲养标准并不能科学高效地发挥我国现有品种的品质优势,限制了我国肉羊产业的发展。为了提高现有品种养殖经济效益,因而需要对不同品种的营养物质消化吸收特点进行探究,针对不同品种实施精准营养势在必行。宁夏地区饲养数量较多的绵羊品种有滩羊、湖羊和杜泊羊等。滩羊有着耐粗饲、抗逆性强且肉质鲜美的特点,但生产力较低[3]。湖羊是产自浙江、江苏等太湖流域的优良绵羊品种,属于皮肉兼用型品种,具有繁殖力强、适应性强等优良特性,是我国绵羊生产的主要母本[4]。杜泊羊原产南非,具有适应能力强、产肉率高的特点,已在我国引种并用作杂交生产的主要品种之一[5]。影响畜牧业生产效率的诸多因素中,遗传因素居于主导地位,不同品种绵羊对于营养物质的需求也不尽相同。绵羊机体的生长发育与自身消化吸收功能密切相关,充分了解不同品种绵羊消化生理特性可以有效发挥品质优势,提高饲料利用率,进而提高生产效率。因此,对不同品种绵羊消化性能差异的研究是实现精准营养的重要基础研究之一。小肠作为绵羊重要的消化吸收器官,其形态与功能对绵羊发挥生长潜能有着至关重要的作用,发育健全、功能完整的小肠可以驱动机体新陈代谢和生长,因此,了解不同品种绵羊小肠功能特性是实现精准营养必不可少的一步。鉴于此,本试验对不同品种绵羊羔羊小肠形态和消化酶活性的差异研究,旨在为实现肉羊精准饲养提供理论依据。
1 材料与方法 1.1 试验动物及试验设计试验于2018年8—11月在宁夏回族自治区盐池县大水坑镇滩羊保种场内进行。试验羊只均购自滩羊中心产区宁夏盐池县朔牧肉羊繁育有限公司。选择体况健康的3月龄杜泊羊[(37.90±2.82) kg]、湖羊[(19.20±2.94) kg]及滩羊[(20.67±2.39) kg]公羔各14只,单栏饲喂105 d,其中预试期15 d,正试期90 d。
1.2 试验饲粮试验饲粮参照NRC(2007)绵羊育肥标准进行配制,其组成及营养水平见表 1。
|
|
表 1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient level of the experimental diet (DM basis) |
试验开始前打扫羊舍并进行消毒,所用试验羊注射疫苗并驱虫。试验羊单栏饲喂,每天08:00和16:00各饲喂1次。颗粒料由宁夏傲农饲料科技有限公司制作,干草由苜蓿、柠条和玉米秸秆组成,比例为2 : 2 : 1,按比例混匀。先精后粗,精粗比50 : 50,分别称取颗粒料和干草进行饲喂,每日保证食槽内剩余10%的饲粮。每日晨饲前收集剩料,计算采食量。所有试验羊自由饮水。每天将试验羊放于运动场自由活动,每次不少于4 h。试验的第1、30、60、90天晨饲前对所有试验羊进行空腹称重。
1.4 样品采集饲喂期间,每月收集颗粒料以及干草样品,在试验第1~3天(试验初期)和第88~90天(试验末期)每组选取4只试验羊臀部套粪袋,收集3 d的粪便。每次将3 d的粪便混匀后取200 g左右加入适量10%稀硫酸,混匀后捏碎,在实验室烘箱内65 ℃烘干,回潮,称重,粉碎过40目筛后装入样品袋保存,留待后续测定营养物质含量。饲养试验结束后,试验羊禁食12 h,采用清真屠宰法,颈动脉放血致死后立即打开腹腔,取出内脏器官,分离小肠。立即分别从十二指肠、空肠以及回肠中取出部分食糜,装入5 mL离心管,-20 ℃保存,留待后续测定消化酶活性。按照形态将小肠分为十二指肠、空肠以及回肠,分离各段肠道后在十二指肠、空肠前端以及回肠末端剪取小肠组织各2 cm左右,生理盐水冲洗干净后置于4%多聚甲醛中保存,并在24 h后换液,留待后续制作小肠组织切片。
1.5 测定指标及方法 1.5.1 生长性能和营养物质表观消化率平均日增重、料重比、增重率的计算公式如下:

|
饲草及粪便样品送往中国农业大学肉牛中心进行常规营养成分分析,采用酸不溶灰分法计算各营养物质表观消化率,计算公式[6]如下:
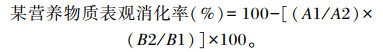
|
式中:A1为饲粮中酸不溶灰分含量(%);A2为粪便中酸不溶灰分含量(%);B1为饲粮中该营养物质含量(%);B2为粪便中该营养物质含量(%)。
1.5.2 小肠形态学指标将固定的小肠样品取出,经梯度酒精脱水后,使用二甲苯进行透明处理,再经石蜡包埋后,用切片机将组织块切成薄片,最后用苏木精-伊红(HE)染色。使用带有数码相机的显微镜将染色后的切片进行拍照保存,使用NDP.view 2软件对切片进行测量,测量指标包括绒毛高度、隐窝深度以及肌层厚度,并计算绒毛高度/隐窝深度(V/C)。
1.5.3 小肠消化酶活性取出冷冻的食糜,解冻后用冷冻离心机在4 ℃条件下12 000 r/min离心10 min,取上清后与4 ℃ 0.4 mol/L的KCl溶液按体积比1 : 4进行稀释,分装后分别测定α-淀粉酶(AMS)、脂肪酶(LPS)、胰蛋白酶和糜蛋白酶活性。采用南京建成生物工程研究所的α-淀粉酶(淀粉-碘比色法,货号C016-1-1)、脂肪酶(微板法,货号A054-2-1)、胰蛋白酶(紫外比色法,货号A080-2-2)和糜蛋白酶测定试剂盒(货号A080-3-2)对上述指标进行测定,测定方法按照产品说明书进行。
1.6 数据处理与分析数据采用SPSS 23软件进行统计分析,使用ANOVA程序进行单因素方差分析,并采用Duncan氏法进行多重比较检验。以P < 0.05为差异显著。
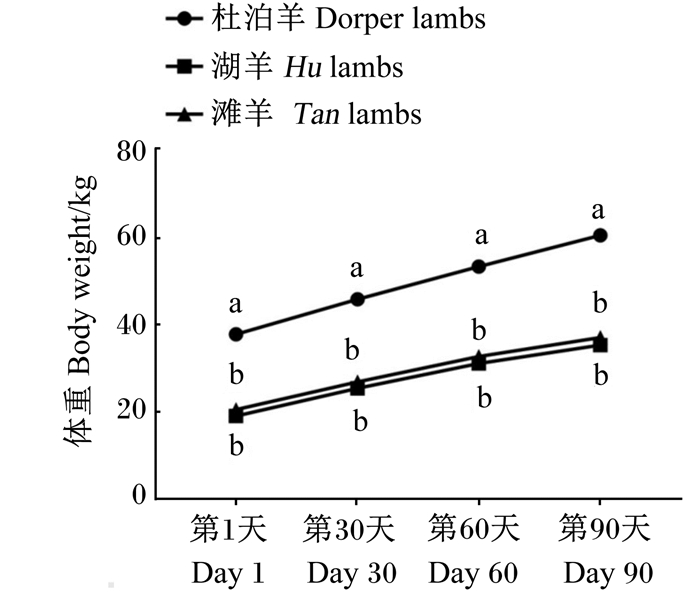
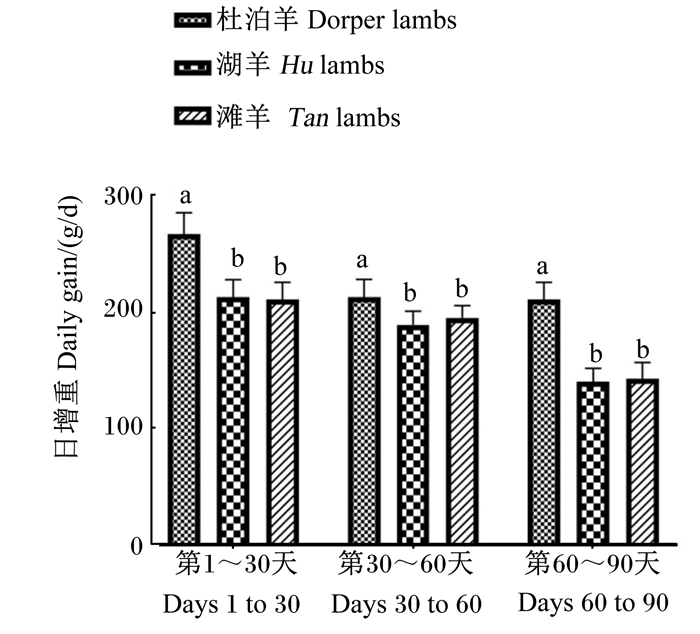
2 结果与分析 2.1 不同品种绵羊羔羊生长性能差异不同品种绵羊羔羊试验期内体重变化及不同阶段日增重分别见图 1和图 2。杜泊羊各阶段体重与日增重均显著高于湖羊和滩羊(P < 0.05)。
|
数据点或柱标注不同小写字母表示差异显著(P < 0.05)。下图同。 Value points or columns with different small letters mean significant difference (P < 0.05). The same as below. 图 1 不同品种绵羊羔羊体重变化 Fig. 1 Body weight change of different breed lambs |
|
图 2 不同品种绵羊羔羊不同阶段的日增重 Fig. 2 Daily gain of different stages of different breed lambs |
如表 2所示,杜泊羊的初始体重、干物质采食量、终末体重、平均日增重均显著高于湖羊和滩羊(P < 0.05),增重率显著低于湖羊和滩羊(P < 0.05),湖羊和滩羊之间上述指标均没有显著差异(P>0.05)。3个品种绵羊羔羊的料重比差异不显著(P>0.05)。
|
|
表 2 不同品种绵羊羔羊的生长性能 Table 2 Growth performance of different breed lambs |
由表 3可知,在试验初期,杜泊羊的干物质、中性洗涤纤维、酸性洗涤纤维表观消化率显著高于湖羊(P < 0.05),湖羊与滩羊以及杜泊羊与滩羊之间无显著差异(P>0.05);杜泊羊的粗蛋白质表观消化率显著高于湖羊和滩羊(P < 0.05);3个品种绵羊羔羊的粗脂肪表观消化率无显著差异(P>0.05)。在试验末期,3个品种绵羊羔羊的粗蛋白质、粗脂肪表观消化率与试验初期时呈相同趋势;3个品种绵羊羔羊的干物质、中性洗涤纤维、酸性洗涤纤维表观消化率无显著差异(P>0.05),但均以杜泊羊最高。
|
|
表 3 不同品种绵羊羔羊的营养物质表观消化率 Table 3 Nutrient apparent digestibility of different breed lambs |
由表 4可知,杜泊羊、湖羊十二指肠肌层厚度显著高于滩羊(P < 0.05)。杜泊羊回肠绒毛高度/隐窝深度显著高于湖羊和滩羊(P < 0.05),肌层厚度显著高于滩羊(P < 0.05)。
|
|
表 4 不同品种绵羊羔羊小肠形态学指标 Table 4 Small intestinal morphological indices of different breed lambs |
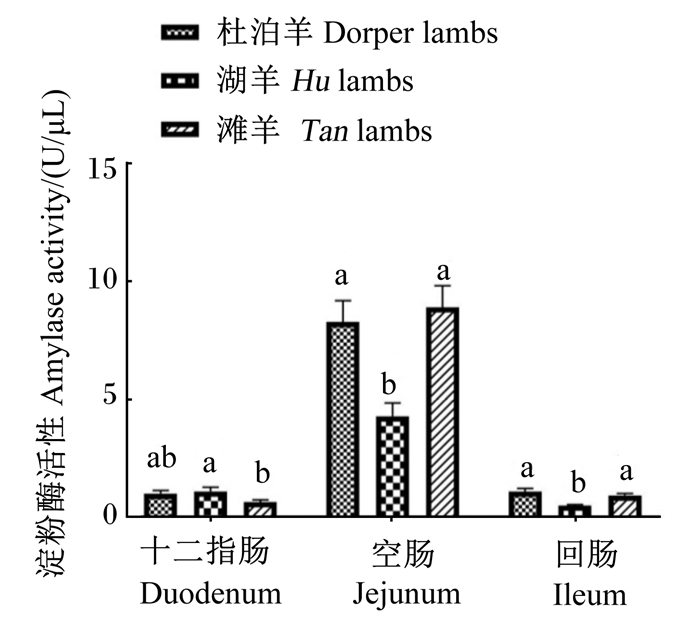
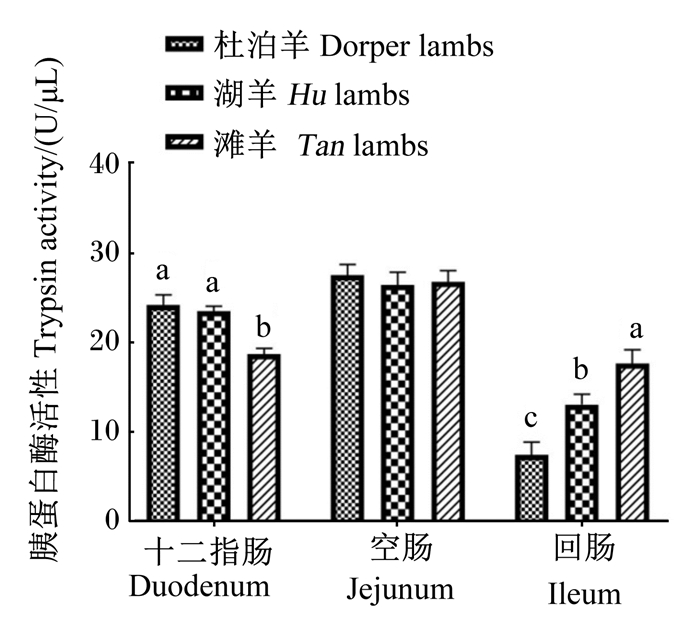
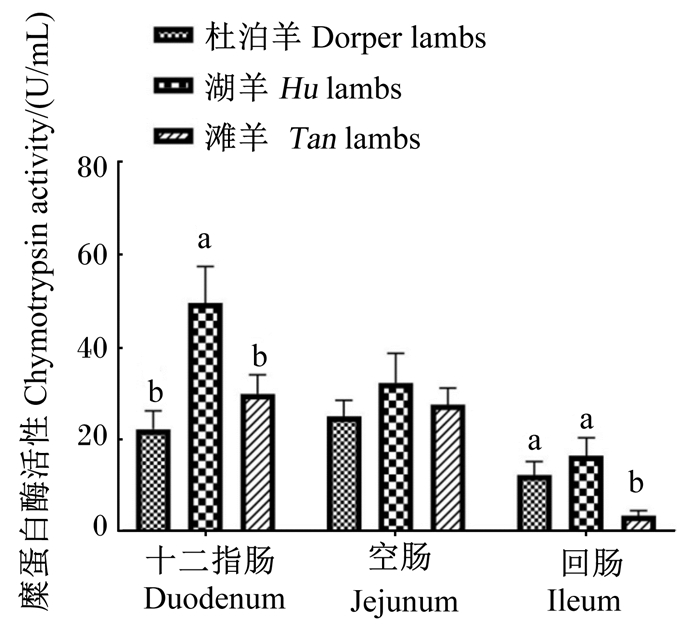
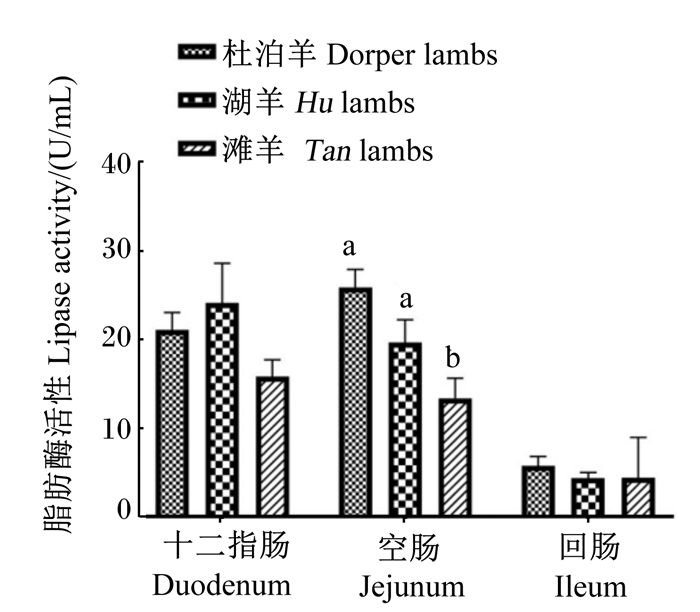
由图 3至图 6所示,在十二指肠和回肠中,3个品种绵羊羔羊淀粉酶活性无显著差异(P>0.05),滩羊空肠淀粉酶活性显著低于杜泊羊和湖羊(P < 0.05)。湖羊十二指肠脂肪酶活性显著高于滩羊(P < 0.05),杜泊羊、滩羊空肠和回肠脂肪酶活性显著高于湖羊(P < 0.05)。滩羊十二指肠胰蛋白酶活性最低,回肠胰蛋白酶活性最高,与杜泊羊和湖羊差异显著(P < 0.05),湖羊回肠胰蛋白酶活性显著高于杜泊羊(P < 0.05)。湖羊十二指肠和回肠糜蛋白酶活性显著高于滩羊(P < 0.05),杜泊羊十二指肠糜蛋白酶活性显著低于湖羊(P < 0.05),并且回肠糜蛋白酶活性显著高于滩羊(P < 0.05)。
|
图 3 不同品种绵羊羔羊小肠淀粉酶活性 Fig. 3 Amylase activity in small intestine of different breed lambs |
|
图 4 不同品种绵羊羔羊小肠脂肪酶活性 Fig. 4 Lipase activity in small intestine of different breed lambs |
|
图 5 不同品种羔羊小肠胰蛋白酶活性 Fig. 5 Trypsin activity in small intestine of different breed lambs |
|
图 6 不同品种绵羊羔羊小肠糜蛋白酶活性 Fig. 6 Chymotrypsin activity in small intestine of different breed lambs |
动物生长发育受诸多因素的调节,其中遗传因素占据主导作用,不同品种的动物生长发育情况不尽相同。在本试验中,选择了相同日龄不同品种绵羊羔羊饲喂统一饲粮,从表 2可以看出,不同品种绵羊羔羊在相同日龄的体重有显著差异,以初始体重为协变量对日增重进行回归分析,分析结果显示日增重和初始体重没有回归关系,说明初始体重对日增重的影响不显著,因此品种因素是影响日增重的主要效应。
杜泊羊在每个阶段的体重显著高于湖羊和滩羊,与之对应的是杜泊羊每个阶段的日增重也高于湖羊和滩羊,符合杜泊羊生长速度快的特点,杜泊羊能够适应多种饲养条件,在舍饲条件下表现尤为突出,可以充分发挥杜泊羊的生长潜力,因此杜泊羊终末体重、试验全期平均日增重均高于湖羊和滩羊。Burke等[7]的研究与此一致,其通过对杜泊羊、卡塔丁羊、圣克洛伊羊以及萨福克羊羔羊进行比较发现,4种羔羊有着不同的初生重以及屠宰体重,对于日增重来说,杜泊羊和萨福克羊显著高于卡塔丁羊和圣克洛伊羊。在本试验中杜泊羊的增重率显著低于湖羊和滩羊,这可能与杜泊羊初始体重较高有关,这与李晖等[8]的研究结果一致,其也证实羊增重率随初始体重的增加而降低。
绵羊的生长发育还受到动物采食量和营养物质摄入量的影响。在本试验中,杜泊羊干物质采食量显著高于湖羊和滩羊,较多的采食量可以充分满足和激发杜泊羊的生长潜力。湖羊和滩羊的干物质采食量没有显著差异可能导致了两者生长性能没有显著差异。有研究表明湖羊和滩羊均属于蒙古羊后裔,这可能是湖羊和滩羊生长性能没有显著差异的原因之一[9]。
营养物质消化率也是衡量动物生长性能的重要指标之一其受多种条件的影响。在放牧条件下,牧草细胞壁的数量以及组成,牧草细胞壁、木质素和二氧化硅均会抑制牧草的消化[10]。研究表明,如果某一品种的动物对高中性洗涤纤维水平的饲料表现出较高的中性洗涤纤维消化率,那么该种动物对其他营养成分也会具有很高的消化能力[11]。在本试验中,试验初期杜泊羊中性洗涤纤维表观消化率高于湖羊,其酸性洗涤纤维和粗蛋白质表观消化率也相应较高,试验末期虽然中性洗涤纤维表观消化率3个品种羔羊差异不显著,但杜泊羊的酸性洗涤纤维表观消化率有高于湖羊和滩羊的趋势,且其粗蛋白质表观消化率显著高于湖羊和滩羊,干物质表观消化率高于湖羊,一定程度上印证了这一观点。杜泊羊较高的营养物质表观消化率可能也是其生长性能优于湖羊和滩羊的原因之一,在Wildeus等[12]的研究中也发现有较高营养物质表观消化率的品种生长性能也较为优异。在本试验中,3个品种羔羊的干物质表观消化率低于中性洗涤纤维和粗蛋白质表观消化率,这与刘莹莹等[13]、Silva等[11]和Tilahun等[14]的研究结果一致。
3.2 不同品种绵羊羔羊小肠形态差异小肠作为营养物质主要的消化吸收器官,在反刍动物对淀粉、脂肪以及过瘤胃蛋白的消化吸收中起关键作用。十二指肠、空肠和回肠受饲粮影响的情况并不一致,相比于十二指肠和空肠,回肠形态不容易受到饲粮的干扰,这可能是由于回肠处在小肠末端,其食糜中的营养成分和非营养成分含量较少,因此饲粮对回肠形态影响较小[15]。Montagne等[16]的研究印证了这一观点,犊牛饲喂不同蛋白质来源的饲粮,十二指肠和空肠的隐窝深度比回肠更容易受到影响。这些都是饲粮干预或者生理应激造成的。在本试验中,饲喂条件一致,小肠形态发育是品种本身种质特性。杜泊羊维持较高的生长速度,除了增加采食量,还要依赖功能强大的消化吸收器官,因此,杜泊羊小肠发育状况明显较优。湖羊分布于我国江浙地区,长期以来以舍饲为主,而滩羊主要分布在我国宁夏、甘肃等西北干旱地区,在品种形成过程中主要以放牧为主。刘学良等[17]研究发现,放牧对滩羊瘤胃发育和功能有重要的积极作用,因此,滩羊瘤胃功能可能优于湖羊,即使处于舍饲条件,滩羊在瘤胃中降解的营养物质占比也较高,流入小肠的营养物质减少,这可能是导致滩羊小肠形态发育弱于湖羊的一个重要原因。在本试验中,杜泊羊、湖羊十二指肠和回肠肌层厚度高于滩羊,杜泊羊空肠肌层厚度有高于滩羊的趋势,因此可以一定程度上说明杜泊羊和湖羊小肠蠕动能力高于滩羊,这可能使小肠食糜与消化酶接触充分,食糜排出速度提高,消化能力也相应增强。杜泊羊回肠绒毛高度/隐窝深度显著高于湖羊和滩羊,一定程度上可以说明杜泊羊在小肠吸收功能上优于湖羊和滩羊。
3.3 不同品种绵羊羔羊小肠消化酶活性差异相比单胃动物,反刍动物消化生理更加复杂,营养物质首先经过瘤胃发酵,然后流入小肠进行化学性消化,在小肠中起消化作用的主要为各种消化酶。消化酶活性可以衡量反刍动物小肠发育情况以及营养物质消化能力,而消化酶活性受到诸多因素的影响。家畜小肠消化酶的分泌和活性与年龄、饲粮组成、添加剂、饲喂方式以及采食量等因素有关。在王宝山[18]的研究中,小尾寒羊小肠消化酶活性均呈现空肠>回肠>十二指肠的趋势。在张英杰等[19]的研究中,肉牛小肠中胰蛋白酶活性也呈现相同规律。消化酶的分泌和活性与反刍动物品种有关,不同品种胰腺和小肠发育及小肠内环境不同,这都对消化酶活性有影响。孙娟[20]的研究表明,在相同饲喂条件下,呼杜杂交一代小肠各消化酶活性均显著高于呼伦贝尔杂交羔羊。一般认为,在动物生长发育时起主导作用的是遗传因素,不同品种之间基因型的差异导致品种特质不同,因此消化酶活性也可能存在差异。在本试验中,饲养条件一致,小肠消化酶活性差异主要是由品种和采食量差异造成的。杜泊羊和湖羊空肠淀粉酶活性显著高于滩羊,一定程度上可以说明杜泊羊和湖羊小肠淀粉消化能力要强于滩羊;杜泊羊和滩羊空肠脂肪酶活性显著高于湖羊,一定程度上可以说明杜泊羊和滩羊小肠脂肪消化能力强于湖羊。造成此结果的主要原因可能是:一方面,杜泊羊需要脂肪来满足自身快速生长的能量需要;另一方面,滩羊属于“肥尾型”绵羊,需要多余的脂肪满足尾脂的沉积。此外,杜泊羊较高的采食量可能也是导致杜泊羊小肠淀粉酶和脂肪酶活性较高的因素之一。Kreikemeier等[21]的研究指出,高采食量可以促进胰腺重量的增加,因此胰腺分泌进入小肠中的淀粉酶增加。胰蛋白酶和糜蛋白酶活性的差异主要集中在十二指肠和回肠,且呈现不同的趋势,由于空肠是主要的消化场所,而且空肠胰蛋白酶和糜蛋白酶活性3个品种羔羊没有显著差异,因此3个品种羔羊小肠对蛋白质的消化能力基本没有差异。
4 结论① 杜泊羊各阶段体重、干物质采食量、日增重均较湖羊和滩羊高。
② 试验初期时杜泊羊干物质、中性洗涤纤维、酸性洗涤纤维、粗蛋白质表观消化率较高,试验末期时粗蛋白质表观消化率较高,杜泊羊总体的营养物质表观消化率高于湖羊和滩羊。
③ 杜泊羊十二指肠肌层厚度高于滩羊,回肠绒毛高度/隐窝深度高于湖羊和滩羊,肌层厚度高于滩羊,说明杜泊羊小肠上皮组织形态较好。
④ 杜泊羊和湖羊空肠淀粉酶活性高于滩羊,杜泊羊、滩羊空肠和回肠脂肪酶活性高于湖羊,滩羊十二指肠胰蛋白酶活性最高,回肠胰蛋白酶活性最低,湖羊十二指肠和回肠糜蛋白酶活性最高,而空肠中3个品种绵羊羔羊空肠胰蛋白酶和糜蛋白酶活性无显著差异,因此杜泊羊小肠对淀粉和脂肪的消化能力较高。
⑤ 综上所述,杜泊羊的干物质采食量、营养物质表观消化率和小肠消化酶活性较高,小肠形态较好,因此杜泊羊表现出较好的生长性能。
| [1] |
王雪娇.中国肉羊生产的经济效率研究[D].博士学位论文.北京: 中国农业大学, 2018.
|
| [2] |
姚巧粉, 吴金亮, 高新, 等. 精准营养技术在我国肉羊生产中的应用[J]. 饲料与畜牧, 2015(4): 14-17. |
| [3] |
赵金宇, 陈学娟, 张鑫荣, 等. 宁夏白滩羊与黑滩羊的种质特性及生产性能的研究[J]. 黑龙江畜牧兽医, 2010(5): 58-59. |
| [4] |
王玉琴, 田志龙, 施会彬, 等. 湖羊肌肉营养特点及肌纤维组织学特性[J]. 动物营养学报, 2017, 29(8): 2867-2874. |
| [5] |
SCHOEMAN S J. A comparative assessment of Dorper sheep in different production environments and systems[J]. Small Ruminant Research, 2000, 36(2): 137-146. DOI:10.1016/S0921-4488(99)00157-1 |
| [6] |
徐凤霞, 刘美, 李兵. AIA法测定小尾寒羊对花生秧及玉米面的消化率的研究[J]. 饲料博览, 2004(3): 33-34. |
| [7] |
BURKE J M, APPLE J K. Growth performance and carcass traits of forage-fed hair sheep wethers[J]. Small Ruminant Research, 2007, 67(2/3): 264-270. |
| [8] |
李晖, 贺宋文. 湘西地区努本杂山羊生长情况调查研究[J]. 畜牧兽医科技信息, 2010(3): 39-40. |
| [9] |
廖信军, 常洪, 孙伟, 等. 利用微卫星标记对六个羊群体性的研究[J]. 家畜生态学报, 2006, 27(2): 13-18. |
| [10] |
HUNT C W, PATERSON J A, WILLIAMS J E. Intake and digestibility of alfalfa-tall fescue combination diets fed to lambs[J]. Journal of Animal Science, 1985, 60(1): 301-306. DOI:10.2527/jas1985.601301x |
| [11] |
SILVA A M A, SOBRINHO A G S, TRINDADE I A C M, et al. Food intake and digestive efficiency in temperate wool and tropic semi-arid hair lambs fed different concentrate:forage ratio diets[J]. Small Ruminant Research, 2004, 55(1/2/3): 107-115. |
| [12] |
WILDEUS S, TURNER K E, COLLINS J R. Growth, intake, diet digestibility, and nitrogen use in three hair sheep breeds fed alfalfa hay[J]. Small Ruminant Research, 2007, 69(1/2/3): 221-227. |
| [13] |
刘莹莹, 肖兵南, 田科雄, 等. 安格斯杂交肉牛放牧采食量及营养物质消化率的测定[J]. 畜牧与饲料科学, 2008, 29(5): 7-9. |
| [14] |
TILAHUN M, KEFELEGN K, ABEBE G, et al. Feed intake, digestibility, weight gain, and slaughter characteristics influenced by genetic percentage of Boer in goats and Dorper in sheep in the central highlands of Ethiopia[J]. Tropical Animal Health and Production, 2014, 46(4): 593-602. DOI:10.1007/s11250-013-0532-y |
| [15] |
LI H Z, RAN T, HE Z X, et al. Postnatal developmental changes of the small intestinal villus height, crypt depth and hexose transporter mRNA expression in supplemental feeding and grazing goats[J]. Small Ruminant Research, 2016, 141: 106-112. DOI:10.1016/j.smallrumres.2016.07.012 |
| [16] |
MONTAGNE L, SALGADO P, TOULLEC R, et al. Enzymes of the small intestine of the calf:effect of dietary protein source on the activities of some enzymes in the small intestinal mucosa and digesta[J]. Journal of the Science of Food and Agriculture, 2002, 82(15): 1772-1779. DOI:10.1002/jsfa.1260 |
| [17] |
刘学良, 罗海玲, 陈勇, 等. 限时放牧对滩羊消化道发育的影响[J]. 中国畜牧兽医, 2013, 40(11): 97-101. |
| [18] |
王宝山.日粮类型对小尾寒羊小肠各段消化酶活性影响的研究[D].硕士学位论文.保定: 河北农业大学, 2003.
|
| [19] |
张英杰, 刘月琴, 冯仰廉. 日粮对肉牛小肠pH值及胰蛋白酶活性的影响[J]. 中国草食动物科学, 2000, 2(1): 8-9. |
| [20] |
孙娟.育肥方式对呼伦贝尔及呼杜杂交羔羊消化道组织形态及酶活的影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2014.
|
| [21] |
KREIKEMEIER K K, HARMON D L, PETERS J P, et al. Influence of dietary forage and feed intake on carbohydrase activities and small intestinal morphology of calves[J]. Journal of Animal Science, 1990, 68(9): 2916-2929. DOI:10.2527/1990.6892916x |




