瘤胃是反刍动物的主要消化器官之一,新生羔羊瘤胃不具备反刍功能,随着羔羊日龄的增加以及固体饲料的采食,瘤胃体积逐渐增大,胃壁增厚,瘤胃乳头增长,瘤胃微生物区系逐渐建立,瘤胃开始具有反刍功能。瘤胃微生物是瘤胃发酵的关键[1],其中宿主自身不能消化的植物纤维会在多种纤维分解菌的作用下发酵生成乙酸、丙酸、丁酸和甲烷等终产物;瘤胃微生物蛋白是反刍动物小肠可吸收蛋白质的主要来源。瘤胃组织的发育以及微生物群落的组成和分布极易受到外界环境的影响,其中日龄和营养水平是影响瘤胃微生物群落结构的主要因素。
适宜的饲粮蛋白质水平能够满足瘤胃的组织形态发育所需营养及瘤胃内微生物对氮的需求,进而提高营养物质的消化率[2]。当饲粮中蛋白质水平过低,瘤胃可降解蛋白质含量减少,不能满足瘤胃微生物合成所需氮源,造成羔羊瘤胃内微生物种群的数量减少,瘤胃微生物对其他营养物质的利用不充分,导致生产性能低下[3];当饲粮蛋白质水平过高,超出反刍动物动物最大氮沉积所需,大部分过量的氮排放到环境中降低了蛋白质饲料的利用率,同时造成环境污染。有研究表明,瘤胃中氨态氮浓度低于5 mg/dL会导致菌体蛋白合成不足,从而减缓了瘤胃发酵的效率,最终导致营养物质利用率下降;反之就会导致氨态氮累积,不能被及时吸收利用,从而导致能量的浪费[4]。Haddad等[5]研究发现,当饲粮蛋白质水平为16%时,羔羊的平均日增重及饲料转化率均高于饲粮蛋白质水平为10%、12%、14%时。吕凯等[6]对藏羔羊饲喂3种不同蛋白质水平饲粮后发现,随着饲粮中蛋白质水平的增加,藏羔羊瘤胃等复胃重量增加,瘤胃乳头及小肠绒毛发育得到优化。
羔羊的饲养管理是规模化养殖场提高饲养效益的关键,准确掌握羔羊对蛋白质的需求对提高养殖业效益和蛋白质资源利用率均具有重要意义[7]。因此,本试验通过研究饲粮蛋白质水平对50日龄断奶羔羊瘤胃组织形态及微生物群落结构与功能的影响,从而找出适宜青海省海东地区小尾寒羊羔羊的饲粮蛋白质水平,为提高羔羊生产效率奠定基础。
1 材料与方法 1.1 试验设计选择体重[(3.17±4.52) kg]、体况、胎次相近的青海省海东地区小尾寒羊双胎羔羊120只,采用单因素试验设计,于50日龄断奶,随机分为3组(Ⅰ、Ⅱ、Ⅲ组),每组40只。Ⅰ、Ⅱ、Ⅲ组饲粮能量水平相同,均为12.00 MJ/kg[8],饲粮蛋白质水平分别为12%、14%、16%。试验期40 d。试验饲粮组成及营养水平见表 1。
|
|
表 1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
所有试验动物从出生后7日龄开始喂饲开食料。所有羔羊在50日龄断奶后分别饲喂蛋白质水平为12%、14%、16%的试验饲粮,本研究通过调整精饲料中原料比例来调整饲粮蛋白质水平,所有羔羊每日饲喂量相同,每5 d按比例增加饲喂量(精饲料:青贮米玉:燕麦干草=7 : 2 : 1,干物质基础),其中精料每次每只羔羊增加15 g。3组羔羊50~90日龄每只每日每次饲喂量见表 2;每天饲喂2次(08:00和17:00),自由饮水。羔羊进圈舍之前对圈舍进行彻底消毒,此后,每天对羔羊圈舍进行清扫处理。对各组羔羊进行常规的免疫注射及内外寄生虫防治。
|
|
表 2 羔羊饲粮饲喂量(干物质基础) Table 2 Feeding level of lamb diet (DM basis) |
羔羊饲养至90日龄后,每组随机选择6只羔羊,早上空腹颈动脉放血屠宰后,解剖,取出瘤胃内容物用匀浆机混匀,取上层液体4层纱布过滤,将滤液装于5 mL冻存管中,液氮带回实验室-80 ℃冷冻保存,用于后期瘤胃微生物多样性的测定。
瘤胃组织用生理盐水清洗后,取瘤胃背囊、腹囊组织样品各4 cm2,放置于4%多聚甲醛中进行固定,用于组织形态学的观察。
1.3.2 样品分析方法饲粮中干物质(DM)、粗蛋白质(CP)、中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)、钙(Ca)、磷(P)、粗脂肪(EE)含量测定分别按照GB/T 6435—2006、GB/T 6432—1994、GB/T 20806—2006、ISO13906—2008、GB/T 6436—2002、GB/T 6437—2002、GB/T 6433—2006的方法。消化能计算公式[9]为:
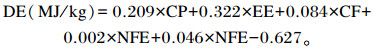
|
瘤胃组织在固定液中固定72 h,然后在不同浓度的葡萄糖溶液中脱水,包埋剂冷冻包埋,切取5~7 μm连续切片,用苏木精-伊红(HE)染色,观察乳头高度、乳头宽度、乳头密度、角质层厚度和肌层厚度。使用Olympus DP21图像采集系统采集图像,使用Image-Pro Plus 5.1图像分析系统进行测量。每个样本进行3张非连续性切片的观察,每张切片选取3个视野,每个视野中测定5组试验数据。
瘤胃液16S rDNA基因的测序工作由百迈克生物公司(北京)进行。通过Illumina HiSeq 2500平台进行微生物多样性检测,分析瘤胃微生物多样性、科水平丰度及瘤胃细菌主要功能分析。以提取的DNA为模板,利用位于V3~V4高变区两侧的引物进行了PCR扩增,通用引物序列为338F:5′-ACTCCTACGGGAGGCAGCA-3′和806R:5′-GGACTACHVGGGTWTCTAAT-3′。PCR扩增程序为:98 ℃持续2 min后进行30个循环,然后依次为98 ℃ 30 s、50 ℃ 30 s、72 ℃ 1 min,最后在72 ℃下延长7 min。
1.4 数据分析采用UCLUST德尔方法[10],对Tags在97%的相似度水平下对优质序列进行操作分类单元(operation taxonomic units,OTU)聚类分析,并过滤OTU(0.005%作为阈值),筛选出OTU的代表性序列。将OTU的代表序列与微生物参考数据库进行比对,可得到每个OTU对应的物种分类信息,进而在各水平统计各样品群落组成,利用QIIME[11]软件生成不同分类水平上的物种丰度表,再利用R语言工具绘制OTU-Venn图,同时对微生物群落进行Unifrac分析,判断不同样品遗传学上距离的远近,比较样品间的差异。
试验数据通过Excel 2013进行初步整理,应用SAS 9.0软件进行单因素方差分析(one-way ANOVA),试验数据以平均值和均值标准误(SEM)表示,P < 0.05表示差异显著。
2 结果 2.1 饲粮蛋白质水平对羔羊生长性能的影响由表 3可知,各组羔羊断奶重和90日龄体重均差异不显著(P>0.05),Ⅱ组平均日增重显著高于Ⅰ、Ⅲ组(P < 0.05)。
|
|
表 3 饲粮蛋白质水平对羔羊生长性能的影响 Table 3 Effects of dietary protein level on growth performance of lambs |
由表 4可知,各组羔羊瘤胃乳头高度差异不显著(P>0.05)。饲粮蛋白质水平对羔羊乳头宽度、乳头密度、角质层厚度、肌肉层厚度影响显著(P < 0.05)。Ⅰ组乳头宽度显著低于Ⅱ、Ⅲ组(P < 0.05);Ⅱ组乳头密度、肌层厚度均高于Ⅰ组(P < 0.05),与Ⅲ组差异不显著(P>0.05);Ⅰ组角质层厚度显著高于Ⅱ组(P < 0.05),与Ⅲ组差异不显著(P>0.05)。
|
|
表 4 饲粮蛋白质水平对羔羊瘤胃组织形态的影响 Table 4 Effects of dietary protein level on rumen morphology of lambs |
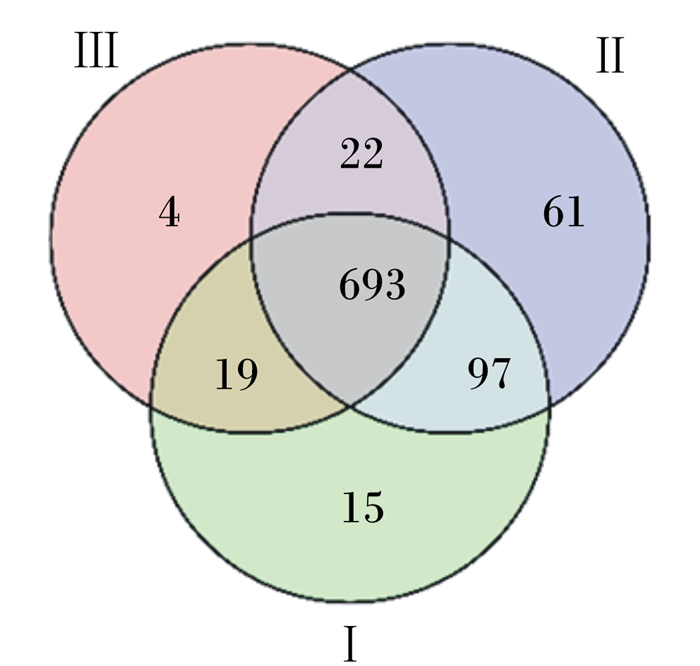
基于97%的物种相似性下所有样本中共有902个OUT,其中有659个为3组共有OTU图 1中覆盖率大于0.99,本试验测序深度能够准确反映羔羊瘤胃细菌的组成;通过显著性分析发现3组羔羊瘤胃细菌特有OTU均差异显著(P < 0.05),且Ⅱ组瘤胃微生物丰富性和多样性优于Ⅰ、Ⅲ组。
|
Ⅰ:Ⅰ组Group Ⅰ;Ⅱ:Ⅱ组Group Ⅱ;Ⅲ:Ⅲ组Group Ⅲ;下图同The same as below。 图 1 羔羊瘤胃微生物群落Venn图 Fig. 1 Venn map of rumen microbial community of lambs |
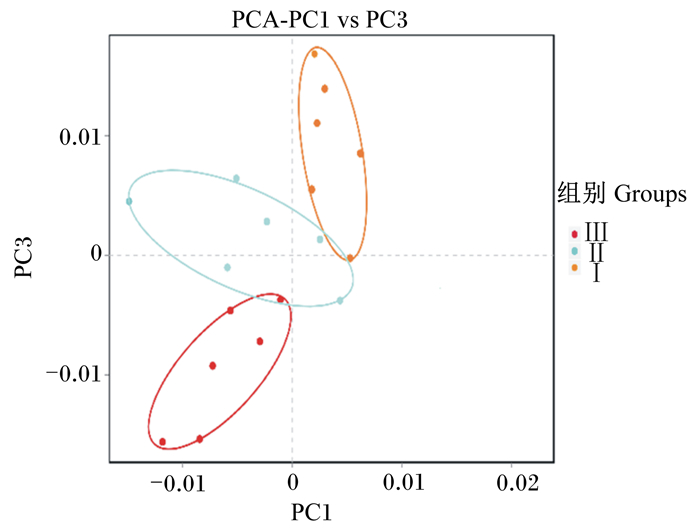
利用UniFrac加权主坐标分析对饲喂不同蛋白质水平饲粮的羔羊瘤胃微生物群落差异进行研究,主坐标分析运用方差分解,将多组数据的差异反映在二维坐标图上,2个样品间的距离越接近,则样品的组成相似性越高。由图 2可知,饲喂不同蛋白质水平饲粮的羔羊瘤胃微生物群落结构差异明显,彼此间可以很好地分隔开,采食相同饲粮羔羊的瘤胃微生物群落可以很好地聚在一起,微生物群落相似度很高。
|
图 2 UniFrac加权主坐标分析图 Fig. 2 UniFrac weighted principal coordinate analysis chart |
由表 5可知,在科水平下,瘤胃菌科(Ruminococcaceae)、毛螺菌科(Lachnospiraceae)、克里斯滕森菌科(Christensenellaceae)、韦荣氏球菌科(Veillonellaceae)的相对丰度均大于5%,为各组的优势物种。其中,Ⅲ组Ruminococcaceae的相对丰度显著高于Ⅰ、Ⅱ组(P < 0.05);Ⅲ组Lachnospiracea的相对丰度显著高于Ⅱ组(P < 0.05),与Ⅰ组差异不显著(P>0.05);Ⅱ组普雷沃氏菌科(Prevotellaceae)、拟杆菌门BS11群(Bacteroidales_BS11_gut_group)、理研菌科(Rikenellaceae)的相对丰度显著高于Ⅰ、Ⅲ组(P < 0.05)。
|
|
表 5 饲粮蛋白质水平对羔羊瘤胃微生物群落科水平相对丰度的影响 Table 5 Effects of dietary protein level on relative abundance of rumen microbial community at family level of lambs |
使用PICRUSt软件通过比对16S测序数据获得的物种组成信息,推测样本中的功能基因组成,从而分析不同样本或分组之间在功能上的差异。先需要对生成的OTU-table进行标准化,后通过每个OTU对应的GreenGene ID,获得OTU对应的KEGG和COG家族信息,从而计算该KEGG和COG的相对丰度并从KEGG数据库的信息中获得Pathway、OTU相对丰度,计算各功能类别的相对丰度。
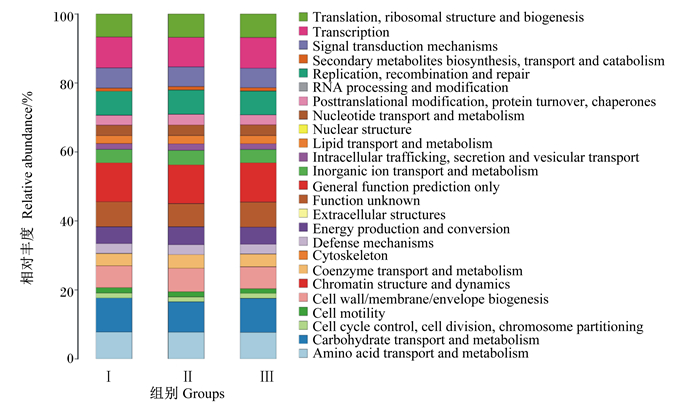
2.5.1 COG功能分析根据COG功能注释图(图 3)表明,在不同饲粮蛋白质水平影响下,羔羊瘤胃生长发育和微生物定植方面共得到25个功能基因家族,其中3组羔羊瘤胃微生物群落的功能均集中在碳水化合物运输和代谢,转录,复制、重组和修复,翻译、核糖体结构与生物发生,细胞壁/膜/包膜生物发生。碳水化合物运输和代谢占比8%以上,在3组中均最高;其次为转录和氨基酸运输与代谢,占比达到7%以上。
|
Translation, ribosomal structure and biogenesis:翻译、核糖体结构与生物发生;Transcription:转录;Signal transduction mechanisms:信号转导机制;Secondary metabolites biosynthesis, transport and catabolism:次生代谢产物的生物合成、运输和分解代谢;Replication, recombination and repair:复制、重组和修复;RNA processing and modification:RNA加工与修饰;Posttranslational modification, protein turnover, chaperones:翻译后修饰、蛋白质转换、伴侣;Nucleotide transport and metabolism:核苷酸转运与代谢;Nuclear structure:核结构;Lipid transport and metabolism:脂质转运与代谢;Intracellular trafficking, secretion and vesicular transport:细胞内运输、分泌和囊泡转运;Inorganic ion transport and metabolism:无机离子转运与代谢;General function prediction only:仅一般功能预测;Function unknown:功能未知;Extracellular structures:细胞外结构;Energy production and conversion:能源生产和转换;Defense mechanisms:防御机制;Cytoskeleton:细胞骨架;Coenzyme transport and metabolism:辅酶转运与代谢;Chromatin structure and dynamics:染色质结构与动力学;Cell wall/membrane/envelope biogenesis:细胞壁/膜/包膜生物发生;Cell motility:细胞运动;Cell cycle control, cell division, chromosome partitioning:细胞周期控制、细胞分裂、染色体分裂;Carbohydrate transport and metabolism:碳水化合物运输和代谢;Amino acid transport and metabolism:氨基酸运输与代谢。 图 3 COG功能注释图 Fig. 3 Picture of COG function annotation |
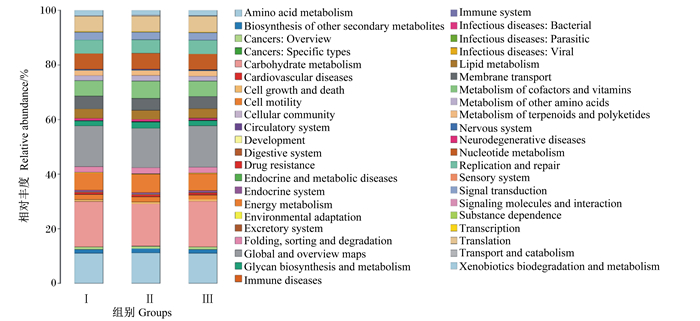
跟据KEGG功能注释图(图 4)表明,3组羔羊瘤胃微生物群落共有43个基因功能家族,占比在前5的瘤胃微生物群落的功能,3组均集中在碳水化合物代谢、氨基酸代谢、能量代谢、辅酶和维生素的代谢、核苷酸代谢,其中碳水化合物代谢占比达到15%以上,氨基酸代谢占比达到11%以上,与COG功能注释的结果一致,瘤胃中与纤维消化有关基因的数量最多。
|
Amino acid metabolism:氨基酸代谢;Biosynthesis of other secondary metabolites:其他次生代谢产物的生物合成;Cancers: Overview:癌症:概述;Cancers: Specific types:癌症:特定类型;Carbohydrate metabolism:碳水化合物代谢;Cardiovascular diseases:心血管疾病;Cell growth and death:细胞生长与死亡;Cell motility:细胞运动;Cellular community:细胞群落;Circulatory system:循环系统;Development:发展;Digestive system:消化系统;Drug resistance:耐药性;Endocrine and metabolic diseases:内分泌代谢疾病;Endocrine system:内分泌系统;Energy metabolism:能量代谢;Environmental adaptation:环境适应;Excretory system:排泄系统;Folding, sorting and degradation:折叠、分类和降解;Global and overview maps:全球和概览地图;Glycan biosynthesis and metabolism:聚糖生物合成与代谢;Immune diseases:免疫性疾病;Immune system:免疫系统;Infectious diseases: Bacterial:传染病:细菌性;Infectious diseases: Parasitic:传染病:寄生虫病;Infectious diseases: Viral:传染病:病毒性;Lipid metabolism:脂质代谢;Membrane transport:膜传输;Metabolism of cofactors and vitamins:辅酶和维生素的代谢;Metabolism of other amino acids:其他氨基酸代谢;Metabolism of terpenoids and polyketides:萜类化合物和聚酮类化合物的代谢;Nervous system:神经系统;Neurodegenerative diseases:神经变性疾病;Nucleotide metabolism:核苷酸代谢;Replication and repair:复制和修复;Sensory system:感觉系统;Signal transduction:信号转导;Signaling molecules and interaction:信号分子与相互作用;Substance dependence:物质依赖性;Transcription:转录;Translation:翻译;Transport and catabolism:运输和分解代谢;Xenobiotics biodegradation and metabolism:外源生物降解与代谢。 图 4 KEGG功能注释图 Fig. 4 Picture of KEGG function annotation |
瘤胃作为反刍动物特有的消化器官,对瘤胃组织形态的研究能直观地了解饲粮营养水平对瘤胃的影响。本试验结果表明,饲粮蛋白质水平14%组的瘤胃乳头宽度、乳头密度均显著高于饲粮蛋白质水平12%、16%组。角质化的瘤胃乳头能增加瘤胃上皮与内容物接触面积,增加瘤胃上皮对营养物质的吸收[12-14]。She等[15]研究表明,在饲喂高能高蛋白质的饲粮条件下,山羊瘤胃乳头高度、乳头宽度发育更加完善。在本研究中,饲粮蛋白质水平12%组的羔羊瘤胃乳头宽度、乳头密度均低于饲粮蛋白质水平14%、16%组,与饲粮蛋白质水平过低难以促进羔羊瘤胃乳头更好的发育有关。反刍动物瘤胃运动的主要动力由瘤胃肌层提供,肌层厚度增加能支撑瘤胃容纳更多的食糜,此外胃壁肌层提供的强大动力能够使得瘤胃食糜与微生物充分混匀[16]。本研究结果显示,饲粮蛋白质水平14%组的羔羊瘤胃肌层发育优于其他2组。瘤胃内食糜与瘤胃上皮角质层间不断摩擦,使得角质层细胞脱落,维持适宜的角质层数。乳头表面角质层具有屏障作用[17],瘤胃上皮角质层过厚,则会降低瘤胃对营养物质的吸收能力[18]。本试验结果显示,饲粮蛋白质水平14%组的羔羊瘤胃角质层厚度低于其他2组,且平均日增重最大。因此,在饲粮蛋白质水平为14%时,能较好地促进羔羊瘤胃上皮发育,增加瘤胃对营养物质的吸收。
3.2 饲粮蛋白质水平对羔羊瘤胃微生物群落结构及功能的影响当饲粮蛋白质进入瘤胃后,饲粮中的蛋白质主要依靠瘤胃中多种与蛋白质降解相关的微生物共同参与下经过溶解、水解和吸收、发酵和合成等过程最终合成微生物蛋白[19]。降解过程中发挥主要作用的细菌,其降解能力是原虫的6~10倍[20-21]。在目前已知的与蛋白质降解有关的瘤胃微生物中,降解活性最高的细菌有普雷沃氏菌、牛链球菌、瘤胃嗜淀粉菌、反刍兽新月形单胞菌等[22]。其中,普雷沃氏菌是瘤胃中数量最多的蛋白质降解菌,在瘤胃中主要参与蛋白质的降解以及肽的吸收和发酵过程[23]。在本研究中,科水平下羔羊瘤胃中Ruminococcaceae、Lachnospiraceae、Christensenellaceae、Veillonellaceae为优势物种,其中Ruminococcaceae可以产生短链脂肪酸与反刍动物纤维素等多糖的消化相关;Lachnospiraceae和Christensenellaceae均可分解纤维,Veillonellaceae与硫代谢、半胱氨酸和蛋氨酸代谢呈正相关。有研究显示,Lachnospiraceae、Veillonellaceae都与氨基酸、辅酶、能量和维生素的代谢、糖苷键代谢以次级代谢产物呈正相关[24]。当饲粮中蛋白质水平增加,羔羊瘤胃中纤维降解菌数量和种类也随之增加。在本研究中,饲粮蛋白质水平16%组Ruminococcaceae的相对丰度显著高于饲粮蛋白质水平12%、14%组,Lachnospiracea的相对丰度在3组最高;而与饲粮蛋白质的降解有关的Prevotellaceae的相对丰度稍低,饲粮蛋白质水平14%组显著高于其他2组。这说明蛋白质水平为14%时瘤胃对蛋白质降解能力最强;当蛋白质水平增加到16%时,瘤胃内能降解饲粮纤维素的细菌数量增加,但与蛋白质水平为14%时差异不显著。郭凯等[25]研究发现,60日羔羊在高蛋白质水平下有关纤维降解菌的的含量比低蛋白质水平组高,与本研究结果相似。
瘤胃中微生物与宿主、微生物与微生物之间均保持着相互依赖、相互制约的关系。瘤胃为微生物提供稳定的生长环境,进入瘤胃的饲粮为微生物的生长提供各种养分;微生物又可为反刍动物提供蛋白质来源和能量[26]。通过研究瘤胃代谢与微生物群落之间的相互关系,可以为饲料资源的合理利用提供科学依据。本研究在不同饲粮蛋白质水平影响下羔羊瘤胃细菌COG功能注释结果表明,在羔羊生长发育和瘤胃微生物定植方面,微生物群落的功能差异不显著,预测功能主要集中在碳水化合物、转录和氨基酸运输与代谢功能,说明瘤胃内关于木质纤维素降解酶相关基因较多。这与在印度水牛[27]上的报道相似。KEGG基因功能预测的结果表明,占比最高的功能为碳水化合物的代谢,其次为氨基酸代谢,与COG数据库所预测的碳水化合物、转录和氨基酸运输与代谢功能一致。
4 结论① 饲粮蛋白质水平为14%时,羔羊平均日增重最大,瘤胃乳头宽度、乳头高度、乳头密度及肌层发育较好。
② 通过高通量测序发现,在科水平下,Ruminococcaceae、Lachnospiraceae、Christensenellaceae、Veillonellaceae为各组的优势物种;随着饲粮蛋白质水平的提高,羔羊瘤胃内有关纤维降解菌的相对丰度均较高,说明高蛋白质水平饲粮有利于纤维降解菌的增殖;饲粮蛋白质水平为14%时,瘤胃对蛋白质降解能力最强。
③ 通过COG和KEGG功能分析发现,羔羊瘤胃微生物群落基因功能均集中在碳水化合物代谢,说明3组羔羊瘤胃内关于木质纤维素降解酶相关基因较多。
| [1] |
柴建民.断母乳日龄对羔羊生长性能与胃肠道发育的影响[D].硕士学位论文.北京: 中国农业科学院, 2015.
|
| [2] |
NEMATI M, AMANLOU H, KHORVASH M, et al. Rumen fermentation, blood metabolites, and growth performance of calves during transition from liquid to solid feed:effects of dietary level and particle size of al-falfa hay[J]. Journal of Dairy Science, 2015, 98(10): 7131-7141. DOI:10.3168/jds.2014-9144 |
| [3] |
周小乔.粗饲料来源和能量供应对奶牛乳蛋白合成调控的影响[D].博士学位论文.哈尔滨: 东北农业大学, 2015.
|
| [4] |
王芳, 徐元君, 牛俊丽, 等. 体外产气法评价反刍动物饲料营养价值的研究[J]. 中国畜牧兽医, 2016, 43(1): 76-83. |
| [5] |
HADDAD S G, NASR R E, MUWALLA M M. Optimum dietary crude protein level for finishing Awassi lambs[J]. Small Ruminant Research, 2001, 39(1): 41-46. DOI:10.1016/S0921-4488(00)00172-3 |
| [6] |
吕凯, 侯生珍, 王志有, 等. 蛋白质水平对早期断奶藏羔羊复胃发育的影响[J]. 黑龙江畜牧兽医, 2013(19): 54-56. |
| [7] |
张乃锋, 屠焰, 刁其玉. 幼龄反刍动物健康培育体系构建及其科学问题[J]. 科学通报, 2017, 62(26): 2999-3007. |
| [8] |
侯生珍, 吕凯, 王志有, 等. 蛋白质水平及Lys/Met对早期断奶藏羔羊应激和免疫的影响[J]. 中国畜牧杂志, 2013, 49(15): 65-69. |
| [9] |
佚名. 中国饲料成分及营养价值表(2019年第30版)[J]. 中国饲料, 2019(22): 111-116. |
| [10] |
EDGAR R C. Search and clustering orders of magnitude faster than BLAST[J]. Bioinformatics, 2010, 26(19): 2460-2461. DOI:10.1093/bioinformatics/btq461 |
| [11] |
CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al. QⅡME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
| [12] |
LESMEISTER K E, TOZER P R, HEINRICHS A J. Development and analysis of a rumen tissue sampling procedure[J]. Journal of Dairy Science, 2004, 87(5): 1336-1344. DOI:10.3168/jds.S0022-0302(04)73283-X |
| [13] |
杨春涛, 刁其玉, 司丙文, 等. 挥发性脂肪酸在反刍动物瘤胃上皮吸收转运及调节作用[J]. 中国畜牧杂志, 2015, 51(7): 78-83. |
| [14] |
汪晓娟, 刘婷, 李发弟, 等. 开食料补饲日龄对羔羊瘤胃和小肠组织形态的影响[J]. 草业学报, 2016, 25(4): 172-178. |
| [15] |
SHE N Z, SEYFERT H M, LÖHRKE B, et al. An energy-rich diet causes rumen papillae proliferation associated with more IGF type 1 receptors and increased plasma IGF-1 concentrations in young goats[J]. The Journal of Nutrition, 2004, 134(1): 11-17. DOI:10.1093/jn/134.1.11 |
| [16] |
于洋, 格日乐玛, 闫素梅, 等. 放牧与舍饲育肥对绒山羊胃肠道组织形态的影响[J]. 动物营养学报, 2020, 32(2): 775-783. |
| [17] |
LIU J H, XU T T, LIU Y J, et al. A high-grain diet causes massive disruption of ruminal epithelial tight junctions in goats[J]. American Journal of Physiology Regulatory, Integrative and Comparative Physiology, 2013, 305(3): R232-R241. DOI:10.1152/ajpregu.00068.2013 |
| [18] |
解彪.不同NDF水平饲粮对羔羊生长性能和瘤胃发育的影响[D].硕士学位论文.晋中: 山西农业大学, 2018.
|
| [19] |
李靖.枯草芽孢杆菌对荷斯坦育成牛生长性能和瘤胃微生物区系的影响[D].硕士学位论文.泰安: 山东农业大学, 2019.
|
| [20] |
张兴夫, 杜瑞平, 高民. 奶牛对饲粮中蛋白质的摄取利用特点及影响因素[J]. 中国畜牧杂志, 2014, 50(18): 42-47. |
| [21] |
王丹丹.奶牛饲粮与瘤胃纤维和蛋白降解菌多样性的关系[D].硕士学位论文.兰州: 甘肃农业大学, 2013.
|
| [22] |
WU S G, WANG G T, ANGERT E R, et al. Composition, diversity, and origin of the bacterial community in grass carp intestine[J]. PLoS One, 2012, 7(2): e30440. DOI:10.1371/journal.pone.0030440 |
| [23] |
柏妍, 郎侠, 王彩莲, 等. 饲粮中添加牛至精油和莫能菌素对荷斯坦犊牛血清生化指标、消化酶活性及瘤胃微生物区系的影响[J]. 畜牧兽医学报, 2019, 50(12): 2458-2469. |
| [24] |
张莉.饲粮纤维对仔猪肠道屏障功能的影响及调控机制的研究[D].博士学位论文.北京: 中国农业科学院, 2018.
|
| [25] |
郭凯, 唐梦琪, 霍倩倩, 等. 不同蛋白质水平饲粮对犊牛瘤胃微生物区系多样性及组成的影响[J]. 家畜生态学报, 2019, 40(11): 22-28. |
| [26] |
吴琼, 王思珍, 张适, 等. 基于16S rRNA高通量测序技术分析草原红牛瘤胃微生物多样性和功能预测的研究[J]. 畜牧与兽医, 2020, 52(1): 62-67. |
| [27] |
SINGH K M, REDDY B, PATEL D, et al. High potential source for biomass degradation enzyme discovery and environmental aspects revealed through metagenomics of Indian buffalo rumen[J]. Biomed Research International, 2014, 2014: 267189. |




