2. 中国水产科学研究院黄海水产研究所, 青岛 266071;
3. 青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室, 青岛 266071
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China
异亮氨酸是支链氨基酸的一种,是鱼类的10种必需氨基酸之一,因其侧链的疏水特性通常位于多种蛋白质的疏水中心,是多种蛋白质结构和功能的基础[1]。异亮氨酸参与机体的多个代谢途径,为鱼类生长和代谢所必需,用于组织修复和生长、维持机体氮平衡等。一些研究表示,异亮氨酸可以提高鱼类的生长性能[2-4]、非特异性免疫[5-7]、抗氧化能力[3, 7]、保持鳃的完整性[8]等。通过生长试验,花鲈[9]、吉富罗非鱼[10]、草鱼[11]、印度鲤[12-13]、斑点叉尾
红鳍东方鲀(Takifugu rubripes),俗称河鲀、廷巴,为近海底层食肉性鱼类,主要分布于北太平洋西部的日本、朝鲜半岛和中国沿海[15],本团队已在过去的研究中确定红鳍东方鲀的赖氨酸、蛋氨酸及精氨酸的需求量[16],但其对异亮氨酸的需求量还未见报道。本试验的目的是研究异亮氨酸对红鳍东方鲀生长性能、蛋白质利用及血清和肌肉游离氨基酸含量的影响,并探讨其对异亮氨酸的需求量,从而丰富红鳍东方鲀营养需求数据库,为配制营养均衡的高效红鳍东方鲀饲料提供依据。
1 材料与方法 1.1 试验设计及饲料以鱼粉、花生粕、菜籽粕为主要蛋白质源,鱼油、豆油为脂肪源,小麦粉为糖源,补充晶体氨基酸配制成基础饲料,分别在基础饲料中添加0、0.3%、0.6%、0.9%、1.2%、1.5%的晶体异亮氨酸(实测饲料异亮氨酸水平分别为1.23%、1.47%、1.61%、1.98%、2.17%、2.31%),以甘氨酸、谷氨酸、天冬氨酸作为其等氮替代物配制出6种等氮等脂饲料,其余氨基酸含量以张庆功[16]报道的红鳍东方鲀赖氨酸、蛋氨酸和精氨酸需求量和高露姣等[17]报道的用鲜杂鱼喂养的红鳍东方鲀肌肉氨基酸含量为参考,配制除异亮氨酸外的氨基酸混合物,使除异亮氨酸外的必需氨基酸含量满足红鳍东方鲀的需求量。试验饲料组成及营养水平见表 1。
|
|
表 1 试验饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets(DM basis) |
所有原料在制作饲料之前,先经粉碎机粉碎到80目,然后按照配方混合均匀,加水搅匀后通过实验室小型颗粒机制成直径为1.5~2.0 mm,长度为3~4 mm的颗粒饲料,置于55 ℃的烘箱烘干,于-20 ℃冰箱保存备用。
1.2 养殖试验及饲养管理试验鱼选用当年人工繁育的同一批红鳍东方鲀鱼苗,养殖试验在唐山海都水产食品有限公司室内水泥池(6.2 m×6.2 m×1.8 m)的架构网箱(1.2 m×1.2 m×1.4 m)中进行,每个水泥池内安装9个网箱,水泥池的水体为69 m3,网箱的有效养殖水体为2 m3。养殖试验开始前,为防止红鳍东方鲀幼鱼的残食,提高养殖的成活率,预先对红鳍东方鲀进行剪牙,然后用商业饲料进行为期2周的暂养,使其适应颗粒饲料和养殖环境。在试验开始时,先饥饿24 h,随后挑选体格健壮、规格相近的红鳍东方鲀幼鱼[平均体重(29.00±0.01) g],称重后放入18个网箱中,每个网箱放养35尾,总共设置6个组,每个组3个网箱(重复)。试验过程中,每天在08:00和16:00饱食投喂2次,养殖周期为10周。养殖期间为保持水的清洁,室内水泥池每天换水1次,溶氧浓度>6 mg/L,水温为(20±2) ℃,盐度为28‰~30‰,pH为7.5~8.0。
1.3 样品收集与分析试验开始前随机抽取5尾鱼作为初始鱼,用于常规营养成分分析。养殖试验结束后,饥饿试验鱼24 h,对每组鱼进行计数、称重,然后再放回对应的网箱中,每个网箱随机取4尾鱼置于-20 ℃冰箱中保存,用于测量鱼体组成和形体指标。随后,再次用每个网箱对应的试验饲料进行饱食投喂,投喂结束后6 h取样,每组随机取6尾鱼,尾静脉取血,冰盒中静置4~6 h,随后3 000 r/min离心10 min获得其血清,液氮速冻后,于-80 ℃冰箱中保存,用于测定血清游离氨基酸含量。取血后的鱼在背部相同位置取肌肉,液氮速冻后,保存于-20 ℃冰箱中,用于测定肌肉游离氨基酸含量。
饲料及鱼体组成的粗脂肪、粗蛋白质、水分、灰分含量的测定均参照AOAC(2005)的方法进行,水分含量用105 ℃烘干法测定;粗脂肪含量使用索氏抽提法测定(Foss Tecator, Hoganas,瑞典);粗蛋白质含量使用凯氏定氮仪(VELP, UDK142 automatic distillation unit, VELP,意大利)测定;饲料全氨基酸含量测定前先采用6 mol/L的HCl在110 ℃下水解22~24 h,然后用氨基酸分析仪(Hitachi L-8900 automatic amino acid analyzer,Hitachi,日本)测定,试验饲料氨基酸组成见表 2;肌肉和血清游离氨基酸含量测定前先采用6%的三氯乙酸处理,然后用氨基酸分析仪测定。
|
|
表 2 试验饲料氨基酸组成(干物质基础) Table 2 Amino acid composition of experiment diets (DM basis) |

|
试验数据以平均值±标准误(mean±SE)表示,使用SPSS 16.0进行单因素方差分析(one-way ANOVA),当差异达到显著性水平(P < 0.05),则采用Duncan氏法进行多重比较。
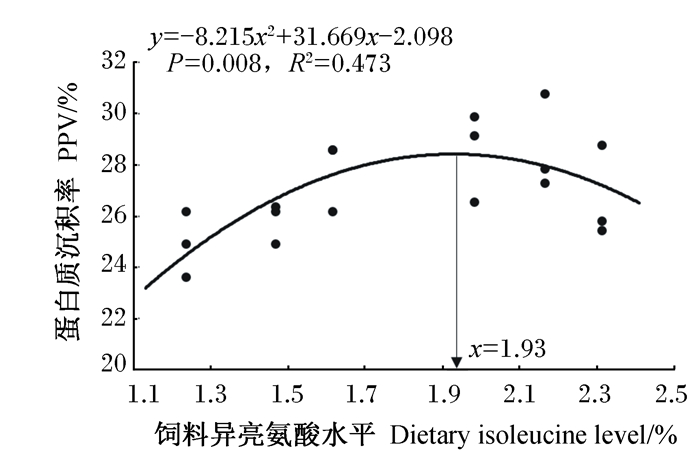
2 结果 2.1 饲料中异亮氨酸水平对红鳍东方鲀生长性能和饲料利用的影响由表 3可知,经过10周的养殖试验,红鳍东方鲀的存活率均在92%以上,且各组之间无显著差异(P>0.05)。饲料中不同水平异亮氨酸对红鳍东方鲀的末重、成活率、增重率、特定生长率、饲料效率均无显著影响(P>0.05)。但蛋白质效率在1.47%和1.61%组显著低于2.31%组(P < 0.05),与1.23%、1.98%、2.17%组之间无显著差异(P>0.05)。饲料中不同水平异亮氨酸显著影响红鳍东方鲀的蛋白质沉积率(P < 0.05),且随着饲料异亮氨酸水平的升高,蛋白质沉积率呈现先上升后下降的趋势,且在1.98%及2.17%组较高,显著高于1.23%组(P < 0.05)。将所得的蛋白质沉积率与饲料异亮氨酸水平进行二次回归分析,发现当饲料中异亮氨酸水平为1.93%时,红鳍东方鲀幼鱼的蛋白质沉积率最高(图 1)。
|
|
表 3 饲料中异亮氨酸水平对红鳍东方鲀生长性能和饲料利用的影响 Table 3 Effects of dietary isoleucine levels on growth performance and feed utilization of Takifugu rubripes |
|
图 1 饲料异亮氨酸水平与蛋白质沉积率之间的关系 Fig. 1 Relationship between dietary isoleucine level and PPV |
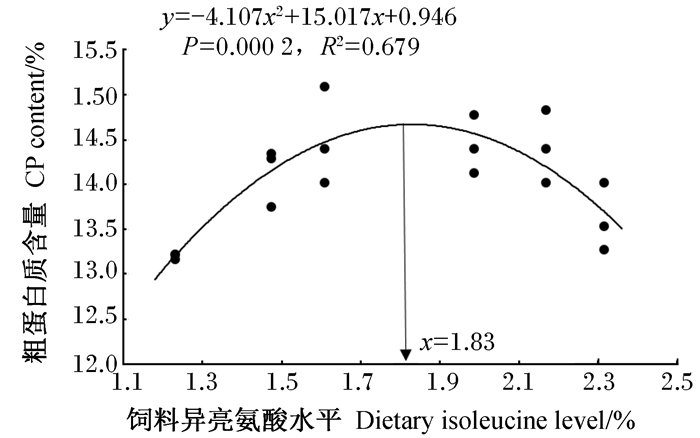
由表 4可知,鱼体组成中,水分含量在1.23%和2.31%组显著高于1.61%、1.98%和2.17%组(P < 0.05)。饲料中不同水平异亮氨酸不仅显著影响鱼体粗蛋白质含量,且粗蛋白质含量随着饲料异亮氨酸水平的增加,呈现先升高后降低的趋势,在1.61%、1.98%及2.17%组较高,显著高于1.23%组(P < 0.05)。经回归分析发现,饲料异亮氨酸水平与鱼体粗蛋白质含量呈二次曲线相关关系,以其为评价指标,得出红鳍东方鲀的异亮氨酸需求量为1.83%(图 2)。鱼体粗脂肪含量在1.98%组最高,显著高于1.47%和2.31%组(P < 0.05),但与1.23%、1.61%和2.17%组之间无显著差异(P>0.05)。此外,饲料中不同水平的异亮氨酸对红鳍东方鲀幼鱼的肥满度、脏体比、肝体比3个形体指标均无显著影响(P>0.05)。
|
|
表 4 饲料中异亮氨酸水平对红鳍东方鲀体组成和形体指标的影响 Table 4 Effects of dietary isoleucine levels on body composition and physical indicators of Takifugu rubripes |
|
图 2 饲料异亮氨酸水平与鱼体粗蛋白质含量之间的关系 Fig. 2 Relationship between dietary isoleucine level and crude protein content of fish body |
由表 5可知,血清异亮氨酸含量在1.47%组最高,显著高于1.23%和1.61%组(P < 0.05),与1.98%、2.17%和2.31%组之间无显著差异(P>0.05)。尽管血清异亮氨酸含量与饲料异亮氨酸水平均存在先升高后趋于平缓的趋势,但是对血清异亮氨酸含量与饲料异亮氨酸水平进行非线性或二次曲线分析,均未发现显著的相关关系(P>0.05)。除血清异亮氨酸含量外,饲料不同水平的异亮氨酸显著影响血清必需氨基酸中的缬氨酸、蛋氨酸、亮氨酸、苯丙氨酸、赖氨酸和精氨酸及血清非必需氨基酸牛磺酸、丝氨酸、谷氨酸、丙氨酸、胱氨酸和酪氨酸含量(P < 0.05),且这些血清产生差异的氨基酸大部分都在1.47%组含量显著升高。
|
|
表 5 饲料中异亮氨酸水平对红鳍东方鲀血清游离氨基酸含量的影响 Table 5 Effects of dietary isoleucine levels on serum free amino acid contents of Takifugu rubripes |
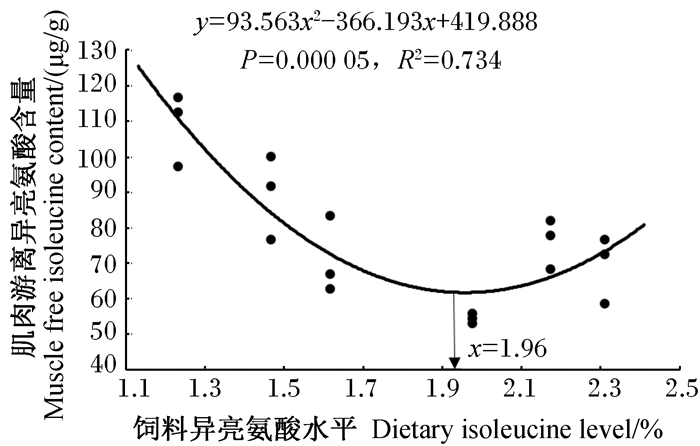
由表 6可知,肌肉异亮氨酸含量随着饲料异亮氨酸水平的增加呈现先降低后升高的二次曲线变化趋势,且以其为评价指标,得到红鳍东方鲀的异亮氨酸需求量为1.93%(图 3)。除肌肉异亮氨酸含量外,饲料不同水平异亮氨酸还显著影响肌肉必需氨基酸缬氨酸、蛋氨酸、亮氨酸、精氨酸和组氨酸及肌肉非必需氨基酸天冬氨酸、丝氨酸、甘氨酸、酪氨酸和脯氨酸含量(P < 0.05),且这些产生差异的肌肉氨基酸中大部分在1.23%组显著升高(P < 0.05)。
|
|
表 6 饲料中异亮氨酸水平对红鳍东方鲀肌肉游离氨基酸含量的影响 Table 6 Effects of dietary isoleucine levels on muscle free amino acid contents of Takifugu rubripes |
|
图 3 饲料异亮氨酸水平与肌肉游离异亮氨酸含量之间的关系 Fig. 3 Relationship between dietary isoleucine level and muscle free isoleucine content |
利用生长结果评价氨基酸需求量,是研究大部分鱼类必需氨基酸需求量的最常用方法[1, 18],除此之外,利用鱼类已知的某一必需氨基酸需求量,结合鱼体的必需氨基酸组成,推测其余必需氨基酸需求量,也是快速获取某种鱼类氨基酸需求量的重要方法[19]。基于后一种方法,在研究红鳍东方鲀饲料异亮氨酸需求量时,根据本团队之前对红鳍东方鲀赖氨酸和蛋氨酸需求量的研究[16],以及红鳍东方鲀肌肉氨基酸含量[17],确定饲料配方中除异亮氨酸外的其余晶体氨基酸混合物的添加水平,该配方已证明具有良好的营养和适口性,保证红鳍东方鲀最大生长潜能[16],同时饲料异亮氨酸水平的设计,也参考该方法预测的异亮氨酸需求量,具体设计6个异亮氨酸梯度的饲料,经实测异亮氨酸的水平分别为1.23%、1.47%、1.61%、1.98%、2.17%和2.31%。
生长性能结果是评价氨基酸需求量的最常用的指标[1],但本试验发现,随着饲料中异亮氨酸水平的增加,红鳍东方鲀幼鱼的特定生长率及饲料效率没有显著变化,通过对本试验蛋白质沉积率数据进行二次多项式回归分析,得到红鳍东方鲀异亮氨酸需求量为1.93%,对红鳍东方鲀鱼体粗蛋白质含量进行二次多项式回归分析,得到红鳍东方鲀异亮氨酸需求量为1.83%。本试验得到的异亮氨酸需求量与鲈鱼对异亮氨酸的需要量(1.94%)接近[20],高于大黄鱼(1.59%~1.71%)[20]、印度鲤鱼(Catla catla)(1.43%~1.47%)[21]、吉富罗非鱼(1.43%~1.47%)[10]、美国红鱼(1.11%)[22]及团头鲂(1.38%~1.40%)[3]的需求量,但低于Khan等[2]报道的印度野鲮(3.80%~3.98%)对异亮氨酸的需求量[2]。一些研究者认为,增重并不是蛋白质沉积的唯一结果,还可以由脂肪沉积引起,他们认为评价鱼类氨基酸需要量最精确和最灵敏的参数应该是氮保持率和蛋白质沉积率[23-24]。此外,这2个指标还考虑到不同试验在饲料投喂和蛋白质摄入的差异[25]。Ogino[26]在氮积累基础上,用氨基酸在鱼体内的沉积量来估计鲤鱼和虹鳟的氨基酸需要量取得了比较满意的结果。Ng等[27]也应用此方法估算了高首鲟(Acipenser transmontanus,Richardson)的苏氨酸需要量。对于生长期的鱼,来自饲料的氮一般仅有30%~40%沉积在鱼体,因此很难保证净累积的氨基酸能满足鱼类最大生长时的全部氨基酸需要量,用这2个指标得到的结果可能偏低[25]。
许多研究表明,当饲料中异亮氨酸水平不足时,鱼类生长缓慢,饲料利用率低,随着饲料中异亮氨酸水平的增加,生长逐渐加快,饲料利用率也得到提高。当饲料中异亮氨酸水平超过需要量时,其生长速度下降,饲料利用率低,一般认为是由于过量的异亮氨酸产生了新的氨基酸不平衡,导致鱼类不能有效利用氨基酸,或是机体因代谢过量的异亮氨酸耗能,加重了机体的代谢负担,也有学者认为是过量的异亮氨酸在鱼体的积累或转化为酮毒性物质影响了生长[2]。本试验中异亮氨酸过量时不影响红鳍东方鲀的生长,可能由于红鳍东方鲀对异亮氨酸过量有一定耐受能力,这与美国红鱼的结果[22]相似,但异亮氨酸不足时,其生长性能也无显著影响。试验设计中为保证红鳍东方鲀的适口性,在配方中添加了22%的鱼粉,饲料中异亮氨酸的最低水平为1.23%,如果饲料异亮氨酸的水平低于1.23%,是否会对红鳍东方鲀的生长性能产生影响有待进一步研究。
3.2 饲料不同水平的异亮氨酸对红鳍东方鲀血清及肌肉异亮氨酸含量的影响血清游离氨基酸含量变化也可以用来评价氨基酸,这一理论在虹鳟赖氨酸需求量的研究中得到验证,Yun等[28]发现,在摄食后5和24 h,以血清游离赖氨酸含量作为评价指标得到的赖氨酸需求量分别为2.34%和2.20%,这一结果与基于生长性能得到的赖氨酸需求量[26, 29]的结果接近,证明了这种方法可以用于鱼类必需氨基酸需求量的评价。基于这一理论,本试验在摄食后6 h取血清,测定异亮氨酸的含量,结果发现尽管血清异亮氨酸含量与饲料异亮氨酸水平的增加没有显著的折线或二次曲线相关关系,但仍然发现异亮氨酸在摄食后1.47%组出现拐点,同时,除异亮氨酸含量外,大部分血清中产生差异的必需或者非必需氨基酸均在1.47%组产生差异,表明红鳍东方鲀的异亮氨酸需求量可能约为1.47%。支链氨基酸是组成动植物蛋白质重要的氨基酸,合计占动植物蛋白质氨基酸总量的18%~20%[30],同时肌肉中的游离氨基酸是组成肌肉蛋白质的物质基础[31],其肌肉游离氨基酸含量变化会通过雷帕霉素靶蛋白(TOR)信号通路调节肌肉蛋白质的合成[32]。而在本试验中,发现饲料中不同水平异亮氨酸显著影响了鱼体粗蛋白质含量和饲料的蛋白质沉积率。因此,我们分析了饲料不同水平异亮氨酸对肌肉游离氨基酸含量的影响,发现肌肉游离异亮氨酸含量随饲料异亮氨酸水平的增加,呈现显著的二次曲线相关关系,且以肌肉游离异亮氨酸含量为评价指标,得到的异亮氨酸需求量为1.96%,与以蛋白质沉积率和鱼体粗蛋白质含量为评价指标得到的异亮氨酸需求量1.93%和1.83%的结果相近,进一步说明饲料中不同水平的异亮氨酸可能通过影响肌肉组织中异亮氨酸含量,影响肌肉蛋白质的合成,进一步影响鱼体粗蛋白质含量和蛋白质沉积率。但是,可能由于红鳍东方鲀自身对异亮氨酸引起的支链氨基酸拮抗作用不敏感,因此,在10周的养殖试验中,没有发现其对生长有显著的作用。
4 结论在本试验条件下,饲料异亮氨酸水平对红鳍东方鲀生长性能没有显著影响,但显著影响了红鳍东方鲀的蛋白质沉积率、鱼体粗蛋白质含量及肌肉游离异亮氨酸含量,并以这些指标为评价标准,得到红鳍东方鲀对饲料异亮氨酸的需求量为1.83%~1.96%。
| [1] |
NRC.Nutrient requirements of fish and shrimp[S].Washington, D.C.: National Academies Press, 2011: 57-92.
|
| [2] |
KHAN M A, ABIDI S F. Dietary isoleucine requirement of fingerling Indian major carp, Labeo rohita (Hamilton)[J]. Aquaculture Nutrition, 2007, 13(6): 424-430. |
| [3] |
REN M, HABTE-TSION H M, LIU B, et al. Dietary isoleucine requirement of juvenile blunt snout bream, Megalobrama amblycephala[J]. Aquaculture Nutrition, 2017, 23(2): 322-330. |
| [4] |
ZHAO J, LIU Y, JIANG J, et al. Effects of dietary isoleucine on growth, the digestion and absorption capacity and gene expression in hepatopancreas and intestine of juvenile Jian carp (Cyprinus carpio var.Jian)[J]. Aquaculture, 2012, 368-369: 117-128. |
| [5] |
银龙, 周小秋, 赵娟, 等. 异亮氨酸对鱼类非特异性免疫功能影响的研究进展[J]. 动物营养学报, 2019, 31(7): 3023-3030. |
| [6] |
ZHAO J, FENG L, LIU Y, et al. Effect of dietary isoleucine on the immunity, antioxidant status, tight junctions and microflora in the intestine of juvenile Jian carp (Cyprinus carpio var.Jian)[J]. Fish & Shellfish Immunology, 2014, 41(2): 663-673. |
| [7] |
ZHAO J, LIU Y, JIANG J, et al. Effects of dietary isoleucine on the immune response, antioxidant status and gene expression in the head kidney of juvenile Jian carp (Cyprinus carpio var.Jian)[J]. Fish & Shellfish Immunology, 2013, 35(2): 572-580. |
| [8] |
FENG L, GAN L, JIANG W D, et al. Gill structural integrity changes in fish deficient or excessive in dietary isoleucine:towards the modulation of tight junction protein, inflammation, apoptosis and antioxidant defense via NF-κB, TOR and Nrf2 signaling pathways[J]. Fish & Shellfish Immunology, 2017, 63: 127-138. |
| [9] |
路凯, 徐玮, 麦康森, 等. 生长中期花鲈对L-异亮氨酸需要量的研究[J]. 水产学报, 2015, 39(2): 203-212. |
| [10] |
孙玉轩.吉富罗非鱼亮氨酸和异亮氨酸需求量的研究[D].硕士学位论文.重庆: 西南大学, 2014: 29-41.
|
| [11] |
尚晓迪, 罗莉, 文华, 等. 草鱼幼鱼对异亮氨酸的需要量[J]. 水产学报, 2009, 33(5): 813-822. |
| [12] |
AHMED I, KHAN M A. Dietary branched-chain amino acid valine, isoleucine and leucine requirements of fingerling Indian major carp, Cirrhinus mrigala (Hamilton)[J]. British Journal of Nutrition, 2006, 96(3): 450-460. |
| [13] |
RAVI J, DEVARAJ K V. Quantitative essential amino acid requirements for growth of catla, Catla catla (Hamilton)[J]. Aquaculture, 1991, 96(3/4): 281-291. |
| [14] |
WILSON R P, POE W E, ROBINSON E H. Leucine, isoleucine, valine and histidine requirements of fingerling channel catfish[J]. The Journal of Nutrition, 1980, 110(4): 627-633. |
| [15] |
马爱军, 李伟业, 王新安, 等. 红鳍东方鲀养殖技术研究现状及展望[J]. 海洋科学, 2014, 38(2): 116-121. |
| [16] |
张庆功.红鳍东方鲀幼鱼赖氨酸、蛋氨酸、精氨酸营养生理研究[D].硕士学位论文.上海: 上海海洋大学, 2019: 15-33.
|
| [17] |
高露姣, 黄艳青, 夏连军, 等. 不同养殖模式下红鳍东方鲀的品质比较[J]. 水产学报, 2011, 35(11): 1668-1676. |
| [18] |
HALVER J E, HARDY R W. Fish nutrition[M]. 3rd edi. San Diego, Calif.: Elsevier Science (USA), 2002: 125-126.
|
| [19] |
KAUSHIK S J. Whole body amino acid composition of European seabass (Dicentrarchus labrax), gilthead seabream (Sparus aurata) and turbot (Psetta maxima) with an estimation of their IAA requirement profiles[J]. Aquatic Living Resources, 1998, 11(5): 355-358. |
| [20] |
李燕.鲈鱼和大黄鱼支链氨基酸与组氨酸营养生理的研究[D].博士学位论文.青岛: 中国海洋大学, 2010: 41-66.
|
| [21] |
ZEHRA S, KHAN M A. Dietary isoleucine requirement of fingerling Catla, catla(Hamilton), based on growth, protein productive value, isoleucine retention efficiency and carcass composition[J]. Aquaculture International, 2013, 21(6): 1243-1259. |
| [22] |
CASTILLO S, GATLIN Ⅲ D M. Dietary requirements for leucine, isoleucine and valine (branched-chain amino acids) by juvenile red drum Sciaenops ocellatus[J]. Aquaculture Nutrition, 2018, 24(3): 1056-1065. |
| [23] |
TIBALDI E, TULLI F. Dietary threonine requirement of juvenile European sea bass (Dicentrarchus labrax)[J]. Aquaculture, 1999, 175(1/2): 155-166. |
| [24] |
RODEHUTSCORD M, JACOBS S, PACK M, et al. Response of rainbow trout (Oncorhynchus mykiss) growing from 50 to 170 g to supplements of either L-arginine or L-threonine in a semipurified diet[J]. The Journal of Nutrition, 1995, 125(4): 970-975. |
| [25] |
麦康森, 何志刚, 艾庆辉. 鱼类苏氨酸营养生理研究进展[J]. 中国海洋大学学报, 2008, 38(2): 195-200, 216. |
| [26] |
OGINO C. Requirements of carp and rainbow trout for essential amino acids[J]. Bulletin of the Japanese Society of Scientific Fisheries, 1980, 46(2): 171-174. |
| [27] |
NG W K, HUNG S S O. Estimating the ideal dietary indispensable amino acid pattern for growth of white sturgeon, Acipenser transmontanus (Richardson)[J]. Aquaculture Nutrition, 1995, 1(2): 85-94. |
| [28] |
YUN H, PARK G, OK I, et al. Determination of the dietary lysine requirement by measuring plasma free lysine concentrations in rainbow trout Oncorhynchus mykiss after dorsal aorta cannulation[J]. Fisheries and Aquatic Sciences, 2016, 19: 4. |
| [29] |
RODEHUTSCORD M, BECKER A, PACK M, et al. Response of rainbow trout (Oncorhynchus mykiss) to supplements of individual essential amino acids in a semipurified diet, including an estimate of the maintenance requirement for essential amino acids[J]. The Joural of Nutrition, 1997, 126(6): 1166-1175. |
| [30] |
LI P, MAI K S, TRYSHENSKI J, et al. New developments in fish amino acid nutrition:towards functional and environmentally oriented aquafeeds[J]. Amino Acids, 2009, 37(1): 43-53. |
| [31] |
WU G Y, BAZER F W, DAI Z L, et al. Amino acid nutrition in animals:protein synthesis and beyond[J]. Annual Review of Animal Biosciences, 2014, 2(1): 387-417. |
| [32] |
WEI Y L, LIANG M Q, XU H G. Fish protein hydrolysate affected amino acid absorption and related gene expressions of IGF-1/AKT pathways in turbot (Scophthalmus maximus)[J]. Aquaculture Nutrition, 2020, 26(1): 145-155. |




