2. 江西省农业科学院畜牧兽医研究所, 南昌 330200;
3. 江西省吉安市水产养殖场, 吉安 343000
2. Institute of Animal Sciences, Jiangxi Academy of Agricultural Sciences, Nanchang 330200, China;
3. The Aquaculture Farm of Ji'an, Jiangxi Province, Ji'an 343000, China
蛋白质是水产动物最重要的营养需求成分之一,水产动物主要依靠蛋白质不停地分解与合成实现体重的增长[1]。饲喂不同蛋白质水平饲料会引起水产动物的生长性能[2]、体组成成分[3]、消化酶活性[4]、氨基酸代谢能力[5]等方面产生变化。同时蛋白质部分也是饲料中最昂贵的组分,研究水产动物对饲料蛋白质水平的需求能够有效地优化饲料组成,节约生产成本,提高经济效益。
黑斑蛙(pelophylax nigromaculatus),属于蛙科(Ranidae),侧褶蛙属(Pelophylax),是一种具有较高生态和科研价值的常见蛙类。黑斑蛙的研究主要集中在病理、毒理试验,而其各个生长阶段的蛋白质、脂肪等各类营养物质的需要量研究尚未见报道,牛蛙、林蛙等其他常见蛙类的营养需求研究也鲜有报道。因此,本试验选取30期黑斑蛙蝌蚪,通过饲喂不同蛋白质水平饲料来研究其对变态阶段[黑斑蛙变态阶段可以分为预变态期(26~33期)、前变态期(34~41期)、变态高峰期(42~46期)[6]]黑斑蛙蝌蚪生长指标、饲料利用、消化酶活性、氨基酸代谢酶活性和抗氧化能力的影响,以期为黑斑蛙蝌蚪的人工饲料配制提供基础数据。
1 材料与方法 1.1 试验材料黑斑蛙蝌蚪来自于江西省农业科学院畜牧兽医研究所,发育阶段为30期(根据Gosner[7]对黑斑蛙生长阶段的划分),平均体重为0.43 g。饲养缸为30 cm×13 cm×20 cm的玻璃缸。饲养用水为经过充分曝气的地下水,pH 7.2,溶氧量5 mg/L以上,水温设置为(26±1) ℃。玻璃缸内放置可定温加热器和数显温度计。饲养过程采用自净水循环系统,包含充氧设备。自行配制试验饲料,饲料原料经粉碎机(GS-20高速粉碎机,北京锟捷玉诚机械设备有限公司)粉碎后过100目筛;按照配方称取原料,经锥形混合机(SYH型实验室三维混合机,常州市轩宇干燥设备有限公司)混匀后,加入油脂和水,再经挤条机(DLJ-108螺杆挤条机,常州市永旭干燥设备有限公司)加工成颗粒状饲料;晾干后经粉碎机粉碎15 s左右,筛选出60~80目饲料颗粒,于-20 ℃冰箱中储存备用。试验饲料组成及营养水平见表 1。
|
|
表 1 试验饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) |
黑斑蛙蝌蚪生长至26期时,各器官基本发育完全,开始正式摄食。选取同一批次26期黑斑蛙蝌蚪,用商业饲料进行5 d预饲喂,蝌蚪发育至30期。选取进食情况良好、体型均匀的蝌蚪450只,随机分成5组,每组3个重复,每个重复30只,放入15个饲养缸内,并对饲养缸进行随机标号。5组黑斑蛙蝌蚪分别饲喂蛋白质水平为25%、30%、35%、40%、45%的试验饲料,每天早晚各饲喂1次,用电子天平称重并记录,每次饲喂至表观饱食。试验至黑斑蛙发育到46期结束,共历时13~15 d。
1.3 样品采集黑斑蛙发育至46期末时整个变态发育阶段完成,尾部完全吸收,基本形成与成体相似的色斑。将所有黑斑蛙采用双毁髓法处理,采全部内脏称重,取肝脏称重,取肝脏、前肠、腿部肌肉液氮保存待测。
1.4 样品测定取肠道(前肠)测定胰蛋白酶、淀粉酶、脂肪酶活性,取肝脏测定谷丙转氨酶(ALT)、谷草转氨酶(AST)、过氧化氢酶(CAT)活性和丙二醛(MDA)含量及总抗氧化能力(T-AOC),取腿部肌肉测定腺苷酸脱氨酶(ADA)活性,上述指标均使用试剂盒(南京建成生物工程研究所)测定。
1.5 数据处理与计算

|

|
试验数据用SPSS 24.0软件中的ANOVA过程进行单因子方差分析,数据使用平均值±标准误(mean±SE)表示,P<0.05为差异显著。
2 结果 2.1 饲料蛋白质水平对黑斑蛙蝌蚪生长及饲料利用指标的影响由表 2可知,随着饲料蛋白质水平的升高,FBW、WGR、SGR、FE、SR均呈现先升高后降低的趋势。40%蛋白质水平组的FBW、WGR、SGR、FE最高,40%、45%蛋白质水平组显著高于其他各组(P<0.05),40%、45%蛋白质水平组之间无显著差异(P>0.05)。35%蛋白质水平组的SR最大,30%、35%、40%、45%蛋白质水平组之间无显著差异(P>0.05),25%蛋白质水平组显著低于30%、35%、40%蛋白质水平组(P<0.05)。25%蛋白质水平组的PER最高,显著高于其他各组(P<0.05)。各组之间摄食量(FI)、HSI和VSI无显著差异(P>0.05)。
|
|
表 2 饲料蛋白质水平对黑斑蛙蝌蚪生长及饲料利用指标的影响 Table 2 Effects of dietary protein level on growth and feed utilization indexes of Pelophylax nigromaculatus tadpoles |
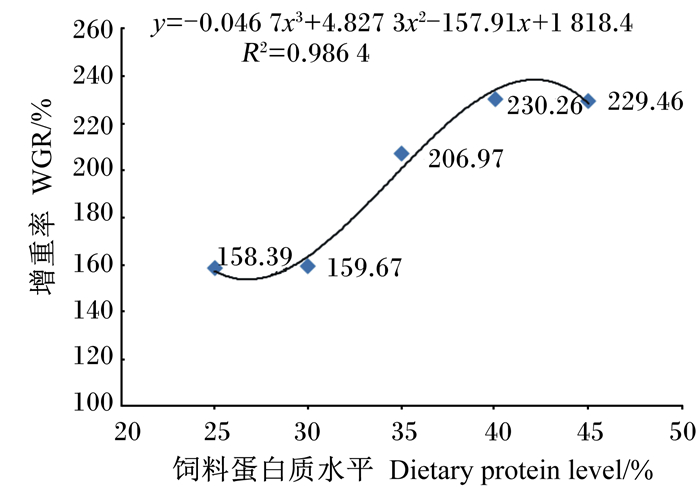
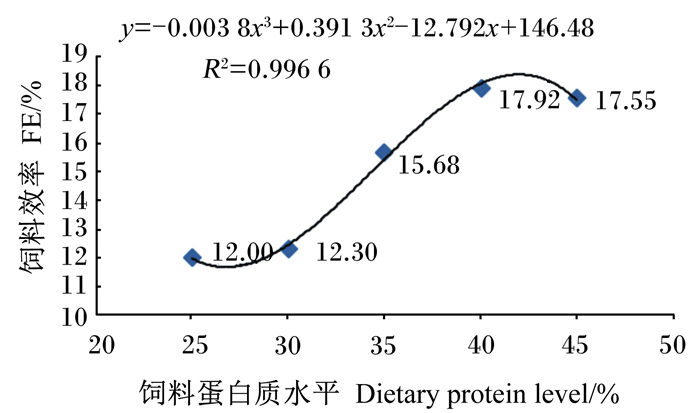
对黑斑蛙蝌蚪的WGR和FE进行回归分析,如图 1和图 2所示。由图可以得到,黑斑蛙蝌蚪的WGR和FE回归方程分别为y=-0.046 7x3+4.827 3x2-157.91x+1 818.4 (R2=0.986 4)和y=-0.003 8x3+0.391 3x2-12.792x+146.48 (R2=0.996 6),增速均呈现先快后慢的趋势,饲料蛋白质水平达40%以后均趋于稳定。根据回归方程估算出,饲料蛋白质水平为42.21%时WGR最高,为241.67%;饲料蛋白质水平为41.81%时FE最高,为17.94%。
|
图 1 饲料蛋白质水平对黑斑蛙蝌蚪增重率的影响 Fig. 1 Effects of dietary protein level on WGR of Pelophylax nigromaculatus tadpoles |
|
图 2 饲料蛋白质水平对黑斑蛙蝌蚪饲料效率的影响 Fig. 2 Effects of dietary protein level on FE of Pelophylax nigromaculatus tadpoles |
由表 3可知,随着饲料蛋白质水平的升高,肠道淀粉酶活性呈降低趋势;25%蛋白质水平组淀粉酶活性最高,显著高于其他各组(P<0.05)。各组之间肠道脂肪酶活性无显著差异(P>0.05)。随着饲料蛋白质水平的升高,肠道胰蛋白酶活性呈现先升高后稳定的趋势;40%蛋白质水平组肠道胰肠道蛋白酶活性最高,显著高于25%、30%、35%蛋白质水平组(P<0.05),40%、45%蛋白质水平组之间无显著差异(P>0.05)。
|
|
表 3 饲料蛋白质水平对黑斑蛙蝌蚪肠道消化酶活性的影响 Table 3 Effects of dietary protein level on intestinal digestive enzyme activitise of Pelophylax nigromaculatus tadpoles |
由表 4可知,各组之间肝脏中谷草转氨酶活性无显著差异(P>0.05)。肝脏中谷丙转氨酶活性随着饲料蛋白质水平的升高逐渐升高;45%蛋白质水平组肝脏中谷丙转氨酶活性最高,显著高于其他各组(P<0.05)。肌肉中腺苷酸脱氨酶活性也随着饲料蛋白质水平的升高逐渐升高;45%蛋白质水平组肌肉中腺苷酸脱氨酶活性最高,显著高于其他各组(P<0.05)。
|
|
表 4 饲料蛋白质水平对黑斑蛙蝌蚪氨基酸代谢酶活性的影响 Table 4 Effects of dietary protein level on amino acid metabolic enzyme activities of Pelophylax nigromaculatus tadpoles |
由表 5可知,随着饲料蛋白质水平的升高,肝脏CAT活性呈现先升高后降低的趋势;40%蛋白质水平组肝脏CAT活性最高,显著高于其他各组(P<0.05);45%蛋白质水平组肝脏CAT活性最低,显著低于其他各组(P<0.05)。随着饲料蛋白质水平的升高,肝脏T-AOC呈现先升高后降低的趋势;35%蛋白质水平组肝脏T-AOC最高,显著高于其他各组(P<0.05);45%蛋白质水平组肝脏T-AOC最低,显著低于其他各组(P<0.05)。随着饲料蛋白质水平的升高,肝脏MDA含量呈现先降低后升高的趋势;35%蛋白质水平组肝脏MDA含量最低,显著低于其他各组(P<0.05)。
|
|
表 5 饲料蛋白质水平对黑斑蛙蝌蚪肝脏抗氧化指标的影响 Table 5 Effects of dietary protein level on liver antioxidant indexes of Pelophylax nigromaculatus tadpoles |
饲料蛋白质水平能够影响黑斑蛙蝌蚪的生长和饲料利用指标。本试验中,40%蛋白质水平组的WGR和SGR较25%蛋白质水平组分别增长了45.38%和25.75%,FE增长了49.33%;根据WGR和FE回归分析得出,适宜饲料蛋白质水平分别为42.21%和41.81%。这一变化规律与牛蛙[8]、刺参[2]、光倒刺鲃幼鱼[9]、达氏鲟幼鱼[10]、对方正银鲫幼鱼[5]、太湖鲂鲌幼鱼[11]、三疣梭子蟹幼蟹[12]等不同类型水产动物的试验结果相似,随着饲料蛋白质水平的升高,黑斑蛙蝌蚪的生长和饲料利用指标随之变化,但是变化幅度和变化持续性在不同水产动物上略有不同。本试验结果表明,PER在饲料蛋白质水平较低时有最大值,随着饲料蛋白质水平的升高,PER逐渐降低。这可能是因为较低蛋白质水平饲料中蛋白质被用来参与体组织合成的比例较高。为了保证饲料中能量水平相同,蛋白质水平较低组饲料中含有较高水平的碳水化合物,而之前的研究表明,动物饲料中碳水化合物水平会影响其对蛋白质的需求[13-15],进而影响PER。在高饲料蛋白质水平组中,蝌蚪的FE、SGR和WGR并没有上升,并且在很多对水产动物的研究中发现,当饲料蛋白质水平过高时,会引起生长指标的下降[5, 9]。这是因为饲料蛋白质在满足动物自身生长发育需要以后,超出部分蛋白质的吸收情况和利用途径发生了改变。肝脏是动物机体代谢和营养储存的重要器官,肝脏的大小往往会由于动物机体发生病变或者营养水平发生较大改变时发生变化。本试验中,各组HSI无显著差异,可能是高蛋白质水平组中部分蛋白质转化为脂肪,并在肝脏存储,饲料中碳水化合物水平降低时会减弱脂肪在肝脏的积累[16],而肝脏中蛋白质和氨基酸含量对糖的代谢和脂肪的生成具有调控作用[17-18]。
3.2 饲料蛋白质水平对黑斑蛙蝌蚪消化酶和氨基酸代谢酶活性的影响饲料蛋白质水平能够影响黑斑蛙蝌蚪的消化酶活性。本试验中,高饲料蛋白质水平组的黑斑蛙肠道淀粉酶活性较低;随着饲料蛋白质水平的升高,肠道胰蛋白酶活性呈现逐渐升高的趋势,肠道脂肪酶活性基本保持不变,在刺参[2]、光倒刺鲃幼鱼[9]、太湖鲂鲌幼鱼[11]等水产动物上的研究得到了相似的结果。饲料原料变化会导致动物机体消化道内各类消化酶活性的变化[19-20];在适宜饲料蛋白质水平范围内,动物机体对蛋白质的消化能力往往会随着饲料蛋白质水平的升高呈现逐渐升高的趋势。本试验结果显示,各组的肠道脂肪酶活性差异不显著,这可能与各试验饲料中脂肪水平基本相同有关。已有研究表明,饲料中脂肪水平的变化会影响动物机体脂肪酶活性的变化[21]。而本试验饲料中,脂肪水平均为7.5%左右。另外,随着饲料蛋白质水平的升高,肠道淀粉酶活性呈降低趋势,这可能是因为本试验饲料中,碳水化合物水平随着饲料中蛋白质水平的升高而逐渐降低,引起淀粉酶的分泌量降低。
饲料蛋白质水平能够影响黑斑蛙蝌蚪的氨基酸代谢能力。谷丙转氨酶和谷草转氨酶是氨基酸在肝脏中进行转氨基作用的重要酶类,其活性高低直接预示着动物肝脏氨基酸分解代谢活动的强弱,氨基酸还可以在肌肉中通过嘌呤核苷酸循环产生腺嘌呤核苷酸[22],腺嘌呤核苷酸在腺苷酸脱氨酶的催化下脱去氨基。本试验中,肝脏中谷丙转氨酶和肌肉中腺苷酸脱氨酶的活性在45%蛋白水平组均最高。这与在方正银鲫幼鱼[5]等水产动物上的研究结论相似,随着饲料蛋白质水平的升高,氨基酸代谢能力逐渐增高。该试验结果说明高饲料蛋白质水平组中肝脏的氨基酸脱氨基反应旺盛,较多的氨基酸用于进行脱氨基作用。之前的研究也表明过剩蛋白质主要通过肝脏和肾脏中进行的转氨基作用生成谷氨酸,进而在L-谷氨酸脱氢酶的催化下进行氧化脱氨基作用[23]。本试验结果显示,各组肝脏中谷草转氨酶活性没有显著差异。谷草转氨酶和腺苷酸脱氨酶所服务的嘌呤核苷酸循环均以天冬氨酸作为反应底物,而各组中2种酶活性变化情况出现差异,同时,肝脏中谷丙转氨酶活性随着饲料蛋白质水平的升高而升高,说明在高蛋白质水平组蝌蚪的肝脏中谷氨酸和α-酮戊二酸含量充足;又因高饲料蛋白质水平组肌肉中腺苷酸脱氨酶活性也是逐渐上升,表明草酰乙酸和天冬氨酸含量并不缺乏。本试验中,谷草转氨酶催化α-酮戊二酸和天冬氨酸生成谷氨酸和草酰乙酸的反应强度并没有上升,说明谷草转氨酶活性受到某种因素的限制,有待进一步研究。另外,在草鱼[24]和重牙鲷[25]上的研究显示,当饲料中蛋白质水平过高时,肝脏中谷丙转氨酶和谷草转氨酶活性并没有受到显著影响,与本试验在黑斑蛙蝌蚪上的结果相左,这与饲料组成、试验动物对饲料中蛋白质水平的耐受能力、饲养试验的时长等因素都有关系。
3.3 饲料蛋白质水平对黑斑蛙蝌蚪抗氧化能力的影响饲料蛋白质水平能够影响黑斑蛙蝌蚪肝脏的抗氧化能力。本试验结果显示,35%蛋白质水平组具有最佳的抗氧化能力。T-AOC反映了动物体内各类抗氧化物质和抗氧化酶等总抗氧化水平的高低,MDA则是动物机体内脂质氧化的产物之一,是检测细胞膜系统氧化损伤的重要指标[26]。提高T-AOC能够有效的减少自由基造成的脂质氧化及细胞膜和DNA损伤,减少MDA的生成,提高黑斑蛙蝌蚪的健康状况。在以往水产饲料研究中,蛋白质水平对水产动物抗氧化能力的影响鲜有报道。本试验结果显示,在过低或者过高饲料蛋白质水平时,黑斑蛙蝌蚪的抗氧化能力均出现降低,说明饲料蛋白质水平对动物抗氧化能力的影响具有潜在的研究价值。饲料蛋白质水平在适当范围内的提高对抗氧化能力的增强,一方面取决于动物营养水平的整体增加。当饲料蛋白质水平在适宜范围内升高时,鱼体将吸收更多的蛋白质,用来构建组织蛋白质,并维持和修复机体组织;另一方面也取决于饲料中特定物质含量的增加,有研究表明,提高饲料中赖氨酸[27]、精氨酸[28]的水平,可以增加动物机体超氧化物歧化酶(SOD)和CAT等抗氧化酶的活性,增强其抗氧化能力。
4 结论在本试验条件下,饲料蛋白质水平对变态阶段黑斑蛙蝌蚪的生长指标、饲料利用、消化酶活性、氨基酸代谢酶活性和抗氧化能力均有影响。以WGR和FE做回归曲线,得到变态阶段黑斑蛙蝌蚪的适宜饲料蛋白质水平为41.81%~42.21%。
| [1] |
DUMAS A, DE LANGE C F M, FRNCE J, et al. Quantitative description of body composition and rates of nutrient deposition in rainbow trout(Oncorhynchus mykiss)[J]. Aquaculture, 2007, 273(1): 165-181. DOI:10.1016/j.aquaculture.2007.09.026 |
| [2] |
冯丹, 高勤峰, 董双林. 不同蛋白水平饲料对刺参生长和消化酶活性的影响[J]. 中国海洋大学学报(自然科学版), 2014, 44(02): 35-40. |
| [3] |
刘勇, 周继术, 吉红, 等. 饲料蛋白水平对多鳞白甲鱼亲鱼生长、体组成与性腺的影响[J]. 饲料工业, 2016, 37(16): 20-26. |
| [4] |
于建华, 周玮, 赵志刚. 不同蛋白源饲料对仿刺参幼参体成分及消化酶活性的影响[J]. 饲料研究, 2015(20): 55-58. |
| [5] |
桑永明, 杨瑶, 尹航, 等. 饲料蛋白水平对方正银鲫幼鱼生长、体成分、肝脏生化指标和肠道消化酶活性的影响[J]. 水生生物学报, 2018, 42(4): 736-743. |
| [6] |
葛雅楠, 李圆圆, 张银凤, 等. 黑斑蛙变态过程中甲状腺发育及甲状腺激素分泌[J]. 水生生物学报, 2014, 38(4): 714-719. |
| [7] |
GOSNER K L. A simplified table for staging anuran embryos and larvae with notes on identification[J]. Herpetologica, 1960, 16(3): 183-190. |
| [8] |
徐德平, 曾训江, 刘素文, 等. 牛蛙饲料中最适蛋白质含量的研究[J]. 湖南水产, 1989(6): 15-18. |
| [9] |
李成, 秦溱, 李金龙, 等. 不同蛋白水平饲料对光倒刺鲃幼鱼生长、消化酶及体成分的影响[J]. 饲料工业, 2018, 39(24): 34-39. |
| [10] |
张磊, 危起伟, 张书环, 等. 饲料蛋白水平对达氏鲟幼鱼生长性能、体组成、消化酶活性以及血液生化指标的影响[J]. 淡水渔业, 2016, 46(6): 79-85. |
| [11] |
陈建明, 黄爱霞, 田儒品, 等. 饲料蛋白质水平对太湖鲂鲌幼鱼生长性能、体组成和消化酶活性的影响[J]. 动物营养学报, 2019, 31(10): 4843-4851. |
| [12] |
金敏.三疣梭子蟹幼蟹对蛋白质、精氨酸、赖氨酸和蛋氨酸需要量的研究[D].硕士学位论文.宁波: 宁波大学, 2014: 54-59.
|
| [13] |
KIM K I, KAYES T B, AMUNDSON C H. Purified diet development and re-evaluation of the dietary protein requirement of fingerling rainbow trout(Oncorhynchus mykiss)[J]. Aquaculture, 1991, 96(1): 57-67. DOI:10.1016/0044-8486(91)90139-X |
| [14] |
罗毅平, 谢小军. 鱼类利用碳水化合物的研究进展[J]. 中国水产科学, 2010, 17(2): 381-390. |
| [15] |
ZENG L, LEI J, AI C, et al. Protein-sparing effect of carbohydrate in diets for juvenile turbot Scophthalmus maximus reared at different salinities[J]. Chinese Journal of Oceanology and Limnology, 2015, 33(1): 57-69. DOI:10.1007/s00343-015-4070-5 |
| [16] |
YANG S D, LIN T S, LIOU C H, et al. Influence of dietary protein levels on growth performance, carcass composition and liver lipid classes of juvenile Spinibarbus hollandi(Oshima)[J]. Aquaculture Research, 2003, 34(8): 661-666. DOI:10.1046/j.1365-2109.2003.00880.x |
| [17] |
LANSARD M, PANSERAT S, PLAGNES JUAN E, et al. Integration of insulin and amino acid signals that regulate hepatic metabolism-related gene expression in rainbow trout: role of TOR[J]. Amino acids, 2010, 39(3): 801-810. DOI:10.1007/s00726-010-0533-3 |
| [18] |
LANSARD M, PANSERAT S, PLAGNES JUAN E, et al. L-leucine, L-methionine, and L-lysine are involved in the regulation of intermediary metabolism-related gene expression in rainbow trout hepatocytes[J]. The Journal of Nutrition, 2010, 141(1): 75-80. |
| [19] |
WANG W L, MANABU I, SHUNSUKE K, et al. Effects of dietary astaxanthin and vitamin E and their interactions on the growth performance, pigmentation, digestive enzyme activity of kuruma shrimp (Marsupenaeus japonicus)[J]. Aquaculture Research, 2019, 50(4): 1186-1197. DOI:10.1111/are.13993 |
| [20] |
KARAPANAGIOTIDIS I T, PSOFAKIS P, MENTE E, et al. Effect of fishmeal replacement by poultry by-product meal on growth performance, proximate composition, digestive enzyme activity, haematological parameters and gene expression of gilthead seabream (Sparus aurata)[J]. Aquaculture Nutrition, 2019, 25(1): 3-14. DOI:10.1111/anu.12824 |
| [21] |
FOUNTOULAKI E, ALEXIS M N, NENGAS I, et al. Effect of diet composition on nutrient digestibility and digestive enzyme levels of gilthead sea bream (Sparus aurata L.)[J]. Aquaculture Research, 2005, 36(13): 1243-1251. DOI:10.1111/j.1365-2109.2005.01232.x |
| [22] |
LOWENSTEIN J. The purine nucleotide cycle revised[J]. International Journal of Sports Medicine, 1990, 11(S 2): S37-S46. DOI:10.1055/s-2007-1024853 |
| [23] |
BUCKING C. A broader look at ammonia production, excretion, and transport in fish:a review of impacts of feeding and the environment[J]. Journal of Comparative Physiology B, 2017, 187(1): 1-18. |
| [24] |
李彬, 梁旭方, 刘立维, 等. 饲料蛋白水平对大规格草鱼生长、饲料利用和氮代谢相关酶活性的影响[J]. 水生生物学报, 2014, 38(2): 233-240. |
| [25] |
SÁ R, POUSÃO FERREIRA A, OLIVA TELES A. Effect of dietary protein and lipid levels on growth and feed utilization of white sea bream (Diplodus sargus) juveniles[J]. Aquaculture Nutrition, 2006, 12(4): 310-321. DOI:10.1111/j.1365-2095.2006.00434.x |
| [26] |
SHI Q H, ZHU Z J, XU M, et al. Effect of excess manganese on the antioxidant system in Cucumis sativus L. under two light intensities[J]. Environmental and Experimental Botany, 2006, 58(1/2/3): 197-205. |
| [27] |
李雪吟, 叶成远, 唐玲, 等.赖氨酸对生长后期草鱼生长、肠道酶活力和抗氧化状态的影响[C].第九届世界华人鱼虾营养学术研讨会论文摘要集.厦门: 第九届世界华人鱼虾营养学术研讨会, 2013.
|
| [28] |
QI C L, WANG X D, HAN F L, et al. Arginine supplementation improves growth, antioxidant capacity, immunity and disease resistance of juvenile Chinese mitten crab, Eriocheir sinensis[J]. Fish & shellfish immunology, 2019, 93: 463-473. |




