2. 甘肃农业大学动物科学技术学院, 兰州 730070
2. College of Animal Science and Technology, Gansu Agricultural University, Lanzhou 730070, China
发展好养羊业对于提高青海省农牧民生活水平以及保护牧区草原生态环境具有重要意义。藏羊作为青海省畜牧业的主要优势家畜,在自然状态下繁殖性能较低,对自然资源的依赖程度高,对区域生态环境破坏严重。因此,通过引入能适应青海省高海拔环境且高繁殖性能的优良绵羊品种,实现青海省牧区草场减压增效、牧民减畜增收对提高牧区养羊业生产效率至关重要。湖羊是我国著名的以多胎为主要特征的绵羊品种,具有早期生长发育快、繁殖力强、性成熟早、常年发情、对自然环境适应能力强等优良特性。研究表明,湖羊喜干燥,耐寒耐旱,在低海拔高湿地区(福建省,海拔高度为300 m)生产性能、繁殖性能等均相对稳定,但温度超过30 ℃时湖羊机体会产生一定程度的热应激反应[1];湖羊在中海拔干旱地区(甘肃省,海拔高度为1 500 m)能够较好地适应当地的自然环境和气候及饲草料,并能很好地表现出繁殖力高、羔羊早期生长发育快等种质特性[2];湖羊在高海拔低氧地区(青海省,海拔高度为2 200 m)虽然在心跳、呼吸、体温等指标上有所上升,但在该地的自然环境和生产模式下母羊繁殖率及羔羊断奶成活率等与原产地差异不显著,表现出良好的适应性[3]。因此,基于湖羊对环境的良好适应性,将其引入青海高海拔地区(海拔高度在3 000 m以上)对提高当地绵羊繁殖水平具有积极意义。
动物为适应青藏高原低氧的特殊环境,机体会形成一系列细胞、组织及分子水平的调节机制[4]。促红细胞生成素(erythropoietin,EPO)基因是最早发现与低氧适应性有关的一种基因,主要作用于造血器官,通过调控血液红细胞增殖、分化及成熟,达到增加血红蛋白含量,增大血液输送氧量,调节高海拔低氧引起的缺氧应激[5]。血液生理生化指标是家畜对氧化应激环境适应性评判标准的重要参考数据,在低氧状态下的动物机体将会通过生理性自身调节,发生一系列补偿性反应来适应生理所发生的改变,从而使得机体内环境达到一种新的平衡状态。随着海拔的升高,动物血液中的红细胞数量(RBC)、红细胞压积(HCT)及血红蛋白浓度(HGB)等指标会显著增加,这种红细胞的变形性增强和聚集性降低抑制了HCT升高所造成的血液浓度的过度升高,从而保证机体得到维护组织的正常供氧[6]。本试验拟对高海拔、中海拔地区舍饲湖羊母羊的EPO基因表达及血液生理生化指标进行测定,探究湖羊母羊在青海高海拔地的适应性,以期为青海高海拔地区湖羊的引种及科学饲养管理提供理论依据。
1 材料与方法 1.1 试验动物本试验于2018年7月从甘肃武威三洋农牧湖羊种羊场(海拔高度为1 500 m)将成年湖羊引入青海海南州哇玉香咔梅哚牧业责任有限公司(海拔高度为3 200 m)。于2019年10月分别从甘肃与青海两地的成年湖羊纯繁后代(各是当地繁殖的第2代、第1代)中选择体型相似的健康8月龄湖羊后备母羊各90只作为试验对象,两地各自随机分为3组,每组30只羊。试验羊只平均体重为(32.11±1.86) kg。
根据试验需要,在不同海拔下的湖羊后备母羊采用统一的基础饲粮,所用基础饲粮组成及营养水平见表 1。试验羊只每天07:30、19:30进行饲喂,每只母羊每天定量饲喂青贮燕麦1.5 kg、燕麦青干草0.2 kg、精料补充料0.3 kg,精、粗料同时饲喂并保证自由饮水。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
血液采集当天,早上空腹颈静脉采集3组湖羊的血液样品(10 mL/只)。第1组采用肝素钠抗凝真空采血管采集血液样品,采样后将采血管缓慢轻轻颠倒180°,混匀,重复3~4次并做好标记送往实验室,用于血液生理指标测定;第2组采用促凝真空采血管采集血液样品,在室温条件下放置30~60 min后,3 500 r/min离心15 min,收集血清并做好标记,于-80 ℃冷冻备用,用于血液生化指标测定;第3组采用肝素钠真空采血管采集血液样品,采样后将采血管缓慢轻轻颠倒180°,混匀做好标记,于-80 ℃冷冻备用,用于总RNA提取及EPO基因表达量分析。
1.3 血液EPO基因表达量测定 1.3.1 总RNA的提取及反转录cDNA采用常规Trizol试剂盒提取法从血样中提取血液总RNA,1%琼脂糖凝胶电泳检测其浓度。利用北京天根生化科技有限公司的FastKing cDNA第1链合成试剂盒将提取的总RNA进行反转录。
1.3.2 引物的设计与合成结合NCBI上绵羊EPO基因全序列(登录号:NM_001024737.1)使用Primer Premier 5.0结合Olig 6.0软件设计引物[以β-肌动蛋白(β-actin)基因为内参基因],送至上海生工生物工程技术有限公司合成,引物序列见表 2。
|
|
表 2 内参基因与EPO基因引物序列 Table 2 Primer sequences of internal reference gene and EPO gene |
PCR扩增体系为25 μL,包括:5 U/μL Taq PCR预混酶0.5 μL,100 μmol/L引物1 μL(上、下游引物各0.5 μL),2.5 mmol/L dNTP 2.0 μL,PCR Loading Buffer 2.5 μL,50 mg/μL模板cDNA 1.5 μL,ddH2O 17.5 μL。PCR扩增条件为:94 ℃预变性3 min;94 ℃变性30 s,58.0 ℃退火30 s,72 ℃延伸1 min 30 s(30次循环),72 ℃延伸10 min;4 ℃保存。回收PCR产物,用1%琼脂糖凝胶电泳检测并干冰运送至上海生工生物工程有限公司测序。
1.3.4 实时荧光定量PCR选择绵羊β-actin基因作为内参基因,采用SYBR Green Ⅰ染料法测定血液中EPO mRNA表达量,每个样品重复3次。反应体系为25 μL,包括:2×SYBR Premix Ex Taq Ⅱ 12.5 μL,100 μmol/L引物1 μL(上、下游引物各0.5 μL),50 mg/μL模板cDNA 1.5 μL,RNase-free ddH2O 10 μL。反应条件为:94 ℃预变性3 min,94 ℃变性30 s,58.0 ℃退火30 s, 72 ℃延伸1 min 30 s (40次循环)。
1.4 血液生理生化指标测定使用美国Drew Scientific公司HEMAVET 950FS动物血液分析仪测定10项血液生理指标,分别为白细胞数量(WBC)、RBC、HGB、HCT、平均红细胞体积(MCV)、平均红细胞血红蛋白含量(MCH)、平均红细胞血红蛋白浓度(MCHC)、红细胞分布宽度变异系数(RDW-CV)、血小板数量(PLT)、平均血小板体积(MPV)。
采用酶联免疫吸附测定试剂盒(北京索莱宝科技有限公司)对血清样品进行总抗氧化能力(T-AOC),超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、谷草转氨酶(AST)、谷丙转氨酶(ALT)、乳酸脱氢酶(LDH)活性以及丙二醛(MDA)、总蛋白(TP)、白蛋白(Alb)、尿素氮(UN)、甘油三酯(TG)、总胆固醇(TC)、葡萄糖(Glu)含量的测定。
1.5 数据处理与分析采用2-△△Ct法对实时荧光定量PCR数据进行相对定量分析,以β-actin基因为内参基因,中海拔组湖羊样品为对照,应用SAS 9.0软件计算重复样品间Ct值及标准偏差。
试验数据用Excel 2019统计整理后,采用SAS 9.0分析软件进行血液生理生化指标的统计分析,结果以平均值±标准差(mean±SD)表示,以P < 0.05为差异显著性判断标准。
2 结果与分析 2.1 海拔高度对湖羊血液中EPO基因表达的影响将获得的cDNA进行PCR扩增,扩增结果见图 1。由图可以看出,扩增出的目的片段与预期片段大小一致,且条带单一整体,无其他杂带,可以判定其为目的片段,能进行下一步的回收纯化。随机选择4个PCR样品纯化回收后送至上海生工生物工程有限公司进行双向测序,测序结果与预期一致,可以进行后续实时荧光定量PCR试验。
|
1和2:EPO基因EPO gene;M:DNA分子质量标准DNA marker。 图 1 EPO基因扩增结果 Fig. 1 EPO gene amplification results |
由图 2可知,EPO基因在高海拔地区湖羊血液中的相对表达量显著高于中海拔地区湖羊(P < 0.05)。
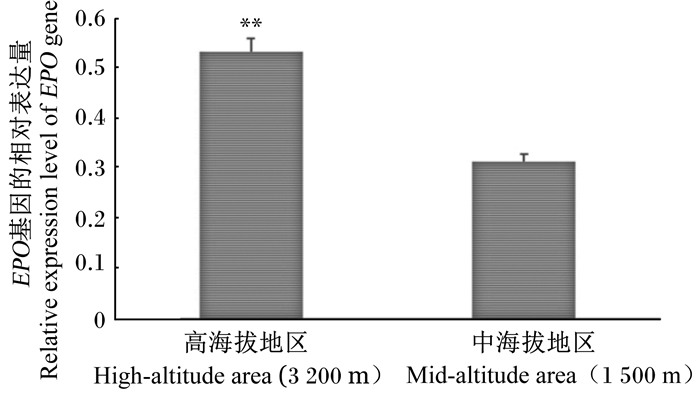
|
数据柱形标注不同小写字母表示差异显著(P < 0.05)。 Value columns with different small letters mean significant difference (P < 0.05). 图 2 不同海拔地区湖羊血液中EPO基因的相对表达量 Fig. 2 Relative expression level of EPO gene in blood of Hu sheep in different altitude areas (n=6) |
由表 3可知,高海拔地区湖羊血液RBC、HGB、HCT、MCV较中海拔地区湖羊依次增加了36.23%、45.94%、58.34%、23.65%(P < 0.05),血液WBC、MCHC、PLT、MPV较中海拔地区湖羊依次降低了27.33%、11.68%、18.27%、6.20%(P < 0.05),血液MCHQ和RDW与中海拔地区差异不显著(P>0.05)。上述结果说明增加海拔高度后湖羊血液生理指标发生了适应性变化。
|
|
表 3 不同海拔地区湖羊血液生理指标 Table 3 Blood physiological indexes of Hu sheep in different altitude areas (n=30) |
不同海拔地区湖羊血清常规生化指标的测定结果见表 4。由表可知,增加海拔高度后血清中各项生化指标均有不同程度的变化。相对于中海拔地区湖羊,高海拔地区湖羊血清AST、ALT活性和Glu含量依次上升了10.71%、16.80%、62.72%(P < 0.05),血清TC含量下降了33.22%(P < 0.05),其他血清生化指标的变化不显著(P>0.05)。
|
|
表 4 不同海拔地区湖羊血清常规生化指标 Table 4 Serum routine biochemical indexes of Hu sheep in different altitude areas (n=30) |
不同海拔地区湖羊血清抗氧化指标的测定结果见表 5。由表可知,高海拔地区湖羊血清GSH-Px、SOD活性以及T-AOC与MDA含量依次是中海拔地区湖羊的5.99、2.35、4.10、1.49倍(P < 0.05)。
|
|
表 5 不同海拔地区湖羊血清抗氧化指标 Table 5 Serum antioxidant indexes of Hu sheep in different altitude areas (n=30) |
血液的各项生理指标可以作为评判机体生理功能正常与否的依据,本试验中湖羊在进入高海拔环境后血液生理指标发生了适应性变化。动物在高原低氧低气压条件下机体处于相对缺氧状况,会引起红细胞和血红蛋白代偿性增多[9]。湖羊在进入高海拔地区后血液RBC、HGB、HCT、MCV显著高于中海拔地区,说明湖羊会通过增加RBC和HGB来提升运输氧气的能力,从而适应高海拔环境。谢云龙[3]测定甘肃天祝地区湖羊的血液生理指标后发现RBC、HGB处于正常范围内的较高水平,猜测这种结果可能是海拔高度造成,与本试验结果相似。PLT是血小板生成与衰亡的指标,MPV是巨核细胞增生和血小板生成的参数[10]。本试验发现高海拔地区湖羊血液PLT、MPV显著低于中海拔地区湖羊,赵士杰[11]通过研究发现人进驻高海拔地区后血液PLT明显减小,而且海拔越高PLT减小越明显,与本试验结果相似。WBC是与机体免疫相关的活性细胞,机体的免疫能力高低与WBC多少密切相关[12]。高海拔地区湖羊血液WBC显著低于中海拔地区湖羊,随着海拔的增高,湖羊血液中的WBC降低说明在高海拔环境下绵羊的免疫力发生了一定程度的下降。在高海拔低氧的环境下,为减小缺氧造成的应激,血液中某些成分的含量会发生变化。湖羊进入高海拔地区后血清AST、ALT活性与Glu含量显著增加,而TC含量显著下降,表明湖羊在高海拔环境下机体肝脏自身功能因抗缺氧发生而改变,进而影响脂类代谢,是机体对高海拔缺氧状态的适应性改变,本试验结果与郭丹丹等[13]对高原移居者肝功能及血脂水平的研究结果一致。有研究表明高海拔地区藏鸡血液Glu含量显著高于低海拔地区藏鸡[14],这与本试验结果一致。间歇性缺氧使得LDH大量释放,增强了机体的无氧代谢能力,保护机体免受低氧应激的影响[15],本试验也显示低氧环境下湖羊血清LDH活性有所提高。低氧环境会对动物血液的某些生化指标产生不同程度的影响[16],增加海拔高度对湖羊血液中某些生化指标也产生了一定的影响,这预示着湖羊在高海拔环境下发生了适应性变化。
当动物机体从中海拔地区运输至高海拔地区时会进入一系列应激状态,使得机体内的氧自由基含量增加,若不能及时清除会导致氧自由基过剩,氧自由基具有极强的杀伤力,会造成机体器官组织的氧化损伤[17]。动物面对氧自由基的损坏时为保持机体健康会不断产生各种抗氧化物质来清除体内过剩的氧自由基,从而保护组织细胞免受氧化损害。氧自由基的清除系统由酶促系统和非酶促系统组成,动物试验中常以血清T-AOC以及SOD、GSH-Px活性与MDA含量作为反映机体抗氧化能力的重要指标。本试验结果表明,高海拔地区湖羊血清抗氧化指标GSH-Px、SOD活性以及T-AOC与MDA含量均显著高于中海拔地区湖羊。湖羊血清中T-AOC的升高说明机体内抗氧化防御体系处于活跃状态。当湖羊在低氧的高海拔地区进入氧化应激状态后,机体内产生了大量的氧自由基,它会破坏细胞的结构与功能,同时动物机体会产生大量的抗氧化物质和抗氧化酶来提高机体的防御能力,并及时清除体内的氧自由基来维持机体氧化剂与抗氧化剂之间的平衡。当湖羊在高海拔地区的适应过程中产生一系列有害物质时,机体就会相应地提高SOD的活性来进行清除工作,在湖羊体内由于大气压降低、氧含量减少等因素产生氧自由基的同时体内SOD活性也提高,通过歧化反应将体内的氧自由基转化为无害的过氧化氢(H2O2)和氧气(O2),减少氧自由基对细胞的损害并及时修复受损细胞[18]。GSH-Px能有效清除湖羊进入高海拔地区后产生脂质过氧化反应的代谢产物[19],其活性的升高说明湖羊在高海拔地区经过一段时间的适应后,体内的抗氧化能力显著升高,能阻断脂质过氧化连锁反应,清除氧自由基并保护机体。湖羊进入高海拔地区后,由于环境的改变,动物机体的细胞及组织会发生大量的过氧化反应,其中包括细胞膜磷脂脂质过氧化反应,MDA是其最终产物。在本试验中,通过测定血清MDA含量来评估脂质过氧化,而MDA含量的升高表明了高海拔地区湖羊应激反应大,间接反映了湖羊在高海拔地区机体细胞的受损伤程度在升高。
氧是机体新陈代谢的重要物质基础,高寒和缺氧是高原地区主要的生态限制因子。EPO是一种单链的酸性糖蛋白,通过对造血干细胞分化的促进来生成红细胞[20],EPO的产生组织在出生前后是不同的,出生前以肝脏为主,出生后以肾脏为主,目前EPO已经被证明在脑、子宫、肾脏、肝脏、实质性肿瘤等中均可产生。许海霞[21]通过提取牦牛、黄牛、绵羊等动物血液中的EPO基因进行了基因多态性检测,结果表明EPO基因在血液中同样存在。本试验通过测定湖羊EPO基因在高海拔和中海拔地区湖羊血液中的表达差异来探究湖羊对高海拔环境下的适应性。动物机体内EPO基因的表达量会随着低氧诱导因子的作用而呈增加的趋势,EPO会随着血液循环进入造血系统,使RBC增加,HGB升高,进而增强血液的携氧能力。包鹏甲等[22]通过对藏羊EPO基因变异及单核苷酸多态位点(SNP)分析发现高原野生盘羊品种体内的RBC增多、MCV降低有赖于其优势单倍型Hap-4,使得机体中血液的携氧能力和氧运输效率得以提高,有利于其适应高原低氧环境。吴周林等[23]通过对生活在高海拔地区的九龙牦牛的EPO基因外显子3、4、5区段进行序列分析发现部分序列发生了SNP变异,这是对低氧适应的结果。在常氧条件下EPO基因表达量最低,低氧条件下其表达量显著增加,生活在高海拔低氧环境下的甘肃鼢鼠比SD大鼠对低氧的适应性更强,说明甘肃鼢鼠已在进化过程中形成了特定的适应低氧的调节机制[24]。在低氧胁迫下,大鼠血清中EPO基因表达量显著上升,肾脏中EPO基因表达量呈上升趋势,缺氧是诱导EPO基因表达量升高的重要因素[25]。本研究显示高海拔地区湖羊血液中EPO基因的相对表达量显著高于中海拔地区湖羊,低氧环境导致EPO基因的表达量升高,与上述研究结果一致。
4 结论养殖在青海高海拔地区的湖羊血液中EPO基因的表达、血液生理生化指标均发生了适应性变化,说明湖羊机体为适应高海拔环境产生了一系列调节机制,表明湖羊具有适应高海拔环境的潜力。
| [1] |
魏国桢, 应建翔, 江斌, 等. 湖羊在福建省清流县的适应性观察[J]. 黑龙江畜牧兽医, 2014(12): 46-47. |
| [2] |
杨磊, 马进忠, 王志明, 等. 湖羊在临夏干旱山区适应性观测[J]. 畜牧兽医杂志, 2019, 38(1): 81-82, 85. |
| [3] |
谢云龙.湖羊在天祝县的适应性及其杂交组合研究[C]//2017年全国养羊生产与学术研讨会暨养羊学分会第七次全国会员代表大会论文集.石家庄: 中国畜牧兽医学会养羊学分会, 2017: 66.
|
| [4] |
王则夫.牦牛和藏羚羊高海拔适应机制的趋同进化研究[D].硕士学位论文.兰州: 兰州大学, 2016.
|
| [5] |
MALLET R T, RYOU M G. Erythropoietin:endogenous protection of ischemic brain[J]. Vitamins and Hormones, 2017, 105: 197-232. DOI:10.1016/bs.vh.2017.01.002 |
| [6] |
HUANG Y C, HSU C C, WANG J S. High-intensity interval training improves erythrocyte osmotic deformability[J]. Medicine and Science Sports and Exercise, 2019, 51(7): 1404-1412. DOI:10.1249/MSS.0000000000001923 |
| [7] |
杨秀平, 肖向红, 李大鹏. 动物生理学[M]. 3版. 北京: 高等教育出版社, 2012: 342-350.
|
| [8] |
邹思湘. 动物生物化学[M]. 5版. 北京: 中国农业出版社, 2012: 126-127.
|
| [9] |
卢晓丽, 赵彦玲, 吴征王, 等. 西藏色瓦藏绵羊高原适应性的血液生理学特性研究[J]. 西南农业学报, 2019, 32(6): 1443-1447. |
| [10] |
张桢.阿司匹林对抗血小板促进肿瘤增殖作用的初步研究[D].硕士学位论文.西安: 西北大学, 2019.
|
| [11] |
赵士杰. 不同海拔地区外周血细胞和血小板参数变化及意义[J]. 青海医药杂志, 2013, 43(2): 51-52. |
| [12] |
王烽.四种SPF猪群体血液生理生化及遗传特征分析[D].硕士学位论文.哈尔滨: 东北农业大学, 2019.
|
| [13] |
郭丹丹, 董矜, 郭晓东, 等. 不同海拔高原适应相关肝脏功能与脂代谢变化[J]. 现代生物医学进展, 2013, 13(1): 71-74. |
| [14] |
王志敏, 徐亚欧, 杨磊, 等. 不同海拔藏鸡生理生化指标的研究[J]. 畜牧与饲料科学, 2018, 39(2): 1-7. |
| [15] |
WU J, STEFANIAK J, HAFNER C, et al. Intermittent hypoxia causes inflammation and injury to human adult cardiac myocytes[J]. Anesthesia and Analgesia, 2016, 122(2): 373-380. DOI:10.1213/ANE.0000000000001048 |
| [16] |
辛笛.低氧环境对大林姬鼠生活节律及血液生理生化指标的影响[D].硕士学位论文.牡丹江: 牡丹江师范学院, 2017.
|
| [17] |
ZHAO H T, WANG Z Y, CHENG C L, et al. UV protective effect of anthocyanin extract from Lonicera caerulea var.edulis[J]. Applied Mechanics and Materials, 2012, 195-196: 1294-1299. DOI:10.4028/www.scientific.net/AMM.195-196.1294 |
| [18] |
GHISELLI A, SERAFINI M, NATELLA F, et al. Total antioxidant capacity as a tool to assess redox status:critical view and experimental data[J]. Free Radical Biology and Medicine, 2000, 29(11): 1106-1114. DOI:10.1016/S0891-5849(00)00394-4 |
| [19] |
姜宁, 杨坤, 张爱忠, 等. 谷胱甘肽对育肥羊机体抗氧化能力的影响[J]. 饲料工业, 2015, 36(23): 45-48. |
| [20] |
FANG J, MENON M, KAPELLE W, et al. EPO modulation of cell-cycle regulatory genes, and cell division, in primary bone marrow erythroblasts[J]. Blood, 2007, 110(7): 2361-2370. DOI:10.1182/blood-2006-12-063503 |
| [21] |
许海霞.高海拔和低海拔部分家畜促红细胞生成素(EPO)基因遗传多态性研究[D].硕士毕业论文.兰州: 甘肃农业大学, 2012.
|
| [22] |
包鹏甲, 裴杰, 阎萍, 等. 藏羊EPO基因遗传多样性与高原低氧适应性[J]. 江苏农业学报, 2014, 30(3): 581-585. |
| [23] |
吴周林, 赵莉, 周贵凤, 等. 九龙牦牛EPO基因部分片段遗传多态性分析[J]. 当代畜牧, 2017(24): 23-25. |
| [24] |
谢静.甘肃鼢鼠(Myospalax cansus)EPO基因克隆及其mRNA在脑组织的表达研究[D].硕士学位论文.西安: 陕西师范大学, 2014.
|
| [25] |
张湑泽, 郭松长, 都玉蓉. 高原鼢鼠低氧适应研究进展[J]. 生命科学研究, 2015, 19(6): 554-558. |




