2. 中国农业科学院北京畜牧兽医研究所, 动物营养学国家重点实验室, 北京 100193;
3. 杭州康德权饲料有限公司包膜饲料添加剂省级重点农业企业研究院, 杭州 311107
2. State Key Laboratory of Animal Nutrition, Institute of Animal Science, Chinese Academy of Agricultural Sciences, Beijing 100193, China;
3. Provincial Key Agricultural Enterprise Research Institute of Encapsulated Feed Additive, Hangzhou King Techina Feed Co., Ltd., Hangzhou 311107, China
植酸酶是催化植酸水解为磷酸根和肌醇衍生物的一类酶,已在畜禽饲粮中广泛使用[1]。在植酸酶对蒸汽调质制粒耐受性的评估中,首先需要探讨植酸酶活性测定的影响因素与变异度以及是否可以准确地测定饲粮中植酸酶的活性。根据植酸酶对六磷酸肌醇(植酸)起始酶切位点的不同分为3位植酸酶和6位植酸酶[1-4]。两者在水解终产物中肌醇衍生物有所差别,但游离的磷酸根是一致的。因此,植酸酶活性的定量都是基于单位时间内释放出的磷酸根离子来确定[5-9],其中最常使用的测定方法为美国AOAC 2000.12[5]、欧盟ISO30024[10]和国家标准GB/T 18634—2009[11]方法。这3种方法在测定原理、溶液类型和测定步骤上大同小异。测定中都采用钼酸铵-偏钒酸铵与磷酸根离子显色来定量水解植酸释放出的磷。然而,本研究组前期预试验发现,钼酸钠、偏钒酸铵均可以螯合饲粮中的有机物形成絮状干扰物,且干扰强度与有机物的浓度有关。AOAC 2000.12[5]建立了以标准植酸酶溶液的活性对吸光度的多项式回归标准曲线,这表明植酸酶的稀释倍数可能会影响植酸酶活性的测定值。然而,鲜见相关研究报道植酸酶活性测定时缓冲液、饲料水溶性有机物的干扰程度以及测定结果的变异度。因此,本试验旨在探讨植酸酶活性测定中稀释液的种类、稀释倍数、待测液显色后离心速度对测定结果的影响,饲料原料对测定结果的干扰程度以及测定结果的日内、日间变异系数,为植酸酶产品评估中准确地测定植酸酶活性提供参考。
1 材料与方法 1.1 试验材料从中国市场上采购商品植酸酶,其基因来源于大肠杆菌,属于6-植酸酶。经毕赤酵母发酵、喷雾干燥、摇摆制粒等工艺生产,产品呈浅黄色颗粒状。实测该商品植酸酶活性为11 472 U/g,使用时样品经万能粉碎机粉碎约20 s。
1.2 试验饲粮根据王亚等[12]的饲粮配方组成,将玉米、豆粕粉碎过2 mm筛后,将维生素、微量元素、磷酸氢钙、石粉、氨基酸分别与豆粕等比逐级稀释后,再与其他成分混合制备成饲粮。
1.3 试验设计本试验分为4个部分。第1部分:考察国标方法中稀释缓冲液类型及溶液显色后离心速度对植酸酶活性测定结果的影响。采用2×3两因素完全随机设计,其中植酸酶来源分别为商品植酸酶和饲粮中植酸酶(植酸酶添加量4 g/kg);样品经提取后,稀释液分别为缓冲液1(乙酸/乙酸钠缓冲液)和缓冲液2(乙酸/乙酸钠+曲拉通X-100+牛血清白蛋白),显色静置10 min后离心速度分别设为3 000、5 000和8 000 r/min,每个处理4个重复。第2部分:考察植酸酶的稀释倍数对植酸酶活性测定结果的影响。以商品植酸酶和饲粮中植酸酶为考察对象,其中商品植酸酶的测定中稀释倍数分别设为150、200、250和300倍;饲粮中植酸酶的测定中稀释倍数分别设为5、10和15倍,每个处理4个重复。第3部分:考察饲料原料对植酸酶活性测定结果的影响。采用单样本比较设计,以玉米、豆粕、小麦麸、菜籽粕、棉籽粕为代表性饲料原料,植酸酶的添加量为4 g/kg,每个样品4个重复。第4部分:在前述内容的基础上,采用单因素完全随机设计,以测定日期为考察因素,测定日期设14个水平即14 d测定磷酸氢钠标准液与显色液结合后的吸光度值、商品植酸酶及饲粮中植酸酶活性的变异,每个处理4个重复。
1.4 植酸酶活性的测定方法植酸酶活性的测定参考GB/T 18634—2009[11]的方法,但反应体积为标准方法的1/2,其活性单位定义为:在37 ℃、pH为5.50条件下,每分钟从浓度为5.0 mmol/L的植酸钠溶液中释放1 μmol无机磷为1个植酸酶活性单位,以U/g风干样表示。缓冲液1和缓冲液2与GB/T 18634—2009[11]规定的配制方法一致。根据第1部分试验的结果,第2~4部分中提取液采用缓冲液2,稀释液采用缓冲液1。
1.5 数据处理与统计分析采用SAS 9.0统计软件Means模块计算基本统计量。对第1部分数据根据两因素方差分析的原理以GLM模块进行方差分析,出现交互效应时对各处理以LSMEAN进行t检验比较。对第2、4部分数据根据单因素方差分析的原理以GLM模块进行方差分析,以Duncan氏法进行多重比较,P < 0.05为差异显著。第3部分数据采用单样本t检验模块进行分析。磷酸二氢钾标准溶液磷含量对吸光度的线性回归采用REG模块进行分析。标准曲线斜率、截距的日间差异显著性采用GLM模块进行分析。标准曲线斜率、截距与植酸酶活性的相关性采用CORR模型进行分析。日内、日间及总变异系数参考蒋红卫等[13]方法,通过GLM模型得出SS总、SS日内、SS日间统计量,再计算变异系数。
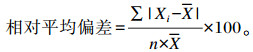
|
由表 2可知,稀释液类型显著影响了商品植酸酶活性的测定值(P < 0.05),其中缓冲液1的测定值显著低于缓冲液2的相应测定值(P < 0.05)。而离心速度对商品植酸酶活性的测定值无显著影响(P>0.05)。稀释液类型与离心速度对商品植酸酶活性的测定结果无显著交互作用(P>0.05)。
|
|
表 2 稀释液类型及离心速度对植酸酶活性测定结果的影响 Table 2 Effects of dilution solution category and centrifugal speed on determined activity results of phytase |
在稀释液类型及离心速度对饲粮中植酸酶活性测定的影响中,使用缓冲液1时,饲粮中植酸酶活性的测定值在3 000、5 000和8 000 r/min间无显著差异(P>0.05);而使用缓冲液2时,饲粮中植酸酶活性的测定值随离心速度的增加而显著升高(P < 0.05)。稀释液类型及离心速度对饲粮中植酸酶活性的测定存在显著的互作效应(P < 0.05)。
2.2 稀释倍数对植酸酶活性测定结果的影响由表 3可知,商品植酸酶和饲粮中植酸酶经缓冲液2提取后,随着稀释倍数的增加,稀释液与钼酸铵-偏钒酸铵显色液反应后的吸光度均线性降低(R2=0.986 6和0.922 3;P < 0.05);相应地,稀释液中植酸酶活性也随稀释倍数的增加呈线性降低(R2=0.982 3和0.922 5;P < 0.05)。稀释倍数显著影响商品植酸酶及饲粮中植酸酶活性的测定值(P < 0.05)。其中,商品植酸酶中植酸酶活性测定值随稀释倍数的增加呈先升高后下降,而饲粮中植酸酶活性测定值随稀释倍数的增加呈线性下降。
|
|
表 3 稀释倍数对植酸酶活性测定结果的影响 Table 3 Effects of dilution rate on determined activity results of phytase |
由表 4可知,玉米、菜籽粕和棉籽粕中未检测到内源植酸酶的活性,而豆粕以及小麦麸中检测出了内源植酸酶的活性。在饲料原料中添加植酸酶后,玉米中植酸酶总活性的实测值显著低于计算值(P < 0.05), 豆粕、小麦麸、菜籽粕和棉籽粕中植酸酶总活性的实测值显著高于计算值(P < 0.05)。
|
|
表 4 饲料原料对植酸酶活性测定结果的影响 Table 4 Effects of feed ingredients on determined activity results of phytase |
由表 5可知,在连续14 d测定期间,磷酸二氢钾溶液的磷摩尔浓度和吸光度的标准曲线中,斜率及截距均有显著差异(P < 0.05)。斜率与截距的平均相对偏差分别为1.58%和274.36%。在商品植酸酶及饲粮中植酸酶,测定日期间检测到的植酸酶活性均存在显著差异(P < 0.05)。商品植酸酶活性测定值的平均相对偏差为4.02%,日内变异系数为3.13%,日间变异系数为6.11%,总变异系数为6.68%。植酸酶活性与标准曲线的斜率及截距的相关系数分别为0.17(P=0.56)和0.39(P=0.17)。饲粮中植酸酶活性测定值的平均相对偏差为3.42%,日内变异系数为1.56%,日间变异系数为3.96%,总变异系数为4.19%。植酸酶活性与标准曲线的斜率及截距的相关系数分别为0.06(P=0.85)和0.39(P=0.17)。
|
|
表 5 不同测定日间标准曲线、商品植酸酶及饲粮中植酸酶活性的变异 Table 5 Variation in standard calibration lines and phytase activity determined in commercial phytase and diet phytase across determinations on different days |
根据植酸酶活性测定的基本原理可以推断,影响测定结果的因素包括底物、酶的提取、酶促反应过程以及底物或产物的定量方法[8]。在底物选择上,人们早期采用来自于稻谷的植酸钠(货号:Sigma P3168)[14],目前该试剂产品已停售。本试验在预试验中比较了Sigma(P8810)、BBI(货号:A600715)及国产食品级植酸钠(广东某品牌生产),发现前2个试剂在酶促反应上表现出底物不饱和而使测定值不成线性,且重复性差。而国产食品级植酸钠则既满足本底值低(吸光度 < 0.2),且测定值呈线性。因此,该植酸钠已成为国内植酸酶活性测定的通用底物。张丽英等[15]报道不同来源的植酸钠底物对植酸酶活性的测定值有影响。Singh[1]、Hirvonen等[4]报道不同植物饲料来源的植酸受植酸酶水解程度的变异大。闵兆升等[16]以植酸钠P3168比P8810作为植酸酶底物时发现,P3168本底颜色较浅,且标准曲线的精度较高,而用P8810作为底物的植酸酶活性测定值比P3168高。Madsen等[17]通过高效液相色谱法证明4种植酸底物(Sigam P0109、P8810、P8810rc、Merck 407125)的六磷酸肌醇含量存在差异,其中P8810产品的六磷酸肌醇含量为73%~78%,由此导致了植酸的来源会显著影响植酸酶活性的测定结果。
在测定固体植酸酶或加入饲粮中的植酸酶活性时,首先都需要通过合适的提取液将固体中的植酸酶提取到溶液中。在标准方法中,GB/T 18634—2009[11]采用加曲拉通-100和牛血清白蛋白的乙酸/乙酸钠缓冲液作为植酸酶的提取液。AOAC 2000.12[5]采用添加氯化钙和吐温-20的乙酸/乙酸钠缓冲液作为提取液。EN ISO 30024—2009[10]采用吐温-20的去离子水溶液提取植酸酶。这主要考虑亲水性非离子表面活性剂促进脂溶性物质分散和利用蛋白质防止植酸酶的分解。因此,不同的测定方法在提取液的组成上存在一些差异。Weaver等[9]比较了柠檬酸(0.2 mol/L, pH=5.5)、乙酸盐加入牛血清白蛋白和曲拉通X-100(0.25 mol/L,pH=5.0)和乙酸盐(0.2 mol/L,pH=5.5)3种提取液对2种植酸酶活性测定的影响,其中一种植酸酶受提取液类型的影响较少,而另一种植酸酶用第2种缓冲液提取后活性比其他2种提取液测定的活性约高15%。这可能是乙酸盐加入牛血清白蛋白和曲拉通X-100能更有效地提取植酸酶。
在植酸酶活性的测定中,商品植酸酶产品因其活性含量高,提取植酸酶后需要将酶液稀释到合理的范围再测定。AOAC 2000.12[5]、Engelen等[14]使用的稀释液由乙酸盐缓冲液加氯化钙和吐温-20组成。EN ISO 30024—2009[10]采用的稀释液由乙酸盐缓冲液加吐温-20组成。GB/T 18634—2009[11]则仍采用提取液作为稀释液。由此可见,现有方法在稀释液的选择上变化较大。由于从样品中提取植酸酶后溶于缓冲液的物质及稀释液中的物质都会进入酶促反应体系中,而钼酸铵-偏钒酸铵显色液可与某些有机物结合形成絮状沉淀,从而导致吸光度增加。因此,在显色后通过离心(离心速度在3 000~20 000×g,3~20 min[5-6, 10])的方法排除干扰。本试验中,稀释液1为乙酸盐缓冲液,而稀释液2为缓冲液1的基础上加入了曲拉通-100和牛血清白蛋白。离心速度对缓冲液1稀释植酸酶的活性测定值无显著影响,但影响了缓冲液2稀释饲粮中植酸酶活性测定值。这表明缓冲液2中的有机物与饲粮中溶解的有机物叠加后对植酸酶的测定值产生了干扰。因此,无机的稀释液1更适合作为植酸酶活性测定时的稀释液。这与Kim等[6]使用柠檬酸缓冲液作为稀释液,Qvirist等[8]用去离子水作为稀释液类似。EN ISO 30024—2009[10]、GB/T 18634—2009[11]都认为稀释倍数与稀释液中植酸酶活性的测定值呈线性关系。本试验中随着稀释倍数的增加,溶液中植酸酶活性与吸光度均呈显著的线性关系,表明本方法具有较好的线性可加。这与EN ISO 30024—2009[10]相一致,而与AOAC 2000.12[5]表达的呈二次方关系相区别。同时,本试验中稀释倍数对商用植酸酶活性的测定值无规律性影响,而随着稀释倍数的增加饲粮中植酸酶的活性测定值则降低。然而,最大相对偏差都在8%以内,属于标准规定的允许误差范围[11]。
3.2 饲料原料对植酸酶活性测定值结果的影响麦类饲料及副产品如小麦、大麦、燕麦、小麦麸中含有较高的内源植酸酶活性,而玉米、大豆、菜籽粕、葵花粕中内源植酸酶的活性在100 U/kg以下[7, 18-20]。不同植物来源的内源植酸酶在最适温度和最适pH上与商品植酸酶有较大的差异[1]。本试验中,玉米、菜籽粕、棉籽粕均未检测到植酸酶的活性,这是由于当前方法检测稀释液中植酸酶活性的下限为0.052 U/mL,当饲料原料的植酸酶活性低于100 U/kg时,则每10 mL提取液需要溶解10 g饲料原料才能达到植酸酶活性的检测限。这一条件下植酸酶显然是无法完全提取到缓冲液中。小麦麸的植酸酶活性为3.03 U/g,该值介于韩延明等[18]和Viveros等[19]的结果之间。豆粕的植酸酶活性为1.04 U/g,该值比现有文献[19]报道的大豆中植酸酶的活性约高30倍。Loop等[21]的试验结果表明,饲粮中添加植酸酶经调质制粒后27个组中有6个组的植酸酶活性超过了调制前的活性,最高达到了140%。因此,本试验中豆粕中溶解的有机物是否干扰了内源植酸酶的测定还需要进一步研究。玉米降低了植酸酶活性测定值,而豆粕、小麦麸、菜籽粕和棉籽粕均增加了植酸酶的活性测定值。这是否是GB/T 18634—2009[11]对2种以上的植酸酶(内源植酸酶与商品植酸酶)因酶学特性的差异而在活性上不具有可加性,或是饲料原料中植酸溶解进入了反应体系中改变了底物的浓度,还是其他有机物的干扰尚需要进一步确定。
3.3 植酸酶活性测定的变异程度Engelen等[14]组织了108个实验室分2批研究了AOAC 2000.12[5]测定饲粮中植酸酶活性在实验室间的重复性,结果表明在108个数据中18个数据出现了明显的异常。剔除异常数据后,重复性相对标准差为2.5%~8.6%,再现性相对标准差为14.0%~27.6%。Gonzalez等[22]组织9个实验室研究了ISO 30024[10]测定商品饲粮及商品植酸酶中植酸酶活性在实验室间的重复性,其重复性相对标准差为2.6%~12.0%,再现性相对标准差为7.7%~23.0%。上述试验结果表明,不同实验室间采用同一方法测定的植酸酶活性存在较大的变异。本试验中,不同测定日间标准曲线的斜率、截距存在显著差异。斜率的相对偏差较小,而截距的相对偏差较大。这表明每天需要作标准曲线用于植酸酶活性的计算。在14 d测定中,第5天的商品植酸酶活性的测定值明显低于其他时间的测定值,该值可以通过SAS Univariate分析予以从统计学的角度剔除。在未剔除的情况下,本方法测定商品植酸酶及饲粮中植酸酶的活性相对平均相对偏差均低于5%,处于标准允许(8%)的误差范围内。总变异系数介于Engelen等[14]和De La Huebra等[22]报道的实验室重复性标准差之内,这表明本试验所用方法可以获得满意的重复性。
4 结论乙酸/乙酸钠缓冲液更适合作为植酸酶测定中的稀释液,饲粮中植酸酶活性的测定值受离心速度及稀释倍数的影响,而商品植酸酶的活性测定值仅受稀释倍数的影响。虽然饲料原料明显干扰了植酸酶活性的测定,但饲粮中植酸酶活性测定值的变异程度低于商品植酸酶。
| [1] |
SINGH P K. Significance of phytic acid and supplemental phytase in chicken nutrition:a review[J]. World's Poultry Science Journal, 2008, 64(4): 553-580. DOI:10.1017/S0043933908000202 |
| [2] |
WOYENGO T A, NYACHOTI C M. Review:supplementation of phytase and carbohydrases to diets for poultry[J]. Canadian Journal of Animal Science, 2011, 91(2): 177-192. DOI:10.4141/cjas10081 |
| [3] |
SINGH B, SATYANARAYANA T. Fungal phytases:characteristics and amelioration of nutritional quality and growth of non-ruminants[J]. Journal of Animal Physiology and Animal Nutrition, 2015, 99(4): 646-660. DOI:10.1111/jpn.12236 |
| [4] |
HIRVONEN J, LILJAVIRTA J, SAARINEN M T, et al. Effect of phytase on in vitro hydrolysis of phytate and the formation of myo-inositol phosphate esters in various feed materials[J]. Journal of Agricultural and Food Chemistry, 2019, 67(41): 11396-11402. DOI:10.1021/acs.jafc.9b03919 |
| [5] |
AOAC.Phytase activity in feed-colorimetric enzymatic method[S].Washington, D.C.: AOAC International, 2002.
|
| [6] |
KIM T W, LEI X G. A improved method for a rapid determination of phytase activity in animal feed[J]. Journal of Animal Science, 2005, 83(5): 1062-1067. DOI:10.2527/2005.8351062x |
| [7] |
SHEN Y R, YIN Y L, CHAVEZ E R, et al. Methodological aspects of measuring phytase activity and phytate phosphorus content in selected cereal grains and digesta and feces of pigs[J]. Journal of Agricultural and Food Chemistry, 2005, 53(4): 853-859. DOI:10.1021/jf049116v |
| [8] |
QVIRIST L, CARLSSON N G, ANDLID T. Assessing phytase activity-methods, definitions and pitfalls[J]. Journal of Biological Methods, 2015, 2(1): e16. |
| [9] |
WEAVER J D, ULLAH A H J, SETHUMADHAVAN K, et al. Impact of assay conditions on activity estimate and kinetics comparison of Aspergillus niger PhyA and Escherichia coli AppA2 phytases[J]. Journal of Agricultural and Food Chemistry, 2009, 57(12): 5315-5320. DOI:10.1021/jf900261n |
| [10] |
ISO.ISO 30024 Animal feeding stuffs-determination of phytase activity[S].Switzerland: ISO, 2009.
|
| [11] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB/T18634—2009饲用植酸酶活性的测定分光光度法[S].北京: 中国标准出版社, 2009.
|
| [12] |
王亚, 赵峰, 张虎, 等. 单宁酸对生长猪胃-小肠仿生消化中消化酶活性及饲粮粗蛋白消化率的影响[J]. 畜牧兽医学报, 2020, 51(6): 1332-1341. |
| [13] |
蒋红卫, 夏结来.基于样本变异系数的组间与组内变异统计量[C]//中国卫生统计学术交流大会论文集.武汉: 中国卫生信息学会, 2006: 1-7.
|
| [14] |
ENGELEN A J, VAN DER HEEFT F C, RANDSDORP P H G, et al. Determination of phytase activity in feed by a colorimetric enzymatic method:collaborative interlaboratory study[J]. Journal of AOAC International, 2001, 84(3): 629-633. DOI:10.1093/jaoac/84.3.629 |
| [15] |
张丽英, 何丽花, 李彬, 等. 国标绝对法测定植酸酶产品活性的关键控制点[J]. 饲料工业, 2008, 29(14): 47-49. |
| [16] |
闵兆升, 郭会明, 洪厚胜. 饲用植酸酶酶活测定过程中底物的影响研究[J]. 中国饲料, 2014(19): 30-32. |
| [17] |
MADSEN C K, BREARLEY C A, BRINCH-PEDERSEN H, et al. Lab-scale preparation and QC of phytase assay substrate from rice bran[J]. Analytical Biochemistry, 2019, 578: 7-12. DOI:10.1016/j.ab.2019.04.021 |
| [18] |
韩延明, 周安国, 杨凤. 常用植物性饲料中的植酸酶活性及加热温度的影响[J]. 动物营养学报, 1995, 7(3): 21-26. |
| [19] |
VIVEROS A, CENTENO C, BRENES A, et al. Phytase and acid phosphatase activities in plant feedstuffs[J]. Journal of Agricultural and Food Chemistry, 2000, 48(9): 4009-4013. DOI:10.1021/jf991126m |
| [20] |
SLOMINSKI B A, DAVIE T, NYACHOTI M C, et al. Heat stability of endogenous and microbial phytase during feed pelleting[J]. Livestock Science, 2007, 109(1/2/3): 244-246. |
| [21] |
LOOP S A, LILLY K G S, SHIRES L K, et al. The phytase analytical activity of pelleted diets may not adequately describe efficacy in the bird[J]. Journal of Applied Poultry Research, 2012, 21(3): 492-501. DOI:10.3382/japr.2011-00384 |
| [22] |
DE LA HUEBRA M J G, ROBOUCH P, EMTEBORG H, et al. Application of the CEN/ISO standard for phytase activity measurements to a new phytase product:determination of a robust conversion factor by an interlaboratory study for screening feed samples[J]. Journal of AOAC International, 2019, 102(6): 1808-1813. DOI:10.1093/jaoac/102.6.1808 |




