2. 江苏省家禽科学研究所, 扬州 225125
2. Jiangsu Institute of Poultry Science, Yangzhou 225125, China
水浴电击晕是目前肉鸡屠宰行业中应用最广泛的一种宰前致晕方式[1]。基于动物和组织水平的研究显示,适宜的电击晕参数可以提高肉鸡肌肉的抗氧化能力,降低脂质氧化程度。研究表明,使用150 V/130 mA/60 Hz电击晕参数将肉鸡击晕后屠宰,能够降低屠宰后肉鸡胸肌中丙二醛(MDA)的含量,提高胸肌和髂腓肌中谷胱甘肽-S-转移酶(GSH-ST)活性,以及髂腓肌中超氧化物歧化酶(SOD)活性[2-3];使用65 V/86 mA/1 000 Hz电击晕参数将肉鸡击晕后屠宰,肉鸡腿肌中与核因子E2相关因子2(Nrf2)/抗氧化反应序列元件(ARE)抗氧化信号通路相关的抗氧化分子Nrf2、应激活化蛋白激酶1(JNK1)和应激活化蛋白激酶2(JNK2)基因表达量显著高于不致晕直接屠宰组和低频电刺激组[4]。在动物水平上,电刺激(电击晕)的电流通过从头到脚的循环,直接刺激了神经内分泌系统,干扰了心脏跳动节律,甚至产生心脏停博,同时电流也可直接刺激肌肉产生电生理反应,不同的电频率对击晕效果、肉品质影响和脂质过氧化的影响也不同,整个作用过程较为复杂。同动物试验相比,细胞试验对于试验条件更加严格,试验模型条件一致化,影响因素更容易控制。通过直接用电流刺激肉鸡的肌细胞,改变刺激频率,将有助于进一步阐述电击晕影响肌肉脂质氧化的作用机制。但是目前对于电击晕改善肌肉脂质氧化机制在细胞水平上的研究还较少,电刺激直接作用于肌肉细胞,改善肌肉细胞脂质氧化的研究更少。在氧化应激条件下,活性氧的过度积累会对细胞成分(包括核酸、蛋白质和脂质)以及其他生物大分子造成损害,甚至导致细胞死亡[5-6]。成肌细胞是含有肌丝的骨骼肌前体细胞,具有很强的增殖分化能力,胚胎期骨骼肌的生长发育主要依赖于成肌细胞的增殖分化[7]。现有研究发现,低频电刺激能够迅速改变骨骼肌成肌细胞细胞色素C等基因的表达[8];在45 V/5 Hz的强度下,电刺激大鼠的C2C12细胞会使细胞发生氧化应激,产生大量活性氧(ROS)并激活重要的抗氧化信号通路——Nrf2信号通路,同时启动该通路相关基因的表达,例如谷胱甘肽过氧化物酶(GSH-PX)等,发挥抗氧化作用[9]。此外,刘永等[10]研究也表明,用适宜的电刺激参数刺激大鼠的C2C12细胞,可以促进Nrf2入核,使Nrf2与抗氧化元件ARE结合,启动抗氧化作用。适宜的电击晕(或电刺激)频率可以激活肉鸡[2, 4]骨骼肌和大鼠[10]骨骼肌成肌细胞Nrf2/ARE抗氧化信号通路,发挥抗氧化作用。但是电击晕提高肉鸡肌肉抗氧化能力的机制研究较少,电刺激频率影响肉鸡骨骼肌成肌细胞抗氧化能力及对Nrf2/ARE信号通路中相关抗氧化基因表达影响的研究尚未见报道。因此,为了更深入地理解电击晕通过Nrf2/ARE通路调控肉鸡肌肉抗氧化能力的机制,本试验以肉鸡成肌细胞为模型,减少了动物试验中体内外的影响因素,通过电刺激体外培养的肉鸡胸肌成肌细胞,观察其对肉鸡成肌细胞抗氧化能力及抗氧化基因表达的影响,探索适宜的体外电刺激频率及其对肉鸡成肌细胞Nrf2/ARE信号通路中部分抗氧化基因的mRNA相对表达量的影响,为研究电刺激通过Nrf2/ARE通路调控肉鸡骨骼肌成肌细胞抗氧化能力的深层机制奠定试验和理论基础。
1 材料与方法 1.1 试验试剂及仪器试验所用的Ⅰ型胶原酶、磷酸盐缓冲液(PBS)、牛血清白蛋白(BSA)、4-羟乙基哌嗪乙磺酸(HEPES)和曲拉通X-100(Triton X-100)购自北京索莱宝生物科技有限公司;DMEM/F12高糖培养基和D-HANKS平衡盐溶液购自美国HyClone公司;胎牛血清和青链霉素混合液购自美国Gibco公司;0.25%胰蛋白酶和BCA试剂盒购自上海碧云天生物有限责任公司;过氧化氢(H2O2)含量测定试剂盒、微量还原型谷胱甘肽(GSH)含量试剂盒、乳酸脱氢酶(LDH)活性测试盒和超氧化物歧化酶(SOD)活性试剂盒购自南京建成生物工程研究所;总RNA提取试剂盒(DP)购自天根生化科技(北京)有限公司;PrimerScriptTM RT Master Mix(perfect real time)反转录试剂盒购自日本TaKaRa公司;荧光定量PCR试剂盒(QuantiNova SYBR Green PCR Kit)购自德国QIAGEN公司。
种蛋孵化箱购自德州市科裕孵化设备有限公司;生物安全柜(BSC-1300ⅡA2)购自苏州安泰空气技术有限公司;二氧化碳培养箱(3111)购自美国Thermo公司;荧光倒置显微镜(DMI3000)购自德国Leica公司;酶标仪(A-5028)购自瑞士TECAN公司;程控电刺激器(YC-2)购自成都仪器厂;NanoDrop2000购自美国Thermo Scientific公司;荧光定量PCR扩增仪(step one plus)购自美国Applied Biosystems公司;PCR扩增仪(9902)购自美国Applied Biosystems公司。
1.2 肉鸡成肌细胞的提取培养及分化本试验种蛋来自于中国农业科学院家禽研究所邵伯试验基地的快速型肉鸡三黄鸡。将种蛋消毒孵化至13胚龄,取胸肌组织,采用差速贴壁法提取成肌细胞[11]。待细胞长满培养皿80%的时候用胰酶消化,计数6遍后传代,传代数量为1×106个/皿(直径3.5 cm)。传代后当细胞贴壁生长至80%以上时,更换2%的马血清完全培养基进行分化培养,分化1~2 d后可见明显的肌管。
1.3 电刺激处理及试验分组在细胞分化培养3 d后,将细胞分为对照组和5个电刺激组,每组3个重复。以中国交流电频率(50 Hz)为基础,50~1 000 Hz是生产上常用的频率变化范围。另外结合我们团队之前在肉鸡上的试验探索和细胞上多次独立的预试验探索,在本研究中5个电刺激组的刺激频率分别为50、160、320、640和1 280 Hz,刺激电压均为30 V,时间均为10 s。电刺激时先用酒精棉球擦拭程控电刺激器的刺激输出线以及金属夹,将金属夹夹在细胞培养皿两侧,夹子伸入液面以下,启动刺激程序,刺激结束后,将细胞放入二氧化碳培养箱中继续培养30 min后收集细胞,以模拟生产中从肉鸡电击晕到采集肌肉组织冷冻的时间间隔。对照组配搭电刺激设备但不进行电刺激处理,与电刺激组同时收样。
1.4 电刺激对肉鸡成肌细胞损伤程度的判定 1.4.1 细胞形态学观察电刺激前对细胞培养皿分别编号后在倒置显微镜下拍照(放大倍数为100倍),同时标记培养皿拍照的位置和方向(以光圈为基准)。其后在相同位置对电刺激后继续培养30 min的细胞进行拍照。对比刺激前后细胞肌管的贴壁状态、脱落情况、肌管与肌管之间的间隙大小和肌管轮廓的清晰程度。
1.4.2 肉鸡成肌细胞培养液中LDH活性测定在生物安全柜中收集电刺激后继续培养30 min的成肌细胞培养液,用于检测细胞损伤程度。采用LDH试剂盒进行检测,按试剂盒说明书进行操作,结果以每升细胞培养液中LDH的活力单位表示。
1.5 肉鸡成肌细胞脂质氧化和抗氧化能力检测将电刺激后继续培养30 min的细胞培养皿放置在生物安全柜中,吸干培养液,用含双抗的无Ca2+和Mg2+的PBS将细胞冲洗2遍,吸出PBS,每个培养皿中加入500 μL 2% Triton X-100,冰上裂解15 min,之后4 ℃、12 000 r/min离心10 min,取上清检测肉鸡成肌细胞的H2O2、GSH含量及SOD活性以及总蛋白含量,检测方法同试剂盒说明书,结果根据细胞裂解液中每克蛋白所含H2O2、GSH的量或SOD的活力单位表示。
1.6 肉鸡成肌细胞抗氧化相关基因的检测在刺激完并培养30 min后的成肌细胞培养皿中加入1 mL Trizol,使细胞充分裂解,将裂解液收集于无RNase的离心管中进行RNA抽提,抽提方案参考天根生化科技(北京)有限公司总RNA提取试剂盒中的说明书进行。吸取2 μL RNA溶液,在NanoDrop2000微量核酸测定仪上检测RNA的浓度和纯度。cDNA反转录根据日本TaKaRa公司的PrimerScriptTM RT Master Mix试剂盒进行。反应体系为20 μL,反应浓度为200 μg/μL,最后稀释成50 μg/μL进行荧光定量PCR(Q-PCR)检测。基因引物由上海生工生物有限公司合成,选用管家基因β-肌动蛋白(β-actin)作为内参基因,引物序列见表 1。
|
|
表 1 荧光定量PCR中使用的基因引物 Table 1 Gene primers used in fluorescent quantitative PCR |
试验结果以“平均值±标准误”来表示,使用Excel 2007软件对原始数据进行处理,采用SPSS 20.0统计软件的one-way ANOVA程序进行显著性分析,并采用Duncan氏法进行组间多重比较,以P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析 2.1 电刺激对肉鸡成肌细胞损伤程度的影响 2.1.1 不同电刺激频率电刺激对肉鸡成肌细胞形态的影响肉鸡成肌细胞在不同频率电刺激前后的形态变化如图 1所示。由图可见,不同电刺激参数刺激完继续培养30 min后的各组成肌细胞均生长良好,贴壁牢固,均未见明显脱落或漂浮状态;肌管边缘清晰,肌管与肌管之间的间隙较刺激前相比未见明显增大。

|
图A~E分别代表 50、160、320、640和1 280 Hz组在电刺激前的细胞形态;图A’~E’分别代表对50、160、320、640和1 280 Hz组进行电刺激10 s后再培养30 min时的细胞形态。 Figures A to E represents the myoblast morphology of groups 50, 160, 320, 640 or 1 280 Hz, respectively, before electrical stimulation. Figures A' to E' represents the myoblast morphology of groups 50, 160, 320, 640 or 1 280 Hz, respectively, after electrical stimulation for 10 s and then cell culture for 30 min. 图 1 肉鸡成肌细胞形态在不同频率电刺激前后的对比 Fig. 1 Comparison of broiler myoblast morphology pre- and post- electrical stimulation using different frequencies (100 ×) |
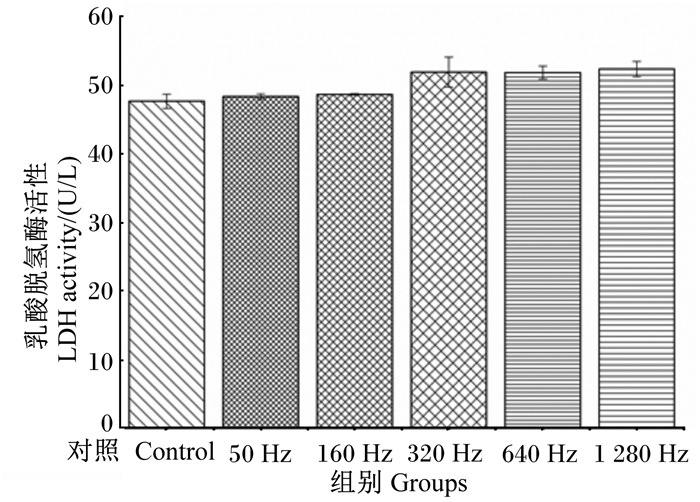
如图 2所示,在30 V电压下,使用不同的电刺激频率刺激已分化3 d的肉鸡成肌细胞10 s,电刺激各组的培养液中的LDH活性与对照组相比,有少量增加,但是各组之间细胞培养液中的LDH活性无显著差异(P>0.05)。
|
无上标表示各组间无显著差异(P>0.05)。 No superscript means no significant difference among groups (P > 0.05). 图 2 不同电刺激频率对肉鸡成肌细胞培养液LDH活性的影响 Fig. 2 Effects of different electrical stimulating frequencies on activity of LDH in myoblasts culture medium of broilers |
如表 2所示,在固定电压30 V,刺激时间10 s的情况下,320 Hz组细胞H2O2含量显著低于50、640和1 280 Hz组(P<0.05),GSH含量和SOD活性显著高于对照组和640 Hz组(P<0.05)。此外,1 280 Hz组细胞中H2O2含量较高,与对照组和320 Hz组存在显著差异(P<0.05),GSH含量和SOD活性也显著高于对照组和640 Hz组(P<0.05)。
|
|
表 2 不同电刺激频率对肉鸡成肌细胞脂质氧化和抗氧化能力的影响 Table 2 Effects of different electrical stimulating frequencies on lipid oxidative and antioxidant capacity in myoblasts of broilers |
如表 3所示,在固定电压30 V,刺激时间10 s的情况下,320 Hz组成肌细胞中Nrf2、Kelch样环氧氯丙烷相关蛋白1(Keap1)和NAD(P)H醌氧还原酶1(NQO1)的mRNA相对表达量显著高于50、160、640和1 280 Hz组(P<0.05)。对照组成肌细胞中Keap1和NQO1的mRNA相对表达量也显著高于50、160、640和1 280 Hz组(P<0.05)。此外,320 Hz组细胞中谷胱甘肽-S-转移酶T1(GSTT1)和血红素氧合酶-1(OH-1)的mRNA相对表达量最高,320 Hz组的GSTT1的mRNA相对表达量与其他各组存在显著差异(P<0.05),OH-1的mRNA相对表达量与除160 Hz组外的其他各组存在显著差异(P<0.05)。
|
|
表 3 不同电刺激频率对肉鸡成肌细胞Nrf2/ARE通路中抗氧化相关基因mRNA相对表达量的影响 Table 3 Effects of different electrical stimulating frequencies on mRNA relative expression of antioxidant-related genes in myoblasts Nrf2/ARE signaling pathway of broilers |
有研究表明,电刺激参数能够影响细胞生长和形态变化[12]。本次试验中,在固定低压30 V的情况下,改变电刺激频率没有对肉鸡成肌细胞的形态产生明显变化。魏严[13]也发现,改变电刺激频率和电压均未对大鼠的心肌细胞形态和生长状况产生显著影响。但使用1 Hz/3 V电刺激参数每隔24 h刺激家兔肋软骨细胞20 min,连续刺激3 d,发现细胞生长良好,分布密集,数量明显增加,而电压增加到5 V,细胞数量明显减少,分布稀疏,形态由之前的梭型演变为不规则形状,生长状态不佳[12],与本试验结果不同的原因可能是本试验采用了固定电压只改变频率的处理,另外,与电刺激装置、刺激方式以及细胞种类不同有关。
LDH是一种存在于细胞浆内的催化酶,参与糖酵解过程。在细胞的离体培养过程中,若细胞受到损伤,细胞膜破损,LDH会由细胞渗透至培养液中,因此,细胞培养液中LDH的活性强弱可以用来衡量细胞的损伤程度[14]。本研究与董云峰等[9]研究结果相似,不同的电刺激参数刺激后,细胞培养液中的LDH活性无显著差异。从细胞形态和细胞培养液中LDH活性的结果中可以得出,本试验使用电刺激的强度和时间并没有引起大量细胞的细胞膜破损,可以采用此电刺激强度和时间来进行试验。
3.2 不同电刺激频率对肉鸡成肌细胞脂质氧化和抗氧化能力的影响当骨骼肌成肌细胞受到电刺激后,细胞内ROS含量会迅速增加并激活抗氧化系统使抗氧化物质GSH和SOD等发挥抗氧化作用,随着电刺激频率的增加,细胞内由自由基导致的H2O2含量也会显著增加[15-16]。研究表明,H2O2是引起细胞氧化应激的重要因素之一[17]。当细胞中的H2O2达到一定含量时,随着的H2O2含量提高,细胞中抗氧化酶SOD、过氧化氢酶(CAT)和GSH-PX活性下降[18]。本试验结果表明,对照组和320 Hz组细胞H2O2含量低于50、640和1 280 Hz组,GSH含量和SOD活性都显著高于对照组和640 Hz组。与本试验结果相似的是,在前期研究结果中,我们发现使用400 Hz频率电击晕后屠宰,肉鸡腿肌中MDA含量显著低于160和1 000 Hz组[3]。这说明频率在300~400 Hz电刺激或电击晕能够激活机体的抗氧化信号通路,而刺激频率较低时,机体产生的ROS较少,不足以激活抗氧化信号通路发挥防氧化作用,刺激频率过高,则会破坏机体氧化与抗氧化平衡,使脂质氧化产物再次堆积。本试验结果表明,电刺激引起了细胞内H2O2的堆积,320 Hz/30 V的刺激条件激活了细胞的抗氧化系统,细胞内抗氧化物质GSH和SOD活性较高,清除了部分自由基和脂质氧化产物,具有提高成肌细胞抗氧化作用、维持氧化平衡的潜能。而随着电刺激频率的提高,细胞内H2O2再一次堆积,氧化与抗氧化平衡被打破。根据试验结果推断,过低或过高的电刺激频率都不利于成肌细胞发挥积极有效的抗氧化作用。
3.3 不同电刺激频率对肉鸡成肌细胞Nrf2/ARE通路中抗氧化相关基因表达的影响Nrf2/AER信号通路是细胞对抗氧化损伤的主要通路,它通过调控下游一系列Ⅱ相解毒酶和抗氧化基因的表达,如OH-1、NQO1和SGTT1等,在细胞、组织和器官的抗氧化损伤中发挥着重要的作用[19]。Ⅱ相解毒酶基因GSTs和NQO1的上调幅度与Nrf2蛋白增加量呈正相关,它们通过增加活性氧和脂质氧化产物的亲水性,使有害物质排出体外[20-21]。抗氧化蛋白酶OH-1可以提高机体内源性抗氧化能力,是维持体内氧化还原平衡的重要因素[18]。在正常生理状态下,Nrf2以抑制的状态存在于细胞质中,与Keap1偶联。当细胞受到电刺激时,细胞质中的Nrf2与Keap1分离,Nrf2被磷酸化进入细胞核,通过小Maf结合蛋白与抗氧化反应元件ARE结合并启动Nrf2/AER信号通路[22]。研究表明,Keap1和Nrf2的蛋白表达量在细胞质中呈正相关,在细胞核中呈负相关[23-24];同本研究结果一致,二者在细胞中的总mRNA表达量呈现相同的变化规律[23-24]。此外,董合玲等[25]研究发现,电刺激能够提高抗氧化酶5′-磷酸腺苷活化蛋白激酶(AMPK)的蛋白表达量,其中,AMPK对减少活性氧和自由基的生产、改善细胞生存环境方面发挥着重要的作用[26]。在本试验研究中,320 Hz组的成肌细胞中Nrf2、Keap1、NQO1和GSTT1的mRNA相对表达量都显著高于其他电刺激组,对照组的成肌细胞中Nrf2、Keap1、NQO1的mRNA相对表达量也显著高于其他电刺激组。结合前文中320 Hz组的H2O2含量也显著低于其他电刺激组,我们推测可能320 Hz的电刺激通过激活Nrf2/AER信号通路减少了H2O2的含量。反过来讲,过高含量的H2O2也可能抑制了Nrf2/AER抗氧化应答途径,从而降低了Nrf2/ARE信号通路中相关抗氧化基因的mRNA相对表达量;该假设与齐晓龙[27]的试验推论一致,齐晓龙[27]用H2O2处理蛋鸡肝细胞建立氧化应激模型时发现对照组抗氧化基因应激活化蛋白激酶(JNK、Nrf2上游的信号分子)的mRNA表达量显著低于H2O2处理组。他们认为高含量的H2O2可能触发了抗氧化相关转录因子与抗氧化酶顺式反应元件相结合,促进抗氧化酶基因表达的相反应答途径,即降低了Nrf2/ARE信号通路中相关抗氧化基因的mRNA相对表达量[25],其作用机制有待进一步研究。由此表明,320 Hz/30 V电刺激激活了成肌细胞的抗氧化信号通路,发挥了抗氧化作用。对照组与320 Hz/30 V组大部分抗氧化基因的mRNA表达量无显著差异的原因可能是电刺激能够在短时间内启动抗氧化信号通路,提高抗氧化基因的相对表达量,而在刺激后继续培养30 min的过程中,细胞中的氧化与抗氧化再一次达到了平衡状态。而在刘永等[10]电刺激大鼠的C2C12细胞研究中发现,随着电刺激频率的增加,Nrf2蛋白转位入核也呈增加趋势,Nrf2蛋白转位入核与电刺激频率存在依赖性,造成这种差异的原因可能与试验动物或电刺激参数不同有关。因此在本试验条件下,使用320 Hz/30 V/10 s电刺激参数可以提高Nrf2/ARE信号通路中抗氧化相关基因表达量,增强细胞的抗氧化功能。在减少外界影响因素干扰的情况下,证实了使用适宜的电击晕参数击晕肉鸡能够通过调控Nrf2/AER信号通路降低肌肉脂质氧化程度;电刺激对肉鸡成肌细胞Nrf2/ARE信号通路发挥抗氧化作用产生了一定的影响,对于其作用机制有必要进行深入探讨。
4 结论本研究结果表明,不同的电刺激频率可以改变肉鸡骨骼肌成肌细胞的抗氧化功能和Nrf2/ARE信号通路的基因表达变化。在固定电压30 V、刺激10 s的情况下,使用320 Hz频率电刺激可以激活肉鸡成肌细胞的抗氧化信号通路,提高Nrf2/ARE信号通路中部分抗氧化相关基因的mRNA相对表达量,发挥抗氧化作用,而不影响细胞形态或引起明显的细胞膜破损。
| [1] |
黄继超, 王鹏, 徐幸莲, 等. 肉鸡宰前击晕研究进展[J]. 食品科学, 2013, 34(11): 344-347. |
| [2] |
XU L, ZHANG H J, YUE H Y, et al. Low-current & high-frequency electrical stunning increased oxidative stress, lipid peroxidation, and gene transcription of the mitogen-activated protein kinase/nuclear factor-erythroid 2-related factor 2/antioxidant responsive element (MAPK/Nrf2/ARE) signaling pathway in breast muscle of broilers[J]. Food Chemistry, 2018, 242: 491-496. DOI:10.1016/j.foodchem.2017.09.079 |
| [3] |
胥蕾.致晕方法影响肉仔鸡肉品质的机理及脂质过氧化调控[D].博士学位论文.北京: 中国农业科学院, 2011. http://d.wanfangdata.com.cn/thesis/Y1932927
|
| [4] |
XU L, ZHANG H J, WAN X L, et al. The evaluation of pre-slaughter low-current/high-frequency ES on lipid oxidative stability and antioxidant status in thigh muscle of broilers[J]. International Journal of Food Science and Technology, 2019. DOI:10.1111/ijfs.14402 |
| [5] |
KREGEL K C, ZHANG H J. An integrated view of oxidative stress in aging:basic mechanisms, functional effects, and pathological considerations[J]. American Journal of Physiology.Regulatory, Integrative and Comparative Physiology, 2007, 292(1): R18-R36. DOI:10.1152/ajpregu.00327.2006 |
| [6] |
FINKEL T. Signal transduction by reactive oxygen species[J]. Journal of Cell Biology, 2011, 194(1): 7-15. DOI:10.1083/jcb.201102095 |
| [7] |
李婷婷.京海黄鸡成肌分化关键mRNAs, IncRNAs和miRNAs筛选[D].博士学位论文.扬州: 扬州大学, 2018. https://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CDFD&dbname=CDFD&filename=1018140102.nh
|
| [8] |
FROST R A, NYSTROM G J, LANG C H. Tumor necrosis factor-α decreases insulin-like growth factor-Ⅰ messenger ribonucleic acid expression in C2C12 myoblasts via a Jun N-terminal kinase pathway[J]. Endocrinology, 2003, 144(5): 1770-1779. DOI:10.1210/en.2002-220808 |
| [9] |
董云峰, 赵秀峰, 徐晓阳. 电刺激对C2C12肌管自由基代谢及Nrf2/ARE信号通路的影响[J]. 中国运动医学杂志, 2017, 36(12): 1066-1071. |
| [10] |
刘永, 潘其乐, 罗冬梅. 电刺激对体外培养C2C12细胞抗氧化能力的影响[J]. 北京体育大学学报, 2014, 37(5): 67-71. |
| [11] |
LUO W, WU H, YE Y, et al. The transient expression of miR-203 and its inhibiting effects on skeletal muscle cell proliferation and differentiation[J]. Cell Death and Disease, 2014, 5(7): e1347. DOI:10.1038/cddis.2014.289 |
| [12] |
刘小利, 李慧娟. 电刺激对软骨细胞增殖及细胞内Ca2+浓度的影响[J]. 山西医科大学学报, 2018, 49(8): 912-916. |
| [13] |
魏严.体外培养心肌细胞对力、电刺激的生物学响应的研究[D].硕士学位论文.北京: 中国人民解放军军事医学科学院, 2008. http://cdmd.cnki.com.cn/Article/CDMD-90106-2008117522.htm
|
| [14] |
LOBNER D. Comparison of the LDH and MTT assays for quantifying cell death:validity for neuronal apoptosis?[J]. Journal of Neuroscience Methods, 2000, 96(2): 147-152. DOI:10.1016/S0165-0270(99)00193-4 |
| [15] |
潘红英.电刺激C2C12收缩运动对自由基代谢影响的实验研究[D].硕士学位论文.广州: 华南师范大学, 2005. http://med.wanfangdata.com.cn/Paper/Detail?id=DegreePaper_Y715935
|
| [16] |
IRRCHER I, HOOD D A. Regulation of Egr-1, SRF, and Sp1 mRNA expression in contracting skeletal muscle cells[J]. Journal of Applied Physiology, 2004, 97(6): 2207-2213. DOI:10.1152/japplphysiol.00388.2004 |
| [17] |
ZHANG J K, YANG L, MENG G L, et al. Protective effect of tetrahydroxystilbene glucoside against hydrogen peroxide-induced dysfunction and oxidative stress in osteoblastic MC3T3-E1 cells[J]. European Journal of Pharmacology, 2012, 689(1/2/3): 31-37. |
| [18] |
吴志红.Nrf2-ARE通路在奶牛乳腺上皮细胞氧化损伤中的作用研究[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2017.
|
| [19] |
RAMOS-GOMEZ M, KWAK M K, DOLAN P M, et al. Sensitivity to carcinogenesis is increased and chemoprotective efficacy of enzyme inducers is lost in Nrf2 transcription factor-deficient mice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(6): 3410-3415. DOI:10.1073/pnas.051618798 |
| [20] |
HASAN W N W, KWAK M K, MAKPOL S, et al. Piper betle induces phase Ⅰ & Ⅱ genes through Nrf2/ARE signaling pathway in mouse embryonic fibroblasts derived from wild type and Nrf2 knockout cells[J]. BMC Complementary and Alternative Medicine, 2014, 14: 72. DOI:10.1186/1472-6882-14-72 |
| [21] |
张倩.金丝桃苷对Nrf2-ARE途径的影响及其对肝细胞氧化应激损伤的保护作用[D].硕士学位论文.重庆: 西南大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10635-1014260768.htm
|
| [22] |
BREWER A C, MURRAY T V A, ARNO M, et al. Nox4 regulates Nrf2 and glutathione redox in cardiomyocytes in vivo[J]. Free Radical Biology and Medicine, 2011, 51(1): 205-215. |
| [23] |
杨丽梦, 熊旭东. Keap1-Nrf2/ARE氧化应激信号通路与脓毒症急性肺损伤的相关性研究[J]. 临床急诊杂志, 2016(8): 590-592. |
| [24] |
王芳, 刘健, 叶英法, 等. 基于Keap1-Nrf2/ARE信号传导通路探讨黄芪多糖改善干燥综合征模型大鼠心功能的机制[J]. 中国中西医结合杂志, 2014, 34(5): 566-574. |
| [25] |
董合玲, 吴洪渊, 唐钰, 等. AMPK调控不同强度电刺激引起的C2C12肌管线粒体氧化应激[J]. 南方医科大学学报, 2018, 38(6): 742-747. |
| [26] |
LO VERSO F, CARNIO S, VAINSHTEIN A, et al. Autophagy is not required to sustain exercise and PRKAA1/AMPK activity but is important to prevent mitochondrial damage during physical activity[J]. Autophagy, 2014, 10(11): 1883-1894. DOI:10.4161/auto.32154 |
| [27] |
齐晓龙.共轭亚油酸对产蛋鸡抗氧化机能的影响[D].博士学位论文.北京: 中国农业科学院, 2013. http://cdmd.cnki.com.cn/Article/CDMD-82101-1013357150.htm
|



