2. 中国农业科学院与世界农用林业中心农用林业与可持续畜牧业联合实验室, 北京 100193
2. Chinese Academy of Agricultural Sciences and World Agroforestry Center Joint Lab on Agroforestry and Sustainable Animal Husbandry, Beijing 100193, China
外泌体是大多数细胞都能够主动分泌的直径为30~150 nm的双层膜结构的囊泡状小体[1],含有大量的蛋白质、RNA、脂质和DNA等[2-4]。大多数细胞可以通过内吞作用方式吸收外泌体,从而进行细胞间信息交流[5],外泌体在血管生成[6]、免疫应答[7]、抗肿瘤[8]等方面发挥重要的功能。尽管有大量的研究表明,培养细胞可以收集大量的外泌体[9],但是其产量还是不足以满足需求,从细胞培养到收集外泌体是一个费时费力又昂贵的过程,在提取过程中外泌体的质量也是一个不可控制的问题,这种情况阻碍了外泌体的功能研究[10]。
最近的研究表明,牛乳中含有大量的外泌体[11]。通过蛋白质组学功能富集分析,牛乳中外泌体富含与免疫相关的蛋白质,从而介导免疫应答[7];牛乳外泌体富含微小RNA(miRNA),可抵抗胃酸环境,从而被肠道吸收并发挥作用[12];牦牛乳来源的外泌体可以提高细胞抵抗缺氧环境的能力[13];骆驼乳来源的外泌体可以抑制乳腺癌肿瘤细胞生长[8]。除此之外,牛乳源性外泌体可作为囊泡运送抗癌药物[14],这些研究为乳源性外泌体的应用提供了理论依据。
在外泌体的研究过程中,已经开发了多种分离方法,如超速离心法[15]、尺寸排阻色谱法[16]、免疫捕获法[17]等,但是提取出来的外泌体纯度以及浓度均没有经过仔细评估。因此,有必要研究各种提取方法的利弊。
娟姗牛作为世界五大奶牛品种之一[18],具有乳蛋白含量高等特点[19-20]。然而,有关娟姗牛乳中外泌体的研究鲜有报道,其相关功能有待于进一步研究。由于目前提取乳中外泌体的方法多样,且不同提取方法的优缺点不一。因此,本研究比较分析了差速超速离心法和试剂盒法提取娟姗牛乳源性外泌体的优缺点,并采用透射电镜(TEM)、Bradford蛋白定量、免疫印迹(WB)和粒径分析(NTA)方法鉴定所提取的外泌体。此外,有研究证实,差速超速离心法提取得到的乳源性外泌体对细胞没有毒性[10],而关于试剂盒法提取得到的乳源性外泌体细胞毒性的研究未见报道。因此,本试验进一步通过细胞毒性试验评估了试剂盒法提取得到的乳源性外泌体的细胞毒性,旨在确定提取娟姗牛乳中外泌体较佳的方法,为进一步开发娟姗牛乳中外泌体功能奠定技术基础。
1 材料与方法 1.1 试验材料娟姗牛乳采自河北某奶牛场,挑选48头健康的泌乳中期娟姗牛,用无菌瓶采集牛乳,用冰袋快速带回实验室,储存于-80 ℃冰箱。荷斯坦奶牛乳源性外泌体由本实验室前期通过差速超速离心法提取,储存于-80 ℃冰箱,提取方法与娟姗牛乳源性外泌体差速超速离心法相同。
1.2 提取方法 1.2.1 差速超速离心法将娟姗牛乳从-80 ℃冰箱取出,于25 ℃恒温水浴锅解冻,完全融化后,将48头娟姗牛乳等体积混匀,1 200×g、4 ℃、10 min离心2次,除去脂肪;21 500×g、4 ℃分别离心30、60 min,去除蛋白质和细胞碎片,转移上清到超速离心管(361625,Beckman,美国)中,使用超速离心机(Optima LE-80K,Beckman,美国)100 000×g、4 ℃离心90 min,去除上清,加磷酸盐缓冲溶液(PBS)100 000×g、4 ℃、90 min离心2次,将上清倒出,用PBS重悬沉淀,得到外泌体[15]。外泌体保存于-80 ℃冰箱。本过程使用完全独立的样品重复3次。
1.2.2 试剂盒法使用外泌体提取试剂盒(4484453,Invitrogen,美国)提取娟姗牛乳源性外泌体,所有的步骤按照说明书操作,具体如下:将娟姗牛乳从-80 ℃冰箱取出,于25 ℃恒温水浴锅解冻,完全融化后,将48头娟姗牛乳等体积混匀,2 000×g室温离心10 min,除去脂肪;10 000×g室温离心30 min,转移上清;10 000×g室温离心10 min,除去蛋白和大的细胞碎片;转移上清到新的离心管,添加等量的PBS,加入等体积的外泌体提取试剂,充分混匀;室温孵育30 min,10 000×g室温离心10 min,小心移去上清,外泌体沉淀在离心管管底;10 000×g室温离心5 min,移除剩余上清;用适量的PBS重悬外泌体,10 000×g室温离心5 min,转移上清到新的离心管中,收集得到的上清即是外泌体。外泌体保存于-80 ℃冰箱。本过程使用完全独立的样品重复3次。
1.3 外泌体鉴定 1.3.1 TEM方法鉴定外泌体取出-80 ℃冰箱中冻存的外泌体,室温解冻直至完全融化,吸取20 μL外泌体滴加在100目的铜网上,滴1滴2%的醋酸双氧铀,负染外泌体,染色时间30 min,日光灯下干燥,透射电镜(Hitachi H-7500,Hitachi,日本)下观察[21]。电压选择80 kV,先从直径为0.5 μm下找到合适的视野,调整直径为200 nm,拍照保存。本过程使用完全独立的样品重复3次。
1.3.2 Bradford蛋白定量方法鉴定外泌体外泌体使用蛋白裂解液进行裂解,超声破碎10 min,冰上放置30 min,丙酮过夜沉淀,12 000×g离心20 min,5 mol/L尿素复溶,用Bradford蛋白定量试剂盒(PC0010,北京索莱宝公司)测出外泌体的蛋白浓度,所有步骤按照说明书操作。本过程使用完全独立的样品重复3次。
1.3.3 WB方法鉴定外泌体外泌体蛋白与5×蛋白上样缓冲液混匀后100 ℃煮沸5 min,蛋白上样量为20 μg;Marker上样量为5 μL,电压140 V,时间为60 min,考马斯亮蓝染色1 h,用水脱色12 h,获得清晰的条带,扫描,保存。
裁剪适当大小的聚偏二氟乙烯(PVDF)膜并在甲醇中浸泡1 min,200 mA转膜2 h,5%的牛血清白蛋白(BSA)封闭液[5 g BSA+100 mL含吐温20的Tris缓冲盐水(TBST)]室温封闭1 h;肿瘤敏感基因101蛋白(TSG101,ABP56454,Abbkine,美国)、四次跨膜蛋白(CD81,SAB3500454,Sigma,美国)、凋亡连接基因2相互作用蛋白X(ALIX,ab225555,Abcam,英国)和钙黏连蛋白(Calnexin,ab75801,Abcam,英国)[12, 22],用5%的BSA封闭液稀释,TSG101和ALIX按1 : 1 000稀释,CD81按1 : 1 500稀释,4 ℃孵育过夜;TBST室温洗5遍,每遍5 min,随后,分别加入山羊抗鼠二抗(A9044,Sigma,英国)和山羊抗兔二抗(A9169,Sigma,美国),二抗(按1 : 5 000的比例稀释)室温孵育1 h,TBST室温洗5遍,每遍10 min,使用天能WB超敏化学发光显色液(180-501,上海天能科技有限公司)显色后采集图像(Tanon-5200Multi,上海天能科技有限公司)。本过程使用完全独立的样品重复3次。
1.3.4 NTA方法鉴定外泌体取出-80 ℃冰箱中冻存的外泌体,25 ℃水浴解冻,冰上放置。用PBS稀释8 000倍上机,粒径分析仪(Zeta view S/N 17-310,Particle Metrix,德国)通过实时地对悬浮液中直径50~1 000 nm特定的外泌体和囊泡进行逐个的直接成像和观察,最终通过Zeta view 8.04.02软件计算出外泌体粒径分布[23]。本过程使用完全独立的样品重复3次。
1.3.5 细胞毒性试验大鼠小肠上皮细胞购自上海细胞库(BFN608006404)。使用添加10%胎牛血清和100 μL/mL双抗(青霉素和链霉素)的DMEM高糖培养基(C11995500BT,Gibco,美国)进行培养。将细胞接种在96孔板中(2×104细胞/孔),设置由试剂盒法提取的外泌体添加浓度梯度,分别为0(对照)、50、100、200 μg/mL,添加到细胞中,37 ℃培养24 h,使用MTT试剂盒(M1020,北京索莱宝公司)测量细胞活力,细胞活力计算公式为:

|
本过程使用完全独立的样品重复3次。
1.4 数据统计分析试验数据采用SAS 9.4软件MIXED模型进行统计分析,统计模型中包括蛋白浓度及2种提取方法,以P<0.05作为差异显著。
2 结果与分析 2.1 TEM方法鉴定不同方法提取的娟姗牛乳源性外泌体的形态结构从图 1可以看出,通过TEM方法分别对差速超速离心法及试剂盒法提取得到的外泌体进行了鉴定,2种提取方法得到的外泌体都拍到了典型的茶托样结构,电镜下观察到的囊泡大小在100 nm左右。图 1-A为差速超速离心法提取得到的外泌体,电镜下观察到的外泌体较少;图 1-B为试剂盒法提取得到的外泌体,电镜下观察到的外泌体较多。
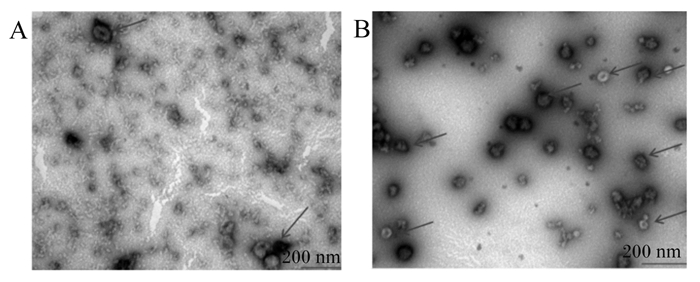
|
A:差速超速离心法提取的外泌体透射电镜图;B:试剂盒法提取的外泌体的透射电镜图。 A: transmission electron micrograph of exosomes extracted by differential ultracentrifugation method; B: transmission electron micrograph of exosomes extracted by kit extraction method. 图 1 外泌体的透射电镜图 Fig. 1 Transmission electron micrograph of exosomes |
从图 2可以看出,试剂盒法提取的外泌体浓度显著高于差速超速离心法(P<0.05)。
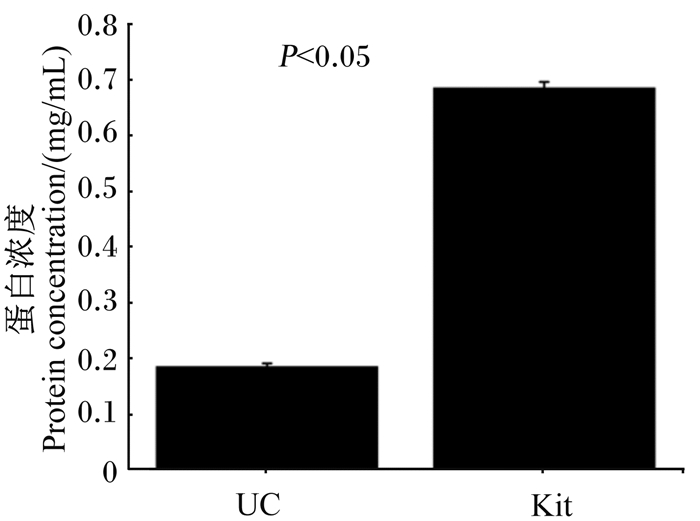
|
UC:差速超速离心法提取的外泌体蛋白浓度;Kit:试剂盒法提取的外泌体蛋白浓度。 UC: the protein concentration of exosomes extracted by differential ultracentrifugation method; Kit: the protein concentration of exosomes extracted by kit extraction method. 图 2 外泌体的蛋白浓度 Fig. 2 Protein concentration of exosomes |
从图 3可以看出,通过对不同提取方法提取的外泌体的蛋白进行鉴定发现,图 3-A中差速超速离心法提取的蛋白条带很杂,在相对蛋白分子量大的部分,蛋白条带很弱,在相对蛋白分子量小的位置,条带不规则;试剂盒法提取的各蛋白条带都比较清晰,蛋白条带也较多。通过WB方法对差速超速离心法和试剂盒法提取的外泌体进行了标志性蛋白CD81、ALIX和TSG101的鉴定,结果显示,2种提取方法均能够检测到外泌体的标志性蛋白ALIX和CD81,但差速超速离心法提取的外泌体标志性蛋白CD81蛋白丰度特别低,且并未鉴定出标志性蛋白TSG101,但试剂盒法检测到了标志性蛋白TSG101,Calnexin作为外泌体阴性对照,2种提取方法均未检测到Calnexin(图 3-B)。
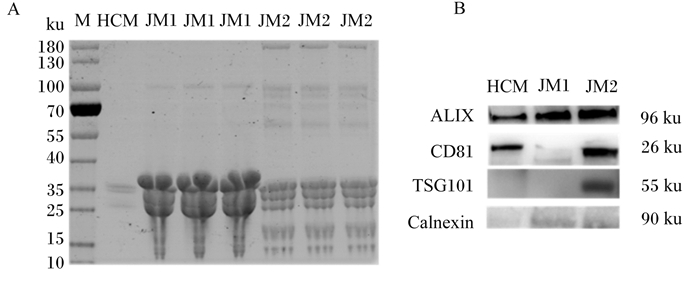
|
A:蛋白凝胶电泳比较不同方法提取的娟姗牛乳中外泌体蛋白;B:WB方法鉴定不同方法提取的娟姗牛乳中外泌体。M为蛋白marker的简写;HCM为差速超速离心法提取的荷斯坦奶牛乳中外泌体;JM1为差速超速离心法提取的娟姗牛乳中外泌体;JM2为试剂盒法提取的娟姗牛乳中外泌体;ALIX为凋亡连接基因2相互作用蛋白X;CD81为四次跨膜蛋白;TSG101为肿瘤敏感基因101蛋白;Calnexin为钙黏联蛋白。 A: comparison of exosomes protein in Jersey milk extracted by different methods by dodecyl sulfate sodium salt-polyacrylamide gel electrophoresis; B: identification of exosomes in Jersey milk extracted by different methods by western blot method. M is the abbreviation of protein marker; HCM is exosomes of Holstein milk extracted by differential ultracentrifugation method; JM1 is exosomes of Jersey milk extracted by differential ultracentrifugation method; JM2 is exosomes of Jersey milk extracted by kit extraction method; ALIX is apoptosis-linked gene-2 interacting protein X; CD81 is transmembrane protein; TSG101 is tumor susceptibility gene 101 protein; Calnexin is calnexin. 图 3 外泌体蛋白标志物的鉴定 Fig. 3 Identification of exosomes protein markers |
从图 4可以看出,通过NTA方法对外泌体进行粒径大小的检测,差速超速离心法提取得到的外泌体,其粒径大小为(114.6±42.6) nm(图 4-A);试剂盒法提取得到的外泌体,其粒径大小为(130.4±44.2) nm(图 4-B)。2种提取方法提取得到的外泌体,都符合外泌体的正常粒径大小(30~150 nm)。
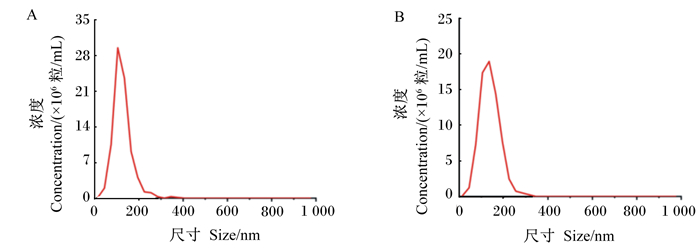
|
A:差速超速离心法提取的外泌体的粒径分布图;B:试剂盒法提取的外泌体粒径分布图。 A: particle size distribution of exosomes extracted by differential ultracentrifugation method; B: particle size distribution diagram of exosomes isolated by kit extraction method. 图 4 外泌体的粒径检测结果 Fig. 4 Particle size detection results of exosomes |
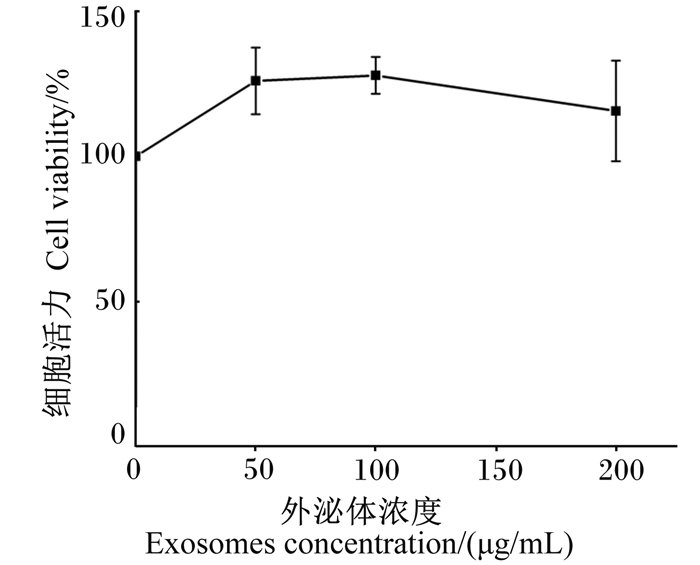
从图 5可以看出,添加不同浓度的由试剂盒法提取的外泌体后,各组的细胞活力都高于对照组。
|
图 5 外泌体的体外细胞毒性 Fig. 5 Cytotoxicity of exosomes in vitro |
当前,乳源性外泌体的提取方法主要是差速超速离心法[13, 24],差速超速离心法提取外泌体的方法是通过不断提高离心速度,收集不同的组分,从而将乳中的脂肪、蛋白、细胞碎片等去除,然后使用超速离心法,将外泌体分离下来[15]。本试验通过差速超速离心法对娟姗牛乳进行外泌体提取,根据国际外囊泡学会(ISEV)发布的细胞外囊泡研究所需的鉴定标准[25],对外泌体的形态结构、标志性蛋白、粒径分析进行鉴定发现,虽然结构符合双层膜结构,但是电镜下只找到了少量的外泌体;标志性蛋白只鉴定到ALIX、CD81,且CD81的蛋白丰度很低。而且并未鉴定到外泌体标志性蛋白TSG101。因此,差速超速离心法提取的外泌体浓度较低,难以满足后续蛋白和核酸提取的需求,使用差速超速离心法并不适用于娟姗牛乳中外泌体的提取。本试验采取的另一种方法试剂盒法,与差速超速离心法相比,电镜下观察到了大量的外泌体,WB方法鉴定到标志性蛋白TSG101、CD81和ALIX,且丰度较高。粒径分析测得2种方法提取得到的外泌体粒径均符合外泌体的正常粒径大小范围(30~150 nm)[1]。而通过蛋白定量结果可以看出试剂盒法提取的娟姗牛乳外泌体的浓度显著高于差速超速离心法。因此,可确定试剂盒法提取娟姗牛乳中的外泌体的方法优于差速超速离心法。
此外,已有研究证明细胞中添加差速超速离心法提取得到的乳源性外泌体的细胞活力与对照组相比没有差异;通过在大鼠小肠上皮细胞中添加差速超速离心法提取的乳源性外泌体,细胞活力高于对照组,因此,差速超速离心法提取得到的外泌体对细胞没有毒性[10-11]。本试验通过对试剂盒法提取的外泌体开展细胞毒性研究,并将试剂盒法提取的外泌体浓度提高至200 μg/mL,结果显示,细胞活力仍较对照组高,与上述研究相符,不同添加浓度无明显差异,进一步证实了试剂盒法提取的外泌体无细胞毒性,可适用于开展细胞试验研究。
鉴于乳源性外泌体在经过酸奶发酵工艺后仍能保持稳定,并激活丝裂原活化蛋白激酶(MAPK)信号通路[26]。即使在缺氧环境下,仍可提高小肠上皮细胞的增殖分化[13]。且其内含有大量与免疫相关的miRNA[12],作为细胞间交流的媒介,其携带的核酸能被细胞吸收,从而发挥其生物学作用[27]。因此,选取更合适的外泌体提取方法可为进一步研究外泌体的功能提供技术保障。本试验探究并证实了较佳的应用于娟姗牛乳中外泌体的提取方法,为娟姗牛乳源性外泌体进一步研究提供技术基础。
4 结论针对娟姗牛乳源性外泌体的提取,差速超速离心法得率较低,不适用提取娟姗牛乳中外泌体;而试剂盒法只需要少量的娟姗牛乳样本,便可得到较多的外泌体,且外泌体的纯度高,同时对细胞没有毒性。因此,试剂盒法更适用于提取娟姗牛乳中的外泌体。
| [1] |
GURUNATHAN S, KANG M H, JEYARAJ M, et al. Review of the Isolation, characterization, biological function, and multifarious therapeutic approaches of exosomes[J]. Cells, 2019, 8(4): 307. DOI:10.3390/cells8040307 |
| [2] |
TKACH M, THÉRY C. Communication by extracellular vesicles:where we are and where we need to go[J]. Cell, 2016, 164(6): 1226-1232. DOI:10.1016/j.cell.2016.01.043 |
| [3] |
SKOTLAND T, SANDVIG K, LLORENTE A. Lipids in exosomes:current knowledge and the way forward[J]. Progress in Lipid Research, 2017, 66: 30-41. DOI:10.1016/j.plipres.2017.03.001 |
| [4] |
KALLURI R, LEBLEU V S. Discovery of double-stranded genomic DNA in circulating exosomes[J]. Cold Spring Harbor Symposia on Quantitative Biology, 2016, 81: 275-280. DOI:10.1101/sqb.2016.81.030932 |
| [5] |
HORIBE S, TANAHASHI T, KAWAUCHI S, et al. Mechanism of recipient cell-dependent differences in exosome uptake[J]. BMC Cancer, 2018, 18: 47. DOI:10.1186/s12885-017-3958-1 |
| [6] |
ANDERSON J D, JOHANSSON H J, GRAHAM C S, et al. Comprehensive proteomic analysis of mesenchymal stem cell exosomes reveals modulation of angiogenesis via nuclear factor-kappa B signaling[J]. Stem Cells, 2016, 34(3): 601-613. |
| [7] |
SAMUEL M, CHISANGA D, LIEM M, et al. Bovine milk-derived exosomes from colostrum are enriched with proteins implicated in immune response and growth[J]. Scientific Reports, 2017, 7: 5933. DOI:10.1038/s41598-017-06288-8 |
| [8] |
BADAWY A A, EL-MAGD M A, ALSADRAH S A. Therapeutic effect of camel milk and its exosomes on MCF7 cells in vitro and in vivo[J]. Integrative Cancer Therapies, 2018, 17(4): 1235-1246. |
| [9] |
WATSON D C, BAYIK D, SRIVATSAN A, et al. Efficient production and enhanced tumor delivery of engineered extracellular vesicles[J]. Biomaterials, 2016, 105: 195-205. DOI:10.1016/j.biomaterials.2016.07.003 |
| [10] |
SOMIYA M, YOSHIOKA Y, OCHIYA T. Biocompatibility of highly purified bovine milk-derived extracellular vesicles[J]. Journal of Extracellular Vesicles, 2018, 7(1): 1440132. DOI:10.1080/20013078.2018.1440132 |
| [11] |
MIYAKE H, LEE C, CHUSILP S, et al. Human breast milk exosomes attenuate intestinal damage[J]. Pediatric Surgery International, 2020, 36(2): 155-163. DOI:10.1007/s00383-019-04599-7 |
| [12] |
BENMOUSSA A, LEE C H C, LAFFONT B, et al. Commercial dairy cow milk microRNAs resist digestion under simulated gastrointestinal tract conditions[J]. The Journal of Nutrition, 2016, 146(11): 2206-2215. DOI:10.3945/jn.116.237651 |
| [13] |
GAO H N, GUO H Y, ZHANG H, et al. Yak-milk-derived exosomes promote proliferation of intestinal epithelial cells in an hypoxic environment[J]. Journal of Dairy Science, 2018, 102(2): 985-996. |
| [14] |
AGRAWAL A K, AQIL F, JEYABALAN J, et al. Milk-derived exosomes for oral delivery of paclitaxel[J]. Nanomedicine:Nanotechnology, Biology, and Medicine, 2017, 13(5): 1627-1636. DOI:10.1016/j.nano.2017.03.001 |
| [15] |
IZUMI H, TSUDA M, SATO Y, et al. Bovine milk exosomes contain microRNA and mRNA and are taken up by human macrophages[J]. Journal of Dairy Science, 2015, 98(5): 2920-2933. DOI:10.3168/jds.2014-9076 |
| [16] |
LOBB R, MÖLLER A.Size exclusion chromatography: a simple and reliable method for exosome purification[M]//KUO W, JIA S.Extracellular vesicles.New York, NY: Humana Press, 2017, 1660: 105-110.
|
| [17] |
ZERINGER E, BARTA T, LI M, et al. Strategies for isolation of exosomes[J]. Cold Spring Harbor Symposia on Quantitative Biology, 2015, 2015(4): 319-323. |
| [18] |
汪翔. 娟姗牛的杂交应用研究进展[J]. 中国奶牛, 2016(9): 12-19. |
| [19] |
梁霄, 刘鹭, 张书文, 等. 不同品种原料乳理化特性分析[J]. 食品科学, 2013, 34(5): 50-54. |
| [20] |
王洋, 于静, 王巍, 等. 娟姗牛品种特性及适应性饲养研究[J]. 中国奶牛, 2011(11): 47-48. |
| [21] |
ASADI J, FERGUSON S, RAJA H, et al. Enhanced imaging of lipid rich nanoparticles embedded in methylcellulose films for transmission electron microscopy using mixtures of heavy metals[J]. Micron, 2017, 99: 40-48. DOI:10.1016/j.micron.2017.03.019 |
| [22] |
VASWANI K, KOH Y Q, ALMUGHLLIQ F B, et al. A method for the isolation and enrichment of purified bovine milk exosomes[J]. Reproductive Biology, 2017, 17(4): 341-348. DOI:10.1016/j.repbio.2017.09.007 |
| [23] |
HOCK A, MIYAKE H, LI B, et al. Breast milk-derived exosomes promote intestinal epithelial cell growth[J]. Journal of Pediatric Surgery, 2017, 52(5): 755-759. DOI:10.1016/j.jpedsurg.2017.01.032 |
| [24] |
REINHARDT T A, LIPPOLIS J D, NONNECKE B J, et al. Bovine milk exosome proteome[J]. Journal of Proteomics, 2012, 75(5): 1486-1492. DOI:10.1016/j.jprot.2011.11.017 |
| [25] |
LÖTVALL J, HILL A F, HOCHBERG F, et al. Minimal experimental requirements for definition of extracellular vesicles and their functions:a position statement from the International Society for extracellular vesicles[J]. Journal of Extracellular Vesicles, 2014, 3: 26913. DOI:10.3402/jev.v3.26913 |
| [26] |
YU S R, ZHAO Z H, SUN L M, et al. Fermentation results in quantitative changes in milk-derived exosomes and different effects on cell growth and survival[J]. Journal of Agricultural and Food Chemistry, 2017, 65(6): 1220-1228. DOI:10.1021/acs.jafc.6b05002 |
| [27] |
LIAO Y L, DU X G, LI J, et al. Human milk exosomes and their microRNAs survive digestion in vitro and are taken up by human intestinal cells[J]. Molecular Nutrition & Food Research, 2017, 61(11): 1700082. |




