2. 湖北省饲料监测所, 武汉 430070;
3. 北京市饲料监察所, 北京 100107
2. Hubei Veterinary Drugs Inspection Department, Wuhan 430070, China;
3. Beijing Feed Testing Institute, Beijing 100107, China
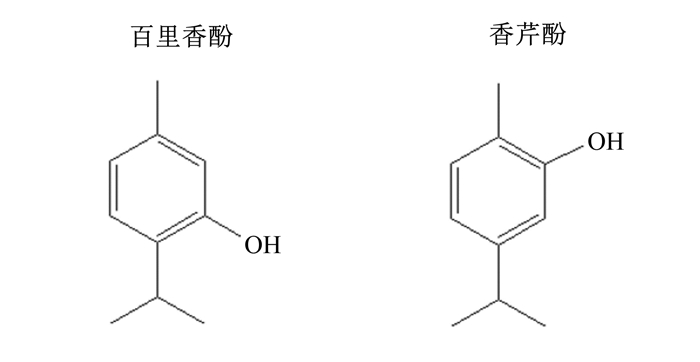
香芹酚(5-甲基-2-异丙基苯酚,carvacrol)和百里香酚(2-甲基-5-异丙基苯酚,thymol)是一对同分异构体,具有特殊的百里香和麝香草香气,天然存在于牛至、百里香等植物中,具有宜人香气和很强的杀菌作用(香芹酚和百里香酚的化学结构式见图 1)[1]。由于具有一定的促进生长、控制禽畜细菌性下痢、防止饲料霉变等功能,香芹酚和百里香酚(牛至油预混剂)曾作为药物饲料添加剂推广使用[2-5]。随着饲料全面“禁抗”的开展,香芹酚和百里香酚促进畜禽生长的功能已不被提及,而其作为香味剂的功能被逐渐重视[6]。香芹酚和百里香酚作为香味剂可改善饲料适口性,增强动物食欲,提高采食量,并能赋予饲料商品独特的风味,是饲料生产企业非常关注的一类饲料添加剂。
|
图 1 香芹酚和百里香酚的化学结构式 Fig. 1 Chemical structure of carvacrol and thymol |
香芹酚和百里香酚都是易挥发的物质,保存时间短,在加工过程及贮藏阶段中极易损失。如何快速、准确地对饲料中香芹酚和百里香酚的含量进行测定成为研究的热点,对保障该类产品质量具有重要意义。有关于饲料及饲料添加剂中香芹酚和百里香酚含量的检测技术已有诸多报道,主要包括液相色谱-紫外法(HPLC-UV)[7]、气相色谱法(GC)[8]、气相色谱-质谱联用法(GC-MS)[9]等。任玉琴等[7]曾使用甲醇对饲料香味剂提取,通过HPLC测定了香芹酚和百里香酚的含量,方法精密度满足要求,稳定性好。罗成江等[8]使用无水乙醇对目标物进行超声提取,通过GC测定了饲料添加剂中的香芹酚和百里香酚含量,方法定量限为100 mg/kg。Jiménez-Salcedo等[9]使用甲醇为溶剂,通过加压溶剂萃取技术(PLE)对微胶囊型饲料添加剂进行提取,采用GC-MS测定了样品中的香芹酚、百里香酚等挥发性物质的含量,该法解决了具有包被结构的饲料添加剂提取效率低的问题,测定结果更为准确。
现有的检测方法多针对于饲料添加剂类样品,而对于饲料中香芹酚和百里香酚的定量分析方法较少,这主要是由于饲料的复杂基质干扰会影响方法的灵敏度和稳定性。基质分散固相萃取技术(MSPD)通过使用多种功能化的吸附材料将样品中的主要干扰杂质吸附,可快速、高效地去除基体中可能存在的磷脂、色素和蛋白质,达到净化和富集的目的[10]。董茂峰等[11]曾以乙酸乙酯为溶剂提取样品,将石墨化碳(GCB)和N-丙基乙二胺(PSA)等吸附材料分散到样品溶液中净化杂质,使用气相色谱-火焰离子化检测器(GC-FID)进行定量分析,该法可去除一定的基质干扰,能检测饲料基质中的香芹酚和百里香酚含量,其检测灵敏度可达10 mg/kg。贺习文等[12]使用类似的方法,以50%乙腈水为提取溶剂,C18和硅酸镁为吸附剂,样品处理后使用HPLC-UV分析,其检出限可达0.1 mg/kg。传统的MSPD虽操作简单、快捷,但只能去除基质中特定种类的杂质,并不适用于种类繁多、成分复杂的饲料样品处理。
本试验在前人研究的基础上,对方法进行改进,使用对香芹酚和百里香酚具有较佳吸附效果的材料,将目标物从样品基质溶液中萃取出来,再经溶剂进行洗脱。通过高选择性MSPD净化前处理方法与高灵敏度的荧光检测器结合,用于测定饲料中香芹酚和百里香酚含量,建立高效、灵敏的香芹酚和百里香酚的定量检测技术,可对市场上存在的该类饲料产品进行质量评价。
1 材料与方法 1.1 仪器与试剂AcquityTM超高效液相色谱配备882MS型荧光检测器(美国Waters公司);ZWY-200D恒温振荡器(上海志诚分析公司);Himac CF 16RX型高速离心机(日本Hitachi公司);MS3 digital型涡旋混匀器(德国IKA公司);Million-Q型超纯水机(美国Millipore公司)。
百里香酚、香芹酚对照品,纯度≥99.0%(德国Sigma-Aldrich公司);乙腈为色谱级(美国Fisher Scientific公司);甲醇、乙酸乙酯、正己烷为分析纯(国药集团);吸附材料:Cleanert C18(简称C18,规格为50 μm)、Cleanert Alumina-N(Alu-N,150 μm)、Cleanert PestiCarb(PestiCarb,120~400目)、Cleanert SLE(SLE,80~100目)、Cleanert IC-H(IC-H,40~60 μm)(Agela Technologies公司);BONDESIL SAX(SAX,40 μm)、BONDESIL SCX(SCX,40 μm)、BONDESIL PSA(PSA,40 μm)、BONDESIL FL(FL,200 μm)(美国Agilent Technologies公司);羟基多壁碳纳米管(qMWNTs,30~50 nm)(南京先锋纳米科技有限公司);碱性氧化铝(Alu-B,100~200目)为分析纯(国药集团);试验用水为一级水;滤膜,0.45 μm,希波氏尼龙滤膜(天津富集科技有限公司);饲料及饲料添加剂样品均由国家饲料质量监督检验中心(北京)提供。
1.2 试验方法 1.2.1 标准溶液的配制1) 混合标准储备液:称取香芹酚和百里香酚标准品各10 mg(精确至0.01 mg),置于100 mL容量瓶中,用乙腈溶解并定容至刻度,制备香芹酚和百里香酚含量为100 μg/mL的混合标准储备溶液。
2) 混合标准中间液:准确移取标准储备溶液1 mL置于100 mL容量瓶中,用乙腈稀释并定容至刻度,制备香芹酚和百里香酚含量为1.0 μg/mL的混合标准中间溶液。
3) 标准工作溶液:准确移取0.1、0.5、1.0、5.0、10.0、50.0 mL的混合标准储备溶液置于100 mL棕色容量瓶中,甲醇定容至刻度,配制成香芹酚和百里香酚的含量分别为1.00、5.00、10.00、50.00、100.00、500.00 ng/mL的标准工作溶液。
1.2.2 样品前处理称取5 g试样(精确至0.001 g)置于50 mL聚丙烯离心管中,依次加入约10 mL超纯水和10 mL正己烷,220 r/min振荡提取40 min。10 000 r/min离心5 min后,移取5 mL有机相至于10 mL离心管中,加入500 mg复合吸附剂,涡旋混合2 min,静置,弃去溶液。再向离心管中加入5 mL乙酸乙酯+正己烷溶液(5 : 95,V/V),涡旋混合2 min,对管内吸附剂进行淋洗,倾倒出上层溶液。移取2 mL乙腈至于10 mL离心管中,对留存在管内的吸附剂进行洗脱,重复洗脱1次,合并洗脱液至于5 mL容量瓶中,使用乙腈定容后。用0.45 μm有机滤膜过滤后上机检测。
复合吸附剂的制备:称取25 g SAX吸附材料、5 g PestiCarb吸附材料和20 g无水硫酸钠于100 mL三角瓶中,振摇混合均匀。
1.2.3 色谱分离条件固定相:Agilent Eclipse Plus C18色谱柱,250 mm×4.6 mm,5 μm;柱温:30 ℃;流动相:乙腈/水溶液(65 : 35,V/V);流速:1.0 mL/min;进样量:10 μL;检测器:荧光检测器,激发波长:274 nm,发射波长:304 nm。
1.2.4 定性定量分析在仪器最佳工作条件下,取试样溶液和标准溶液分别进样,试样中待测物质的保留时间与混合标准溶液中对应的保留时间相对偏差在±2.5%之内,则可判定为样品中存在对应的待测物。以标准溶液中被测组分峰面积为纵坐标,被测组分含量为横坐标,绘制标准曲线,外标法计算样品中香芹酚和百里香酚含量(Xi),单位以μg/kg表示。计算公式如下:
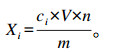
|
式中:ci为标准曲线中查得的香芹酚和百里香酚含量(ng/mL);V为定容体积(mL);m为试样质量(g);n为稀释倍数。计算结果以3次平行测定值的算术平均值表示。
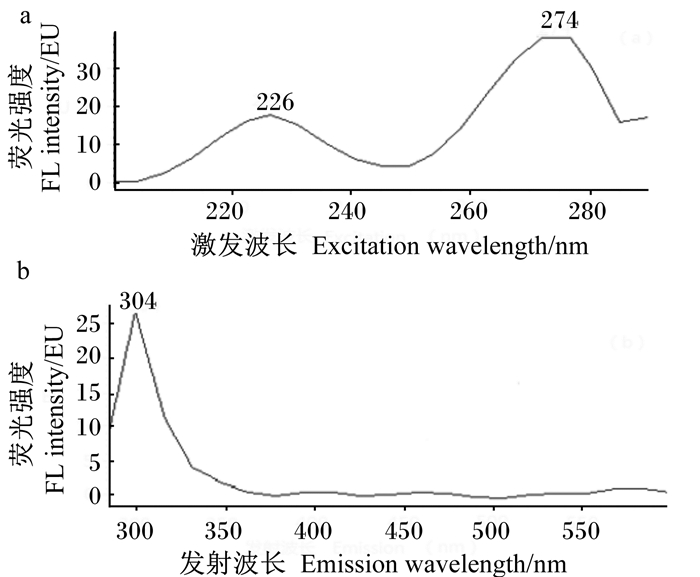
2 结果与分析 2.1 激发波长和发射波长的确定香芹酚和百里香酚为同分异构体,仅苯环上酚羟基的取代位置不同。由于结构相似,香芹酚和百里香酚的荧光光谱特征基本一致,因此选择香芹酚对其荧光光谱特征进行研究。使用荧光检测器对香芹酚标准溶液(1 mg/mL)进行激发光谱扫描,扫描范围:200~300 nm,结果如图 2所示。
|
图 2 香芹酚标准溶液的激发(a)和发射(b)光谱 Fig. 2 Excitation (a) and emission (b) spectra of carvonol standard solution |
从图 2可以看出,当激发波长为226和274 nm,香芹酚的荧光信号较强。当使用226 nm作为激发波长时,液相色谱基线漂移程度较大,有明显的溶剂峰干扰,而使用274 nm作为激发波长时,基线漂移较小,且目标峰信号增强。固定激发波长为274 nm对发射波长进行扫描(扫描范围为290~600 nm),发现发射波长在304 nm处其荧光响应最强。因此确定荧光激发波长为274 nm,发射波长为304 nm。
2.2 提取方法的确定基于现有文献[7-9]可知,对于未包被的饲料添加剂及饲料产品,使用甲醇、乙腈、乙酸乙酯进行处理时都可以得到较高的提取效率,然而对于包被型饲料产品的提取效率却少有研究。试验以微胶囊型饲料添加剂为试样,考察了甲醇、乙酸乙酯、正己烷、80%甲醇水和正己烷/水(50/50,V/V)等5种不同极性的提取溶剂对香芹酚和百里香酚的提取效果。
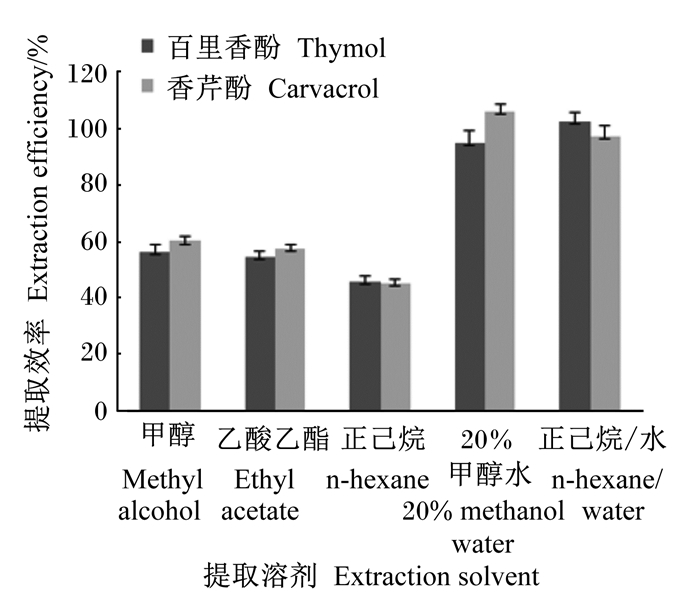
称取0.5 g微胶囊型饲料添加剂至于50 mL离心管中,分别加入30 mL甲醇、乙酸乙酯、正己烷、80%甲醇水和正己烷/水(50/50,V/V),振荡提取40 min。将提取溶液取出,定容至50 mL。取1 mL提取溶液使用乙腈稀释,过0.45 μm滤膜后,按1.2.3条件进行仪器分析,所得结果见图 3。
|
误差线为3次测量结果的标准偏差。下图同。 Error bars were the standard deviation of the results of 3 measurements. The same as below. 图 3 不同提取溶剂对香芹酚和百里香酚提取效率的比较 Fig. 3 Comparison of extraction efficiency of carvacrol and thymol with different extraction solutions |
图 3中的结果表明,选取80%甲醇水和正己烷/水作为提取溶剂对饲料添加剂样品具有较佳的提取效果,香芹酚和百里香酚的提取效率在95%~103%,且重复性良好。而甲醇、乙腈、正己烷的提取效率较低,测量值仅为标示量的50%~60%,证明包被的香芹酚和百里香酚并未被完全提取。
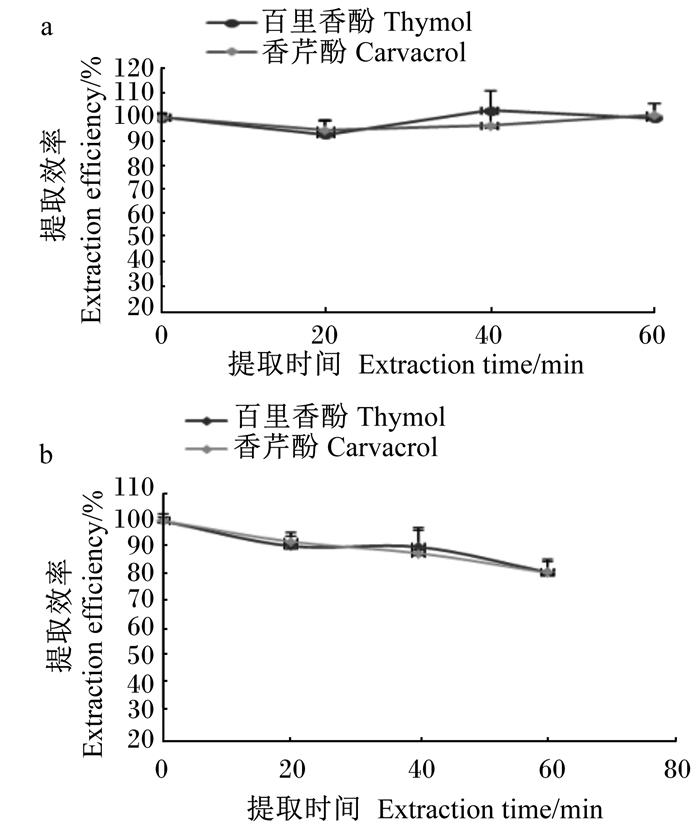
在样品中加入水进行提取可有效地去除淀粉、果胶等水溶性包被,但考虑到饲料中含有大量的金属离子,在水相溶液中可能发生催化氧化反应,加速香芹酚和百里香酚的破坏。试验为考察不同溶剂体系中,金属离子对香芹酚、百里香酚稳定性的影响,选择在微量元素预混料中进行添加回收试验(添加浓度为20 μg/kg),绘制了正己烷/水和80%甲醇水作为提取溶剂时,提取时间对回收率的数据曲线(图 4)。
|
图 4 提取时间对香芹酚和百里香酚回收率的影响(提取溶剂:a. n-正己烷/水,b.80%甲醇水) Fig. 4 Effects of extraction time on recovery of carvacrol and thymol with n-hexane/water (a) and 80% menthol (b) as solvents |
图 4的结果表明,当使用水/正己烷两相溶剂系统对样品进行提取时,在0~60 min内香芹酚和百里香酚的峰面积没有显著差异,回收率在95%~105%;而使用80%甲醇水提取,香芹酚和百里香酚的峰面积逐渐降低,振荡提取60 min后,其回收率仅为80%左右。因此试验使用正己烷/水溶剂系统对香芹酚和百里香酚进行提取。
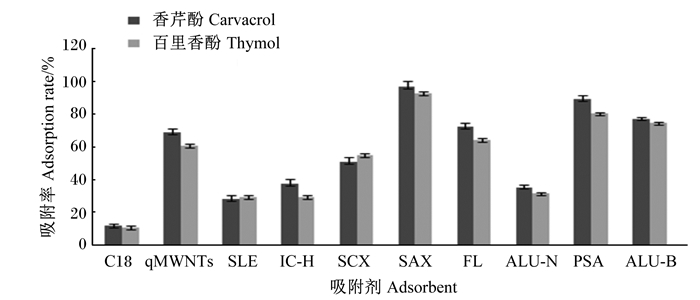
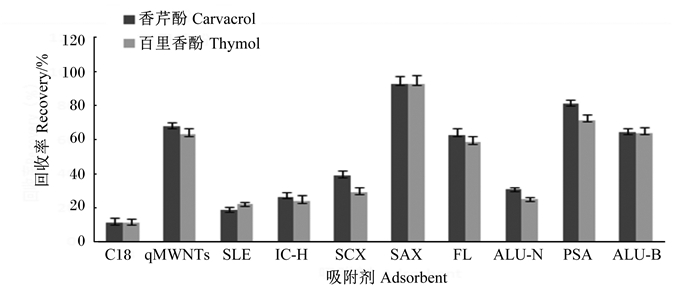
2.3 净化方法的确定选择了市售的10种吸附材料(C18、Alu-N、SLE、SAX、SCX、PSA、IC-H、FL、HMWNTs、Alu-B)进行了吸附和解析研究试验。称取5 g空白配合饲料样品进行标准添加,香芹酚和百里香酚添加量为20 μg/kg。样品按方法1.2.2提取,移取5 mL有机层分别加入250 mg上述吸附材料,漩涡混合2 min,取上清液过膜,按1.2.3方法进行液相分析,同时以不加入吸附材料作为空白对照,不同吸附材料的吸附效率见图 5。进一步对管内吸附剂进行洗脱,移取2 mL乙腈洗脱吸附剂,重复洗脱1次,合并洗脱液后定容至5 mL,过膜,按1.2.3条件进行液相分析,香芹酚和百里香酚经不同吸附材料处理的回收率见图 6。
|
图 5 不同吸附材料对饲料中香芹酚和百里香酚的吸附效率 Fig. 5 Absorption efficiency of carvacrol and thymol in feeds with different adsorbed materials |
|
图 6 不同吸附材料对饲料中香芹酚和百里香酚的回收率 Fig. 6 Recovery of carvacrol and thymol in feeds with different adsorbed materials |
在使用不同吸附材料处理后,香芹酚和百里香酚的色谱峰降低或消失,这一现象可以证明吸附剂对香芹酚和百里香酚有较为明显的吸附作用。由图 5可知,SAX、PSA和Alu-B等3种吸附材料对香芹酚(百里香酚)的吸附效果较佳,其吸附效率分别为97.7%(95.6%)、88.9%(80.2%)、77.1%(74.3%)。试验以乙腈为洗脱溶剂,考察了上述吸附材料的回收率。由图 6可知,10种吸附材料中,SAX对香芹酚和百里香酚的回收率最高,分别为93.0%和92.9%。因此试验选择以SAX为基质分散固相萃取材料对样品进行处理。
2.4 线性关系和检出限配制含量为1~500 ng/mL的香芹酚、百里香酚标准溶液,以上述最优条件进行检测,以色谱峰面积(y)和标准溶液浓度(x)作标准曲线,结果见表 1。
|
|
表 1 香芹酚和百里香酚对照溶液的线性回归曲线 Table 1 Linear regression of carvacrol and thymol reference solution |
从表 1中可以看出,香芹酚、百里香酚标准溶液在1~500 ng/mL线性关系良好。如果样品中香芹酚等的含量不在此线性范围之内,可以通过稀释对样品进行处理,再进行检测。
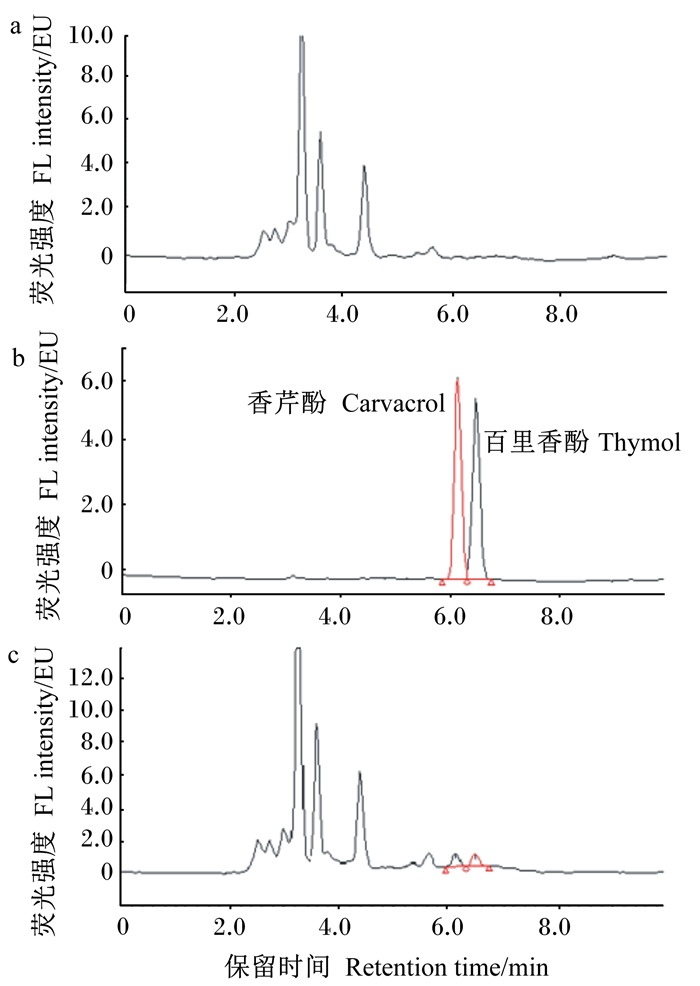
对方法的检测极限进行探讨,选取不同来源的饲料样品,按照1.2所述方法进行样品处理和测定,代表性的空白及添加样品色谱图如图 7所示。检测限(limits of detection,LOD)以空白样品中与标准品保留时间相同位置的基线噪声的3倍值为依据,定量限(limitsof quantification,LOQ)以空白样品在标准品保留时间的基线噪声的10倍值为依据,测得空白基质中香芹酚和百里香酚的LOD、LOQ分别为0.6和2.0 μg/kg,能够满足饲料中香芹酚和百里香酚含量的分析需要。
|
图 7 代表性空白样品(a)、香芹酚和百里香酚标准溶液(b,100 ng/mL)、添加样品(c,20 μg/kg)色谱图 Fig. 7 Chromatograms of representative blank sample (a), carvacrol and thymol standard solution (b, 100 ng/mL) and spiked sample (c, 20 μg/kg) |
在确定样品前处理方法后,试验选择未添加香芹酚和百里香酚的预混料、配合饲料、浓缩饲料作为空白基质,进行加标回收率试验,以考察方法的准确度和重现性。制备不同含量的香芹酚、百里香酚的试样,每批次内的同1含量做6个平行试验,共设置3个含量,分别为2、10和20 μg/kg。
由表 2可以看出,不同基质中香芹酚和百里香酚的回收率为80.2%~108.6%,符合在一定含量上的回收率范围;变异系数(CV%)≤10.2%。
|
|
表 2 不同饲料中添加香芹酚、百里香酚的回收率及精密度 Table 2 Recovery and precision of carvacrol and thymol in different feeds (n=6) |
通过建立的上述方法对市场上采集的10批次不同类型的饲料样品进行检测,检测结果见表 3。
|
|
表 3 饲料样品的测定结果 Table 3 Measurement results of feed samples |
由表 3结果可知,混合型饲料添加剂样品中的香芹酚和百里香酚含量的测量值分别为1.5×107和5.0×106 μg/kg(该产品的标示量为1.5%和0.5%),该方法的测定值与其标示量相一致。而对于母猪配合饲粮、草鱼配合料、仔猪配合饲粮和精料补充料等饲料样品中的香芹酚和百里香酚,因其含量较低,推测该产品中的香芹酚和百里香酚可能是由产品中的植物性饲料原料引入。同时,本试验并未在鱼粉和复合预混料中检测到香芹酚和百里香酚。
3 讨论 3.1 提取方式由于香芹酚和百里香酚易挥发,保存时间短,在加工过程及贮藏阶段中极易损失。现代饲料工业为解决上述问题,常将该类饲料添加剂产品制成微胶囊制剂或进行水溶性包被以保证挥发性香味物质保存持久。基于现有文献可知,对于未包被的饲料添加剂及饲料产品,使用甲醇[7]、乙醇[8]、乙腈[11]、乙酸乙酯[12]进行处理时都可以得到较高的提取效率,而对于包被(或微胶囊)型样品,甲醇、乙酸乙酯、正己烷的提取效率较低,测量值仅为标示量的50%~60%,这严重影响了样品的检测结果。众所周知,水作为破壁剂可以高效地去除包被的影响,但考虑到饲料中含有大量的金属离子,在水相溶液中可能发生催化氧化反应,加速香芹酚和百里香酚的破坏,因此使用水相提取溶剂并不适合。本文使用水和正己烷2项溶剂系统对样品进行提取,试样中金属离子快速溶于水相,目标分子溶于正己烷,2项溶剂互不相容,减少了金属离子和目标分子的接触,从而在一定程度上降低了香芹酚和百里香酚的损失。
3.2 净化方法因饲料和饲料添加剂产品种类众多,成分复杂,基质干扰较为严重。传统的MSPD方法是通过净化材料除去目标化合物以外的杂质,虽操作简单、快捷,但去除的杂质较为固定。本试验选择对目标物香芹酚和百里香酚具有高效吸附作用的材料,从复杂的饲料基质中选择性吸附目标物,再通过特定溶剂将目标物洗脱下来,从而达到净化的目的。这种方法选择性更强,适用于饲料等复杂基质的净化。
本试验研究了10种吸附材料对香芹酚和百里香酚的吸附-洗脱效果,发现SAX吸附剂对香芹酚和百里香酚的吸附能力最佳。从吸附机理上来看,SAX填料为硅胶上键合卤化季铵盐,为强阴离子交换萃取剂,对阴离子物质具有较强的吸附作用;而香芹酚和百里香酚为酚类化合物,易给出质子氢而呈现电负性,因此SAX可以很好地吸附香芹酚和百里香酚[13]。同时使用的辅助吸附材料为PestiCarb,主要成分是石墨化碳黑,其表面为正六元环的结构,对平面分子具有极强的亲和力,适用于去除、分离各种基质色素和甾醇等物质。当使用SAX和PestiCarb对样品进行处理时,样品溶液澄清,显著降低了目标化合物的基体干扰。
3.3 高含量样品的检测本试验建立方法的净化原理是通过高选择性的前处理材料从复杂的饲料基质中选择性吸附目标物,再经溶剂洗脱净化,因此方法的检测上限受到了吸附材料的最大载样量的限制:如1 g SAX材料处理高于300 μg的香芹酚或百里香酚时,其吸附效率将低于95%。又因荧光检测器具有高灵敏度、高选择性的特点,更适用于饲料等复杂基质中低含量的香芹酚和百里香酚检测。而对于待测组分含量较高,且基质干扰较少的饲料添加剂和添加剂预混合饲料样品,则需要对提取溶液进行稀释后才能上机检测。
3.4 方法学性质的比较目前已见报道的饲料中香芹酚和百里香酚的检测方法多采用HPLC-UV、GC-FID和GC-MS技术。现有的检测方法虽稳定、可靠,但在分析复杂样品时,其灵敏度和选择性还有诸多不足。如使用GC-FID对饲料样品中香芹酚和百里香酚进行分析时,其最低定量限为10 mg/kg;使用HPLC-UV时,方法定量限为0.3 mg/kg;GC-MS虽具有较高灵敏度,但因设备昂贵,样品前处理较为繁琐,并不能满足实际使用需求。而本试验利用荧光光谱检测器灵敏度高,选择性强的技术优势,结合新型的MSPD前处理方法,可有效地提升检测的灵敏度,使得方法的定量限达到2.0 μg/kg,检出限为0.6 μg/kg。
本试验通过对预混料、配合饲粮、浓缩饲料进行加标回收率试验考察了方法的准确度和精密度。在3个添加量(2、10、20 μg/kg)的评价试验中,香芹酚的添加回收率为80.2%~108.6%,批内变异系数小于9.8%,批间变异系数小于5.8%;百里香酚的添加回收率为82.1%~108.1%,批内变异系数小于10.2%,批间变异系数小于6.2%。将本试验方法与文献中报道方法(表 4)的回收率进行比较,发现众多方法的回收率并没有显著性差别,满足在一定添加量上的回收率要求[14],表明了新建立的荧光检测法在对香芹酚和百里香酚含量进行定量分析时,具有较高的准确性和精密度。该分析方法简便、准确,且具有更高的灵敏度,在实际应用中更具有优势。
|
|
表 4 不同检测方法的方法学性质比较 Table 4 Comparison of methodological properties of different detection methods |
本试验建立了基质分散固相萃取净化技术在荧光检测条件下测定饲料中香芹酚和百里香酚含量的高效液相色谱分析方法。香芹酚和百里香酚在1~500 ng/mL线性关系良好,方法检出限为0.6 μg/kg,定量限为2.0 μg/kg,回收率为80.2%~108.6%,RSD小于10.2%。该方法具有检测时间短、前处理操作简便、灵敏度高等特点,可以满足对饲料中香芹酚、百里香酚含量的检测。
| [1] |
梁建勇, 李晓康, 焦婷, 等. 牛至精油在畜禽生产中的研究进展[J]. 中国饲料, 2017(9): 22-25. |
| [2] |
NETOPILOVA M, HOUDKOVA M, RONDEVALDOVA J, et al. Evaluation of in vitro growth-inhibitory effect of carvacrol and thymol combination against Staphylococcus aureus in liquid and vapour phase using new broth volatilization chequerboard method[J]. Fitoterapia, 2018, 129: 185-190. DOI:10.1016/j.fitote.2018.07.002 |
| [3] |
王思宇, 夏添, 赵君梅, 等. 化学合成百里香酚和香芹酚对仔猪生产性能影响及机制[J]. 饲料研究, 2013(6): 31-35. |
| [4] |
RIVAS L, MCDONNELL M J, BURGESS C M, et al. Inhibition of verocytotoxigenic Escherichia coli in model broth and rumen systems by carvacrol and thymol[J]. International Journal of Food Microbiology, 2010, 139(1/2): 70-78. |
| [5] |
中华人民共和国农业部公告第168号[Z].北京: 中华人民共和国农业部, 2001.
|
| [6] |
中华人民共和国农业农村部公告第194号[EB/OL].(2019-07-10).http://www.xmsyj.moa.gov.cn/zcjd/201907/t20190710_6320678.htm.
|
| [7] |
任玉琴, 张晓丽. 高效液相色谱法同时测定饲料香味剂中肉桂醛、丁香酚、香芹酚和百里香酚含量的研究[J]. 中国饲料, 2018(9): 60-62. |
| [8] |
罗成江, 周炜, 侯轩, 等. 气相色谱法测定香味剂中桉油精肉桂醛百里香酚及香芹酚的含量[J]. 中国兽医杂志, 2019, 55(2): 113-115. |
| [9] |
JIMÉNEZ-SALCEDO M, TENA M T. Determination of cinnamaldehyde, carvacrol and thymol in feedstuff additives by pressurized liquid extraction followed by gas chromatography-mass spectrometry[J]. Journal of Chromatography A, 2017, 1487: 14-21. DOI:10.1016/j.chroma.2017.01.042 |
| [10] |
ŚMIEŁOWSKA M, ZABIEGAŁA B. Matrix solid-phase dispersion (MSPD) as simple and useful sample preparation technique for determination of polybrominated diphenyl ethers (PBDEs) in dust[J]. Analytica Chimica Acta, 2019, 1084: 33-42. DOI:10.1016/j.aca.2019.08.001 |
| [11] |
董茂锋, 杨海锋, 白冰, 等. 气相色谱法测定饲料中香芹酚和百里香酚的含量[J]. 饲料工业, 2015, 36(1): 47-51. |
| [12] |
贺习文, 李宏, 赵彩会, 等. QuEChERS-高效液相色谱法测定饲料中牛至香酚新方法的研究[J]. 饲料工业, 2019, 40(22): 55-60. |
| [13] |
WANG P L, WANG X, ZHANG W, et al. Development of "one-pot" method for multi-class compounds in porcine formula feed by multi-function impurity adsorption cleaning followed ultra-performance liquid chromatography-tandem mass spectrometry detection[J]. Journal of Chromatography B, 2014, 947-948: 192-200. DOI:10.1016/j.jchromb.2013.12.013 |
| [14] |
中华人民共和国国家质量监督检验检疫总局.中国国家标准化管理委员会.GB/T 23182-2008饲料中兽药及其他化学物检测试验规程[S].北京: 中国标准出版社, 2008.
|




