2. 西北农林科技大学动物科技学院, 杨凌 712100
2. College of Animal Science and Technology, Northwest A & F University, Yangling 712100, China
反刍动物胃肠道的结构是保障消化功能的前提,其胃肠道组织形态发育正常是营养物质被充分消化吸收的生理基础[1]。此前对反刍动物胃肠道组织形态影响因素的研究主要集中在年龄[2]、饲养方式[3-4]、断奶日龄[5]、添加剂[6-7]以及饲粮类型等[8]。有关饲粮精粗比对反刍动物瘤胃组织形态影响的系统研究较少且结论不一。如张双奇等[9]试验发现,6月龄荷斯坦公犊的瘤胃黏膜上皮角化层、颗粒层和基底层厚度随着精料比例的增加而增大,其中精粗比为60 : 40饲粮组显著高于精粗比为40 : 60饲粮组,不同精粗比饲粮对瘤胃固有膜厚度以及瘤胃乳头长度、宽度和密度均无显著差异。然而,Nocek等[10]认为随着饲粮中精料比例和营养水平的提高,瘤胃乳头长度和密度也随之增加,但过高的精料比例会导致乳头角质化不全,形态异常。Norouzian等[11]也指出粗饲料的物理刺激可以促进羔羊瘤胃肌肉层的发育,从而促使瘤胃容积增大。
藏羊作为青藏高原及其毗邻地区特有的动物资源,长期生活在低温、缺氧、强紫外辐射等恶劣环境中,具有耐寒、耐粗饲及抗病性强等优点,在高原畜牧业中占有重要地位[12]。在生产实践中,由于缺乏饲粮非纤维性碳水化合物(NFC)/中性洗涤纤维(NDF)对藏羊消化道影响的相关研究数据,不仅制约了羔羊养殖的推广和普及,也使得针对性开发高寒牧区绵羊饲粮的研究缺乏相关的科学依据。基于此,本试验以生活在高海拔地区的藏羊为试验对象,研究不同NFC/NDF饲粮对育成期藏羊复胃组织形态的影响,以期为藏羊饲养管理策略的制订提供理论指导。
1 材料与方法 1.1 试验设计从青海省海北州高原现代畜牧示范园区中选取2~4胎次、体重[(26.38±0.43) kg]相近的4月龄健康高原型藏羊30只,依据性别随机分为3个公羊组(M1组、M2组、M3组)和3个母羊组(F1组、F2组、F3组),每组5只,分别饲喂NFC/NDF为2.20(精粗比为70 : 30,F1组和M1组)、1.39(精粗比为50 : 50,F2组和M2组)和0.92(精粗比为30 : 70,F3组和M3组)的试验饲粮。饲喂方式为精料和粗料均匀搅拌后混合饲喂。整个试验期105 d,其中预试期为15 d,正试期为90 d。各组试验羊每天饲喂2次(07:30和18:00),自由采食,自由饮水。
1.2 试验饲粮根据当地藏羊的养殖模式、饲料资源以及我国《肉羊饲养标准》(NY/T 816—2004)进行试验饲粮的配制,其组成及营养水平见表 1。粗饲料为燕麦青干草。
|
|
表 1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
饲养试验结束时,每组随机选取3只羊,禁食24 h、禁水12 h后进行颈静脉放血致死。立即打开腹腔,按照《家畜解剖学及组织胚胎学》[13]所述分离出各胃室。用无菌手术刀分别从每只羊瘤胃背囊、网胃底、瓣胃和皱胃贲门腺区、胃底腺区和幽门腺区的附近区域取组织块1.0 cm2左右,并用生理盐水将各组织块上的食糜冲洗干净,然后迅速放入4%的多聚甲醛溶液中固定,以备制作组织切片。
1.4 测定指标及方法 1.4.1 营养成分含量测定试验饲粮中干物质(DM)、粗蛋白质(CP)、粗灰分(Ash)、粗脂肪(EE)、中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)、钙(Ca)、磷(P)含量分别按照GB/T 6435—2014、GB/T 6432—1994、GB/T 6438—2007、GB/T 10359—2008、GB/T 20806—2006、GB/T 20805—2006、GB/T 6436—2002、GB/T 6437—2002。
1.4.2 复胃组织形态观察从4%多聚甲醛固定液中取出样品,依次经水洗、脱水、包埋、冷冻切片机冷冻(-30~-20 ℃)、切片(厚度10 μm)、烤片、苏木精-伊红(HE)染色、封片等程序制成冷冻切片。利用Olympus BX51显微镜以及Imaginge pro plus 6.0软件分别观察瘤胃、网胃、瓣胃及皱胃的组织形态学。每个样本观察3张非连续切片,每张切片选取5个视野(组织完整),每个视野分别测定4组数据,其平均值作为1个测定数据。
1.5 数据统计分析初始数据用Excel 2016初步整理后,采用SPSS 21.0统计软件进行单因素方差分析(one-way ANOVA),再利用Duncan氏法进行多重比较,结果以平均值±标准差(mean±SD)表示,P < 0.05为差异显著。
2 结果与分析 2.1 不同NFC/NDF饲粮对高原型藏羊瘤胃组织形态的影响图 1为饲喂不同NFC/NDF饲粮的高原型藏公羊的瘤胃冷冻切片。由表 2可知,饲粮NFC/NDF对公羊的瘤胃角质层厚度、乳头长度和肌层厚度的均无显著影响(P>0.05),但上述指标随着饲粮NFC/NDF的下降有增加的趋势。M3组公羊的瘤胃颗粒层厚度比M1组、M2组分别高出67.46%、64.36%(P<0.05);M3组公羊的瘤胃乳头宽度显著大于M1组(P<0.05),比M1组、M2组分别高出255.50%(P<0.05)、18.07%(P>0.05);M3组公羊的瘤胃中央肌层厚度比M1组、M2组分别高出25.80%、24.13%(P<0.05)。上述结果说明饲喂NFC/NDF为0.92饲粮的高原型藏公羊的瘤胃形态发育较好。
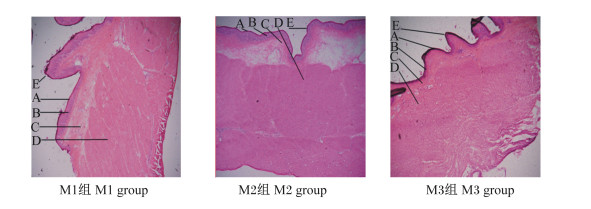
|
A:角质层corneum;B:颗粒层stratum granulosum;C:中央肌层central muscularis;D:肌层muscular layer;E:乳头papillae。 图 1 饲喂不同NFC/NDF饲粮高原型藏公羊的瘤胃冷冻切片 Fig. 1 Frozen sections of rumen of plateau type Tibetan rams fed diets with different NFC/NDF (400×) |
|
|
表 2 不同NFC/NDF饲粮对高原型藏公羊瘤胃组织形态的影响 Table 2 Effects of diets with different NFC/NDF on rumen tissue morphology of plateau type Tibetan rams |
图 2为饲喂不同NFC/NDF饲粮的高原型藏母羊的瘤胃冷冻切片。由表 3可知,F2组和F3组母羊的瘤胃角质层厚度、乳头长度、乳头宽度均显著大于F1组(P<0.05);F3组母羊的瘤胃颗粒层厚度比F1组、F2组分别高出66.50%、64.56%(P<0.05);F3组母羊的瘤胃肌层厚度比F1组、F2组分别高出22.95%(P<0.05)、15.24%(P>0.05);母羊的中央肌层厚度以F3组最大,但与F1组和F2组差异不显著(P>0.05)。上述结果说明饲喂NFC/NDF为0.92饲粮的高原型藏母羊的瘤胃形态发育较好。
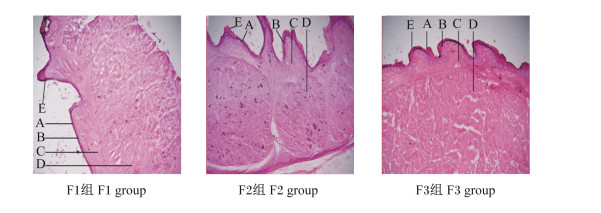
|
A:角质层corneum;B:颗粒层stratum granulosum;C:中央肌层central muscularis;D:肌层muscular layer;E:乳头papillae。 图 2 饲喂不同NFC/NDF饲粮高原型藏母羊的瘤胃冷冻切片 Fig. 2 Frozen sections of rumen of plateau type Tibetan ewes fed diets with different NFC/NDF (400×) |
|
|
表 3 不同NFC/NDF饲粮对高原型藏母羊瘤胃组织形态的影响 Table 3 Effects of diets with different NFC/NDF on rumen tissue morphology of plateau type Tibetan ewes |
图 3为饲喂不同NFC/NDF饲粮的高原型藏公羊的网胃冷冻切片。由表 4可知,M2组和M3组公羊的网胃角质层厚度分别较M1组高出25.33%和26.08%(P<0.05);M2组和M3组公羊的网胃颗粒层厚度分别较M1组高出25.20%和27.26%(P<0.05);M3组公羊的网胃乳头宽度比M1组、M2组分别高出55.50%(P<0.05)、18.07%(P>0.05);M1组和M2组公羊的网胃乳头长度、肌层厚度、中央肌层厚度均低于M3组,但差异不显著(P>0.05)。上述结果说明饲喂NFC/NDF为0.92饲粮的高原型藏公羊的网胃形态发育较好。
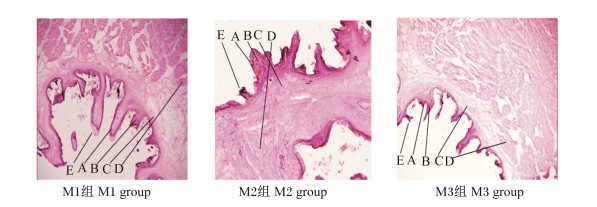
|
A:角质层corneum;B:颗粒层stratum granulosum;C:中央肌层central muscularis;D:肌层muscular layer;E:乳头papillae。 图 3 饲喂不同NFC/NDF饲粮高原型藏公羊的网胃冷冻切片 Fig. 3 Frozen sections of reticulum of plateau type Tibetan rams fed diets with different NFC/NDF (400×) |
|
|
表 4 不同NFC/NDF饲粮对高原型藏公羊网胃组织形态的影响 Table 4 Effects of diets with different NFC/NDF on reticulum tissue morphology of plateau type Tibetan rams |
图 4为饲喂不同NFC/NDF饲粮的高原型藏母羊的网胃冷冻切片。由表 5可知,F2组和F3组母羊的网胃角质层厚度、颗粒层厚度、乳头长度以及乳头宽度均显著大于F1组(P<0.05),且F3组略高于F2组(P>0.05);母羊的肌层厚度随着饲粮NFC/NDF的增大呈现下降趋势,但各组间差异不显著(P>0.05);F3组母羊的中央肌层厚度比F1组、F2组分别高出50.54%(P<0.05)、20.86%(P>0.05)。上述结果说明饲喂NFC/NDF为0.92饲粮的高原型藏母羊的网胃形态发育较好。
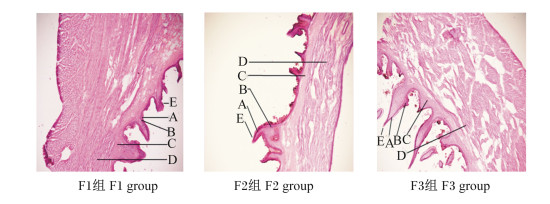
|
A:角质层corneum;B:颗粒层stratum granulosum;C:中央肌层central muscularis;D:肌层muscular layer;E:乳头papillae。 图 4 饲喂不同NFC/NDF饲粮高原型藏母羊的网胃冷冻切片 Fig. 4 Frozen sections of reticulum of plateau type Tibetan ewes fed diets with different NFC/NDF (400×) |
|
|
表 5 不同NFC/NDF饲粮对高原型藏母羊网胃组织形态的影响 Table 5 Effects of diets with different NFC/NDF on reticulum tissue morphology of plateau type Tibetan ewes |
图 5为饲喂不同NFC/NDF饲粮的高原型藏公羊的瓣胃冷冻切片。由表 6可知,公羊的瓣胃角质层厚度、颗粒层厚度、乳头长度、乳头宽度、肌层厚度及中央肌层厚度各组间差异均不显著(P>0.05),但随着饲粮NFC/NDF的减小,上述指标均逐渐增大。其中,M3组公羊的瓣胃角质层厚度比M1组、M2组分别高出6.92%、6.67%;M3组公羊的瓣胃颗粒层厚度比M1组、M2组分别高出46.14%、20.62%;M3组公羊的瓣胃乳头长度比M1组、M2组分别高出10.36%、7.50%;M3组公羊的瓣胃乳头宽度比M1组、M2组分别高出10.96%、10.06%;M3组公羊的瓣胃肌层厚度比M1组和M2组分别高出6.23%、3.92%;M3组公羊的瓣胃中央肌层厚度比M1组和M2组分别高出19.40%、16.13%。上述结果说明饲喂NFC/NDF为0.92饲粮的高原型藏公羊的瓣胃形态发育较好。
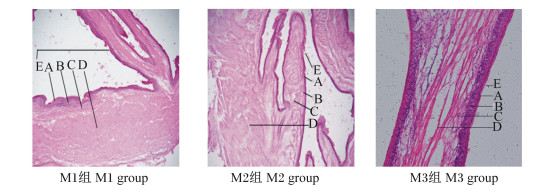
|
A:角质层corneum;B:颗粒层stratum granulosum;C:中央肌层central muscularis;D:肌层muscular layer;E:乳头papillae。 图 5 饲喂不同NFC/NDF饲粮高原型藏公羊的瓣胃冷冻切片 Fig. 5 Frozen sections of omasum of plateau type Tibetan rams fed diets with different NFC/NDF (400×) |
|
|
表 6 不同NFC/NDF饲粮对高原型藏公羊瓣胃组织形态的影响 Table 6 Effects of diets with different NFC/NDF on omasum tissue morphology of plateau type Tibetan rams |
图 6为饲喂不同NFC/NDF饲粮的高原型藏母羊的瓣胃冷冻切片。由表 7可知,F1组母羊的瓣胃角质层厚度、颗粒层厚度、乳头长度、乳头宽度及肌层厚度均小于F2组(P>0.05),且F3组母羊的瓣胃角质层厚度、颗粒层厚度、乳头长度、乳头宽度及肌层厚度比F2组分别高出4.16%、32.99%、7.37%、16.24%、2.14%(P>0.05);F3组母羊的中央肌层厚度比F1和F2组分别高出50.54%(P < 0.05)、20.86%(P>0.05)。上述结果说明饲喂NFC/NDF为0.92饲粮的高原型藏母羊的瓣胃形态发育较好。
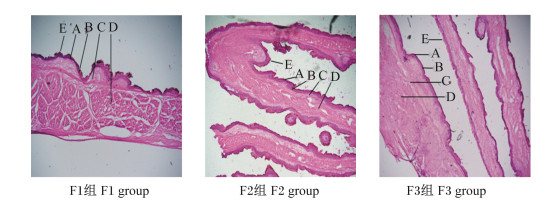
|
A:角质层corneum;B:颗粒层stratum granulosum;C:中央肌层central muscularis;D:肌层muscular layer;E:乳头papillae。 图 6 饲喂不同NFC/NDF饲粮高原型藏母羊的瓣胃冷冻切片 Fig. 6 Frozen sections of omasum of plateau type Tibetan ewes fed diets with different NFC/NDF (400×) |
|
|
表 7 不同NFC/NDF饲粮对高原型藏母羊瓣胃组织形态的影响 Table 7 Effects of diets with different NFC/NDF on omasum tissue morphology of plateau type Tibetan ewes |
图 7为饲喂不同NFC/NDF饲粮的高原型藏公羊的皱胃冷冻切片。由表 8可知,M3组公羊的皱胃角质层厚度、黏膜层厚度及肌层厚度均大于M2组和M1组,但各组间差异不显著(P>0.05);M3组公羊的皱胃黏膜下层厚度比M1组、M2组分别高出53.06%(P<0.05)、4.93%(P>0.05)。上述结果说明饲喂NFC/NDF为0.92饲粮的高原型藏公羊的皱胃形态发育较好。
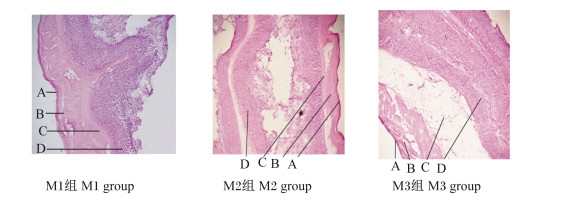
|
A:角质层corneum;B:黏膜层mucosal layer;C:黏膜下层submucosa;D:肌层muscular layer。 图 7 饲喂不同NFC/NDF饲粮高原型藏公羊的皱胃冷冻切片 Fig. 7 Frozen sections of abomasum of plateau type Tibetan rams fed diets with different NFC/NDF (400×) |
|
|
表 8 不同NFC/NDF饲粮对高原型藏公羊皱胃组织形态的影响 Table 8 Effects of diets with different NFC/NDF on abomasum tissue morphology of plateau type Tibetan rams |
图 8为饲喂不同NFC/NDF饲粮的高原型藏母羊的皱胃冷冻切片。由表 9可知,母羊的皱胃角质层厚度、黏膜层厚度、黏膜下层厚度以及肌层厚度随着饲粮NFC/NDF的减小而增大。其中,F3组母羊的皱胃角质层厚度与F1组和F2组相比差异不显著(P>0.05);F3组母羊的黏膜层厚度、黏膜下层厚度以及肌层厚度均显著高于F1组和F2组(P<0.05)。上述结果说明饲喂NFC/NDF为0.92饲粮的高原型藏母羊的皱胃形态发育较好。
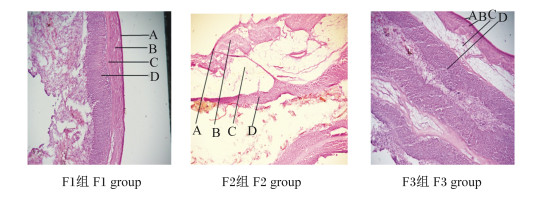
|
A:角质层corneum;B:黏膜层mucosal layer;C:黏膜下层submucosa;D:肌层muscular layer。 图 8 饲喂不同NFC/NDF饲粮高原型藏母羊的皱胃冷冻切片 Fig. 8 Frozen sections of abomasum of plateau type Tibetan ewes fed diets with different NFC/NDF (400×) |
|
|
表 9 不同NFC/NDF饲粮对高原型藏母羊皱胃组织形态的影响 Table 9 Effects of diets with different NFC/NDF on abomasum tissue morphology of plateau type Tibetan ewes |
反刍动物瘤胃组织生长发育可依据饲粮的物理形态、类型以及营养水平高低等因素发生相应形态学变化,来达到机体正常生理代谢的需要[15-16]。王安思[17]研究得出,饲喂精粗比为80 : 20饲粮的肉公犊牛瘤胃乳头宽度比饲喂精粗比为70 : 30、60 : 40和50 : 50饲粮的肉牛分别高出10.81%、58.17%和60.18%,而肌层厚度各组间差异不显著。杨宏波[18]研究发现,饲喂精粗比为60 : 40的饲粮的犊牛瘤胃腹囊胃壁厚度、背囊乳头长度和背囊胃壁厚度显著大于饲喂精粗比为75 : 25、70 : 30饲粮的犊牛,饲喂精粗比为65 : 35饲粮的犊牛瘤胃腹囊乳头长度、腹囊乳头宽度和背囊乳头宽度显著大于饲喂精粗比为75 : 25、70 : 30饲粮的犊牛。黄智南[19]试验表明,精饲料中含有大量的NFC,补饲精饲料后增加了瘤胃上皮乳头长度、表面积。Beiranvand等[20]认为纤维具有较高的粗糙性,可通过与瘤胃表皮的接触移除角质层,最终使瘤胃上皮更加完整。在本试验中,高原型藏羊瘤胃角质层厚度、颗粒层厚度、肌层厚度、中央肌层、乳头长度以及乳头宽度与饲粮NFC/NDF呈负相关。其原因是粗饲料尺寸较大且纤维含量高,具有高粗糙性和研磨值,通过与反刍动物瘤胃表皮不断的接触能移除角蛋白或者死亡的上皮细胞,使瘤胃上皮维持适宜的角化程度和完整性,从而促进瘤胃的生长发育[21]。
3.2 不同NFC/NDF饲粮对高原型藏羊网胃形态发育的影响网胃是网-瘤胃运动的起始点,反刍动物通过网-瘤胃有节律的收缩,使瘤胃内食糜混合并推动瘤胃内容物向瘤胃后转移[22]。Nemati等[23]指出,当饲粮精料水平较高时,瘤胃内含有较多的易发酵碳水化合物, 发酵产生大量的丁酸和丙酸,而丁酸含量增加时,会促进瘤胃上皮异常增殖,导致瘤胃乳头结块和角化不全,引起消化道重量的异常增加。Giger-Reverdin等[24]研究发现,随着饲粮中精料水平的提高,奶山羊瘤胃总挥发性脂肪酸、丙酸和丁酸含量显著增加,而乙酸含量显著降低。从本试验来看,NFC/NDF为0.92的饲粮(M3组)对藏公羊网胃角质层厚度、颗粒层厚度以及乳头宽度发育的促进作用大于NFC/NDF为2.20(M1组)和1.39的饲粮(M2组);不同NFC/NDF饲粮对藏公羊网胃乳头长度、肌层厚度以及中央肌层厚度的促进作用相近,但都以M3组最大;F2组和F3组藏母羊的网胃角质层厚度、颗粒层厚度、乳头长度以及乳头宽度均显著大于F1组,且F3组略高于F2组,同时F3组藏母羊的肌层厚度、中央肌层厚度也大于F1组与F2组。这可能正是由于精饲料在反刍动物瘤胃中发酵产生大量的乙酸、丙酸和丁酸等,而随着丁酸含量的不断增加,影响到了网胃乳头以及黏膜上皮的生长发育,最终不利于网胃的生长发育。
3.3 不同NFC/NDF饲粮对高原型藏羊瓣胃形态发育的影响瓣胃的作用在于容纳网胃送来的食糜并向皱胃转移,同时将瘤胃未能消化的纤维素及部分木质素继续磨压加工以便为后面消化道提供易于消化、吸收的食糜[25]。本试验中,饲粮NFC/NDF为0.92(M3组、F3组)时,藏羊的瓣胃角质层厚度、颗粒层厚度、乳头长度、乳头宽度、肌层厚度和中央肌层厚度均大于饲粮NFC/NDF为2.20(M1组、F1组)、1.39(M2组、F2组)。这说明粗饲料中大量的纤维素及木质素等除了在瘤胃中发酵分解外,还需通过网胃以及瓣胃的强烈收缩和舒张活动进行机械消化,从而使得瓣胃壁肌层不断发育增厚,促进其生长发育。吕凯等[26]研究了蛋白质水平分别为21.03%(高)、18.02%(中)、15.01%(低)的饲粮对早期断奶藏羔羊复胃发育的影响,结果显示低蛋白质水平饲粮组藏羔羊瓣胃中央肌层厚度极显著高于中蛋白质水平饲粮组,而不同蛋白质水平饲粮对瓣胃角质层厚度、黏膜上皮厚度、固有膜厚度以及黏膜肌层厚度的影响不显著,这与本试验结果相一致。
3.4 不同NFC/NDF饲粮对高原型藏羊皱胃形态发育的影响皱胃作为反刍动物唯一具有分泌液的胃室,可分泌消化酶,类似单胃动物的胃,因此通常被称为腺胃,又叫作真胃[27]。除了小肠外,皱胃也是反刍动物营养物质消化吸收的主要部位[28],而营养物质的吸收决于其组织形态。在本试验中,M2组和M3组藏公羊的皱胃角质层厚度、黏膜层厚度、黏膜下层厚度及肌层厚度均高于M1组,其中M2组和M3组公羊的黏膜下层厚度与M1组差异显著;藏母羊的皱胃角质层厚度、黏膜层厚度、黏膜下层厚度以及肌层厚度随着饲粮NFC/NDF的减小而增大,且F3组显著大于F1组和F3组,在藏母羊皱胃角质层厚度方面,F3组>F2组>F1组。由此可见,各组藏羊皱胃组织形态存在差异,这将严重影响其对营养物质的吸收,因相关内容报道较少,其影响机理还有待进一步研究。
4 结论在本试验条件下,饲粮NFC/NDF影响高原型藏羊瘤胃、网胃、瓣胃和皱胃的组织形态,饲喂NFC/NDF为0.92饲粮的藏羊复胃形态发育优于饲喂NFC/NDF为2.20和1.39饲粮的藏羊。
| [1] |
郑琛, 李发弟, 李飞, 等. 代乳粉添加甘露寡糖对7~28日龄湖羊羔羊胃肠道发育的影响[J]. 中国农业科学, 2020, 53(2): 398-408. ZHENG C, LI F D, LI F, et al. Effects of adding mannan oligosaccharides to milk replacer on the development of gastrointestinal tract of 7 to 28 days old Hu lambs[J]. Scientia Agricultura Sinica, 2020, 53(2): 398-408 (in Chinese). |
| [2] |
马俊南, 屠焰. 固液饲料饲喂水平对犊牛生长及胃肠道发育影响的研究进展[J]. 家畜生态学报, 2017, 38(5): 7-12. MA J N, TU Y. Research progress on feeding patterns of different solid and liquid feed level on growth and gastrointestinal tract development in Holstein calves[J]. Journal of Domestic Animal Ecology, 2017, 38(5): 7-12 (in Chinese). |
| [3] |
孙娟.育肥方式对呼伦贝尔及呼杜杂交羔羊消化道组织形态及酶活的影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2014. SUN J.The effects of fattening patterns on enzyme activities and gastrointestinal tract morphology of Hulun Buir lambs and F1 hybrid lambs between Hulun Buir and Dorper sheep[D]. Master's Thesis.Huhhot: Inner Mongolia Agricultural University, 2014.(in Chinese) |
| [4] |
于洋, 格日乐玛, 闫素梅, 等. 放牧与舍饲育肥对绒山羊胃肠道组织形态的影响[J]. 动物营养学报, 2020, 32(2): 775-783. YU Y, GE R L M, YAN S M, et al. Effects of pasture fattening and stall fattening on gastrointestinal tract morphology of cashmere goats[J]. Chinese Journal of Animal Nutrition, 2020, 32(2): 775-783 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.02.033 |
| [5] |
柴建民.断母乳日龄对羔羊生长性能与胃肠道发育的影响[D].硕士学位论文.北京: 中国农业科学院, 2015. CHAI J M.Effect of weaning age on the growth performance and development of the gastrointestinal tract in lambs[D]. Master's Thesis.Beijing: Chinese Academy of Agricultural Sciences, 2015.(in Chinese) |
| [6] |
张林, 项斌伟, 王宁, 等. 中草药复合添加剂对绵羊瘤胃形态发育的影响[J]. 饲料工业, 2019, 40(11): 31-35. ZHANG L, XIANG B W, WANG N, et al. Effect of a Chinese herbal medicine compound additive on morphological development of sheep's rumen[J]. Feed Industry, 2019, 40(11): 31-35 (in Chinese). |
| [7] |
郑琛, 李发弟, 李飞, 等. 代乳粉添加单宁酸对7~28日龄湖羊羔羊胃肠道发育的影响[J]. 中国农业科学, 2019, 52(21): 3924-3933. ZHENG C, LI F D, LI F, et al. Effects of tannic acid addition in milk replacer on development of gastrointestinal tract of 7 to 28 days old Hu lambs[J]. Scientia Agricultura Sinica, 2019, 52(21): 3924-3933 (in Chinese). DOI:10.3864/j.issn.0578-1752.2019.21.019 |
| [8] |
吴志强.不同喂奶量和不同类型开食料对哺乳期犊牛胃肠道发育的影响[D].硕士学位论文.泰安: 山东农业大学, 2016. WU Z Q.Effect of different milk allowances and different starter on gastrointestinal development of dairy calves[D]. Master's Thesis.Tai'an: Shandong Agricultural University, 2016.(in Chinese) |
| [9] |
张双奇, 昝林森, 梁大勇, 等. 日粮精粗比对荷斯坦公犊瘤胃组织结构的影响[J]. 西北农林科技大学学报(自然科学版), 2009, 37(9): 59-64. ZHANG S Q, ZAN L S, LIANG D Y, et al. Effect of different dietary concentrate to forage ratio on rumen morphological structure of Chinese Hostein bull[J]. Journal of Northwest A&F University (Natural Science Edition), 2009, 37(9): 59-64 (in Chinese). |
| [10] |
NOCEK J E, HEALD C W, POLAN C E. Influence of ration physical form and nitrogen availability on ruminal morphology of growing bull calves[J]. Journal of Dairy Science, 1984, 67(2): 334-343. DOI:10.3168/jds.S0022-0302(84)81306-5 |
| [11] |
NOROUZIAN M A, VALIZADEH R. Effect of forage inclusion and particle size in diets of neonatal lambs on performance and rumen development[J]. Journal of Animal Physiology and Animal Nutrition, 2014, 98(6): 1095-1101. |
| [12] |
周力, 李雪清, 李鹏翔, 等. 不同青贮饲料对欧拉型藏羊生长性能、屠宰性能和经济效益的影响[J]. 饲料研究, 2020, 43(10): 5-8. ZHOU L, LI X Q, LI P X, et al. Effect of different silage on growth performance, slaughter performance and economic benefit of Oula Tibetan sheep[J]. Feed Research, 2020, 43(10): 5-8 (in Chinese). |
| [13] |
马仲华. 家畜解剖学及组织胚胎学[M]. 3版. 北京: 中国农业出版社, 2002. MA Z H. Domestic animal anatomy, histology and embryology[M]. 3th ed. Beijing: China Agriculture Press, 2002 (in Chinese). |
| [14] |
中国饲料成分及营养价值表(2019年第30版)[J].中国饲料, 2019(22): 111-116. ANON.Tables of feed composition and nutritive in China (2019 30th edition)[J]. Chinese feed, 2019(22):111-116.(in Chinese) |
| [15] |
HEINRICHS J. Rumen development in the dairy calf[J]. Advances in Dairy Technology, 2005, 17: 179-187. |
| [16] |
BROWNLEE A. The development of rumen papillae in cattle fed on different diets[J]. British Veterinary Journal, 2002, 112(9): 369-375. |
| [17] |
王安思.不同精粗比日粮对肉公犊牛生长性能及瘤胃发育的影响[D].硕士学位论文.郑州: 河南农业大学, 2017. WANG A S.Effects of different diets on growth performance and rumen development of meat calves[D]. Master's Thesis.Zhengzhou: Henan Agricultural University, 2017.(in Chinese) |
| [18] |
杨宏波.不同精粗比颗粒饲料对3~6月龄犊牛生长性能和胃肠道发育的影响[D].硕士学位论文.扬州: 扬州大学, 2015. YANG H B.Effects of pellet diets with different concentrate-roughage ratio on growth performance and development of gastrointestinal tract of 3 to 6 monthly calves.[D]. Master's Thesis.Yangzhou: Yangzhou University, 2015.(in Chinese) |
| [19] |
黄智南.日粮营养对前胃上皮生长和组织形态的影响[D].硕士学位论文.南京: 南京农业大学, 2010. HUANG Z N.The effects of nutrition level on the growth and morphology of forestomach epithelial[D]. Master's Thesis.Nanjing: Nanjing Agricultural University, 2010.(in Chinese) |
| [20] |
BEIRANVAND H, GHORBANI G R, KHORVASH M, et al. Interactions of alfalfa hay and sodium propionate on dairy calf performance and rumen development[J]. Journal of Dairy Science, 2014, 97(4): 2270-2280. |
| [21] |
SUAREZ B J, VAN REENEN C G, STOCKHOFE N, et al. Effect of roughage source and roughage to concentrate ratio on animal performance and rumen development in veal calves[J]. Journal of Dairy Science, 2007, 90(5): 2390-2403. |
| [22] |
郭江鹏, 潘建忠, 李发弟, 等. 不同早期断奶日龄对舍饲肉用羔羊胃组织形态发育变化的影响[J]. 畜牧兽医学报, 2018, 49(5): 971-985. GUO J P, PAN J Z, LI F D, et al. Effect of different early weaned day on morphological development of stomach for housed lambs[J]. Chinese Journal of Animal and Veterinary Sciences, 2018, 49(5): 971-985 (in Chinese). |
| [23] |
NEMATI M, AMANLOU H, KHORVASH M, et al. Rumen fermentation, blood metabolites, and growth performance of calves during transition from liquid to solid feed:effects of dietary level and particle size of alfalfa hay[J]. Journal of Dairy Science, 2015, 98(10): 7131-7141. |
| [24] |
GIGER-REVERDIN S, RIGALMA K, DESNOYERS M, et al. Effect of concentrate level on feeding behavior and rumen and blood parameters in dairy goats :Relationships between behavioral and physiological parameters and effect of between-animal variability[J]. Journal of Dairy Science, 2014, 97(7): 4367-4378. |
| [25] |
袁赞, 侯生珍, 崔晓鹏. 不同蛋白水平日粮对西藏羊复胃形态学的影响[J]. 草学, 2018(1): 64-69. YUAN Z, HOU S Z, CUI X P. Effects of dietary protein Levels on the morphology of the stomach in Tibetan sheep[J]. Prataculture & Animal Husbandry, 2018(1): 64-69 (in Chinese). |
| [26] |
吕凯, 侯生珍, 王志有, 等. 蛋白水平对早期断奶藏羔羊复胃发育的影响[J]. 黑龙江畜牧兽医, 2013(19): 54-56. LYU K, HOU S Z, WANG Z Y, et al. Effects of the protein levels on the development of complex stomach on early-weaning Tibetan lambs[J]. Heilongjiang Animal Science and Veterinary Medicine, 2013(19): 54-56 (in Chinese). |
| [27] |
陈杰. 家畜生理学[M]. 4版. 北京: 中国农业出版社, 2003. CHEN J. Physiology of domestic animals[M]. 4th ed. Beijing: China Agricultural Press, 2003 (in Chinese). |
| [28] |
SUN D M, LI H W, MAO S Y, et al. Effects of different starch source of starter on small intestinal growth and endogenous GLP-2 secretion in preweaned lambs[J]. Journal of Animal Science, 2018, 96(1): 306-317. |




