2. 上海海洋大学水产与生命学院, 农业部鱼类营养与环境生态研究中心, 上海 201306;
3. 上海海洋大学水产与生命学院, 水产动物遗传育种中心上海市协同创新中心, 上海 201306;
4. 广州智特奇生物科技有限公司, 广州 510663
2. Centre for Research on Environmental Ecology and Fish Nutrition of the Ministry of Agriculture, Shanghai Ocean University, Shanghai 201306, China;
3. Shanghai Collaborative Innovation for Aquatic Animal Genetics and Breeding, Shanghai Ocean University, Shanghai 201306, China;
4. Guangzhou Wisdom Bio-Technology Co., Ltd., Science Avenue, Guangzhou 510663, China
近年来,虹鳟(Oncorhynchus mykiss)在我国的养殖发展迅猛,至2019年养殖产量已达到3.937万t,是我国重要的冷水性经济鱼类。虹鳟的肌肉红度值是市场评价其品质的一个重要标准,生产中往往会通过外源添加虾青素的方式改善虹鳟肌肉色泽。目前,生产上使用的虾青素主要为合成虾青素(Ast),其成本占饲料总成本的10%~20%[1]。Ast由于存在不同立体异构性以及可能的合成中间体的残留,故其安全性问题一直存在争论。天然来源的虾青素有雨生红球藻(Haematococcus pluvialis)[2]、红法夫酵母(Phaffia rhodozyma)[3]、钝顶螺旋藻(Spirulina platensis)[4]、小球藻(Chlorella zofingiensis)[5]等,天然来源虾青素较为稳定,使用安全,但存在提取工艺复杂、价格高等问题。
夏侧金盏花(Adonis aestivalis L.),又名福寿花,属毛茛科(Ranunculaceae),侧金盏花属(Adonis L.),其花瓣中含有丰富的类胡萝卜素,其中虾青素含量占类胡萝卜素总量的80%以上,约为花瓣干重的1%,是一种优质的天然虾青素源[6]。然而,目前有关夏侧金盏花的研究主要侧重于其中富含的强心甙方面[7],有关其作为着色剂的研究很少。Kamata等[8]用添加5.05%福寿花花瓣(AF)和0.01%福寿花提取物(AE)(折算成虾青素含量均为100 mg/kg)的饲料饲喂虹鳟3个月,结果AF组产生了高死亡率(30%),AE组虽增加了肌肉红度值,但肌肉中虾青素沉积量很低,仅为1.17 mg/kg,达不到市场要求(6 mg/kg)。
雨生红球藻,属绿藻门(Chlorophyta),团藻目(Volvocales),红球藻属(Haematococcus),是目前所有已知天然虾青素积累量最高的生物,其虾青素积累量可达干重的5%[9]。雨生红球藻中的虾青素通常以酯的形式存在,构型为纯左旋结构(3S,3’S),是抗氧化活性最强的一种构型[10]。然而,雨生红球藻具有较厚的细胞壁,会阻碍鱼类对类胡萝卜素的吸收利用[11],降低了藻粉直接作为饵料的利用率。因此,雨生红球藻作为虾青素源添加到饲料中,应选用适当的破壁方法,若破壁方法不当,破壁不完全,会影响虾青素的活性和利用率。雨生红球藻藻粉在水产养殖中应用的报道已见于虹鳟[12]、大西洋鲑(Salmo salar)[13]、赤鲷(Pagrus pagrus)[14]、大黄鱼(Pseudosciaena crocea)[15]、欧鲶(Silurus glanis)[16]等,这些研究表明雨生红球藻具有良好的着色和抗氧化作用,并能改善生长性能,提高鱼体免疫力。目前在雨生红球藻上的研究多基于藻粉,而雨生红球藻提取物(HE)的研究相对较少[2, 17],尤其是在鲑鳟鱼类着色方面。
作为天然虾青素源,AF、AE、HE在改善虹鳟肉色和机体抗氧化性能方面的作用效果如何?与Ast相比,其效果如何?尚未有明确报道。因此, 本试验以虹鳟为研究对象, 在饲料中分别添加Ast、AF及AE和HE,考察其对虹鳟生长性能、色素沉积和抗氧化能力的影响,为天然虾青素源在水产饲料中的合理应用提供理论依据。
1 材料与方法 1.1 试验材料Ast、AF、AE和HE(正丁烷浸提法)均由广州某生物科技股份有限公司提供,虾青素含量分别为10.30%、1.54%、2.90%和2.26%。
1.2 试验饲料试验配制5种等氮等能的饲料,分别为基础饲料和在基础饲料中分别添加1.0 g/kg Ast、6.5 g/kg AF、3.4 g/kg AE、4.4 g/kg HE的试验饲料,折算成虾青素添加量均为100 mg/kg。各种饲料原料粉碎后过60目筛,按饲料配方(表 1)逐级混匀,用单螺杆挤压机制粒成直径为2.0 mm的硬颗粒沉性饲料[制粒温度为(85±5) ℃],用鼓风干燥箱40 ℃烘干至水分含量低于10%,密封保存备用。经检测,这5种饲料中虾青素含量分别为11.00、95.23、101.32、104.25和93.52 mg/kg。
|
|
表 1 试验饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) |
试验用虹鳟购自四川省眉山市东坡区天贵水产养殖场。试验开始前,将虹鳟暂养2周以适应试验环境。正式试验前停止投喂24 h,选取体质健壮、大小均匀的虹鳟375尾[平均体重为(6.28±0.07) g],随机分配到15个自动充气循环玻璃缸内(0.60 m×0.60 m×0.50 m),每缸25尾鱼,共5组,每组3个重复。养殖试验开始前,取20尾虹鳟于-20 ℃保存,用于初始全鱼常规成分分析。养殖期间,每天投喂2次(09:00、16:00),日投喂量为体重的2%~3%,根据鱼的摄食情况和天气情况进行适当调整,各组投喂水平基本保持一致,以每次投喂无残饵为宜。养殖期间水温为13~18 ℃,溶氧含量为6~7 mg/L,pH为7.24~7.78,氨氮含量≤0.2 mg/L,亚硝酸盐含量≤0.1 mg/L。每天在上午摄食1~2 h后采用虹吸法吸走缸底粪便,每周换水2次,换水量为缸体水量的1/3。养殖试验在上海海洋大学鱼类营养实验室进行,共持续6周。
1.4 样品采集样品采集参照Zhao等[18]方法,在养殖第2、4和6周末,鱼体饥饿24 h后,每缸随机取3尾鱼,用100 mg/L MS-222麻醉。于尾静脉处采血,8 000 r/min离心10 min,取血清-80 ℃保存,用于测定血清类胡萝卜素含量。取血后,剥离两侧背部皮肤,取侧线与背鳍之间的肌肉,测定色差值后,与皮肤和尾鳍于-20 ℃保存,用于测定组织虾青素含量。6周养殖试验结束后,鱼体饥饿24 h,对所有缸中虹鳟进行称重,记录重量及尾数,从中取3尾鱼麻醉后于-20 ℃保存,用于测定全鱼常规成分和虾青素含量。另取6尾鱼,3尾采用上述方法采集肌肉、肝脏和血清用于抗氧化能力的测定;另外3尾鱼,采集背部两侧肌肉各1.5 g,分别用于滴水损失和冷冻损失的测定。
1.5 测定指标 1.5.1 生长性能根据虹鳟初重、末重、尾数和投喂量,计算成活率、增重率和饲料系数,计算公式如下:

|
末全鱼、初始全鱼和饲料粉碎后,参照AOAC(2000)进行常规成分分析,方法如下:水分含量采用105 ℃烘干法测定;粗蛋白质含量采用自动凯氏定氮仪(2300-Auto-Analyzer, Fosstecator, 瑞典)测定;粗脂肪含量采用氯仿甲醇浸提法测定;粗灰分含量采用550 ℃马弗炉(SXL-1008马弗炉,上海精宏实验设备有限公司)灼烧法测定。
1.5.3 肌肉色差值虹鳟抽血剥皮后,取侧线与背鳍之间的肌肉,用吸水纸将表面水分吸干,再将WSC-S色差计(WSC-S colorimeter,o/d光源, 带光泽, 稳定性ΔY≤0.6, 上海精密科学仪器有限公司物理光学仪器厂)探头紧贴于肌肉朝向背脊的一面测量,记录亮度、红度和黄度值。
1.5.4 虾青素含量肌肉和全鱼虾青素含量参考Zhang等[19]方法,采用氯仿-乙醇(1 : 1)萃取法测定;皮肤和鳍条虾青素含量参考Song等[20]方法,采用二氯甲烷-甲醇溶液(1 : 3)萃取法测定。测得吸光度(OD)值后根据虾青素标准曲线计算虾青素含量(虾青素标准品购于上海吉至生化科技有限公司,产品编号A18781)。虾青素沉积率计算公式如下:

|
取0.2 mL血清加入0.4 mL 95%乙醇斡旋混合后,加入1 mL正己烷斡旋混合,1 000 r/min离心5 min,取上清液在470 nm下测定OD值,根据全反式虾青素标准曲线计算总类胡萝卜素含量。全反式虾青素标准曲线的绘制参考Tolasa等[13]。

|
取虹鳟一侧背部肌肉(1.5 g),称重(W1)后用细铁丝悬挂于4 ℃冰箱中,分别于2、4、6 h取出,用吸水纸轻轻拭去表面水分后称重,记录重量(W2)。取另一侧背部肌肉(1.5 g),称重(W3)后装袋密封,置于-20 ℃冰箱,24 h后取出,室温解冻10 min,用吸水纸轻轻拭去表面水分后称重,记录重量(W4)。滴水损失和冷冻损失计算公式如下:
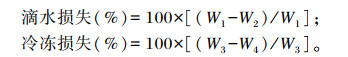
|
肝脏和背部肌肉于4 ℃解冻后,用0.9%生理盐水制成20%的组织匀浆液,2 500 r/min离心10 min,取上清备用。血清、肌肉和肝脏的抗氧化性能指标包括:肌肉和肝脏总蛋白(TP)含量,血清、肌肉和肝脏的丙二醛含量(MDA)含量、总超氧化物歧化酶(T-SOD)活性以及抑制羟自由基能力。以上指标的测定均按照试剂盒(南京建成生物工程研究所)说明书操作,其中蛋白质总量采用考马斯亮蓝法测定,MDA含量采用硫代巴比妥酸(TAB)法测定,抑制羟自由基能力根据Fenton反应测定。
血清和组织T-SOD活性单位定义(U/mL):每毫升反应液中和每毫克组织蛋白质在1 mL反应液中SOD抑制率达50%时所对应的SOD量为1个SOD活性单位(U)。
1.6 数据统计与分析试验数据采用SPSS 22.0进行单因素方差分析(one-way ANOVA),结合Tukey’s法进行多重比较,差异显著水平为P < 0.05。
2 结果 2.1 不同来源虾青素对虹鳟生长性能的影响由表 2可知,养殖6周后,Con、Ast、AE和HE组在增重率、饲料系数和成活率上均无显著差异(P>0.05);AF组在增重率上显著低于其他组(P < 0.05),饲料系数显著高于其他组(P < 0.05),与对照组相比,AF组增重率降低13.5%,饲料系数增加0.10(P < 0.05)。
|
|
表 2 不同来源虾青素对虹鳟生长性能的影响 Table 2 Effects of different astaxanthin sources on growth performance of rainbow trout |
由表 3可知,各组间虹鳟全鱼常规成分组成,包括水分、粗蛋白质、粗灰分和粗脂肪含量,均无显著差异(P>0.05)。
|
|
表 3 不同来源虾青素对虹鳟全鱼常规成分的影响 Table 3 Effects of different astaxanthin sources on whole body routine composition of rainbow trout |
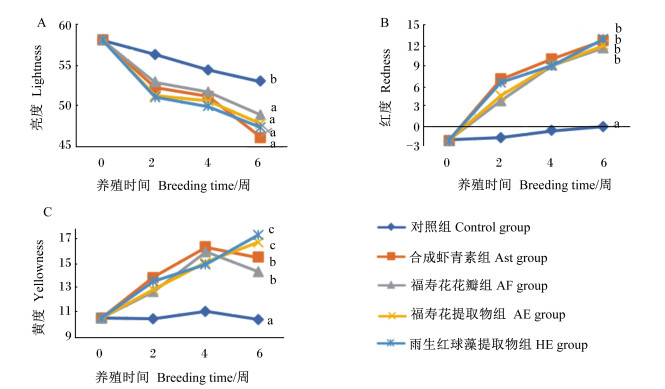
由图 1可知,随着养殖时间的延长,各组虹鳟肌肉亮度值减小,肌肉红度值增大;Ast、AF、AE和HE组的肌肉亮度值在各时间点上均显著低于对照组(P < 0.05),红度和黄度值显著高于对照组(P < 0.05);在第6周时,各虾青素添加组间的肌肉亮度、红度值无显著差异(P>0.05),AE和HE组的肌肉黄度值显著高于Ast和AF组(P < 0.05)。
|
数据点标注不同小写字母表示差异显著(P < 0.05)。 Data points with different small letters mean significant difference (P < 0.05). 图 1 不同来源虾青素对虹鳟肌肉色差的影响 Fig. 1 Effects of different astaxanthin sources on flesh chromatism of rainbow trout |
由表 4可知,各虾青素添加组的不同组织中虾青素含量均随养殖时间的增加而升高。在第2、4、6周时,Ast、AF、AE和HE组的肌肉、皮肤和尾鳍虾青素含量均显著高于对照组(P < 0.05);第6周时,HE组的肌肉虾青素含量最高,AF组的皮肤和尾鳍虾青素含量最高;在全鱼虾青素含量和虾青素沉积率方面,Ast、AF、AE和HE组均无显著差异(P>0.05),全鱼虾青素含量均显著高于对照组(P < 0.05),虾青素沉积率均显著低于对照组(P < 0.05)。
|
|
表 4 不同来源虾青素对虹鳟各组织虾青素含量和沉积率的影响 Table 4 Effects of different astaxanthin sources on astaxanthin content and retention in tissue of rainbow trout |
由表 5可知,各组血清类胡萝卜素含量随养殖时间的增加而增加,Ast、AF(除第2周外)、AE和HE组血清类胡萝卜素含量在第2、4、6周时均显著高于对照组(P < 0.05),且在第4、6周时相互之间无显著差异(P>0.05)。
|
|
表 5 不同来源虾青素对虹鳟血清类胡萝卜素含量的影响 Table 5 Effects of different astaxanthin sources on serum carotenoid contents of rainbow trout |
由表 6可知,各虾青素添加组肌肉和血清的T-SOD活性和MDA含量均显著低于对照组(P < 0.05),Ast、AF、AE和HE组各组织的抑制羟自由基能力均显著高于对照组(P < 0.05);AF组的肌肉抗氧化指标与AE组无显著差异(P>0.05),但肝脏抑制羟自由基能力显著低于AE组(P < 0.05),血清T-SOD活性显著高于AE组(P < 0.05);AE和HE组的肌肉、肝脏和血清抗氧化指标与Ast组均无显著差异(P>0.05)。
|
|
表 6 不同来源虾青素对虹鳟肌肉、肝脏和血清抗氧化能力的影响 Table 6 Effects of different astaxanthin sources on antioxidant ability of flesh, liver and serum of rainbow trout |
由表 7可知,各组的滴水损失随时间的延长而增加,Ast、AE和HE组的滴水损失(除Ast组2 h的滴水损失外)和冷冻损失均显著低于对照组(P < 0.05);此外,AF组4、6 h的滴水损失也显著低于对照组(P < 0.05),冷冻损失与对照组无显著差异(P>0.05)。
|
|
表 7 不同来源虾青素对虹鳟肌肉持水力的影响 Table 7 Effects of different astaxanthin sources on flesh water-holding capacity of rainbow trout |
关于Ast和HP对鱼类生长的影响均存在不同报道。Christiansen等[21]和王磊等[22]分别在大西洋鲑鱼种(1.75 g)和七彩神仙鱼饲料中添加Ast和HP,两者的生长性能均得到了显著提高。然而,Page等[23]、Yanar等[24]和Amar等[25]分别在饲料中添加50、70和100 mg/kg Ast,对虹鳟的生长性能均无显著影响。Pham等[2]在饲料中添加2.0 g/kg HE(折算成虾青素含量为100 mg/kg),对牙鲆幼鱼增重率、特定生长率和存活率也无显著影响。本试验中,Ast和HE的添加,对虹鳟的生长性能也无显著影响,尽管两者的饲料系数略高于对照组,但无显著差异,可能是由试验误差引起。虾青素对鱼类生长性能的作用效果,可能与鱼的种类、性别、生长阶段、饲料组成、养殖条件等因素有关。
本试验中,AF的添加虽然对虹鳟存活率没有产生影响(为100%),却降低了鱼体生长性能,这在一定程度上反映了花瓣中所含的生物碱、强心甙等有毒有害物质对摄食和饲料利用产生了负面影响,表明AF不宜直接添加到虹鳟饲料中。为减轻或消除AF中有毒有害物的影响,对其中的虾青素进行提取是一条有效的途径。强心甙是水溶性物质,而虾青素的提取是一个有机溶剂萃取的过程,故AE中已基本不含强心甙物质。有研究表明,饲料中添加0.01%的AE(折算成虾青素添加量为100 mg/kg)对虹鳟生长性能无显著影响[8],本试验在饲料中添加3.4 g/kg AE,对虹鳟的生长性能也没有产生不利影响。今后,福寿花资源的开发利用应走活性物质提取这条道路。
3.2 不同来源虾青素对虹鳟肉色和虾青素沉积的影响虹鳟的肌肉红度值是其品质的一个重要评价标准,主要取决于体内虾青素的沉积。Rahman等[26]以添加100 mg/kg Ast的饲料饲喂体重18.5 g的虹鳟10周,显著增加了肌肉红度值,肌肉虾青素含量达到6.1 mg/kg。Zhang等[19]用添加了100 mg/kg的Ast饲料饲喂101 g的虹鳟60 d,肌肉红度值显著增加,虾青素含量达到8.03 mg/kg;De La Mora等[27]在饲料中添加80 mg/kg Ast,饲喂体重161 g的虹鳟6周后,肌肉虾青素含量可达8.8 mg/kg。本试验虹鳟养殖6周后,HE和AE组的肌肉红度值、虾青素含量均显著增加,达到和Ast一致的水平,但肌肉虾青素含量偏低,仅为4.96~5.26 mg/kg,可能与养殖时间较短(6周)以及试验鱼的规格较小有关(初重为6.28 g)。在养殖生产中,通常是在上市前一段时间对虹鳟肌肉进行着色,本试验采用的虹鳟规格较小,主要是考虑到小规格鱼种在实验室条件下易于开展养殖,可在更大范围内进行虾青素源的筛选,从而为虹鳟成鱼着色试验的开展奠定基础。
此外,本试验在饲料中分别添加Ast、AF和AE均显著提高了虹鳟的肌肉红度和黄度值;其中Ast和AE组在养殖6周末,肌肉红度值和虾青素含量均无显著差异,这与Kamata等[28]在虹鳟上的研究结果一致。然而,Kamata等[8]发现在饲料中添加5.05% AF(折算成虾青素添加量为100 mg/kg)对虹鳟的肉色无显著影响,其原因可能是试验饲料在制作5~6 d后出现了轻微变味,对虹鳟的摄食量产生了较大影响,从而导致色素沉积效果较差。
AF和HP中的虾青素多数以酯的形式存在[29],而人工Ast为游离态[9]。有研究表明,酯化虾青素更有利于动物体吸收,这可能与虾青素酯极性小,在消化道中的溶解性好有关[30-31];而Henmi等[32]认为,在同等虾青素添加量下,游离虾青素的着色效果优于酯化虾青素,这可能是因为游离虾青素与肌动球蛋白结合紧密,单酯化的虾青素与肌动球蛋白结合弱,而二酯则完全不结合[32],由此导致酯化虾青素的沉积效果差。然而,在本试验中,AF、AE和HE组的虾青素沉积与Ast组无显著差异,与Bowen等[33]用添加单酯、双酯和Ast的饲料饲喂虹鳟的研究结果一致。Schiedt[34]和周庆新等[35]研究认为,虾青素酯进入动物体后需要进行水解才能被吸收利用。苏芳[36]的研究也发现,雨生红球藻源虾青素在虹鳟体内传递的过程中发生了脱酯化。这些研究均表明,虾青素的酯化并不影响虹鳟对其的吸收利用。
3.3 不同来源虾青素对虹鳟抗氧化能力的影响Rahman等[26]和Zhang等[19]分别在饲料中添加50和100 mg/kg虾青素投喂虹鳟,显著降低了血清SOD活性;虹鳟摄食添加红法夫酵母[37]和Ast[18-19]的饲料后,肌肉MDA含量显著降低。此外,在马脂鲤(Hyphessobrycon eques Steindachner)、艳脂鲤(Hyphessobrycon callistus)和斑节对虾(Penaeus monodon)饲料中添加Ast也显著提高了机体抗氧化能力[38-40]。同时,饲料中添加虾青素还能增强虹鳟血清、肌肉和肝脏抑制羟自由基的能力[18, 26]。本试验在饲料中分别添加AE和HE,虹鳟肌肉、肝脏和血清中的抑制羟自由基能力显著提高,T-SOD活性和MDA含量显著降低,达到与Ast一致水平。虾青素的抗氧化性能与其两端的紫罗兰酮环上的不饱和酮基和羟基有关,这些结构均具有较活泼的电子效应,可以吸引自由基或者向自由基提供电子,最终达到清除自由基,提高抗氧化的目的[41]。
系水力是指当肌肉受到加压、冷冻等外力作用时仍保持原有水分的能力,是反映肌肉品质的一个重要指标,当肌肉暴露于空气中,会受到一定程度的氧化,致使肌肉表面水分挥发,使得滴水损失增加;当肌肉中存在如虾青素、维生素E等抗氧化物质时,可以减轻细胞膜的氧化程度,增强肌肉系水力[19, 42]。在本试验中,Ast、AE和HE组的滴水损失和冷冻损失较对照组均有显著降低(Ast组2 h滴水损失除外)。可见,在饲料中添加Ast、AE和HE均能延长虹鳟肌肉的货架寿命。本试验还发现,AE组在6 h的肌肉滴水损失低于Ast和HE组,这意味着AE改善肌肉货架寿命的能力可能强于Ast和HE,这是否与AE中的其他抗氧化物质有关,有待于进一步研究。
4 结论饲料中添加AE、HE能有效改善虹鳟肌肉颜色,增强机体抗氧化能力,达到和添加Ast一致的效果,但AF不宜直接用作虹鳟的着色剂。
| [1] |
BAKER R T M, PFEIFFER A M, SCHÖNER F J, et al. Pigmenting efficacy of astaxanthin and canthaxanthin in fresh-water reared Atlantic salmon, Salmo salar[J]. Animal Feed Science and Technology, 2002, 99(1/2/3/4): 97-106. |
| [2] |
PHAM M A, BYUN H G, KIM K D, et al. Effects of dietary carotenoid source and level on growth, skin pigmentation, antioxidant activity and chemical composition of juvenile olive flounder Paralichthys olivaceus[J]. Aquaculture, 2014, 431: 65-72. DOI:10.1016/j.aquaculture.2014.04.019 |
| [3] |
STOREBAKKEN T, SØRENSEN M, BJERKENG B, et al. Utilization of astaxanthin from red yeast, Xanthophyllomyces dendrorhous, in rainbow trout, Oncorhynchus mykiss:effects of enzymatic cell wall disruption and feed extrusion temperature[J]. Aquaculture, 2004, 236(1/2/3/4): 391-403. |
| [4] |
TEIMOURI M, AMIRKOLAIE A K, YEGANEH S. The effects of Spirulina platensis meal as a feed supplement on growth performance and pigmentation of rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 2013, 396: 14-19. |
| [5] |
YUAN J P, CHEN F, LIU X, et al. Carotenoid composition in the green microalga Chlorococcum[J]. Food Chemistry, 2002, 76(3): 319-325. DOI:10.1016/S0308-8146(01)00279-5 |
| [6] |
RENSTRØM B, BERGER H, LIAAEN-JENSEN S. Esterified, optically pure (3S, 3'S)-astaxanthin from flowers of Adonis annua[J]. Biochemical Systematics and Ecology, 1981, 9(4): 249-250. DOI:10.1016/0305-1978(81)90003-X |
| [7] |
HOSSEINI M, TAHERKHANI M, GHORBANI NOHOOJI M. Introduction of Adonis aestivalis as a new source of effective cytotoxic cardiac glycoside[J]. Natural Product Research, 2019, 33(6): 915-920. DOI:10.1080/14786419.2017.1413573 |
| [8] |
KAMATA T, NEAMTU G, TANAKA Y, et al. Utilization of Adonis aestivalis as a dietary pigment source for rainbow trout Salmo gairdneri[J]. Nippon Suisan Gakkaishi, 1990, 56(5): 783-788. DOI:10.2331/suisan.56.783 |
| [9] |
LORENZ R T, CYSEWSKI G R. Commercial potential for Haematococcus microalgae as a natural source of astaxanthin[J]. Trends in Biotechnology, 2000, 18(4): 160-167. DOI:10.1016/S0167-7799(00)01433-5 |
| [10] |
AL-BULISHI M S M, XUE C H, TANG Q J. Health aspects of astaxanthin:a review[J]. Canadian Journal of Clinical Nutrition, 2015, 3(2): 71-78. DOI:10.14206/canad.j.clin.nutr.2015.02.08 |
| [11] |
HAGEN C, SIEGMUND S, BRAUNE W. Ultrastructural and chemical changes in the cell wall of Haematococcus pluvialis (Volvocales, Chlorophyta) during aplanospore formation[J]. European Journal of Phycology, 2002, 37(2): 217-226. DOI:10.1017/S0967026202003669 |
| [12] |
SHEIKHZADEH N, TAYEFI-NASRABADI H, OUSHANI A K, et al. Effects of Haematococcus pluvialis supplementation on antioxidant system and metabolism in rainbow trout (Oncorhynchus mykiss)[J]. Fish Physiology and Biochemistry, 2012, 38(2): 413-419. DOI:10.1007/s10695-011-9519-7 |
| [13] |
TOLASA S, CAKLI S, OSTERMEYER U. Determination of astaxanthin and canthaxanthin in salmonid[J]. European Food Research and Technology, 2005, 221(6): 787-791. DOI:10.1007/s00217-005-0071-5 |
| [14] |
TEJERA N, CEJAS J R, RODRIGUEZ C, et al. Pigmentation, carotenoids, lipid peroxides and lipid composition of skin of red porgy (Pagrus pagrus) fed diets supplemented with different astaxanthin sources[J]. Aquaculture, 2007, 270(1/2/3/4): 218-230. |
| [15] |
LI M, WU W J, ZHOU P P, et al. Comparison effect of dietary astaxanthin and Haematococcus pluvialis on growth performance, antioxidant status and immune response of large yellow croaker Pseudosciaena crocea[J]. Aquaculture, 2014, 434: 227-232. DOI:10.1016/j.aquaculture.2014.08.022 |
| [16] |
ZAŤKOVÁ I, SERGEJEVOVÁ M, URBAN J, et al. Carotenoid-enriched microalgal biomass as feed supplement for freshwater ornamentals:albinic form of wels catfish (Silurus glanis)[J]. Aquaculture Nutrition, 2011, 17(3): 278-286. DOI:10.1111/j.1365-2095.2009.00751.x |
| [17] |
JU Z Y, DENG D F, DOMINY W G, et al. Pigmentation of Pacific White shrimp, Litopenaeus vannamei, by dietary astaxanthin extracted from Haematococcus pluvialis[J]. Journal of the World Aquaculture Society, 2011, 42(5): 633-644. DOI:10.1111/j.1749-7345.2011.00511.x |
| [18] |
ZHAO X X, HU J, ZHANG X Q, et al. Effects of E/Z isomers and coating materials of astaxanthin products on the pigmentation and antioxidation of rainbow trout, Oncorhynchus mykiss[J]. Journal of the World Aquaculture Society, 2016, 47(3): 341-351. DOI:10.1111/jwas.12277 |
| [19] |
ZHANG J J, LI X Q, LENG X J, et al. Effects of dietary astaxanthins on pigmentation of flesh and tissue antioxidation of rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture International, 2013, 21(3): 579-589. DOI:10.1007/s10499-012-9590-9 |
| [20] |
SONG X L, WANG L, LI X Q, et al. Dietary astaxanthin improved the body pigmentation and antioxidant function, but not the growth of discus fish (Symphysodon spp.)[J]. Aquaculture Research, 2017, 48(4): 1359-1367. DOI:10.1111/are.13200 |
| [21] |
CHRISTIANSEN R, TORRISSEN O J. Growth and survival of Atlantic salmon, Salmo salar L.fed different dietary levels of astaxanthin.Juveniles[J]. Aquaculture Nutrition, 1996, 2(1): 55-62. DOI:10.1111/j.1365-2095.1996.tb00008.x |
| [22] |
王磊, 陈再忠, 冷向军, 等. 饲料中添加雨生红球藻对七彩神仙鱼生长、体色及抗氧化力的影响[J]. 淡水渔业, 2016, 46(6): 92-97. WANG L, CHEN Z Z, LENG X J, et al. Effect of Haematococcus pluvialis on growth, body color andantioxidation capacity of discus fish Symphysodon haraldi[J]. Freshwater Fisheries, 2016, 46(6): 92-97 (in Chinese). DOI:10.3969/j.issn.1000-6907.2016.06.016 |
| [23] |
PAGE G I, DAVIES S J. Tissue astaxanthin and canthaxanthin distribution in rainbow trout (Oncorhynchus mykiss) and Atlantic salmon (Salmo salar)[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2006, 143(1): 125-132. |
| [24] |
YANAR Y, BÜYÜKÇAPAR H, YANAR M, et al. Effect of carotenoids from red pepper and marigold flower on pigmentation, sensory properties and fatty acid composition of rainbow trout[J]. Food Chemistry, 2007, 100(1): 326-330. DOI:10.1016/j.foodchem.2005.09.056 |
| [25] |
AMAR E C, KIRON V, SATOH S, et al. Influence of various dietary synthetic carotenoids on bio-defence mechanisms in rainbow trout, Oncorhynchus mykiss (Walbaum)[J]. Aquaculture Research, 2001, 32(Suppl.1): 162-173. |
| [26] |
RAHMAN M M, KHOSRAVI S, CHANG K H, et al. Effects of dietary inclusion of astaxanthin on growth, muscle pigmentation and antioxidant capacity of juvenile rainbow trout (Oncorhynchus mykiss)[J]. Preventive Nutrition and Food Science, 2016, 21(3): 281-288. DOI:10.3746/pnf.2016.21.3.281 |
| [27] |
DE LA MORA G I, ARREDONDO-FIGUEROA J L, PONCE-PALAFOX J T, et al. Comparison of red chilli (Capsicum annuum) oleoresin and astaxanthin on rainbow trout (Oncorhyncus mykiss) fillet pigmentation[J]. Aquaculture, 2006, 258(1/2/3/4): 487-495. |
| [28] |
KAMATA T, TANAKA Y, YAMADA S, et al. Study of carotenoid composition and fatty acids of astaxanthin diester in rainbow trout Salmo gairdneri fed the Adonis extract[J]. Nippon Suisan Gakkaishi, 1990, 56(5): 789-794. DOI:10.2331/suisan.56.789 |
| [29] |
MAOKA T, ETOH T, KISHIMOTO S, et al. Carotenoids and their fatty acid esters in the petals of Adonis aestivalis[J]. Journal of Oleo Science, 2011, 60(2): 47-52. DOI:10.5650/jos.60.47 |
| [30] |
SOMMER T R, POTTS W T, MORRISSY N M. Utilization of microalgal astaxanthin by rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 1991, 94(1): 79-88. DOI:10.1016/0044-8486(91)90130-Y |
| [31] |
HORN D, RIEGER J. Organic nanoparticles in the aqueous phase-theory, experiment, and use[J]. Angewandte Chemie (International Edition), 2001, 40(23): 4330-4361. DOI:10.1002/1521-3773(20011203)40:23<4330::AID-ANIE4330>3.0.CO;2-W |
| [32] |
HENMI H, IWATA T, HATA M. Studies on the carotenoids in the muscle of salmons Ⅰ.Intracellular distribution of carotenoids in the muscle studies on the carotenoids in the muscle of salmons[J]. Tohoku Journal of Agricultural Research, 1987, 37(3/4): 101-111. |
| [33] |
BOWEN J, SOUTAR C, SERWATA R D, et al. Utilization of (3S, 3'S)-astaxanthin acyl esters in pigmentation of rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture Nutrition, 2002, 8(1): 59-68. DOI:10.1046/j.1365-2095.2002.00190.x |
| [34] |
SCHIEDT K.Absorption and metabolism of carotenoids in birds, fish and crustaceans[M]//BRITTON G, LIAAEN-JENSEN S, PFANDER H.Carotenoids volume 3: biosynthesis and metabolism.Basel, Switzerland: Birkhäuser, 1998: 285-358.
|
| [35] |
周庆新, 杨鲁, 徐杰. 雨生红球藻源虾青素酯的消化吸收特性研究[J]. 中国食品学报, 2019, 19(4): 125-132. ZHOU Q X, YANG L, XU J, et al. Studies on the digestion and absorption characteristics of esterified astaxanthins from Haematococcus pluvialis[J]. Journal of Chinese Institute of Food Science and Technology, 2019, 19(4): 125-132 (in Chinese). |
| [36] |
苏芳.类胡萝卜素在藻虾蟹鱼中的结构分布特征及虾青素异构化研究[D].博士学位论文.青岛: 中国科学院海洋研究所, 2018: 93-99. SU F.A study on the structure distribution of carotenoids in algae, shrimps, crabs and fishes and the isomerization of astaxanthin[D]. Ph.D.Thesis.Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2018: 93-99.(in Chinese) |
| [37] |
NAKANO T, KANMURI T, SATO M, et al. Effect of astaxanthin rich red yeast (Phaffia rhodozyma) on oxidative stress in rainbow trout[J]. Biochimica et Biophysica Acta:General Subjects, 1999, 1426(1): 119-125. DOI:10.1016/S0304-4165(98)00145-7 |
| [38] |
PAN C H, CHIEN Y H, WANG Y J, et al. Antioxidant defence to ammonia stress of characins (Hyphessobrycon eques Steindachner) fed diets supplemented with carotenoids[J]. Aquaculture Nutrition, 2011, 17(3): 258-266. DOI:10.1111/j.1365-2095.2009.00747.x |
| [39] |
WANG Y J, CHIEN Y W, PAN C H, et al. Effects of dietary supplementation of carotenoids on survival, growth, pigmentation, and antioxidant capacity of characins, Hyphessobrycon callistus[J]. Aquaculture, 2006, 261(2): 641-648. DOI:10.1016/j.aquaculture.2006.08.040 |
| [40] |
PAN C H, CHIEN Y H, HUNTER B. The resistance to ammonia stress of Penaeus monodon Fabricius juvenile fed diets supplemented with astaxanthin[J]. Journal of Experimental Marine Biology and Ecology, 2003, 297(1): 107-118. |
| [41] |
NAGUIB Y M A. Antioxidant activities of astaxanthin and related carotenoids[J]. Journal of Agricultural and Food Chemistry, 2000, 48(4): 1150-1154. DOI:10.1021/jf991106k |
| [42] |
李小勤, 胡斌, 冷向军, 等. VE对草鱼成鱼肌肉品质和抗氧化性能的影响[J]. 水生生物学报, 2009, 33(6): 1132-1139. LI X Q, HU B, LENG X J, et al. Effect of supplemental VE on meat quality and antioxidant capacity of adult grass carp[J]. Acta Hydrobiologica Sinica, 2009, 33(6): 1132-1139 (in Chinese). |




