2. 广东省名特优鱼类生殖调控与繁育工程技术研究中心, 湛江 524088;
3. 广东省海水养殖生物育种工程实验室, 湛江 524088;
4. 广东省水产经济动物病原生物学及流行病学重点实验室, 湛江 524088
2. Guangdong Research Center on Reproductive Control and Breeding Technology of Indigenous Valuable Fish Species, Zhanjiang 524088, China;
3. Guangdong Provincial Engineering Laboratory for Mariculture Organism Breeding, Zhanjiang 524088, China;
4. Guangdong Provincial Key Laboratory of Pathogenic Biology and Epidemiology for Aquatic Economic Animals, Zhanjiang 524088, China
单宁是广泛存在于植物叶、茎、树皮、种子和花的细胞壁和液泡之中的复杂酚类次生代谢产物[1],其中水解单宁(hydrolyzable tannins, HTs)是通过葡萄糖与没食子酸发生氧化反应得到的具有较强生物活性的产物,分子质量在500~3 000 u[2]。水解单宁是许多传统草药中的有效成分,如能够治疗心血管疾病的牡丹根、具有止血消炎效果的五倍子和对肠道黏膜具有保护作用的山枝叶等[3]。以往因单宁可与蛋白质发生交联反应,表现出收敛性,进而阻碍动物体的消化吸收,所以长期被视为抗营养因子。近年来随着对单宁的深入研究,发现单宁独特的化学结构使其作为饲料添加剂能对动物机体产生各种促进作用,如抗氧化作用、抑菌作用,利用这一特性可以防治动物腹泻及反刍动物发生瘤胃胀气,提高生长性能和通过抑制肠道中的病原菌来改善菌群结构[4]。
珍珠龙胆石斑鱼(Epinephelus lanceolatus♂ ×Epinephelus fuscoguttatus ♀)是近年来通过杂交得到的石斑鱼新品种,其头似虎斑,尾似龙胆,身体两侧的斑纹似珍珠[5],具有生长快速和抵抗力强的杂交优势,是一种极具潜力的商业养殖品种。珍珠龙胆石斑鱼目前主要在我国广东、福建、海南等石斑鱼养殖大省集中养殖,因其具有生长快、抗病强、性格温顺等特点,能够很好地适应池塘、网箱及工厂化等高密度的养殖环境[6]。但因高密度养殖模式的推广及发展,且针对高密度养殖所带来的疾病问题缺少研究和解决办法,因此给水产行业育苗与成鱼养殖带来严重的经济损失。
目前,国内外主要针对提高珍珠龙胆石斑鱼的繁育技术和改良养殖方法等方面进行研究[7],有关该鱼种的营养学、生长与免疫增强剂等方面的研究则报道较少,有待进行深入研究。本试验通过在珍珠龙胆石斑鱼基础饲料中添加不同比例的水解单宁,从生长性能、抗氧化相关酶活性、抗氧化相关基因表达水平、肠道组织结构与菌群多样性等方面研究水解单宁对该种石斑鱼的影响,以期寻找出水解单宁对该种石斑鱼配合饲料的最适添加量,为实际生产提供理论指导。
1 材料与方法 1.1 试验设计根据珍珠龙胆石斑鱼的营养需求配制基础饲料,在基础饲料配方的基础上分别以0、0.05%、0.10%、0.15%和0.20%的水解单宁替代等量微晶纤维素,配制5种试验饲料,其组成及营养水平见表 1。水解单宁购于斯洛文尼亚某公司。试验饲料根据配方制备完成后于通风处放置,晾干后于4 ℃冰箱内保存备用。
|
|
表 1 试验饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
试验所用珍珠龙胆石斑鱼购于湛江市东海岛石斑鱼苗厂,在位于湛江市东海岛的广东海洋大学东海岛试验基地进行养殖试验。将珍珠龙胆石斑鱼暂养在已经消毒处理的暂养池中并使用基础饲料驯化饲养2周。正常摄食后从中选取出600尾大小统一、健康无损伤、有活力、平均体重为(21.43±1.31) g的个体作为试验用鱼。将600尾试验用鱼随机分为5组,每组设3个重复,每个重复40尾,以重复为单位放养于2 m3的网箱中,分别投喂水解单宁添加量为0(F0组,作为对照组)、0.05%(F1组)、0.10%(F2组)、0.15%(F3组)和0.20%(F4组)的试验饲料。每天定量投喂2次,分别在07:00和18:00进行,投喂量根据试验鱼的生长情况进行调整。养殖试验期间,24 h持续充气,溶氧浓度≥6 mg/L,水温为(30.0±1.5) ℃,pH为8.0±0.2,养殖周期60 d。
1.3 样品采集养殖试验后采集样品,样品采集前24 h停止投料,从每组的每个网箱中随机抓取9尾珍珠龙胆石斑鱼测量体长和体重等生长数据。使用一次性无菌注射器(1 mL)在尾静脉处采取血样,4 ℃静置4 h后将血液放至高速冷冻离心机(Eppendorf,德国)进行离心(4 ℃,3 500 r/min,10 min),取上清液于1.5 mL离心管中,保存在-80 ℃超低温冰箱待用;用灭菌后的工具剪取肝脏,放于1.5 mL离心管中,液氮速冻后转至-80 ℃超低温冰箱保存;血清样本用于酶活性的测定,肝脏样本用于酶活性的测定以及总RNA的提取和抗氧化相关基因表达量的测定;取中肠放置于Bouin氏液中固定后用于肠道组织结构分析;参考尚碧娇等[9]的试验方法采集肠道菌群分析所用样品。
1.4 指标测定 1.4.1 生长性能生长性能相关指标的计算公式如下:

|
式中:W0表示初始体重(g);Wt表示终末体重(g);t为试验天数(d);F为试验期内摄食的饲料量(g);L表示体长(cm);N0表示初始尾数;Nt表示终末尾数。
1.4.2 血清和肝脏酶活性称取1 g肝脏组织样本放于试管中,加入其9倍体积的磷酸盐缓冲溶液,破碎匀浆后放入离心机进行离心(4 ℃,4 000 r/min,10 min),取匀浆上清液在4 ℃保存。
血清和肝脏匀浆上清液的碱性磷酸酶(alkaline phosphatase, AKP)、酸性磷酸酶(acid phosphatase, ACP)和超氧化物歧化酶(superoxide dismutase, SOD)活性均使用商业试剂盒(南京建成生物工程研究所产品)检测。测定操作过程严格遵守试剂盒说明书进行,确保测量结果的准确性。
1.4.3 肝脏抗氧化相关基因表达量 1.4.3.1 总RNA的提取及cDNA的合成使用TRIzol试剂(Invitrogen, 美国)进行珍珠龙胆石斑鱼肝脏总RNA的提取,操作步骤严格按照试剂说明书进行。将提取的总RNA用浓度1.5%的琼脂糖凝胶进行电泳,之后在全自动数码凝胶图像分析系统(Tanon, 上海)观察其完整性。使用Nano Drop 2000c(Thermo Fisher Scientific,美国)微量分光光度计,分别在260、280 nm下检测吸光度(OD)值,OD260 nm与OD280 nm比值在1.8~2.0的样品保存于-80 ℃超低温冰箱用于后续试验。
使用反转录酶试剂盒(TaKaRa, 日本)将所提取的肝脏总RNA反转录成cDNA,操作步骤严格参照试剂盒说明书进行。使用PCR仪扩增并将扩增后的产物于-20 ℃冰箱保存,用于之后的实时荧光定量PCR(RT-qPCR)。
1.4.3.2 引物设计谷胱甘肽过氧化物酶(glutathione peroxidase, GPx)、锰超氧化物歧化酶(manganese superoxide dismutase, Mn-SOD)、过氧化氢酶(catalase, CAT)基因引物的设计参照文献[10],引物均由上海生工生物工程股份有限公司合成,内参基因β-肌动蛋白(β-actin)以及目的基因GPx、Mn-SOD、CAT的引物序列见表 2。
|
|
表 2 RT-qPCR所用引物序列 Table 2 Primer sequences used for RT-qPCR |
RT-qPCR按照SYBR Green qPCR Mix (with ROX)试剂盒(广州东盛生物科技有限公司)说明书进行操作,具体反应体系见表 3。试验仪器为LightCycler 480荧光定量PCR仪。反应程序如下:94 ℃预变性3 min;94 ℃变性15 s,60 ℃退火15 s,72 ℃延伸20 s,循环40次。目的基因mRNA的相对表达量使用2-ΔΔCt法[11]计算。
|
|
表 3 RT-qPCR体系 Table 3 RT-qPCR system |
采用苏木精-伊红(HE)染色法制作切片后观察中肠道组织形态,具体方法参考林佳洁[12]的报道。
1.4.5 肠道菌群 1.4.5.1 DNA提取及测序按照DNA提取试剂盒(北京天根生化科技有限公司)说明书进行肠道微生物总DNA的提取。将提取后肠道微生物总DNA用正向序列341F(5′-CCTAYGGGRBGCASCAG-3′)和反向序列为806F(5′-GGACTACNNGGGTATCTAAT-3′)的特定引物进行PCR扩增。回收的PCR产物,利用Illumina MiSeq平台(北京诺禾致源科技股份有限公司)进行高通量测序。
1.4.5.2 肠道菌群生物信息分析使用Cutadapt(V1.9.1,http://cutadapt.readthedocs.io/en/stable/)[13]先对reads进行低质量部分剪切,再根据Barcode从得到的reads中拆分出各样品数据,原始数据(raw reads)通过链接质控去除Barcode和引物序列,reads序列通过(https://github.com/torognes/vsearch/)[14]与物种注释数据库进行比对检测嵌合体序列,并最终去除其中的嵌合体序列[15],得到最终的有效数据(clean reads)。利用Uparse软件(v7.0.1001,http://www.drive5.com/uparse/)[16]对所有样品的全部clean reads进行聚类,默认以97%的一致性(identity)将序列聚类成为操作分类单元(operational taxonomic units,OTUs),同时选取出现频率最高的序列根据算法筛选为OTUs的代表性序列。对OTUs序列进行物种注释,用Mothur方法与SILVA132(http://www.arb-silva.de/)[17]的SSUrRNA数据库[18]进行物种注释分析(设定阈值为0.8~1.0),获得分类学信息并统计各样本的群落构成。对质控和过滤得到的优化数据进行OTUs聚类,并根据97%的相似水平,利用Usearch软件(v7.0.1001,http://www.drive5.com/uparse/)[16]将得到的所有样品序列聚类成为OTUs。通过RDP Classifier贝叶斯算法(http://sourceforge.net/projects/rdp-classifier/)[19]与GreenGene数据库(http://greengenes.lbl.gov/cgi-bin/nph-index.cgi)[20]进行物种注释分析,再对OTUs进行丰度、多样性指数和各分类水平的群落构成等分析。
1.5 数据统计与分析使用Excel 2016对数据进行处理,并制作相关图表。利用SPSS 18.0对试验数据进行单因素方差分析(one-way ANOVA),若组间差异显著,则采用Duncan氏法进行多重比较检验,显著性水平设为P < 0.05。数据以平均值±标准差(mean±SD)来表示。
2 结果与分析 2.1 水解单宁对珍珠龙胆石斑鱼生长性能的影响由表 4可知,饲料中添加水解单宁对CF、SR均无显著影响(P>0.05)。随着饲料中水解单宁添加量的增加,WGR呈现先升高后降低的趋势,且F2组的WGR显著高于F0组和其他试验组(P < 0.05);SGR与WGR呈现相同的变化趋势,F2组的SGR显著高于F0和F4组(P < 0.05),其他各组间无显著差异(P>0.05)。FCR则是随着水解单宁添加量的增加呈现先降低后升高的趋势,并且F2组显著低于F0组和其他试验组(P < 0.05)。以WGR为判断依据,构建二次曲线回归模型,得出WGR(y)与水解单宁添加量(x)的回归方程y=-6 153.9x2+1 254.8x+303.63(R2=0.710 5),由此得出水解单宁添加量为0.10%时有最佳的WGR(图 1)。
|
|
表 4 水解单宁对珍珠龙胆石斑鱼生长性能的影响 Table 4 Effects of HTs on growth performance of pearl gentian grouper (Epinephelus lanceolatus♂ × Epinephelus fuscoguttatus ♀) |
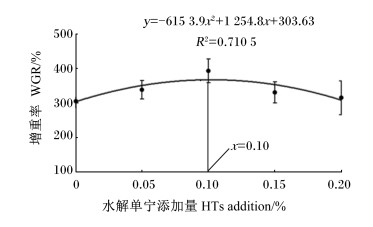
|
图 1 水解单宁添加量与珍珠龙胆石斑鱼增重率的关系 Fig. 1 Relationship between HTs addition and WGR of pearl gentian grouper (Epinephelus lanceolatus♂ × Epinephelus fuscoguttatus ♀) |
血清AKP、ACP、SOD活性随着水解单宁添加量的增加呈现先上升后下降的趋势,其中F2和F3组血清AKP活性显著高于F0组(P < 0.05)(图 2-A),F1、F2和F3组血清ACP活性显著高于F0组(P < 0.05)(图 2-B),F2、F3和F4组血清SOD活性显著高于F0组(P < 0.05)(图 2-C)。
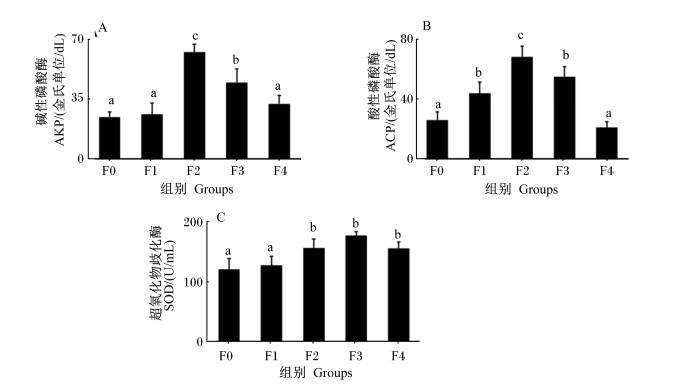
|
数据柱标注不同小写字母表示差异显著(P < 0.05)。下图同。 Value columns with different small letters mean significant difference (P < 0.05). The same as below. 图 2 水解单宁对珍珠龙胆石斑鱼血清酶活性的影响 Fig. 2 Effects of HTs on serum enzymatic activities of pearl gentian grouper (Epinephelus lanceolatus♂ × Epinephelus fuscoguttatus ♀) |
F2、F3和F4组肝脏AKP和ACP活性显著高于F0组(P < 0.05)(图 3-A和图 3-B);F1和F4组肝脏SOD活性显著低于F0组(P < 0.05),F2和F3组肝脏SOD活性则显著高于F0组(P < 0.05)(图 3-C)。
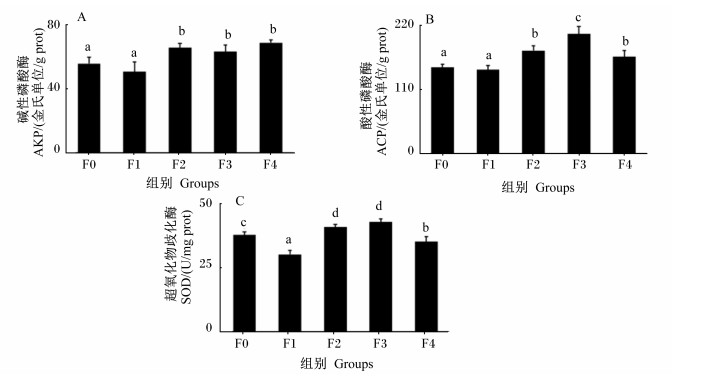
|
图 3 水解单宁对珍珠龙胆石斑鱼肝脏酶活性的影响 Fig. 3 Effects of HTs on liver enzymatic activities of pearl gentian grouper (Epinephelus lanceolatus♂ × Epinephelus fuscoguttatus ♀) |
由图 4可知,各试验组肝脏CAT mRNA的相对表达量均显著高于F0组(P < 0.05),且F2和F4组显著高于F1和F3组(P < 0.05);肝脏Mn-SOD和GPx mRNA的相对表达量变化趋势一致,均表现为F2、F3和F4组显著高于F0和F1组(P < 0.05)。
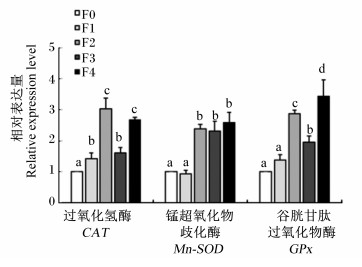
|
F0:F0组F0 group;F1:F1组F1 group;F2:F2组F2 group;F3:F3组F3 group;F4:F4组F4 group。下图同The same as below。 图 4 水解单宁对珍珠龙胆石斑鱼肝脏抗氧化相关基因表达的影响 Fig. 4 Effects of HTs on relative mRNA expression levels of liver antioxidant-related genes of pearl gentian grouper (Epinephelus lanceolatus♂ × Epinephelus fuscoguttatus ♀) |
如图 5所示,水解单宁不同程度地影响了珍珠龙胆石斑鱼的肠道组织形态。5组珍珠龙胆石斑鱼肠道结构完整,肠壁完整;但是F0组绒毛相对稀疏且高度较低,F1组虽然绒毛高但是较为稀疏,F2和F3组绒毛高且密集,F4组与F1组则相反,绒毛密集但是高度低。
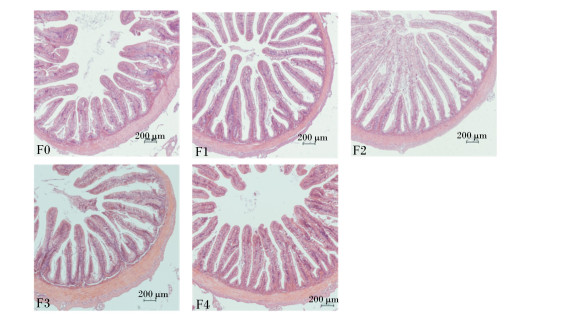
|
图 5 水解单宁对珍珠龙胆石斑鱼肠道组织形态的影响 Fig. 5 Effects of HTs on intestinal histomorphology of pearl gentian grouper (Epinephelus lanceolatus♂ × Epinephelus fuscoguttatus ♀) |
由表 5可知,F1、F2和F3组绒毛高度显著高于F0组(P < 0.05),绒毛宽度各组之间无显著差异(P>0.05),F3组肌层厚度显著高于F0组和其他试验组(P < 0.05)。
|
|
表 5 水解单宁对珍珠龙胆石斑鱼肠道绒毛高度、绒毛宽度和肌层厚度的影响 Table 5 Effects of HTs on intestinal villus height, villus width and muscle thickness of pearl gentian grouper (Epinephelus lanceolatus♂ ×Epinephelus fuscoguttatus ♀) |
对MiSeq测序原始数据处理后,5组样品共产生301 518条优化序列,各组分别为59 608(F0组)、59 462(F0组)、51 506(F2组)、60 197(F3组)和70 744(F4组)条,对数据进行均一化处理后,5组样品总序列均值为603 034。5组样品中产生的OTUs数目在93~271个,5组共产生816个OTUs(表 6)。除了F2组以外,其他试验组的OUT数目均高于F0组。覆盖度每组均≥99.95%。F1、F2、F3和F4组的Shannon指数和Chao1指数均高于F0组,F1、F2和F4组的谱系多样性指数均高于F0组,说明水解单宁的添加提升了珍珠龙胆石斑鱼肠道菌群的多样性,并且使群落的丰度增加。
|
|
表 6 水解单宁对珍珠龙胆石斑鱼肠道菌群多样性的影响 Table 6 Effects of HTs on intestinal bacterial diversity of pearl gentian grouper (Epinephelus lanceolatus♂ ×Epinephelus fuscoguttatus ♀) |
根据OTUs聚类分析结果,分析不同样品(组)之间共有、特有的OTUs,绘制成Venn图(图 6),5组样品的共有物种数目为63个,其中F2组的特有物种数目最多,为293个,F0组特有物种数目最少,为28个。
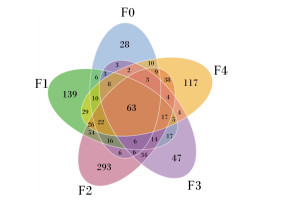
|
图 6 各组OTUs的Venn图 Fig. 6 Venn diagram of OTUs shared in different groups |
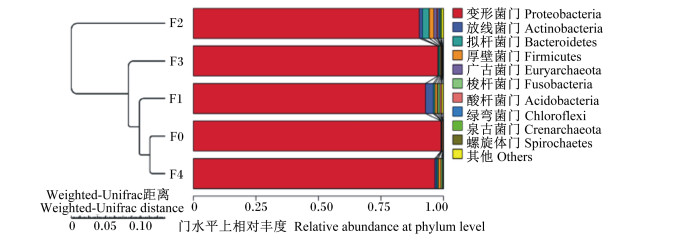
在门水平上进行物种注释分析,将每个OTUs中丰度排列前10的序列作为代表序列。各组样品的分类学统计分析结果显示[合并相对丰度 < 1%的区域为其他(others)],饲料中添加水解单宁改变了肠道优势菌门的相对丰度,各组肠道主要菌群为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)(图 7)。与F0组,饲料中添加水解单宁的各试验组肠道菌群中变形菌门的比例降低,放线菌门、拟杆菌门和厚壁菌门的比例增加,其中F2组泉古菌门、绿湾菌门和广古菌门的比例均高于其他组(表 7)。
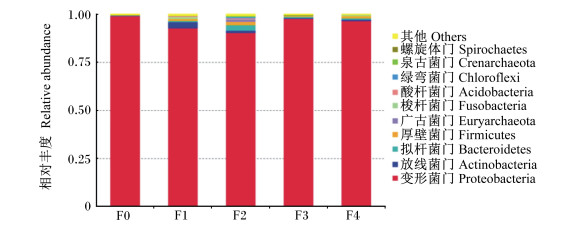
|
图 7 肠道菌群在门水平上的组成 Fig. 7 Intestinal bacteria composition at phylum level |
|
|
表 7 水解单宁对珍珠龙胆石斑鱼肠道菌群中排名前10的菌门比例的影响 Table 7 Effects of HTs on proportions of top 10 phyla in intestinal bacteria of pearl gentian grouper (Epinephelus lanceolatus♂ ×Epinephelus fuscoguttatus ♀) |
主坐标分析(principal coordinates analysis,PCoA)可以用于比较多样品菌落结构的相似性和差异性,样品的物种组成越相似,在PCoA图中的距离越近。对5组样品进行属水平上的PCoA后发现,F0、F1和F4组距离较近,微生物群落组成相似度较高,它们与F2和F3组距离较远,说明F0、F1和F4组的微生物群落组成与F2和F3组相差较大;而F2与F3组距离也较远,说明这2组之间微生物群落组成相似度也较低(图 8)。对各组样品进行UPGMA聚类分析(Weighted-Unifrac距离算法),构建样品聚类树(图 9),结果显示F0与F4组聚为一支,然后与F1组聚为一支,接着与F3组聚为一支,最后才与F2组聚为一支,与PCoA的结果相一致。
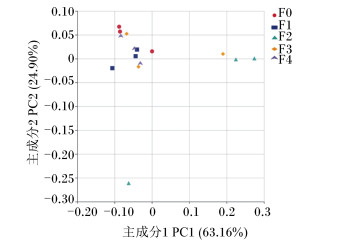
|
图 8 5组肠道菌群以Weighted-Unifrac距离算法在门水平上的主坐标分析 Fig. 8 PCoA of intestinal bacteria of five groups at phylum level based on Weighted-Unifrac distance. |
|
图 9 5组肠道菌群以Weighted-Unifrac距离算法在门水平上的UPGMA聚类分析 Fig. 9 UPGMA cluster analysis of intestinal bacteria in five groups at phylum level based on Weighted-Unifrac distance |
目前水解单宁常见应用于畜牧行业。侯海锋等[21]通过在蛋鸡饲粮中添加水解单宁,发现添加0.1%的水解单宁能显著提高蛋鸡的产蛋率。回海勇等[22]通过在奶牛饲粮中添加水解单宁,发现添加水解单宁能显著增加奶牛的产奶量。Brus等[23]、Zotte等[24]、Schiavone等[25]的试验结果也表明通过在饲粮中添加低剂量的水解单宁可以保护猪、兔和鸡的机体健康,促进营养物质的消化吸收,提高生长性能。本试验结果表明,饲料中添加不同剂量的水解单宁对珍珠龙胆石斑鱼的CF和SR没有产生显著差异。与F0组相比,F2组珍珠龙胆石斑鱼的WGR和SGR显著提高,这与郭慧等[26]研究得出的水解单宁能够显著提高凡纳滨对虾的WGR和SGR的结果相一致;F2组的FCR较其他组显著降低,这与姚静婷等[27]的研究结果一致;而其他添加水解单宁的试验组(F1、F3和F4组)与F0组相比,WGR、SGR和FCR虽然没有显著差异,但是从数值上看,随着水解单宁添加量的增加WGR、SGR呈现先增高后降低的趋势,FCR呈现先降低后增高的趋势,说明珍珠龙胆石斑鱼对水解单宁有一定的剂量依赖效应,水解单宁在饲料中的添加量例应保持在合理范围内。
AKP、ACP和SOD的活性是反映鱼体健康程度的重要指标[28]。AKP本身作为动物体溶酶体酶的组成部分[29],可以提高吞噬细胞吞噬降解异物的速度[30],并参与体内毒素解毒,降低脏器损伤[31],据报道,ACP是免疫系统中的关键参与者,是溶酶体酶和消化物在水生动物中入侵生物的重要化合物[32]。SOD是一种具有帮助宿主生物免受氧化应激作用的抗氧化酶[33],它是一种重要的健康状况指标,可用于评价抗氧化能力[34]。刘蕾[35]对鳙鱼的研究发现,饲料中添加水解单宁提高了鳙鱼血清AKP和SOD活性。本试验中珍珠龙胆石斑鱼血清和肝脏中AKP、ACP和SOD活性都是在水解单宁添加量为0.10%~0.15%的时候达到峰值之后又降低。然而,与F0组相比,水解单宁添加量为0.05%时上述指标无显著差异甚至下调,由此推测长期摄食一定剂量的水解单宁可以提高珍珠龙胆石斑鱼机体抗氧化能力和免疫能力,但是摄入量过高或者过低时效果不显著,甚至会呈现消极作用。
动物机体在进行正常的新陈代谢时会产生活性氧自由基,因其活性较强,因此会对机体产生一定的毒害作用[36]。动物机体抗氧化系统是由酶促抗氧化系统和非酶促抗氧化系统2类组成[37],其中酶促抗氧化系统主要包括SOD、GPx和CAT这3种抗氧化酶[38-39]。SOD主要进行超氧离子自由基歧化反应的催化,从而消除活性氧自由基对机体的直接毒害作用[17]。GPx在还原性谷胱甘肽还原过氧化氢反应中起到特异催化作用,还对细胞膜结构和功能完整有一定的保护作用[40]。CAT则负责催化过氧化氢使其分解为氧和水,进而保护细胞免受过氧化氢的毒害[41-42]。SOD、CAT和GPx是抗氧化酶系统的关键[38-39],因此以上3种抗氧化酶基因的表达量能间接反映珍珠龙胆石斑鱼抗氧化能力的变化。
水解单宁具有一定的抗氧化能力,陈学斌等[4]通过体外试验证明1个单位摩尔的单宁抗氧化能力比维生素C和维生素E强。魏海峰[43]通过给糖尿病模型大鼠腹腔注射不同剂量的单宁酸,证明单宁酸能有效清除大鼠体内的氧自由基,并提高体内各种抗氧化酶(SOD、CAT、GPx)的活性,从而降低机体氧化应激水平。刘华伟[44]通过在肉兔饲粮中添加栗树单宁,证明在饲粮中添加栗树单宁能显著提高肉兔血清中SOD和GPx的活性,同时能显著提高SOD和GPx的基因表达。本试验发现,饲料中添加水解单宁的各组肝脏CAT的mRNA相对表达量均较F0组显著提高,而肝脏Mn-SOD和GPx的mRNA相对表达量只有水解单宁添加量为0.10%~0.20%时显著提高。这说明适量水解单宁的添加能够提高珍珠龙胆石斑鱼机体各组织的抗氧化能力。本试验结果与上述刘华伟[44]所得结论相似,均表明水解单宁能促进机体抗氧化相关基因(SOD、GPx)的表达,但不同试验所得适宜添加量不一致,这一方面可能是因为肉兔与石斑鱼之间所存在的物种差异,另一方面则可能是因为水解单宁种类存在差异。至于水解单宁对抗氧化基因产生作用的具体机理则需后续深入研究。综上所得,在饲料中添加水解单宁能显著地促进石斑鱼机体抗氧化基因的表达,且当添加量为0.10%~0.20%时效果较好。
动物肠道在营养吸收和代谢中起着至关重要的作用,是抵御病原体和环境压力的第1道防线[45]。而饲料中的添加剂会不同程度地影响鱼类肠道组织形态,并且营养条件和环境条件的改变也会引起消化道形态变化[46],特别是肠道绒毛高度、绒毛宽度和肌层厚度的变化。相关研究表明水解单宁可以促使肉鸡空肠的绒毛高度升高[46],保护断奶仔猪肠道形态[47]。在本试验中,饲料中添加0.05%~0.15%水解单宁的珍珠龙胆石斑鱼的肠道绒毛高度显著增加,并且小肠绒毛排列更加紧密,这可能与水解单宁提高了机体是抗氧化能力有关,SOD已被证实证明能够清除动物机体内的自由基,从而降低自由基对肠道等消化器官及其他组织造成的损伤[48]。在饲料中添加0.05%~0.15%水解单宁的3个组中,以添加0.10%水解单宁组珍珠龙胆石斑鱼的生长速率最快,其可能是因为该组饲料中水解单宁添加量更合理,水解单宁通过增加珍珠龙胆石斑鱼肠道绒毛的数量和长度来改善肠道形态,保护肠道健康,从而显著提升生长性能。
肠道中的微生物和细菌代谢物会直接影响无脊椎动物和脊椎动物的生理,如宿主能量吸收和代谢、肠道屏障完整性和免疫功能[49]。本研究利用Illumina测序技术研究了珍珠龙胆石斑鱼肠道菌群组成。在门水平上,各组珍珠龙胆石斑鱼肠道菌群中相对丰度最高均是变形菌门,第二是放线菌门,第三是拟杆菌门,第四是厚壁菌门。已有研究表明脊椎动物肠道中的的优势菌门为变形菌门、厚壁菌门和拟杆菌门[50],这与本试验结果相似。在细菌中,变形菌门是最大的一门,很多病原菌是其中的成员,其也是罗非鱼腐败过程中的优势菌门[51]。有研究表明,变形菌门是导致生物功能失调和增加疾病风险的潜在因素[52]。放线菌门是水生和陆生生态系统中普遍存在的最大的细菌门之一,具有较高的G+C含量[53-54],并且一直是制作新型抗生素的极佳来源,属于潜在益生菌[55]。厚壁菌门中的部分细菌对促进肠道中的纤维素分解和多糖发酵有重要作用[56],从而提高机体免疫力[57]。拟杆菌门在宿主肠道中被认为是降解多糖等碳水化合物以及蛋白质的重要菌群[58]。本研究结果表明,相对于对照组,各试验组珍珠龙胆石斑鱼肠道中变形菌门的比例均有所降低,而放线菌门、厚壁菌门和拟杆菌门的比例有所升高,在水解单宁添加量为0.10%时尤为明显,并且该组肠道绒毛发育良好,说明饲料中添加0.10%的水解单宁有利于促进珍珠龙胆石斑鱼肠道转换和吸收营养物质,从而提高机体免疫能力,保护肠道健康,降低患病的几率。由此猜想0.10%的水解单宁能够促进肠道有益菌的生长,减少变形菌门中一些致病菌的数量。PCoA和UPGMA聚类分析均显示,对照组与F4组的微生物群落结构最为相似,而与对其他试验组有较大差别,说明饲料中添加低剂量的水解单宁对珍珠龙胆石斑鱼肠道菌群结构有较大影响。结合生长性能指标和经济成本,饲料中较为经济有效的水解单宁添加量为0.10%。
4 结论综上所述,饲料中添加0.05%~0.15%水解单宁可以提高珍珠龙胆石斑鱼的生长性能,增强鱼体免疫和抗氧化能力,改善肠道组织结构;并且,水解单宁可以通过增加珍珠龙胆石斑鱼肠道某些有益菌和减少某些有害菌的比例来优化肠道菌群结构,保护肠道健康。以WGR为评价指标,通过回归方程确定珍珠龙胆石斑鱼饲料中水解单宁的适宜添加量为0.10%。
| [1] |
李元恒, 金龙, 韩国栋, 等. 植物单宁在反刍动物营养和健康养殖作用中的研究进展[J]. 草地学报, 2013, 21(6): 1043-1051. LI Y H, JIN L, HAN G D, et al. Effects of plant tannin on the nutrition and healthy production of ruminant:a review[J]. Acta Agrestia Sinica, 2013, 21(6): 1043-1051 (in Chinese). |
| [2] |
朱南山, 张彬, 李丽立. 单宁的抗营养作用机理及处理措施[J]. 中国饲料, 2006(17): 26-29. ZHU N S, ZHANG B, LI L L. Anti-nutritional effect and treatment measures of tannin[J]. China Feed, 2006(17): 26-29 (in Chinese). DOI:10.3969/j.issn.1004-3314.2006.17.011 |
| [3] |
朱子洁. 水解单宁酸对动物营养与健康的积极作用[J]. 中国动物保健, 2013, 15(6): 40-42. ZHU Z J. The positive effects of hydrolyzed tannin acid on animal nutrition and health[J]. China Animal Health, 2013, 15(6): 40-42 (in Chinese). DOI:10.3969/j.issn.1008-4754.2013.06.018 |
| [4] |
陈学斌, PANCIROLI N. 植物单宁的生物活性及在动物饲料中应用[J]. 广东饲料, 2016, 25(12): 38-41. CHEN X B, PANCIROLI N. The biological activity and application in animal feed of tannin[J]. Guangdong Feed, 2016, 25(12): 38-41 (in Chinese). DOI:10.3969/j.issn.1005-8613.2016.12.010 |
| [5] |
陈超, 孔祥迪, 李炎璐, 等. 棕点石斑鱼(♀)×鞍带石斑鱼(♂)杂交子代胚胎及仔稚幼鱼发育的跟踪观察[J]. 渔业科学进展, 2014, 36(5): 135-144. CHEN C, KONG X D, LI Y L, et al. Embryonic and morphological development in the larva, juvenile, and young stages of Epinephelus fuscoguttatus (♀)×E.lanceolatus (♂)[J]. Progress in Fishery Sciences, 2014, 36(15): 135-144 (in Chinese). |
| [6] |
本刊综合.养殖业新秀——珍珠龙胆石斑鱼[J].农家之友, 2016(2): 50. REVIEW.The aquaculture rookie——pearl gentian grouper[J]. Friends of the Farmhouse, 2016(2): 50.(in Chinese) |
| [7] |
徐安乐, 黎中宝, 上官静波, 等. 复方中草药对珍珠龙胆石斑鱼生长、非特异性免疫及消化酶活性的影响[J]. 海洋学报, 2018, 40(12): 49-57. XU A L, LI Z B, SHANGGUAN J B, et al. Effects of compound Chinese herbal medicine on growth performance, non-specific immunity and digestive enzyme activity of Pearl gentian grouper[J]. Acta Oceanologica Sinica, 2018, 40(12): 49-57 (in Chinese). DOI:10.3969/j.issn.0253-4193.2018.12.006 |
| [8] |
刘韬, 黄旭雄, 苏美英, 等. 发酵豆粕替代鱼粉对凡纳滨对虾生长、免疫相关酶及免疫相关基因表达的影响[J]. 水产学报, 2018, 42(9): 1417-1427. LIU T, HUANG X X, SU M Y, et al. Effects of fermented soybean meal replacing fish meal on the growth performance, immune-related enzymes and gene expression of Litopenaeus vannamei[J]. Journal of Fisheries of China, 2018, 42(9): 1417-1427 (in Chinese). |
| [9] |
尚碧娇, 左志晗, 窦春萌, 等. 高通量测序法分析两株益生菌对凡纳滨对虾肠道菌群结构的影响[J]. 水产学报, 2018, 42(12): 1967-1976. SHANG B J, ZUO Z H, DOU C M, et al. Analysis of the characteristics of Litopenaeus vannamei intestinal microflora after being fed with two probiotics using high-throughput sequencing method[J]. Journal of Fisheries of China, 2018, 42(12): 1967-1976 (in Chinese). |
| [10] |
TAN X H, SUN Z Z, LIU Q Y, et al. Effects of dietary ginkgo biloba leaf extract on growth performance, plasma biochemical parameters, fish composition, immune responses, liver histology, and immune and apoptosis-related genes expression of hybrid grouper (Epinephelus lanceolatus ♂×Epinephelus fuscoguttatus ♀) fed high lipid diets[J]. Fish & Shellfish Immunology, 2018, 72: 399-409. |
| [11] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [12] |
林佳洁.发酵豆粕替代鱼粉对黄金鲫生长、免疫及肠道组织的影响[D].硕士学位论文.长春: 吉林农业大学, 2016. LIN J J.Effects of replacement of fish meal by fermented soybean meal in diets on growth, immunity and intestinal tissue of Carassius auratus[D]. Master's Thesis.Changchun: Jilin Agricultural University, 2016.(in Chinese) |
| [13] |
ABHAUER K P, WEMHEUER B, DANIEL R, et al. Tax4Fun:predicting functional profiles from metagenomic 16S rRNA data[J]. Bioinformatics, 2015, 31(7): 2882-2884. |
| [14] |
MARTIN M. Cutadapt removes adapter sequences from high-throughput sequencing reads[J]. Embnet Journal, 2011, 17(1): 10-12. DOI:10.14806/ej.17.1.200 |
| [15] |
刘驰, 李家宝, 芮俊鹏, 等. 16S rRNA基因在微生物生态学中的应用[J]. 生态学报, 2015, 35(9): 2769-2788. LIU C, LI J B, RUI J P, et al. The applications of the 16S rRNA gene in microbial ecology:current situation and problems[J]. Acta Ecologica Sinica, 2015, 35(9): 2769-2788 (in Chinese). |
| [16] |
HAAS B J, GEVERS D, EARL A M, et al. Chimeric 16S rRNA sequence formation and detection in sanger and 454-pyrosequenced PCR amplicons[J]. Genome Research, 2011, 21(3): 494-504. DOI:10.1101/gr.112730.110 |
| [17] |
EDGAR C R. UPARSE:highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 2013, 10(10): 996-998. DOI:10.1038/nmeth.2604 |
| [18] |
WANG Q, GARRITY G M, TIEDJE J M, et al. Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J]. Applied and Environmental Microbiology, 2007, 73(16): 5261-5267. DOI:10.1128/AEM.00062-07 |
| [19] |
STAT M, POCHON X, FRANKLIN E C, et al. The distribution of the thermally tolerant symbiont lineage (Symbiodinium clade D) in corals from Hawaii:correlations with host and the history of ocean thermal stress[J]. Ecology and Evolution, 2013, 3(5): 1317-1329. DOI:10.1002/ece3.556 |
| [20] |
ANDERSON M J. A new method for non-parametric multivariate analysis of variance[J]. Austral Ecology, 2001, 26(1): 32-46. |
| [21] |
侯海锋, 高宗旺, 李茜. 水解单宁酸对蛋鸡生产性能及肠道健康的影响[J]. 中国饲料, 2017(12): 21-23. HOU H F, GAO Z W, LI X. Effects of hydrolyzed tannin acid on laying performance and intestinal health of layers[J]. China Feed, 2017(12): 21-23 (in Chinese). |
| [22] |
回海勇, 安文亭, 李占一, 等. 单宁酸对奶牛生产性能、营养物质利用率及免疫力影响[J]. 饲料研究, 2018(6): 14-18, 24. HUI H Y, AN W T, LI Z Y, et al. Effects of tannin acid on performance, nutrient utilization and immunity of cows[J]. Feed Research, 2018(6): 14-8, 24 (in Chinese). |
| [23] |
BRUS M, DOLINŠEK J, CENCIČ A, et al. Effect of chestnut (Castanea sativa Mill.) wood tannins and organic acids on growth performance and faecal microbiota of pigs from 23 to 127 days of age[J]. Bulgarian Journal of Agricultural Science, 2013, 19(4): 841-847. |
| [24] |
ZOTTE A D, COSSU M E. Dietary inclusion of tannin extract from red quebracho trees (Schinopsis spp.) in the rabbit meat production[J]. Italian Journal of Animal Science, 2010, 8(Suppl.2): 784-786. |
| [25] |
SCHIAVONE A, GUO K, TASSONE S, et al. Effects of a natural extract of chestnut wood on digestibility, performance traits, and nitrogen balance of broiler chicks[J]. Poultry Science, 2008, 87(3): 521-527. DOI:10.3382/ps.2007-00113 |
| [26] |
郭慧, 朱旭枫, 陈锦霖, 等. 水解单宁对凡纳滨对虾生长性能和肠道微生物的影响[J]. 中国水产科学, 2019, 26(5): 883-892. GUO H, ZHU X F, CHEN J L, et al. Effects of hydrolyzable tannins on growth performance and intestinal microflora in Litopenaeus vannamei[J]. Journal of Fishery Sciences of China, 2019, 26(5): 883-892 (in Chinese). |
| [27] |
姚静婷, 孔纯, 华雪铭, 等. 水解单宁对暗纹东方鲀摄食偏好、消化代谢和抗氧化能力的效应[J]. 水产学报, 2019, 43(6): 1449-1462. YAO J T, KONG C, HUA X M, et al. Effects of supplemental hydrolysable tannin on feeding preference, nutrition digestion and antioxidant ability of obscure puffer (Takifugu fasciatus)[J]. Journal of Fisheries of China, 2019, 43(6): 1449-1462 (in Chinese). |
| [28] |
靳雅琦, 郁二蒙, 张凯, 等. 三种饵料对草鱼血清酶活性和肠道组织结构及细菌菌群的影响[J]. 农业生物技术学报, 2019, 27(9): 1652-1663. JIN Y Q, YU E M, ZHANG K, et al. Effects of three feeds on serum enzyme activity, intestinal structure and bacterial flora of Ctenopharyngodon idellus[J]. Journal of Agricultural Biotechnology, 2019, 27(9): 1652-1663 (in Chinese). |
| [29] |
孙静秋, 许燕, 张慧绮, 等. 凡纳对虾体内ACP、AKP酶的细胞化学定位[J]. 复旦学报(自然科学版), 2007, 46(6): 947-951. SUN J Q, XU Y, ZHANG H Q, et al. Study on cytochemical location of acid phosphatase and alkaline phosphatase of Litopenaeus vannamei[J]. Journal of Fudan University (Natural Science), 2007, 46(6): 947-951 (in Chinese). DOI:10.3969/j.issn.0427-7104.2007.06.016 |
| [30] |
陈慕雁, 张秀梅, 连建华. 大菱鲆仔稚鱼期消化酶及碱性磷酸酶活性的变化[J]. 中国海洋大学学报(自然科学版), 2005, 35(3): 483-486. CHEN M Y, ZHAN X M, LIAN J H. Development of some digestive enzymes and alkaline phosphatase activities in turbot Scophthalmus maximus larvae and juveniles[J]. Periodical of Ocean University of China (Natural Science), 2005, 35(3): 483-486 (in Chinese). |
| [31] |
牟海津, 江晓路, 刘树青, 等. 免疫多糖对栉孔扇贝酸性磷酸酶、碱性磷酸酶和超氧化物歧化酶活性的影响[J]. 青岛海洋大学学报(自然科学版), 1999, 29(3): 124-129. MU H J, JIANG X L, LIU S Q, et al. Effects of Immunopolysaccharide on the activities of acid phosphatase, alkaline phosphatase and superoxide dismutase in Chlamys farreri[J]. Periodical of Ocean University of China (Natural Science), 1999, 29(3): 124-129 (in Chinese). |
| [32] |
AMOAH K, HUANG Q C, TAN B P, et al. Dietary supplementation of probiotic Bacillus coagulans ATCC 7050, improves the growth performance, intestinal morphology, microflora, immune response, and disease confrontation of Pacific white shrimp, Litopenaeus vannamei[J]. Fish & Shellfish Immunology, 2019, 87: 796-808. |
| [33] |
LIU Y, WANG W N, WANG A L, et al. Effects of dietary vitamin E supplementation on antioxidant enzyme activities in Litopenaeus vannamei (Boone, 1931) exposed to acute salinity changes[J]. Aquaculture, 2007, 265(1/2/3/4): 351-358. |
| [34] |
ZHANG C N, LI X F, XU W N, et al. Combined effects of dietary fructooligosaccharide and Bacillus licheniformis on innate immunity, antioxidant capability and disease resistance of triangular bream (Megalobrama terminalis)[J]. Fish & Shellfish Immunology, 2013, 35(5): 1380-1386. |
| [35] |
刘蕾.五倍子对鳙鱼消化机能及免疫机能的影响[D].硕士学位论文.长春: 吉林农业大学, 2014. LIU L.Effects of Chinese gall on digestive function and immune function of Aristichthys nobilis[D]. Master's Thesis.Changchun: Jilin Agricultural University, 2014.(in Chinese) |
| [36] |
孙鹏, 尹飞, 王建建, 等. 操作胁迫对云纹石斑鱼肝脏抗氧化和鳃Na+-K+ ATPase活力的影响[J]. 海洋渔业, 2014, 36(3): 247-251. SUN P, YIN F, WANG J J, et al. Effects of handling stress on activities of antioxidant enzymes in liver and Na+-K+ ATPase in gill of Epinephelus moara[J]. Marine Fisheries, 2014, 36(3): 247-251 (in Chinese). DOI:10.3969/j.issn.1004-2490.2014.03.008 |
| [37] |
焦洪超, 林海.青贮姜苗对肉仔鸡机体氧化还原平衡的影响[C]//中国畜牧兽医学会动物营养学分会——第九届学术研讨会论文集.重庆: 中国农业科学技术出版社, 2004: 1. JIAO H C, LIN H.Effect of dietary supplementation of ginger stem silage on redox balance in broiler chickens[C]//Animal Nutrition Branch of Chinese Association of Animal Science and Veterinary Medicine: Proceedings of the Ninth National Symposium.Chongqing: China Agricultural Science and Technology Press, 2004: 1.(in Chinese) |
| [38] |
LIU X L, XI Q Y, YANG L, et al. The effect of dietary Panax ginseng polysaccharide extract on the immune responses in white shrimp, Litopenaeus vannamei[J]. Fish & Shellfish Immunology, 2011, 30(2): 495-500. |
| [39] |
KALT W, FORNEY C F, MARTIN A, et al. Antioxidant capacity, vitamin C, phenolics, and anthocyanins after fresh storage of small fruits[J]. Journal of Agricultural Food Chemistry, 1999, 47(11): 4638-4644. DOI:10.1021/jf990266t |
| [40] |
FLOHE L, GVNZLER W A, SCHOCK H H. Glutathione peroxidase:a selenoenzyme[J]. FEBS Letters, 1973, 32(1): 132-134. DOI:10.1016/0014-5793(73)80755-0 |
| [41] |
TAVARES-SÁNCHEZ O L, GÓMEZ-ANDURO G A, FELIPE-ORTEGA X, et al. Catalase from the white shrimp Penaeus (Litopenaeus) vannamei:molecular cloning and protein detection[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2004, 138(4): 331-337. DOI:10.1016/j.cbpc.2004.03.005 |
| [42] |
AEBI H. Catalase in vitro[J]. Methods in Enzymology, 1984, 105: 121-126. |
| [43] |
魏海峰.单宁酸对实验性糖尿病大鼠肾脏病变的改善作用及其机制的研究[D].博士学位论文.长春: 吉林大学, 2010. WEI H F.Study on ameliorating effect of tannic acid on renal lesion in experimental diabetic rats and its mechanism[D]. Ph.D.Thesis.Changchun: Jilin University, 2010.(in Chinese) |
| [44] |
刘华伟.栗树单宁的抗氧化能力及其对肉兔生产性能的影响研究[D].博士学位论文.北京: 中国农业科学院, 2010. LIU H W.Study on antioxidant activity of chestnut tannins and its effect on growth performance of rabbits[D]. Ph.D.Thesis.Beijing: Chinese Academy of Agricultural Sciences, 2010.(in Chinese) |
| [45] |
SONNENBURG J L, BÄCKHED F. Diet-microbiota interactions as moderators of human metabolism[J]. Nature, 2016, 535(7610): 56-64. |
| [46] |
李茜, 侯海锋. 水解单宁酸对肉鸡肠道形态和内源酶活性的影响[J]. 今日畜牧兽医, 2016(4): 45-48. LI Q, HOU H F. Effects of hydrolyzed tannin acid on intestinal morphology and endogenous enzyme activity of broiler[J]. Today Animal Husbandry and Veterinary Medicine, 2016(4): 45-48 (in Chinese). |
| [47] |
邓文, 张世昌, 蔡荣斌, 等. 栗树单宁对断奶仔猪生产性能、肠道形态和通透性及抗氧化性能的影响[J]. 中国饲料, 2018(1): 44-48. DENG W, ZHANG S B, CAI R B, et al. Effects of chestnut tannins on the performance, intestinal morphology and permeability, and antioxidant status in weaned piglets[J]. China Feed, 2018(1): 44-48 (in Chinese). |
| [48] |
刘云, 孔伟丽, 姜国良, 等. 2种免疫多糖对刺参组织主要免疫酶活性的影响[J]. 中国水产科学, 2008, 15(5): 787-793. LIU Y, KONG W L, JIANG G L, et al. Effects of two kinds of immunopolysaccharide on the activities of immunoenzymes in sea cucumber, Apostichopus japonicus[J]. Journal of Fishery Sciences of China, 2008, 15(5): 787-793 (in Chinese). DOI:10.3321/j.issn:1005-8737.2008.05.010 |
| [49] |
DE VADDER F, MITHIEUX G. Gut-brain signaling in energy homeostasis:the unexpected role of microbiota-derived succinate[J]. The Journal of Endocrinology, 2018, 236(2): R105-R108. DOI:10.1530/JOE-17-0542 |
| [50] |
QIN J J, LI R Q, RAES J, et al. A human gut microbial gene catalogue established by metagenomic sequencing[J]. Nature, 2010, 464(7285): 59-65. |
| [51] |
韩少锋.罗非鱼腐败过程菌群结构分析及腐败菌的分离、鉴定与调控[D].硕士学位论文.北京: 中国农业科学院, 2010. HAN S F.Analysis of the bactrial community structure change in tilapia during spoilage and isolation, identification and control of spoilage organisms[D]. Master's Thesis.Beijing: Chinese Academy of Agricultural Sciences, 2010.(in Chinese) |
| [52] |
SHIN N R, WHON T W, BAE J W. Proteobacteria:microbial signature of dysbiosis in gut microbiota[J]. Trends in Biotechnology, 2015, 33(9): 496-503. DOI:10.1016/j.tibtech.2015.06.011 |
| [53] |
VENTURA M, CANCHAYA C, TAUCH A, et al. Genomics of Actinobacteria:tracing the evolutionary history of an ancient phylum[J]. Microbiology and Molecular Biology Reviews, 2007, 71(3): 495-548. |
| [54] |
BARKA E A, VATSA P, SANCHEZ L, et al. Taxonomy, physiology, and natural products of Actinobacteria[J]. Microbiology and Molecular Biology Reviews, 2015, 80(1): 1-43. |
| [55] |
MANIKKAM R, IMCHEN M, KAARI M, et al. Metagenomic insights unveil the dominance of undescribed actinobacteria in pond ecosystem of an Indian shrine[J]. Meta Gene, 2019, 23: 100639. |
| [56] |
麦浩彬, 郭鑫伟, 王金港, 等. 摄食不同水平饲料蛋白质对珍珠龙胆石斑鱼幼鱼肠道组织形态和菌群组成的影响[J]. 大连海洋大学学报, 2020, 35(1): 63-70. MAI H B, GUO W X, WANG J G, et al. Effects of dietary protein levels on intestinal tract histomorphology and microflora composition in juvenile pearl gentian grouper (Epinephelus lanceolatu♂×E. fuscoguttatus♀)[J]. Journal of Dalian Ocean University, 2020, 35(1): 63-70 (in Chinese). |
| [57] |
姬玉娇, 祝倩, 耿梅梅, 等. 高、低营养水平饲粮对环江香猪结肠菌群结构及代谢物的影响[J]. 微生物学通报, 2016, 43(7): 1650-1659. JI Y J, ZHU Q, GENG M M, et al. Effect of diets with high or low level nutrient on colonic microbial community structure and metabolites in Huanjiang mini-pigs[J]. Microbiology China, 2016, 43(7): 1650-1659 (in Chinese). |
| [58] |
刘文舒, 郭小泽, 陈彦良, 等.养殖黑斑蛙(Rana nigromaculata Howell)肠道微生物结构与功能分析[J/OL].经济动物学报, 2020: 1-12[2020-10-22].https://doi.org/10.13326/j.jea.2019.1415. LIU W S, GUO X Z, CHEN Y L, et al.Analysis of microbial composition and function in the of farmed black-spot frog[J/OL]. Journal of Economic Animal, 2020, 1-12[2020-10-22]. https://doi.org/10.13326/j.jea.2019.1415.(in Chinese) |




