饲粮被反刍动物采食,其碳水化合物在瘤胃微生物发酵下生成可利用的终产物挥发性脂肪酸(VFA),主要成分是乙酸、丙酸和丁酸,可为反刍动物提供75%以上的代谢能,是最主要的能量来源[1]。碳水化合物在瘤胃的代谢过程中,可以由丙酮酸生成甲酸,而且甲酸在厌氧条件下可以生成二氧化碳和氢,进而在产甲烷菌的作用下生成甲烷[2-3]。反刍动物瘤胃甲烷的生成不仅造成动物能量的巨大损失,而且甲烷作为一种重要的温室气体,对地球生态环境产生破坏性作用[4-5]。因此,对瘤胃液中挥发性脂肪酸的检测,尤其是甲酸的检测对于深入系统研究反刍动物体内碳水化合物的消化代谢及甲烷的生成具有重要的意义。
目前,文献报道的测定挥发性脂肪酸的方法主要有离子色谱法[6-8]、气相色谱-质谱联用法[9]、气相色谱法[10-11]、毛细管电泳法[12]以及微量压电称量法[13]。离子色谱法测定甲酸,具有灵敏度高、重现性好的特点,但是其样品类型主要有泡菜废水[6]、河流[7]、生物柴油[8]等,前处理过程复杂,所需的样品量大,不适宜瘤胃液这类样品量少的样品检测;气相色谱-质谱法测定水中的有机酸需要用到有毒的有机试剂进行样品萃取,不仅操作费时繁琐,操作过程还会对环境产生污染[9],并且甲酸不能在气相色谱仪的氢火焰离子化检测器上直接被检测到,需将其进行衍生后才能测定[11];毛细管电泳法虽然测定时间短,检出限低,但仅限于较为干净的雨水样品中甲酸和乙酸的测定[12];微量压电称量法电极可循环,环保性能好,但其电极制备是难点,且仅限于空气中甲酸和乙酸的测定[13]。目前,对反刍动物瘤胃碳水化合物代谢及甲烷生成的相关研究中,所见文献均涉及到乙酸、丙酸、丁酸等挥发性脂肪酸的测定,几乎未见甲酸的检测,最主要的原因是缺乏相应的检测瘤胃液中甲酸的方法。
因此,本试验选用耐水的极性色谱柱,利用25%偏磷酸(m/v)对瘤胃液进行处理,低温高速离心后采用气相色谱-质谱联用法进行分析,以期建立一种测定瘤胃液中甲酸、乙酸、丙酸、丁酸等挥发性脂肪酸的实验室分析方法,为研究反刍动物瘤胃碳水化合物消化代谢及甲烷的生成提供技术支撑。
1 材料与方法 1.1 试剂配制偏磷酸购自国药集团有限公司;乙酸、甲酸、丙酸、异丁酸、丁酸、异戊酸和戊酸标准品为色谱纯,购自阿拉丁试剂公司;超纯水为中国科学院亚热带农业生态过程重点实验室自制。
分别精确称取1.027 0 g乙酸、0.388 4 g丙酸、0.091 7 g异丁酸、0.181 0 g丁酸、0.043 3 g异戊酸和0.090 5 g戊酸于100 mL容量瓶中,用超纯水定容,其中乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸浓度分别为10 270、3 884、917、1 810、433、905 μg/mL,作为储备液A,用作标准曲线的制备。精确称取0.121 0 g甲酸于10 mL容量瓶中,配制成浓度为12 100 μg/mL的溶液作为储备液B,用作标准曲线的制备;以储备液B为母液,配制成浓度为242.0 μg/mL的溶液作为储备液C。试验样品为中国科学院亚热带农业生态研究所畜禽健康养殖研究中心提供的湘东黑山羊和荷斯坦奶牛的瘤胃液,-80 ℃保存备用。
1.2 仪器与设备7890A-5975C气相色谱-质谱联用仪(Agilent,美国),配备有电子轰击(EI)离子源和四级杆质量分析仪,自动进样器;CR22 GⅡ冷冻离心机(日立,日本);Classic DI超纯水系统(ELGA,英国);0.22 μm滤膜(希波氏,中国)。
1.3 色谱条件Agilent DB-FFAP色谱柱(30 m×0.25 mm×0.25 μm),程序升温条件:60 ℃,保持2 min,然后以20 ℃/min升至220 ℃,保持0.5 min;进样口:250 ℃;离子源:230 ℃;四级杆:150 ℃;质谱接口:220 ℃。流速:0.8 mL/min;进样量:1 μL;分流比:50 : 1,选择离子扫描模式,定量离子选择质荷比(m/z):甲酸46,辅助定量离子45、29;乙酸43,辅助定量离子60、45;丙酸74,辅助定量离子73、75;异丁酸43,辅助定量离子41、73;丁酸60,辅助定量离子73、42;异戊酸60,辅助定量离子43、87;戊酸60,辅助定量离子73、41。
1.4 样品制备将瘤胃液样品4 ℃解冻,充分混匀,18 000 r/min离心10 min,取上层清液。将上层清液与25%的偏磷酸按照9 : 1(v : v)比例混合均匀,静置0.5 h后,4 ℃条件下18 000 r/min离心10 min,取上层清液过0.22 μm滤膜,进行气相色谱-质谱分析。
1.5 试验条件优化以瘤胃液样品为试验样品,分别对样品与25%偏磷酸的体积比以及25%偏磷酸的处理时间进行优化。
1.5.1 样品与25%偏磷酸体积比的选择以瘤胃液样品为试验样品,充分混匀,18 000 r/min离心10 min,取上层清液。将上层清液与25%偏磷酸分别按照体积比为6 : 1、7 : 1、8 : 1、9 : 1和10 : 1的比例混合均匀,静置30 min后,4 ℃条件下18 000 r/min离心10 min,取上层清液过0.22 μm滤膜后,进行气相色谱-质谱分析。以上层清液与25%偏磷酸的体积比为横坐标,各对应目标物质的色谱峰峰面积为纵坐标作图。
1.5.2 25%偏磷酸处理时间的选择以瘤胃液样品为试验样品,充分混匀,18 000 r/min离心10 min,取上层清液。将上层清液与25%偏磷酸按照体积比9 : 1的比例混合均匀后,分别静置0.5、1.0、2.0、3.0、5.0、7.0和12.0 h后,4 ℃条件下18 000 r/min离心10 min,取上层清液过0.22 μm滤膜后,进行气相色谱-质谱分析。以25%偏磷酸处理时间为横坐标,各对应目标物质的色谱峰峰面积为纵坐标作图。
1.6 标准曲线、线性范围及检出限将储备液A和储备液B混合稀释,并按照样品与25%偏磷酸体积比为9 : 1混合均匀,配制成各目标物浓度(表 1)的S1、S2、S3、S4、S5、S6系列标准曲线。以各目标物的浓度为横坐标(X),目标物峰面积为纵坐标(Y)作图,得线性回归方程;以目标物3倍信噪比的浓度为其检出限,10倍信噪比的浓度为其定量限。
|
|
表 1 标准样品浓度 Table 1 Concentrations of standard samples |
以S4作为供试品,按照1.3色谱条件测定,重复测定7次,考察所建立方法的精密性;以山羊和奶牛瘤胃液样品为供试品,分别平行取样3份按1.4进行样品处理后,经1.3色谱条件测定,考察所建立方法的重复性;以山羊和奶牛瘤胃液样品为供试品,分别取瘤胃液样品0.5 mL,各加入100 μL 25%偏磷酸,然后分别向其中加入乙酸、甲酸、丙酸、异丁酸、丁酸、异戊酸和戊酸的储备液,即分别向其中加入储备液A 20 μL,储备液C 50 μL;储备液A 40 μL,储备液C 100 μL;储备液A 60 μL,储备液C 200 μL,按1.4处理方法将其制成待测溶液,按1.3色谱条件上机测定加标回收率以及验证方法的普适性。
2 结果与分析 2.1 样品与25%偏磷酸体积比的选择由图 1可知,当样品与25%偏磷酸的体积比在6 : 1~10 : 1时,各个目标物的峰面积基本保持不变,为了操作方便,选择样品与25%偏磷酸的体积比为9 : 1。
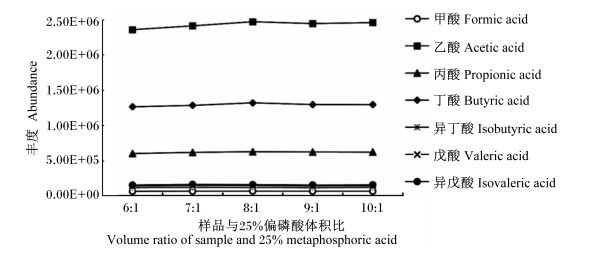
|
图 1 样品与25%偏磷酸体积比的选择对目标物的影响 Fig. 1 Effects of volume ratio of sample and 25% metaphosphoric acid on analytes |
由图 2可知,25%偏磷酸处理时间在0.5~12.0 h内,不同处理时间对目标物峰面积几乎无影响,因此处理时间在0.5 h以上即可。
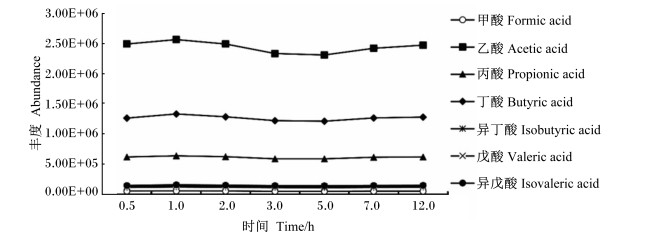
|
图 2 25%偏磷酸处理时间对目标物的影响 Fig. 2 Effects of processing time of 25% metaphosphoric acid on analytes |
由表 1可知,甲酸、乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸分别在0.8~121.0 μg/mL、0.3~3 081.0 μg/mL、0.4~1 165.2 μg/mL、0.4~275.1 μg/mL、0.2~543.0 μg/mL、0.5~129.9 μg/mL和0.4~271.5 μg/mL内线性关系良好,线性相关系数均达到0.998以上,检出限(3倍信噪比)分别为0.252、0.098、0.105、0.124、0.069、0.148和0.116 μg/mL,结果见表 2。标准品和样品中甲酸和其他6种挥发性脂肪酸的总离子流图见图 3。图 3样品中甲酸、乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸的浓度分别为28.4、1 715.5、894.2、35.1、154.8、22.6和34.3 μg/mL。
|
|
表 2 甲酸和其他6种挥发性脂肪酸的线性方程、线性范围、线性相关系数以及检出限 Table 2 Linear equation, linear range, linear correlation coefficient and detection limit of formic acid and other six kinds of volatile fatty acids |
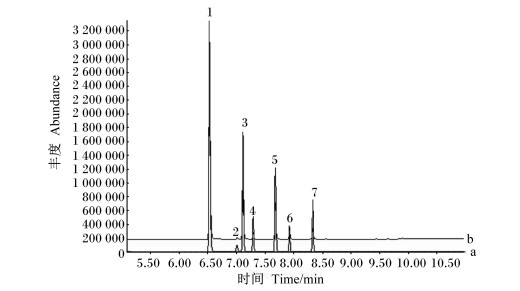
|
1:乙酸;2:甲酸;3:丙酸;4:异丁酸;5:丁酸;6:异戊酸;7:戊酸。 1: acetic acid; 2: formic acid; 3: propionic acid; 4: isobutyric acid; 5: butyric acid; 6: isovaleric acid; 7: valeric acid. 图 3 标准品(a)和样品(b)中甲酸和其他6种挥发性脂肪酸的总离子流图 Fig. 3 Total ion flow diagram of formic acid and other six kinds of volatile fatty acids in standard (a) and sample (b) |
方法精密性检测结果表明,各色谱峰保留时间的相对标准偏差不超过0.5%,峰面积的相对标准偏差不超过5.0%,说明本方法精密性良好;方法的重复性检测结果表明,各色谱峰保留时间的相对标准偏差不超过0.5%,各色谱峰的峰面积的相对标准偏差不超过5.0%;回收率检测结果表明,山羊瘤胃液样品的加标回收率为91.8%~103.8%,结果见表 3;奶牛瘤胃液样品的加标回收率为78.7%~95.2%,结果见表 4。加标回收率结果表明该方法对反刍动物瘤胃液样品中挥发性脂肪酸的测定具有普适性。
|
|
表 3 山羊瘤胃液样品中甲酸和其他6种挥发性脂肪酸的加标回收率 Table 3 Recovery rate of standard addition for formic acid and other six kinds of volatile fatty acids in goats' rumen fluid sample |
|
|
表 4 奶牛瘤胃液样品中甲酸和其他6种挥发性脂肪酸的加标回收率 Table 4 Recovery rate of standard addition for formic acid and other six kinds of volatile fatty acids in dairy cows' rumen fluid sample |
瘤胃液中含有大量的脂质、蛋白质以及微生物等杂质,如果不能去除脂质和蛋白质,加上微生物的活动,将导致瘤胃液样品即使当天过滤澄清以后,不仅很快又会变得浑浊,阻塞测样系统如进样针等,而且还会造成挥发性脂肪酸的损失。加入25%偏磷酸,既可以去除大部分蛋白质和脂质物质,同时还可以固定挥发性脂肪酸,抑制挥发性脂肪酸的挥发。
正常情况下,甲酸在瘤胃液内为中间产物,浓度较低,一般在0~46 μg/mL,很快被瘤胃壁吸收或微生物利用。与甲酸相比,瘤胃液中乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸等挥发性脂肪酸的浓度要高很多,易于检测。因此,在提升甲酸检测灵敏度的同时,还要兼顾其他挥发性脂肪酸检测的准确性,以及它们的浓度对色谱柱造成的损伤。甲酸的挥发性较强,即使其浓度较低,仍不能通过常规的浓缩方法来增加样品量进行富集,因为处理过程中会造成目标物的极大损失,难于检测其准确浓度甚至不能检测出。本方法中甲酸的线性范围最高为121.0 μg/mL,完全可以满足反刍动物瘤胃液样品的检测。
本试验建立的方法利用气相色谱-质谱联用法的选择离子模式,减少了其他非目标离子的干扰,提高了检测的灵敏度,而且所需样品量较少,1 mL的样品即能满足测定需求,且在反刍动物瘤胃液样品中具有普适性。因此,本方法的实验室可操作性强,实验室人员易于上手,利于检测方法的推广应用。
4 结论本试验建立了一种采用外标法测定瘤胃液中甲酸、乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸的气相色谱-质谱联用方法。这7种组分色谱峰保留时间的相对标准偏差均小于0.5%,峰面积的相对标准偏差均小于5.0%,线性相关系数均在0.998以上,检出限(3倍信噪比)在0.069~0.252 μg/mL;山羊和奶牛瘤胃液样品的加标回收率分别为91.8%~103.8%和78.7%~95.2%。该方法前处理简单,样品用量少,灵敏度高,易于实验室中检测瘤胃液中甲酸及其他挥发性脂肪酸,可为系统研究反刍动物瘤胃碳水化合物代谢及甲烷生成提供技术支撑。
| [1] |
BERGMAN E N. Energy contributions of volatile fatty acids from the gastrointestinal tract in various species[J]. Physiological Reviews, 1990, 70(2): 567-590. |
| [2] |
李洋, 高民, 胡红莲, 等. 反刍动物瘤胃挥发性脂肪酸的吸收机制[J]. 动物营养学报, 2018, 30(6): 2070-2078. LI Y, GAO M, HU H L, et al. Ruminal absorption mechanism of volatile fatty acids in ruminants[J]. Chinese Journal of Animal Nutrition, 2018, 30(6): 2070-2078 (in Chinese). DOI:10.3969/j.issn.1006-267x.2018.06.008 |
| [3] |
吕晓梦. 甲酸厌氧代谢途径[J]. 化工管理, 2019(11): 20-21. LYU X M. Anaerobic pathway of formic acid[J]. Chemical Management, 2019(11): 20-21 (in Chinese). |
| [4] |
HUNGATE R E, SMITH W, BAUCHOP T, et al. Formate as an intermediate in the bovine rumen fermentation[J]. Journal of Bacteriology, 1970, 102(2): 389-397. |
| [5] |
UNGERFELD E M. Limits to dihydrogen incorporation into electron sinks alternative to methanogenesis in ruminal fermentation[J]. Frontiers in Microbiology, 2015, 6: 1272. |
| [6] |
张剑, 罗进, 宋金丽, 等. 离子色谱/电导检测泡菜废水中8种有机酸[J]. 环境化学, 2014, 33(12): 2212-2213. ZHANG J, LUO J, SONG J L, et al. Detection of eight organic acids in kimchi wastewater by ion chromatography/conductance[J]. Environmental Chemistry, 2014, 33(12): 2212-2213 (in Chinese). |
| [7] |
张银平, 王海燕, 薛耀华, 等. 离子色谱法测定河流中乙酸、丙酸和丁酸含量的研究[J]. 中国环境监测, 2011, 27(1): 21-24. ZHANG Y P, WANG H Y, XUE Y H, et al. Determination of acetic acid, propionic acid and butyric acid concentration in the river water sample by ion-chromatography[J]. Environmental Monitoring in China, 2011, 27(1): 21-24 (in Chinese). DOI:10.3969/j.issn.1002-6002.2011.01.006 |
| [8] |
胡琳琳, 容晓文. 离子色谱法测定生物柴油中甲酸、乙酸、丙酸[J]. 广东化工, 2009, 36(7): 220-221, 237. HU L L, RONG X W. Determination of the methanoic acid, ethanoic acid and propanoic acid in bio-diesels via ion chromatography[J]. Guangdong Chemical, 2009, 36(7): 220-221, 237 (in Chinese). DOI:10.3969/j.issn.1007-1865.2009.07.083 |
| [9] |
DEL BARRIO M A, HU J, ZHOU P Z, et al. Simultaneous determination of formic acid and formaldehyde in pharmaceutical excipients using headspace GC/MS[J]. Journal of Pharmaceutical and Biomedical Analysis, 2006, 41(3): 738-743. DOI:10.1016/j.jpba.2005.12.033 |
| [10] |
耿梅梅, 许丽卫, 袁红朝, 等. 气相色谱法测定猪结肠内容物中短链脂肪酸含量[J]. 现代生物医学进展, 2015, 15(6): 1010-1014. GENG M M, XU L W, YUAN H Z, et al. A determination method based on gas chromatography for analysis of short-chain fatty acids in colonic contents of piglet[J]. Progress in Modern Biomedicine, 2015, 15(6): 1010-1014 (in Chinese). |
| [11] |
KOTEL'NIKOVA T S, VDOVENKO O V, VORONINA S G, et al. Gas-chromatographic determination of formic acid in the oxidation products of organic substances[J]. Journal of Analytical Chemistry, 2006, 61(4): 338-342. DOI:10.1134/S1061934806040071 |
| [12] |
CASTEDO R, PE N ' A R M, HERRERO C, et al. Analysis of formic and acetic acid in rain water by capillary electrophoresis[J]. International Journal of Environmental Analytical Chemistry, 2003, 83(3): 247-253. |
| [13] |
KORENMAN Y I, POPOVA N N, KUCHMENKO T A. Determination of formic and acetic acids in air by piezoelectric microweighing[J]. Russian Journal of Applied Chemistry, 2007, 80(6): 955-959. |




