藏绵羊又称藏系绵羊,是中国三大原始绵羊品种(蒙古羊、藏绵羊、哈萨克羊)之一,繁育在海拔3 000 m以上的青藏高原地区,存栏量约2 500万只,是中国群体数量最大的绵羊品种。藏绵羊生活在高寒低氧的环境中,全年放牧饲养,主要通过采食天然牧草获取营养。
藏绵羊对青藏高原的高寒低氧和冷季营养匮乏等严酷生态因子具有较好的适应性,但暖、冷季营养供给严重不均衡是限制藏绵羊产业发展的主要因素。所以,解析藏绵羊应对冷季营养胁迫的适应策略、提高藏绵羊适应冷季营养匮乏的能力成为其保护利用的主要目标。
动物的生长、发育和健康(所有功能)都受到所处环境微生物的影响,并决定了宿主的生理、行为、生态和进化[1-2]。多样化和反应灵敏的肠道菌群是动物适应的重要机制,使动物个体能够适应饲粮营养成分和质量随季节变化而变化的广泛采食[3]。瘤胃是反刍动物发酵、消化和代谢的重要场所,对反刍动物营养物质消化和吸收起着至关重要的作用[4]。反刍动物瘤胃中含有大量微生物,包括细菌、原虫和真菌等,其中细菌种类最多,约7 000种,在瘤胃中通过发酵对纤维物质进行消化吸收[5]。根据底物和发酵产物不同,将细菌分为纤维降解菌[包括黄色瘤胃球菌(Ruminococcus flavefaciens)、白色瘤胃球菌(Ruminococcus albus)、产琥珀酸丝状杆菌(Fibrobacter succinogenes)]、部分溶纤维丁酸弧菌、半纤维素降解菌、蛋白质降解菌[包括溶纤维丁酸弧菌(Butyrivibrio fibrisolvens)和嗜淀粉瘤胃杆菌(Ruminobacter amylophilus)]、脂肪降解菌等[6-8];瘤胃中的原虫主要为纤毛虫和极少数的鞭毛虫,虽在瘤胃中少于细菌,但体积较大,占瘤胃微生物的30%~80%,由于牧草营养成分的影响,反刍动物瘤胃中的细菌及原虫数量与种类也会随之发生改变[9-10]。
短链脂肪酸(short-chain fatty acid,SCFA)与反刍动物瘤胃营养以及瘤胃微生物之间有着密切的关系,瘤胃通过对养分的消化吸收产生大量SCFA,且不同种类SCFA对反刍动物生理作用不同,SCFA是有机物质在瘤胃中发酵的主要产物,同时,可以使瘤胃保持一个理想的酸性环境,从而形成一个良性循环的瘤胃环境[11-12]。相对于瘤胃微生物来说,瘤胃中的SCFA由瘤胃微生物厌氧发酵产生,包括甲酸、乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸等,对动物体代谢作用最为重要的有乙酸、丙酸和丁酸,约占瘤胃SCFA的95%[13]。研究显示,瘤胃微生物的组成和多样性也与瘤胃SCFA组成相关[14]。目前,针对藏绵羊不同季节瘤胃微生物菌群密度与SCFA浓度互作的研究鲜见报道,已有研究主要针对藏绵羊瘤胃纤毛虫种群动态受季节影响、瘤胃细菌数量及其放牧地牧草养分随季节变化以及放牧绵羊瘤胃液中SCFA浓度随季节而发生动态变化[9, 15-16]。因此,本试验旨在探讨暖、冷季藏绵羊瘤胃SCFA浓度、微生物菌群密度及其互作特征,进而为藏绵羊应对不同季节营养供给变化的适应机制研究提供基础。
1 材料与方法 1.1 试验动物及样品采集在甘肃省甘南藏族自治州合作市佐盖曼玛乡(海拔3 300 m)同一牧户羊群选取1周岁(±1月龄)、身体健康、体重[(35.12±1.43) kg]相近、自然放牧的欧拉型藏绵羊母羊12只。分别在7(暖季)和12月(冷季)采集藏绵羊瘤胃液。试验羊只归牧后,在次日早晨测量体重,利用羊用胃管式瘤胃采样器采集瘤胃液,将样品立刻放入准备好的液氮罐中进行冷冻保存,带回实验室-80 ℃保存。
1.2 试验方法 1.2.1 藏绵羊瘤胃SCFA浓度测定利用岛津(GC-2010 plus)气相色谱仪测定瘤胃SCFA浓度,内标为2-乙基丁酸(2EB),色谱柱:AT-FFAP(50 m×0.32 mm×0.25 μm)毛细管柱。色谱柱程序升温:温度60 ℃保持1 min,以5 ℃/min升至115 ℃,不保留,再以15 ℃/min升至180 ℃,检测器温度260 ℃,进样口温度250 ℃。
1.2.2 瘤胃微生物菌群密度测定利用天根粪便基因组DNA提取试剂盒(DP-328)提取藏绵羊瘤胃微生物总DNA。用1%的琼脂糖凝胶电泳检测DNA完整性和纯度,用超微量分光光度计(Therm Nano Drop-2000)检测OD260/280的值。
以瘤胃微生物DNA为模板,选取产甲烷菌(Methanogenic bacteria)、蛋白质降解菌(包括溶纤维丁酸弧菌和嗜淀粉瘤胃杆菌)、纤维降解菌(产琥珀酸丝状杆菌、黄色瘤胃球菌和白色瘤胃球菌)进行相对定量研究。利用NCBI BLAST (www.ncbi.nih.gov/BLAST)搜寻菌群16S rRNA序列,采用Primers软件设计特异性引物(表 1),引物由上海生物工程有限公司合成。以细菌为内参,引物序列参考Muyze等[17]研究方法,利用荧光定量PCR仪(ABI QuantStudio-6)测定微生物黄色瘤胃球菌、产琥珀酸丝状杆菌、白色瘤胃球菌、嗜淀粉瘤胃杆菌、溶纤维丁酸弧菌和产甲烷菌的相对密度。PCR反应体系20 μL:2×SuperReal PreMix Plus 10 μL,上、下游引物各0.6 μL,模板1 μL,50×Rox Reference Dye 0.4 μL,ddH2O 7.4 μL。反应参数:95 ℃预变性15 min; 95 ℃变性10 s,60 ℃退火32 s,共40个循环。
|
|
表 1 菌群引物序列 Table 1 Primer sequences of microorganisms |
试验数据利用Excel 2010进行整理,然后采用SPSS 21.0软件进行统计分析,数据用平均值±标准差来表示。SCFA浓度及比例进行独立样本t检验和单因素方差分析,目的菌相对密度采用2-△△Ct法分析。瘤胃SCFA浓度与微生物区系相对密度进行Spearman相关性分析。
2 结果与分析 2.1 藏绵羊暖、冷季瘤胃SCFA浓度及比例的测定结果由表 2可知,冷季总SCFA浓度显著高于暖季(P < 0.05),其中,乙酸与丙酸浓度在冷季显著高于暖季(P < 0.05),而其他SCFA浓度在暖、冷季无显著差异(P>0.05);各种SCFA所占比例分析发现,异丁酸比例在暖、冷季无显著差异(P>0.05),冷季乙酸、丙酸比例显著高于暖季(P < 0.05),而暖季丁酸、异丁酸、异戊酸、戊酸比例显著高于冷季(P < 0.05)。冷季乙酸/丙酸显著高于暖季(P < 0.05)。
|
|
表 2 藏绵羊瘤胃SCFA浓度及比例的测定结果 Table 2 Determination results of SCFA concentration and ratio in rumen of Tibetan sheep |
由图 1可知,藏绵羊暖、冷季瘤胃微生物菌群密度存在显著差异(P < 0.05),暖季瘤胃黄色瘤胃球菌、产琥珀酸丝状杆菌、白色瘤胃球菌、嗜淀粉瘤胃杆菌和产甲烷菌的相对密度显著高于冷季(P < 0.05);暖季瘤胃微生物菌群中黄色瘤胃球菌、产琥珀酸丝状杆菌和溶纤维丁酸弧菌之间的相对密度均差异显著(P < 0.05),而白色瘤胃球菌、嗜淀粉瘤胃杆菌和产甲烷菌之间相对密度差异不显著(P>0.05);冷季瘤胃微生物菌群中黄色瘤胃球菌和产琥珀酸丝状杆菌的相对密度差异显著(P < 0.05),而白色瘤胃球菌、嗜淀粉瘤胃杆菌、溶纤维丁酸弧菌和产甲烷菌之间相对密度差异不显著(P>0.05)。
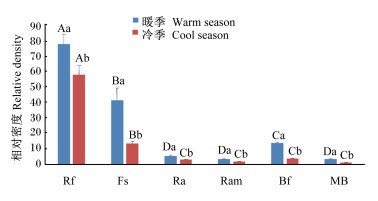
|
Rf:黄色瘤胃球菌Ruminococcus flavefaciens;Fs:产琥珀酸丝状杆菌Fibrobacter succinogenes;Ra:白色瘤胃球菌Ruminococcus albus;Ram:嗜淀粉瘤胃杆菌Ruminobacter amylophilus;Bf:溶纤维丁酸弧菌Butyrivibrio fibrisolvens;MB:产甲烷菌Methanogenic bacteria。 同一菌种,不同季节标注不同小写字母表示差异显著(P < 0.05);反之,差异不显著(P>0.05)。同一季节,不同菌种标注不同大写字母表示差异显著(P < 0.05);反之,差异不显著(P>0.05)。For the same strain, different small letters marked in different seasons mean significant differences (P < 0.05); on the contrary, the difference was not significant (P>0.05). In the same season, different capital letters marked on different strains mean significant differences (P < 0.05); on the contrary, the difference was not significant (P>0.05). 图 1 暖、冷季藏绵羊瘤胃微生物相对密度的变化 Fig. 1 Relative density changes of rumen microorganisms in warm and cold season of Tibetan sheep |
由表 4可知,6种SCFA浓度之间存在相关性,其中,乙酸、丙酸与异戊酸、戊酸浓度呈显著负相关(P < 0.05),而乙酸与异丁酸浓度呈极显著负相关(P < 0.01),相关性系数均大于0.900;反之,异丁酸与异戊酸、戊酸浓度呈极显著正相关(P < 0.01),相关系数均在0.950以上;其中丁酸与其他5种SCFA浓度之间无显著相关性(P>0.05)。
|
|
表 4 藏绵羊暖、冷季瘤胃SCFA浓度间相关性分析 Table 4 Correlation analysis of rumen SCFA concentration in warm and cold seasons of Tibetan sheep |
由表 5可知,SCFA浓度与微生物菌群相对密度之间存在相关性,其中,乙酸浓度与黄色瘤胃球菌相对密度呈极显著正相关(P < 0.01),相关系数大于0.950,与产琥珀酸丝状杆菌、嗜淀粉瘤胃杆菌、溶纤维丁酸弧菌、产甲烷菌相对密度呈极显著负相关(P < 0.01);丙酸浓度与白色瘤胃球菌相对密度呈极显著正相关(P < 0.01),相关系数大于0.900,与产琥珀酸丝状杆菌相对密度呈极显著负相关(P < 0.01);异戊酸、戊酸浓度与黄色瘤胃球菌相对密度呈极显著负相关(P < 0.01),相关系数均在0.950以上;异戊酸、戊酸浓度与白色瘤胃球菌相对密度呈显著负相关(P < 0.05),相关系数均在0.850以上;反之,异丁酸、异戊酸、戊酸浓度与黄色瘤胃球菌、溶纤维丁酸弧菌、产甲烷菌相对密度呈显著正相关(P < 0.05)。另外,丙酸浓度与黄色瘤胃球菌、嗜淀粉瘤胃杆菌、溶纤维丁酸弧菌、产甲烷菌相对密度之间无显著相关性(P>0.05),而丁酸浓度与6种微生物菌种相对密度均无显著相关性(P>0.05)。
|
|
表 5 藏绵羊暖、冷季瘤胃SCFA浓度与微生物菌群相对密度的相关分析 Table 5 Correlation analysis of rumen SCFA concentration and microbial flora relative density in warm and cold seasons of Tibetan sheep |
SCFA浓度是衡量瘤胃发酵方式与能力的关键参数,也是藏绵羊瘤胃微生物合成的重要能量来源[18]。瘤胃SCFA浓度和组成差异主要是由于饲粮的差异(即中性洗涤纤维),导致瘤胃微生物活性和比例的不同,最终影响瘤胃SCFA浓度和组成[19]。在本试验中,藏绵羊冷季瘤胃中乙酸、丙酸浓度显著高于暖季,可能与暖季牧草营养丰富、个体采食量大、瘤胃易发酵、体内碳水化合物充足有关,为瘤胃微生物生长提供充足养分,从而为产乙酸菌生长增殖提供充足的氮源。瘤胃内纤维分解菌生长速度快,分解纤维能力显著增加,为甲烷菌生长增殖提供充足的氢源,产乙酸菌与甲烷菌通过氢气和二氧化碳反应生产甲烷与乙酸,且甲烷含量高于乙酸。因此,暖季甲烷含量升高导致乙酸含量降低[20]。从各种SCFA所占比例进行分析,发现异丁酸比例在暖、冷季间无显著差异,冷季乙酸比例显著高于暖季,而丁酸和其他SCFA比例则是暖季显著高于冷季。另外,乙酸/丙酸在冷季显著高于暖季,这与魏德泳等[21]研究结果一致。在枯草期,牧草中结构性碳水化合物含量较高,中性洗涤纤维含量高于青草期和返青期,纤维含量较高,乙酸发酵为主,使得瘤胃乙酸/丙酸升高。SCFA浓度是瘤胃发酵的主要指标之一[22],SCFA为反刍动物提供70%~80%的能量,其中,乙酸、丙酸和丁酸是SCFA的主要组成,占SCFA的95%,与能量的利用率有着很大的关联[23],而本研究中,藏绵羊冷季瘤胃中乙酸、丙酸浓度显著高于暖季,可能与藏绵羊特殊的冷季适应性有关,为应对严酷的冷季环境,表现出高效的能量利用效率。王月[24]研究表明,季节变化对内蒙古白绒山羊瘤胃发酵特性及其微生物区系有一定的影响,阿尔巴斯型和二狼山型绒山羊冷季瘤胃中乙酸浓度显著高于暖季;暖季阿拉善型羊瘤胃SCFA浓度显著高于其他2个类型,而冷季则显著低于其他2个类型,前者与本试验结果一致;后者与本试验结果相反,可能由于地域的差异及环境不同造成。
3.2 藏绵羊暖、冷季瘤胃微生物菌群密度变化特征反刍动物出生时,瘤胃内并无微生物,随着出生1 d后,通过母畜的哺乳及周边环境的影响,在体内形成了瘤胃微生物区系并逐渐完善,进而达到一个相对稳定及平衡的状态,瘤胃微生物包括细菌、原虫和真菌三大类,瘤胃微生物的组成及结构不仅对维持瘤胃吸收与健康具有重要作用,还是调控瘤胃微生物区系的重要组成[25-26]。李长青等[27]对放牧绵羊不同季节瘤胃细菌多样性动态变化特征研究发现,牧草的营养状况能显著影响瘤胃的细菌分布,导致不同季节瘤胃消化不同;研究表明,依靠瘤胃降解的纤维细菌主要有3种,分别为黄色瘤胃球菌、白色瘤胃球菌和产琥珀酸丝状杆菌[28]。同时,瘤胃中还有大量产甲烷菌,可将其他微生物发酵产生甲烷,通过打嗝排出体外,虽不利于环境保护,但在瘤胃中能维持正常的氢气分压及瘤胃的发酵并起着重要的作用[29]。本试验中,藏绵羊暖、冷季瘤胃微生物菌群中黄色瘤胃球菌、产琥珀酸丝状杆菌、白色瘤胃球菌、嗜淀粉瘤胃杆菌、产甲烷菌、溶纤维丁酸弧菌的相对密度为暖季显著高于冷季。可能与暖季个体采食量大、牧草营养丰富易发酵产生充足的碳水化合物有关,为瘤胃微生物生长提供充足养分,瘤胃中纤维素含量增加的同时纤维分解菌的数量也相应增加,能够向瘤胃微生物提供更多易消化的细胞壁物质、蛋白质和营养底物,有利于刺激纤维分解菌的生长和繁殖,与刘大程等[30]的研究结果一致。阿拉善型绒山羊产琥珀酸丝状杆菌、黄色瘤胃球菌相对密度暖季显著高于冷季,白色瘤胃球菌相对密度暖、冷季间差异不显著[31],与本试验结果一致。本试验中,冷季瘤胃微生物菌群中黄色瘤胃球菌和产琥珀酸丝状杆菌的相对密度差异显著,而白色瘤胃球菌、嗜淀粉瘤胃杆菌、溶纤维丁酸弧菌和产甲烷菌相对密度差异不显著,与靳继鹏等[32]的研究结果一致;另外,本试验中,暖、冷季瘤胃微生物菌群中产甲烷菌相对密度差异不显著,与淡瑞芳等[33]的研究结果一致。同时,高海拔的藏绵羊相比低海拔藏绵羊产甲烷菌含量低[34]。所以,饲草质量、SCFA浓度、海拔等都会影响瘤胃微生物菌群多样性及密度,因而,对动物瘤胃的菌群密度进行研究,将有助于揭示动物的适应性机制,从而为动物的饲养管理提供参考。
3.3 藏绵羊瘤胃SCFA浓度与微生物菌群密度的相关性瘤胃SCFA浓度与反刍动物瘤胃营养以及瘤胃微生物之间存在着密切的关系,通过对养分的消化吸收产生大量的SCFA,且不同种类SCFA对反刍动物生理作用不同,瘤胃微生物是有机物质在瘤胃中发酵的主要产物,其中的一部分被其他微生物所利用。瘤胃中产琥珀酸丝状杆菌和黄色瘤胃球菌通过分解纤维素主要产生乙酸和琥珀酸盐,而白色瘤胃球菌的主要发酵产物是乙酸,嗜淀粉瘤胃杆菌、产琥珀酸丝状杆菌、黄色瘤胃球菌及其他细菌等也产生琥珀酸盐,琥珀酸盐是丙酸产生的中间产物,黄色瘤胃球菌的最终代谢产物主要是氢、乙酸和甲酸,以及少量的乙醇和乳酸[35]。本试验发现,藏绵羊瘤胃乙酸和丙酸浓度与产琥珀酸丝状杆菌相对密度呈显著负相关,乙酸浓度与黄色瘤胃球菌相对密度呈显著正相关,说明黄色瘤胃球菌是藏绵羊乙酸产生的重要分解菌群,也是藏绵羊瘤胃能量供给的重要SCFA。钟书[36]通过对温湿度指数(THI)介导山羊瘤胃细菌群落的变化研究发现,产琥珀酸丝状杆菌相对密度与丙酸浓度呈负相关,与乙酸浓度呈正相关,前者与本试验结果一致,后者与本试验结果相反,可能随着暖、冷季的变化,瘤胃发酵类型趋于乙酸型,缓解纤维素分解菌的抑制,使瘤胃内氢的浓度升高,从而促进甲烷菌生长,增加了甲烷的产量;另外,Yang等[37]研究结果表明,乙酸浓度与产琥珀酸丝状杆菌相对密度呈显著正相关,与本试验结果一致。
4 结论暖、冷季瘤胃微生物菌群密度与SCFA浓度存在显著性差异;进一步相关性分析发现,SCFA浓度与菌群密度之间存在一定的相关性,这种互作机制可能在藏绵羊应对暖、冷季的适应性方面发挥着重要作用,研究结果将为藏绵羊产业发展及种质资源保护利用提供参考。
| [1] |
MCFALL-NGAI M, HADFIELD M G, BOSCH T C G, et al. Animals in a bacterial world, a new imperative for the life sciences[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(9): 3229-3236. DOI:10.1073/pnas.1218525110 |
| [2] |
FOSTER K R, SCHLUTER J, COYTE K Z, et al. The evolution of the host microbiome as an ecosystem on a leash[J]. Nature, 2017, 548(7665): 43-51. DOI:10.1038/nature23292 |
| [3] |
AMATO K R, LEIGH S R, KENT A, et al. The gut microbiota appears to compensate for seasonal diet variation in the wild black howler monkey (Alouatta pigra)[J]. Microbial Ecology, 2015, 69(2): 434-443. DOI:10.1007/s00248-014-0554-7 |
| [4] |
李洋, 高民, 胡红莲, 等. 反刍动物瘤胃挥发性脂肪酸的吸收机制[J]. 动物营养学报, 2018, 30(6): 2070-2078. LI Y, GAO M, HU H L, et al. Absorption mechanism of rumen volatile fatty acids in ruminants[J]. Chinese Journal of Animal Nutrition, 2018, 30(6): 2070-2078 (in Chinese). DOI:10.3969/j.issn.1006-267x.2018.06.008 |
| [5] |
马惠忠.不同精粗比日粮对内蒙古白绒山羊瘤胃发酵和瘤胃微生物区系的影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2008. MA H Z.Effects of different diets on rumen fermentation and rumen microflora of Inner Mongolia white cashmere goats[D]. Master's Thesis.Hohhot: Inner Mongolia Agricultural University, 2008.(in Chinese) |
| [6] |
马健, SHAHALI M, 王之盛. 瘤胃微生物区系的影响因素及其调控措施[J]. 动物营养学报, 2020, 32(5): 1957-1964. MA J, SHAHALI M, WANG Z S. Influencing factors and control measures of rumen microflora[J]. Chinese Journal of Animal Nutrition, 2020, 32(5): 1957-1964 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.05.001 |
| [7] |
李志鹏.梅花鹿瘤胃微生物多样性与优势菌群分析[D].硕士学位论文.北京: 中国农业科学院, 2013. LI Z P.Analysis of rumen microbial diversity and dominant flora of Sika deer[D]. Master's Thesis.Beijing: Chinese Academy of Agricultural Sciences, 2013.(in Chinese) |
| [8] |
常维毅.不同季节日粮组成对狍瘤胃微生物区系、瘤胃内环境及血清生化指标的影响[D].博士学位论文.长春: 吉林大学, 2012. CHANG W Y.Effects of dietary composition in different seasons on rumen microflora, rumen environment and serum biochemical indexes of roe deer[D]. Ph.D.Thesis.Changchun: Jilin University, 2012.(in Chinese) |
| [9] |
姚军, 郭健, 赵晋军, 等. 青藏高原草地营养与牦牛和藏羊瘤胃纤毛虫种群动态相关分析[J]. 中国草食动物科学, 2002(增刊): 162-163. YAO J, GUO J, ZHAO J J, et al. Correlation analysis between grassland nutrition and rumen ciliate population dynamics of yaks and Tibetan sheep in Qinghai-Tibet plateau[J]. Chinese Herbivores Science, 2002(Suppl.): 162-163 (in Chinese). |
| [10] |
王梦芝, 徐爱秋, 李世霞, 等. 瘤胃微生物类群的多样性及其综合发酵的研究进展[J]. 饲料工业, 2008, 29(15): 37-40. WANG M Z, XU A Q, LI S X, et al. Research progress on diversity of rumen microbial groups and their comprehensive fermentation[J]. Feed Industry, 2008, 29(15): 37-40 (in Chinese). DOI:10.3969/j.issn.1001-991X.2008.15.013 |
| [11] |
李旺. 瘤胃挥发性脂肪酸的作用及影响因素[J]. 中国畜牧杂志, 2012, 48(7): 63-66. LI W. Effects and influencing factors of rumen volatile fatty acids[J]. Chinese Journal of Animal Science, 2012, 48(7): 63-66 (in Chinese). DOI:10.3969/j.issn.0258-7033.2012.07.017 |
| [12] |
经语佳, 高健, 郑亚洲, 等. 6种长链脂肪酸对瘤胃微生物体外发酵挥发性脂肪酸浓度的影响[J]. 动物营养学报, 2014, 26(1): 252-259. JING Y J, GAO J, ZHENG Y Z, et al. Effects of 6 long-chain fatty acids on volatile fatty acid concentration of in vitro fermentation of rumen microorganisms[J]. Chinese Journal of Animal Nutrition, 2014, 26(1): 252-259 (in Chinese). DOI:10.3969/j.issn.1006-267x.2014.01.033 |
| [13] |
尹召华, 王梦芝, 王洪荣, 等. 乙酸与丙酸比对体外瘤胃液挥发性脂肪酸发酵模式和微生物群体多样性的影响[J]. 动物营养学报, 2011, 23(12): 2129-2135. YIN Z H, WANG M Z, WANG H R, et al. Effect of acetic acid and propionic acid ratio on volatile fatty acid fermentation model and microbiotic population diversity in gastric juice[J]. Chinese Journal of Animal Nutrition, 2011, 23(12): 2129-2135 (in Chinese). DOI:10.3969/j.issn.1006-267x.2011.12.013 |
| [14] |
刘玉洁.高谷物日粮对山羊瘤胃微生物区系和瘤胃、血清、肝脏中代谢物组成的影响[D].硕士学位论文.南京: 南京农业大学, 2015. LIU Y J.Effects of high grain diet on rumen microflora and metabolite composition in rumen, serum and liver of goats[D]. Master's Thesis.Nanjing: Nanjing Agricultural University, 2015.(in Chinese) |
| [15] |
淡瑞芳, 张海涛, 龙瑞军, 等. 藏系绵羊瘤胃细菌数量及其放牧地牧草养分随季节变化的研究[J]. 草业学报, 2009, 18(1): 100-104. DAN R F, ZHANG H T, LONG R J, et al. The number of rumen bacteria in Tibetan sheep and the seasonal variation of forage nutrients in grazing land[J]. Acta Prataculturae Sinica, 2009, 18(1): 100-104 (in Chinese). DOI:10.3321/j.issn:1004-5759.2009.01.015 |
| [16] |
王洪荣, 冯宗慈, 卢德勋, 等. 放牧绵羊瘤胃液挥发性脂肪酸的变化规律及其受蠕虫感染的影响[J]. 畜牧与饲料科学, 2010, 31(6): 382-385. WANG H R, FENG Z C, LU D X, et al. The variation rule of volatile fatty acids in gastric fluid of pastured sheep tumor and its influence on helminth infection[J]. Animal Husbandry and Feed Science, 2010, 31(6): 382-385 (in Chinese). DOI:10.3969/j.issn.1672-5190.2010.06.131 |
| [17] |
MUYZER G, DE WAAL E C, UITTERLINDEN A G. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J]. Applied and Environmental Microbiology, 1993, 59(3): 695-700. DOI:10.1128/AEM.59.3.695-700.1993 |
| [18] |
淡瑞芳, 张海涛, 龙瑞军, 等. 季节变化对放牧藏系绵羊瘤胃发酵特性及产甲烷菌的影响[J]. 西北农业学报, 2013, 22(2): 1-6. DAN R F, ZHANG H T, LONG R J, et al. Effects of seasonal variation on rumen fermentation characteristics and Methanogenic bacteria of pastured Tibetan sheep[J]. Journal of Northwest Agriculture, 2013, 22(2): 1-6 (in Chinese). |
| [19] |
袁庆启, 姜发彬, 王亚琼, 等. 不同精粗比日粮对奶牛瘤胃发酵与肝脏VFA代谢及产奶性能的影响[J]. 家畜生态学报, 2016, 37(7): 36-43. YUAN Q Q, JIANG F B, WANG Y Q, et al. Effects of different diets on rumen fermentation, liver VFA metabolism and milk-producing energy in dairy cows[J]. Journal of Domestic Animal Ecology, 2016, 37(7): 36-43 (in Chinese). DOI:10.3969/j.issn.1673-1182.2016.07.007 |
| [20] |
杨春蕾, 孙中远, 王佳堃, 等. 通过强化产乙酸菌途径实现瘤胃甲烷减排[J]. 动物营养学报, 2012, 24(5): 796-803. YANG C L, SUN Z Y, WANG J K, et al. Methane reduction in rumen by strengthening acetic acid-producing bacteria[J]. Chinese Journal of Animal Nutrition, 2012, 24(5): 796-803 (in Chinese). DOI:10.3969/j.issn.1006-267x.2012.05.002 |
| [21] |
魏德泳, 朱伟云, 毛胜勇. 日粮不同NFC/NDF比对山羊瘤胃发酵与瘤胃微生物区系结构的影响[J]. 中国农业科学, 2012, 45(7): 1392-1398. WEI D Y, ZHU W Y, MAO S Y. Effects of different NFC/NDF ratios on rumen fermentation and rumen microflora structure of goats[J]. Scientia Agricultura Sinica, 2012, 45(7): 1392-1398 (in Chinese). |
| [22] |
鲍宏云, 闫素梅, 乔良, 等. 日粮精粗比与维生素A添加水平对奶牛体外瘤胃发酵参数的影响[J]. 饲料工业, 2011, 32(13): 40-45. BAO H Y, YAN S M, QIAO L, et al. Effects of dietary essence coarse ratio and vitamin A supplementation level on rumen fermentation parameters of dairy cows in vitro[J]. Feed Industry, 2011, 32(13): 40-45 (in Chinese). DOI:10.3969/j.issn.1001-991X.2011.13.012 |
| [23] |
赵国琦, 贾亚红, 陈小连, 等. 不同NDF/NFE比的日粮对山羊瘤胃发酵参数影响的研究[J]. 中国畜牧杂志, 2006, 42(13): 29-33. ZHAO G Q, JIA Y H, CHEN X L, et al. Effects of diets with different NDF/NFE ratios on rumen fermentation parameters of goats[J]. Chinese Journal of Animal Science, 2006, 42(13): 29-33 (in Chinese). DOI:10.3969/j.issn.0258-7033.2006.13.011 |
| [24] |
王月.季节对内蒙古白绒山羊瘤胃发酵特性及其微生物区系的影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2015. WANG Y.Seasonal effects on rumen fermentation characteristics and its microflora of Inner Mongolia white cashmere goats[D]. Master's Thesis.Hohhot: Inner Mongolia Agricultural University, 2015.(in Chinese) |
| [25] |
牟春堂, 郝小燕, 刘笑梅, 等. 葡多酚对绵羊瘤胃体外发酵参数及微生物区系的影响[J]. 动物营养学报, 2020, 32(1): 302-309. MOU C T, HAO X Y, LIU X M, et al. Effects of glucophenol on rumen fermentation parameters and microflora of sheep[J]. Chinese Journal of Animal Nutrition, 2020, 32(1): 302-309 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.01.037 |
| [26] |
李岚捷, 成述儒, 刁其玉, 等. 不同NFC/NDF水平饲粮对犊牛瘤胃发酵参数和微生物区系多样性的影响[J]. 畜牧兽医学报, 2017, 48(12): 2347-2357. LI L J, CHENG S R, DIAO Q Y, et al. Effects of diets with different NFC/NDF levels on rumen fermentation parameters and diversity of microflora of calves[J]. Chinese Journal of Animal and Veterinary Sciences, 2017, 48(12): 2347-2357 (in Chinese). DOI:10.11843/j.issn.0366-6964.2017.12.014 |
| [27] |
李长青, 金海, 薛树媛.放牧绵羊不同季节瘤胃细菌多样性动态变化研究[C]//2018年全国养羊生产与学术研讨会论文集.蚌埠: 中国畜牧兽医学会养羊学分会, 2018: 39-40. LI C Q, JIN H, XUE S Y.Dynamic changes of rumen bacterial diversity in grazing sheep in different seasons[C]//Proceedings of the 2018 National Sheep Production and Academic Symposium.Bengbu: Chinese Society of Animal Husbandry and Veterinary Sheep science Branch, 2018: 39-40.(in Chinese) |
| [28] |
沈美英.日粮内不同粗饲料品质对绵羊瘤胃发酵功能和微生物区系的影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2006. SHEN M Y.Effects of different roughage quality on rumen fermentation function and microflora of sheep[D]. Master's Thesis.Hohhot: Inner Mongolia Agricultural University, 2006.(in Chinese) |
| [29] |
ZHOU M, MCALLISTER T A, GUAN L L. Molecular identification of rumen methanogens:technologies, advances and prospects[J]. Animal Feed Science and Technology, 2011, 166-167: 76-86. DOI:10.1016/j.anifeedsci.2011.04.005 |
| [30] |
刘大程, 卢德勋, 侯先志, 等. 不同品质粗饲料日粮对瘤胃发酵及主要纤维分解菌的影响[J]. 中国农业科学, 2008, 41(4): 1199-1206. LIU D C, LU D C, HOU X Z, et al. Effects of roughage diets of different quality on rumen fermentation and main fiber-degrading bacteria[J]. Scientia Agricultura Sinica, 2008, 41(4): 1199-1206 (in Chinese). DOI:10.3864/j.issn.0578-1752.2008.04.033 |
| [31] |
杨硕.养殖方式和绒山羊类型对瘤胃产甲烷菌及相关微生物区系的影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2018. YANG S.Effects of farming methods and cashmere goat types on Methanogens and related microflora in the rumen[D]. Master's Thesis.Hohhot: Inner Mongolia Agricultural University, 2018.(in Chinese) |
| [32] |
靳继鹏, 郭武君, 张筱艳, 等. 冷季放牧补饲对甘肃高山细毛后备母羊瘤胃代谢参数及瘤胃微生物数量的影响[J]. 草业学报, 2018, 27(7): 93-102. JIN J P, GUO W J, ZHANG X Y, et al. Effect of supplemental grazing in cold season on rumen metabolic parameters and gastric microorganism quantity of alpine fine hair reserve ewe in Gansu[J]. Acta Prataculturae Sinica, 2018, 27(7): 93-102 (in Chinese). |
| [33] |
淡瑞芳, 张海涛, 丁学智, 等. 藏系绵羊瘤胃古菌季节动态分析[J]. 甘肃农业大学学报, 2012, 47(2): 12-16, 20. TAN R F, ZHANG H T, DING X Z, et al. Seasonal dynamic analysis of rumen archaea in Tibetan sheep[J]. Journal of Gansu Agricultural University, 2012, 47(2): 12-16, 20 (in Chinese). DOI:10.3969/j.issn.1003-4315.2012.02.003 |
| [34] |
ZHANG Z G, XU D M, WANG L, et al. Convergent evolution of rumen microbiomes in high-altitude mammals[J]. Current Biology, 2016, 26(14): 1873-1879. DOI:10.1016/j.cub.2016.05.012 |
| [35] |
郭雪峰.内蒙古白绒山羊甲烷产生量估测模型的建立及其影响因素的研究[D].博士学位论文.呼和浩特: 内蒙古农业大学, 2008. GUO X F.Establishment of methane production estimation model for Inner Mongolia white cashmere goat and study on its influencing factors[D]. Ph.D.Thesis.Hohhot: Inner Mongolia Agricultural University, 2008.(in Chinese) |
| [36] |
钟书.温湿度指数(THI)介导山羊瘤胃细菌群落的变化[D].硕士学位论文.杨凌: 西北农林科技大学, 2019. ZHONG S.Temperature and humidity index (THI) mediated changes of bacterial community in rumen of goats[D]. Master's Thesis.Yangling: Northwest A&F University, 2019.(in Chinese) |
| [37] |
YANG L Y, CHEN J, CHENG X L, et al. Phylogenetic analysis of 16S rRNA gene sequences reveals rumen bacterial diversity in yaks (Bos grunniens)[J]. Molecular Biology Reports, 2010, 37(1): 553-562. |




